Hóa học Phần 1 - Hướng dẫn Nhanh
Giới thiệu
Mọi thứ được tìm thấy trong vũ trụ này đều được tạo thành từ một số vật liệu, các nhà khoa học đã đặt tên cho chúng là “matter.” Ví dụ, thực phẩm chúng ta ăn, không khí chúng ta hít thở, đá, mây, sao, thực vật, động vật, nước, bụi, mọi thứ đều được phân loại là vật chất.
Đặc điểm của các hạt vật chất
Các hạt vật chất rất nhỏ, bình thường, không thể nhìn thấy bằng mắt thường.

Các hạt vật chất liên tục chuyển động, được gọi là “kinetic energy.”
Động năng của các hạt phụ thuộc trực tiếp vào nhiệt độ, khi nhiệt độ tăng thì tốc độ chuyển động cũng tăng.
Các hạt vật chất có lực hút; do đó, chúng hút nhau.
Lực hút của các hạt giữ các hạt lại với nhau; tuy nhiên, cường độ của lực hút khác nhau giữa các loại vật chất.
Các trạng thái của vật chất
Vật chất có ba trạng thái sau:
Solid State
Liquid State
Gaseous State

Hãy thảo luận ngắn gọn về chúng -
Thể rắn
Tất cả các vật liệu rắn có hình dạng xác định, ranh giới rõ ràng và thể tích cố định.
Hầu hết các vật liệu rắn có khả năng nén không đáng kể.
Tất cả các vật liệu rắn có xu hướng tự nhiên để duy trì hình dạng của chúng khi chịu tác động của lực bên ngoài.
Các vật liệu rắn có thể bị phá vỡ dưới tác dụng của lực tác dụng, nhưng rất khó thay đổi hình dạng của chúng, vì chúng cứng.
Trạng thái lỏng
Không giống như chất rắn, chất lỏng không có hình dạng cố định; tuy nhiên, chúng có một khối lượng cố định.
Chất lỏng có hình dạng của vật chứa trong đó chúng được giữ.
Chất lỏng có đặc tính chảy và thay đổi hình dạng.
Thể khí
Vật chất ở dạng không khí, không rắn cũng không lỏng, được gọi là khí. Ví dụ, oxy, nitơ, hydro, v.v.
Không giống như chất rắn, chất khí có kích thước và hình dạng không xác định.
Các loại khí, chẳng hạn như khí hóa lỏng (LPG - dùng trong nấu nướng); khí nén tự nhiên (CNG - dùng làm nhiên liệu cho xe cộ), v.v ... có khả năng nén cao; do đó, thể tích lớn của một chất khí có thể được nén vào một xi lanh nhỏ và có thể được vận chuyển dễ dàng.
Thông thường, các chất khí thể hiện đặc tính khuếch tán rất nhanh vào các chất khí khác. Đây là lý do mà chúng ta có thể ngửi thấy (hoặc tốt hoặc xấu) từ xa.
Vật chất có thể thay đổi trạng thái của nó
Nước có thể tồn tại ở cả ba trạng thái, ví dụ: Nước đá ở thể rắn; nước (H2O) ở dạng lỏng; và hơi nước ở dạng khí. Sơ đồ sau minh họa sự chuyển hóa của nước ở các trạng thái khác nhau -

Nhiệt độ, tại đó chất rắn nóng chảy và chuyển thành chất lỏng (ở áp suất khí quyển đã cho), được gọi là “melting point.”
Điểm nóng chảy của một chất rắn là một biểu hiện về cường độ của lực hút giữa các hạt của nó.
Nhiệt độ nóng chảy của nước đá là 273,16 K, tức là 0 0 C.
Quá trình nóng chảy (tức là sự thay đổi trạng thái rắn thành trạng thái lỏng) được gọi là fusion.
Lượng nhiệt năng cần thiết để biến đổi 1 kg vật liệu rắn thành vật liệu lỏng ở áp suất khí quyển nhất định, được gọi là latent heat của sự hợp nhất.
Nhiệt độ tại đó chất lỏng bắt đầu sôi ở áp suất khí quyển đã cho được gọi là “boiling point.”
Nhiệt độ sôi của nước là 373 K tức là 100 0 C.
Sự thay đổi trạng thái của vật chất trực tiếp từ rắn sang khí mà không chuyển sang trạng thái lỏng (hoặc ngược lại) được gọi là “sublimation.”
Hiện tượng tức là sự thay đổi chất lỏng thành hơi ở bất kỳ nhiệt độ nào dưới điểm sôi của nó được gọi là “evaporation.”
Khí cacbonic rắn (CO 2 ) được bảo quản dưới áp suất cao.

CO 2 rắn được chuyển đổi trực tiếp thành trạng thái khí khi áp suất giảm xuống 1 khí quyển.
Atmosphere(atm) là đơn vị đo áp suất do chất khí tạo ra và đơn vị đo áp suất là Pascal (Pa); 1 bầu khí quyển = 1,01 × 105 Pa.
Trạng thái vật chất thứ tư
Plasma là trạng thái bao gồm các hạt siêu năng lượng và siêu kích thích.

Các hạt siêu kích thích được tìm thấy dưới dạng các chất khí bị ion hóa. Ví dụ: bóng đèn huỳnh quang (chứa khí heli) và bóng đèn neon (chứa khí neon) bao gồm plasma.
Giới thiệu
Chất tinh khiết là chất bao gồm một loại hạt hoặc các hạt.

Hỗn hợp của hai hoặc nhiều thành phần tinh khiết không có bất kỳ chất không mong muốn nào được gọi là Mixtures, ví dụ, nước, khoáng chất, đất, v.v.
Một hỗn hợp đồng nhất của hai hoặc nhiều chất được gọi là solution. Ví dụ, nước chanh, nước soda, v.v.
Dung dịch có thể ở bất kỳ dạng nào chẳng hạn như - nó có thể ở thể lỏng, rắn hoặc khí.
Alloyslà một ví dụ khác về hỗn hợp chứa hỗn hợp đồng nhất của các kim loại; chúng không thể được tách thành các thành phần của chúng bằng các phương pháp vật lý. Ví dụ: đồng thau là hỗn hợp của kẽm (khoảng 30%) và đồng (khoảng 70%).
Các tính năng quan trọng của giải pháp
Dung dịch thường là một hỗn hợp đồng nhất.
Các hạt của dung dịch thậm chí có đường kính nhỏ hơn 1 nm (10-9 mét) và do đó, chúng không thể nhìn thấy bằng mắt thường.
Đường đi của ánh sáng không thể nhìn thấy trong dung dịch.
Các hạt hòa tan không thể tách ra khỏi hỗn hợp bằng quá trình lọc đơn giản.
Các hạt hòa tan không lắng xuống khi nó không bị xáo trộn.
Ở một nhiệt độ nhất định, khi không còn chất tan nào có thể hòa tan được trong dung dịch, nó được gọi là ‘saturated solution.’
Ở một nhiệt độ nhất định, số lượng các hạt hòa tan có trong dung dịch bão hòa, được gọi là solubility.’
Huyền phù
Huyền phù là một hỗn hợp không đồng nhất trong đó các phần tử chất tan không hòa tan, mà vẫn lơ lửng trong toàn bộ phần lớn của môi trường, được gọi là ‘suspension.’
Các tính năng quan trọng của hệ thống treo
Các hạt của huyền phù có thể nhìn thấy rõ ràng bằng mắt thường.

Các hạt của huyền phù phân tán một chùm ánh sáng đi qua nó và tương tự, đường đi của nó có thể nhìn thấy được.
Các hạt chào có thể được tách ra khỏi hỗn hợp bằng quá trình lọc đơn giản.
Keo
Một hỗn hợp không đồng nhất được gọi là ‘colloid.’ Ví dụ như sương mù, sương mù, khói, kem dưỡng da mặt, v.v.

Kích thước của các hạt keo quá nhỏ để có thể nhìn thấy bằng mắt thường.
Các hạt keo đủ lớn để tán xạ một chùm ánh sáng đi qua nó và làm cho đường đi có thể nhìn thấy được.
Các hạt keo không thể tách ra khỏi hỗn hợp bằng quá trình lọc đơn giản.
Kỹ thuật lọc đặc biệt tức là centrifugation, có thể được sử dụng để tách các hạt keo.
Sắc ký
Quá trình tách các thành phần của hỗn hợp được gọi là chromatography; thông thường nó được sử dụng để tách màu.
Kỹ thuật sắc ký được sử dụng để tách các chất tan hòa tan trong cùng một dung môi.
Chưng cất
Quá trình tinh chế chất lỏng bằng cách làm nóng và làm lạnh được gọi là quá trình chưng cất.
Kết tinh
Quá trình tách một chất rắn nguyên chất ở dạng tinh thể của nó ra khỏi dung dịch được gọi là ‘crystallization.’
Thành phần
Năm 1661, Robert Boyle là nhà khoa học đầu tiên sử dụng thuật ngữ element; Antoine Laurent Lavoisier, một nhà hóa học người Pháp, là người đầu tiên xác định bằng thực nghiệm thuật ngữ nguyên tố.
Nguyên tố là một dạng vật chất cơ bản không thể bị phân hủy thành các chất đơn giản hơn bằng một phản ứng hóa học.
Các phần tử thường có thể được phân loại là metals, non-metals, và metalloids.
Kim loại
Một vật liệu rắn, thường cứng, dẻo, dễ uốn, sáng bóng và dễ chảy với tính dẫn điện và nhiệt tốt, được gọi là metal. Ví dụ: vàng, bạc, đồng, nhôm, v.v.

Mercury là kim loại duy nhất ở trạng thái lỏng ở nhiệt độ thường.
Phi kim loại
Tất cả các nguyên tố hoặc chất không phải là kim loại được gọi là phi kim loại. Ví dụ: hydro, oxy, iot, carbon, v.v.
Các phi kim loại có nhiều màu sắc và chúng dẫn nhiệt và dẫn điện kém.
Các phi kim loại không bóng, bóng hoặc dễ uốn.
Hợp chất
Một chất, bao gồm hai hoặc nhiều nguyên tố, được gọi là ‘compound.’
Hợp chất là kết quả của sự kết hợp hóa học của hai hoặc nhiều nguyên tố theo một tỷ lệ cố định.

Tính chất của một hợp chất bằng một cách nào đó khác với các nguyên tố cấu thành của nó, trong khi đó, các tính chất của một hỗn hợp cũng giống như các nguyên tố hoặc hợp chất cấu thành nó.
Giới thiệu
Vào khoảng năm 500 trước Công nguyên, một nhà triết học Ấn Độ Maharishi Kanad, lần đầu tiên công nhận khái niệm phần không thể phân chia của vật chất và đặt tên cho nó là ‘pramanu.’
Năm 1808, John Dalton đã sử dụng thuật ngữ ‘atom’ và công nhận atomic theory để nghiên cứu vật chất.

Lý thuyết nguyên tử của Dalton
Theo thuyết nguyên tử của Dalton, tất cả vật chất, dù là nguyên tố, hợp chất hay hỗn hợp đều được cấu tạo bởi các hạt nhỏ gọi là nguyên tử.
Theo lý thuyết nguyên tử của Dalton, tất cả các vấn đề, cho dù chúng là nguyên tố, hợp chất hay hỗn hợp, đều được cấu tạo từ các hạt nhỏ gọi là nguyên tử.
Đặc điểm nổi bật của Thuyết nguyên tử của Dalton
Tất cả vật chất đều được tạo ra từ các hạt rất nhỏ gọi là nguyên tử.
Nguyên tử là một hạt không thể phân chia, không thể được tạo ra hoặc phá hủy thông qua phản ứng hóa học.
Tất cả các nguyên tử của một nguyên tố đều giống nhau về khối lượng và tính chất hóa học trong khi nguyên tử của các nguyên tố khác nhau có khối lượng và tính chất hóa học khác nhau.
Để tạo thành một hợp chất, các nguyên tử được kết hợp với nhau theo tỷ lệ các số nguyên nhỏ.
Trong một hợp chất nhất định, số lượng và loại nguyên tử tương đối không đổi.
Khối lượng nguyên tử
Khối lượng của một nguyên tử của một nguyên tố hóa học; nó được biểu thị bằng đơn vị khối lượng nguyên tử (kí hiệu là u ).
Khối lượng nguyên tử gần tương đương với số proton và neutron có trong nguyên tử.
Một đơn vị khối lượng nguyên tử là đơn vị khối lượng bằng chính xác một phần mười hai (1/12) khối lượng của một nguyên tử cacbon-12 và khối lượng nguyên tử tương đối của tất cả các nguyên tố đã được tính toán đối với nguyên tử cacbon-12.
Phân tử
Là hạt nhỏ nhất của nguyên tố hoặc hợp chất, có khả năng tồn tại độc lập và thể hiện tất cả các tính chất của chất tương ứng.

Thông thường, phân tử là một nhóm gồm hai hoặc nhiều nguyên tử được liên kết hóa học với nhau.
Các nguyên tử của cùng một nguyên tố hoặc của các nguyên tố khác nhau có thể tham gia (bằng liên kết hóa học) với nhau để tạo thành phân tử.
Số lượng nguyên tử cấu thành một phân tử được gọi là atomicity.
Ion
Một hạt tích điện được gọi là ion; nó có thể là một trong hainegative charge hoặc là positive charge.
Ion tích điện dương được gọi là ‘cation’.
Ion tích điện âm được gọi là ‘anion.’
Công thức hóa học
Công thức hóa học của một hợp chất biểu thị các nguyên tố cấu thành của nó và số nguyên tử của mỗi nguyên tố kết hợp.

Công thức hóa học của một hợp chất là đại diện ký hiệu của Thành phần của nó.
Khả năng kết hợp của một phần tử được gọi là ‘valency.’
Khối lượng phân tử
Khối lượng phân tử của một chất được tính bằng cách lấy tổng khối lượng nguyên tử của tất cả các nguyên tử trong phân tử của chất tương ứng. Ví dụ, khối lượng phân tử của nước được tính là -
Nguyên tử khối của hiđro = 1u
Nguyên tử khối của oxi = 16 u
Nước chứa hai nguyên tử hydro và một nguyên tử oxy.
Khối lượng phân tử của nước là = 2 × 1+ 1 × 16 = 18 u ( u là ký hiệu của khối lượng phân tử).
Công thức Đơn vị Khối lượng
Đơn vị công thức khối lượng của một chất được tính bằng cách lấy tổng khối lượng nguyên tử của tất cả các nguyên tử trong một đơn vị công thức của hợp chất.
Avogadro Constant hoặc Avogadro Number
Avogadro là một nhà khoa học người Ý đã đưa ra khái niệm về Số Avogadro (còn được gọi là Hằng số Avogadro).
Số lượng các hạt (nguyên tử, phân tử hoặc ion) có trong 1 mol chất bất kỳ là cố định và giá trị của nó luôn được tính bằng 6.022 × 1023.
Năm 1896, Wilhelm Ostwald đưa ra khái niệm 'nốt ruồi'; tuy nhiên, đơn vị mol đã được chấp nhận để cung cấp một cách đơn giản để báo cáo một số lượng lớn vào năm 1967.
Luật Bảo tồn Khối lượng
Trong một phản ứng hóa học, tổng khối lượng của chất phản ứng và sản phẩm không thay đổi, được gọi là ‘Law of Conservation of Mass.’
Luật tỷ lệ xác định
Trong một hợp chất hóa học tinh khiết, các nguyên tố của nó luôn có mặt theo một tỷ lệ xác định theo khối lượng, được gọi là ‘Law of Definite Proportions.’
Giới thiệu
Đến năm 1900, người ta phát hiện ra rằng nguyên tử không phải là một hạt đơn giản, không thể phân chia mà nó chứa các hạt phụ nguyên tử.
J.J. Thomson phát hiện ra hạt phụ nguyên tử cụ thể là ‘electron.’

JJ Thomson là người đầu tiên đề xuất model đối với cấu trúc của nguyên tử.
Năm 1886, E. Goldstein phát hiện ra sự có mặt của các bức xạ mới trong phóng điện khí và đặt tên cho chúng là canal rays.
Một hạt tiểu nguyên tử mang điện tích dương khác được phát hiện bằng các thí nghiệm về tia kênh và đặt tên cho nó proton.
Mô hình nguyên tử của Thomson
Thomson đề xuất rằng một nguyên tử bao gồm một quả cầu tích điện dương và các điện tử (điện tích âm) được nhúng trong đó (như trong hình bên dưới).

Hơn nữa, Thomson nói rằng các điện tích âm và dương có độ lớn bằng nhau. Do đó, nguyên tử nói chung là trung hòa về điện.
Mô hình nguyên tử của Rutherford
E. Rutherford nổi tiếng là 'Cha đẻ' của vật lý hạt nhân.

Rutherford chủ yếu được biết đến với công trình nghiên cứu về hiện tượng phóng xạ và khám phá ra nucleus của một nguyên tử với thí nghiệm lá vàng (như trong hình dưới đây.

Rutherford nói rằng trong một nguyên tử, có một trung tâm tích điện dương được gọi là nucleus.
Rutherford nói rằng gần như tất cả khối lượng của một nguyên tử đều tồn tại trong hạt nhân.
Theo Rutherford, các electron quay xung quanh hạt nhân theo những quỹ đạo xác định rõ.
Mô hình nguyên tử của Bohr
Neils Bohr tiếp tục mở rộng mô hình của Rutherford và cải thiện những nhược điểm của anh ta.

Theo Bohr, chỉ một số quỹ đạo đặc biệt được gọi là quỹ đạo rời rạc của các electron, được phép bên trong nguyên tử.
Bohr nói rằng các electron không bức xạ năng lượng khi quay trong các quỹ đạo rời rạc.
Bohr đặt tên quỹ đạo hoặc vỏ là mức năng lượng (như trong hình dưới đây).

Bohr đại diện cho các quỹ đạo hoặc vỏ này bằng các chữ cái K, L, M, N,… hoặc các số, n = 1,2,3,4,….
Nơtron
Năm 1932, J. Chadwick phát hiện ra một hạt phụ nguyên tử mới tức là nơtron.
Nơtron không có điện tích và khối lượng gần bằng prôtôn.
Nơtron có trong hạt nhân của tất cả các nguyên tử, ngoại trừ hydro.
Các electron được phân bố theo các quỹ đạo khác nhau (Vỏ)
Số electron tối đa có thể có trong một lớp vỏ được cho bởi công thức 2n2.
‘n’ là số quỹ đạo hoặc chỉ số mức năng lượng, tức là 1, 2, 3,….
Theo công thức đã cho -
Quỹ đạo đầu tiên tức là K-shellsẽ là = 2 × 1 2 = 2
Quỹ đạo thứ hai tức là L-shellsẽ là = 2 × 2 2 = 8
Quỹ đạo thứ ba tức là M-shellsẽ là = 2 × 3 2 = 18
Quỹ đạo thứ tư tức là N-shellsẽ là = 2 × 4 2 = 32
Tương tự như vậy, số electron tối đa có thể chứa ở quỹ đạo ngoài cùng là 8.
Các electron không được lấp đầy trong một lớp vỏ nhất định, trừ khi các lớp vỏ bên trong được lấp đầy. Nó có nghĩa là, các vỏ được lấp đầy một cách khôn ngoan; bắt đầu từ vỏ trong đến vỏ ngoài.
Valence
Các electron, những electron hiện diện ở lớp vỏ ngoài cùng của nguyên tử, được gọi là valence các electron.
Theo mô hình Bohr-Bury, lớp vỏ ngoài cùng của nguyên tử có thể có tối đa 8 electron.
Số nguyên tử
Tổng số proton, có trong hạt nhân của một nguyên tử, được gọi là atomic number.
Số proton của một nguyên tử xác định số hiệu nguyên tử.
Số hiệu nguyên tử được ký hiệu là ‘Z’.
Proton và neutron gọi chung là nucleons.
Số khối
Tổng của tổng số proton và neutron, có trong hạt nhân của một nguyên tử, được gọi là mass number.
Đồng vị
Các nguyên tử của cùng một nguyên tố, có cùng số hiệu nguyên tử nhưng số khối khác nhau, được gọi là đồng vị. Ví dụ: Nguyên tử hydro có ba đồng vị là protium, đơteri và triti.
Tính chất hóa học của các đồng vị của một nguyên tử là giống nhau nhưng tính chất vật lý của chúng khác nhau.
Isobars
Nguyên tử của các nguyên tố khác nhau có số hiệu nguyên tử khác nhau, có cùng số khối được gọi là đồng phân. Ví dụ: số nguyên tử của canxi là 20 và số nguyên tử của argon là 18; xa hơn, số electron trong các nguyên tử này khác nhau, nhưng số khối của cả hai nguyên tố này là 40.
Giới thiệu
Một quá trình trong đó một hoặc nhiều chất hóa học phản ứng với chất hóa học khác và chuyển thành một hoặc nhiều chất khác nhau được gọi là phản ứng hóa học.
Phương trình hóa học
Một phương trình hóa học là biểu diễn biểu tượng của một phản ứng hóa học; nó được biểu diễn thông qua các ký hiệu và công thức. Ví dụ
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
Các chất magiê và ôxy được gọi là chất phản ứng và kết quả của phản ứng, tức là ôxít magiê được gọi là sản phẩm.
Hãy nhớ rằng, tổng khối lượng của các nguyên tố có trong sản phẩm của một phản ứng hóa học phải bằng tổng khối lượng của các nguyên tố có trong chất phản ứng.
Số nguyên tử của mỗi nguyên tố luôn không đổi, trước và sau phản ứng hóa học.
Các loại phản ứng hóa học
Sau đây là các loại phản ứng hóa học chính:
Combination Reaction
Decomposition Reaction
Displacement Reaction
Hãy thảo luận ngắn gọn về từng người trong số chúng -
Phản ứng kết hợp
Khi hai hoặc nhiều chất (tức là các nguyên tố hoặc hợp chất) phản ứng để tạo thành một sản phẩm duy nhất, phản ứng đó được gọi là combination reaction. Ví dụ
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
Như minh họa trong phản ứng trên, canxi oxit và nước đã phản ứng (hoặc kết hợp) để tạo thành một sản phẩm duy nhất, được gọi là canxi hiđroxit.
Phản ứng hóa học trong đó nhiệt cũng được giải phóng cùng với sự tạo thành sản phẩm được gọi là exothermic chemical reactions.
Phản ứng phân hủy
Phản ứng, trong đó một chất phản ứng đơn lẻ bị phân hủy thành các sản phẩm đơn giản hơn, được gọi là phản ứng phân hủy. Ví dụ

Trong phản ứng đã cho ở trên, các tinh thể sắt sunfat (FeSO 4 , 7H 2 O) khi đun nóng sẽ mất nước và màu của tinh thể thay đổi. Cuối cùng, nó phân hủy thành oxit sắt (Fe 2 O 3 ), lưu huỳnh đioxit (SO 2 ) và lưu huỳnh trioxit (SO 3 ).
Phản ứng dịch chuyển
Phản ứng, trong đó một phần tử thay thế hoặc loại bỏ một phần tử khác, được gọi là phản ứng chuyển vị. Ví dụ
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
Trong phản ứng đã cho ở trên, sắt chuyển đồng ra khỏi dung dịch đồng sunfat và tạo thành Sắt sunfat.
Quá trình oxy hóa và khử
Nếu một chất nhận được oxy trong một phản ứng, nó được gọi là oxidation. Mặt khác, trong một phản ứng, nếu một chất bị mất oxi, chất đó được gọi làreduction. Ví dụ

Trong phản ứng đã cho ở trên, đồng oxit mất oxi và do đó bị khử (tức là tính khử); mặt khác, hydro thu được oxy và do đó bị oxy hóa (tức là quá trình oxy hóa).
Ăn mòn
Khi một kim loại bị tấn công bởi các chất được tìm thấy trong môi trường ngay lập tức, chẳng hạn như độ ẩm, axit, v.v., nó được gọi là corrosion. Ví dụ: lớp phủ màu đen trên bạc, lớp phủ màu xanh lá cây trên đồng, v.v.,

Rancidity
Khi chất béo và dầu bị oxy hóa, quá trình này được gọi là ôi thiu. Mùi, vị, màu sắc, v.v. của chúng cũng thay đổi; tương tự như vậy, nó làm cho thực phẩm không an toàn cho tiêu dùng.
Giới thiệu
Chúng ta nếm thức ăn chua và đắng, đó chỉ là do sự hiện diện của axit và bazơ tương ứng.
Giải pháp Litmus
Litmus, được chiết xuất từ địa y, có màu tím (xem hình ảnh bên dưới), nhưng điều kiện là khi nó không có tính axit hoặc bazơ, tức là trung tính.

Về cơ bản, cây quỳ là một loài thực vật thuộc họ Thallophyta, và trong thí nghiệm hóa học, nó thường được dùng làm chất chỉ thị.
Các chất thay đổi mùi trong môi trường axit hoặc bazơ, được gọi là olfactory các chỉ số.
Axit hoặc bazơ trong dung dịch nước
Các ion hydro trong HCl được tạo ra do sự có mặt của nước. Thứ hai, việc tách ion H + ra khỏi phân tử HCl không thể thực hiện được trong điều kiện không có nước. Công thức hóa học được minh họa bên dưới
HCl + H2O → H3O+ + Cl–
Hơn nữa, các ion hydro không thể tồn tại một mình, nhưng chúng có thể tồn tại trong sự hiện diện của các phân tử nước. Do đó, các ion hydro được hiển thị dưới dạng H + (aq) hoặc ion hydronium (H 3 O + ). Công thức hóa học là -
H+ + H2O → H3O+
Các bazơ hòa tan trong nước được gọi là alkalis. Nhưng tất cả các bazơ đều không tan trong nước.
Nếu cho nước vào axit đậm đặc thì nhiệt lượng được sinh ra.
Trộn axit hoặc bazơ với nước dẫn đến giảm nồng độ của các ion (tức là H 3 O + / OH–) trên một đơn vị thể tích và quá trình này được gọi làdilution.
quy mô ph
Một thang đo, được sử dụng để đo nồng độ ion hydro trong dung dịch, được gọi là pH scale.
Các ‘p’ trong pH là viết tắt của ‘potenz’, nó là một thuật ngữ tiếng Đức, có nghĩa là ‘power’.
Giá trị pH được lấy đơn giản là một con số, cho biết tính chất axit hoặc bazơ của dung dịch. Vì vậy, nếu nồng độ của ion hydronium cao hơn, thì giá trị của pH sẽ thấp hơn.
Giá trị của thang pH nằm trong khoảng giữa ‘0’ và ’14;’ vì vậy, nếu giá trị pH được đo bằng '0', điều đó có nghĩa là - nó rất acidic và nếu nó là 14, thì nó có nghĩa là - nó rất alkaline.
Giá trị trung tính của thang pH là ‘7’.
Trên thang đo pH, giá trị nhỏ hơn 7 thể hiện dung dịch có tính axit và giá trị lớn hơn 7 thể hiện dung dịch bazơ.
Thông thường, giấy tẩm chất chỉ thị thông thường được sử dụng để đo độ pH (xem hình ảnh bên dưới) -
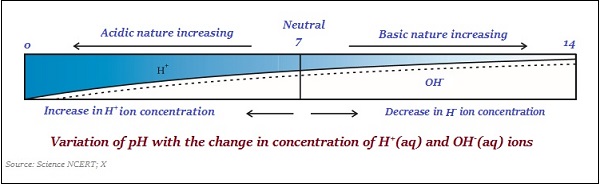
Tương tự như vậy, độ mạnh của axit và bazơ chủ yếu phụ thuộc vào số lượng ion H + và ion OH - được tạo ra tương ứng.
Hình ảnh sau đây minh họa khái quát (các biến thể về màu sắc) giá trị pH của một số chất phổ biến -

Tầm quan trọng của pH trong cuộc sống hàng ngày
Giá trị pH của cơ thể con người nằm trong khoảng từ 7,0 đến 7,8.
Dạ dày của cơ thể con người sản xuất axit clohydric giúp tiêu hóa thức ăn; đáng ngạc nhiên là dù sao nó cũng không gây hại cho dạ dày.
Tuy nhiên, khi dạ dày tạo ra quá nhiều axit (được gọi là khó tiêu), nó sẽ gây ra đau và kích thích. Để giảm bớt cơn đau này, các bác sĩ khuyên bạn nên sử dụng các chất nền được gọi là thuốc kháng axit.
Các thuốc kháng axit này trung hòa và kiểm soát lượng axit tăng lên.
Răng, được tạo thành từ canxi photphat, là chất cứng nhất trong cơ thể. Tuy nhiên, khi độ pH trong miệng giảm xuống (dưới 5,5), nó sẽ ăn mòn răng.
Thông thường, muối được tạo thành do sự kết hợp của axit clohydric và dung dịch natri hydroxit; và, sự kết hợp được gọi là natri clorua.
Khi giá trị pH của nước mưa được đo nhỏ hơn 5,6, nó được gọi là acid rain.
Khi mưa axit chảy vào sông, nó cũng làm giảm độ pH của nước sông
Nước sông có tính axit là mối đe dọa cho sự tồn tại của các loài thủy sinh.
Bột tẩy trắng
Bột tẩy trắng được tạo ra do tác dụng của clo với vôi tôi [Ca (OH) 2 ] khô và nó được đại diện là CaOCl 2 .
Bột tẩy trắng thường được sử dụng trong ngành dệt may, nhà máy giấy, công nghiệp hóa chất và khử trùng nước uống.
Baking Soda
Muối nở thường được sử dụng trong nhà bếp để nấu các món ăn giòn ngon. Nó cũng nấu một số món ăn nhanh hơn.
Tên hóa học của muối nở là natri hiđrocacbonat và công thức là NaHCO 3 .
Soda rửa
Kết tinh lại của natri cacbonat thành soda giặt.
Công thức hóa học của soda wash là Na 2 CO 3 .10H 2 O.
Soda rửa được sử dụng phổ biến trong các ngành sản xuất thủy tinh, xà phòng và giấy.
Thạch cao Paris
Plaster of Paris là một loại bột màu trắng mà các bác sĩ sử dụng làm thạch cao để hỗ trợ xương bị gãy.
Tên hóa học của thạch cao của paris là canxi sulfat hemihydrate và công thức hóa học là 2CaSO 4 .H 2 O.
Giới thiệu
Các kim loại có thể được phân biệt với các phi kim loại trên cơ sở các tính chất hóa học và vật lý của chúng.
Tính chất của kim loại mà chúng có thể được đập thành các tấm mỏng được gọi là malleability.
Tính chất của kim loại mà nó có thể được kéo thành dây được gọi là ductility.
Các kim loại thường cứng, dễ uốn, bóng, dẻo, dẻo và dẫn nhiệt và điện tốt. Ví dụ: sắt, đồng, canxi, nhôm, magiê, v.v.

Các vật liệu không thấm nước và dẫn nhiệt và dẫn điện kém, được gọi là non-metals. Ví dụ: lưu huỳnh, cacbon, oxy, phốt pho, v.v.
Một số kim loại, chẳng hạn như sodium và potassium mềm và có thể cắt bằng dao.
Mercury là kim loại duy nhất, vẫn ở trạng thái lỏng ở nhiệt độ thường.
Khi lưu huỳnh đioxit được hòa tan trong nước, axit lưu huỳnh được tạo thành. Hình minh họa - Lưu huỳnh đioxit (SO 2 ) + Nước (H 2 O) → Axit lưu huỳnh (H 2 SO 3 ).
Oxit của phi kim loại có bản chất là axit.
Axit lưu huỳnh làm đổi màu xanh giấy quỳ thành màu đỏ.
Phốt pho là một phi kim loại rất dễ phản ứng và nó bắt lửa bất cứ khi nào tiếp xúc với không khí.
Để ngăn sự tiếp xúc của phốt pho với oxy trong khí quyển, phốt pho được lưu trữ trong nước.
Khi đốt cháy, kim loại dễ dàng phản ứng với oxi và tạo ra oxit kim loại, đây là những chất có tính bazơ.
Phi kim loại phản ứng với oxi và tạo ra oxit phi kim loại; chúng có bản chất axit.
Một số kim loại phản ứng với nước và tạo ra hiđroxit kim loại và khí hiđro.
Các phi kim thường không phản ứng với nước.
Kim loại cũng phản ứng với axit và tạo ra khí hiđro và muối kim loại.
Các phi kim loại thường không phản ứng với axit.
Công dụng của kim loại và phi kim loại
Kim loại được sử dụng để chế tạo máy móc, máy bay, ô tô, tàu hỏa, vệ tinh, thiết bị công nghiệp, dụng cụ nấu ăn, nồi hơi nước, v.v.
Các phi kim loại được sử dụng trong phân bón để cải thiện sự phát triển của cây trồng.
Phi kim loại được sử dụng trong lọc nước.
Các phi kim loại được sử dụng trong bánh quy giòn.
Giới thiệu
Một vật liệu rắn, thường cứng, dễ uốn, sáng bóng, dễ chảy và dễ uốn, được gọi là kim loại. Ví dụ: sắt, đồng, nhôm, magiê, natri, chì, kẽm, v.v.
Thông thường, kim loại có tính dẫn điện và dẫn nhiệt tốt.

Kim loại, ở trạng thái tinh khiết, có bề mặt sáng, được gọi là metallic luster.
Kim loại có thể được đập thành các tấm mỏng; tài sản này được gọi làmalleability.
Đặc tính của kim loại được kéo thành dây mỏng được gọi là ductility. Vd: vàng là kim loại dễ uốn nhất.
Bạc và đồng là chất dẫn nhiệt tốt nhất.
Phi kim loại
Các phi kim loại thường được tìm thấy ở trạng thái rắn hoặc khí. Tuy nhiên, brom là một ngoại lệ được tìm thấy ở trạng thái lỏng.
Một số ví dụ chính về phi kim loại là cacbon, lưu huỳnh, iot, oxy, hydro, v.v.

Sự kiện về kim loại và phi kim loại
Tất cả các kim loại đều tồn tại ở thể rắn ở nhiệt độ thường, trừ thủy ngân.
Gali và xêzi có điểm nóng chảy rất thấp; hai kim loại này bị tan chảy ngay cả trên lòng bàn tay.
Iốt là một phi kim loại, nhưng nó có độ bóng (bóng là tính chất của kim loại).
Carbon là một phi kim loại có thể tồn tại ở các dạng khác nhau. Mỗi dạng được gọi là một allotrope.
Kim cương là một dạng thù hình của cacbon và nó là chất tự nhiên cứng nhất được biết đến.
Nhiệt độ nóng chảy và sôi của kim cương rất cao.
Graphit cũng là dạng thù hình của cacbon; nó là một chất dẫn điện.
Kim loại kiềm, chẳng hạn như liti, kali, natri, là những ví dụ về kim loại mềm, vì chúng có thể được cắt bằng dao.
Gần như tất cả các kim loại khi kết hợp với oxi đều tạo thành oxit kim loại.
Các kim loại khác nhau có tần số phản ứng khác nhau; một số phản ứng chậm, nhưng một số phản ứng rất nhanh. Ví dụ: kali và natri rất dễ phản ứng và chúng chỉ bắt lửa nếu để ngoài trời.
Do đó, kali và natri được giữ trong dầu hỏa để chúng không thể bắt lửa.
Tuy nhiên, trong số tất cả các kim loại, natri (nhiều khả năng), là kim loại phản ứng mạnh nhất.
Anodizing là một quá trình hình thành một lớp oxit nhôm bảo vệ dày và nó bảo vệ khỏi sự ăn mòn.
Các nguyên tố hoặc hợp chất xuất hiện tự nhiên trong lớp vỏ (lớp trên) của trái đất, được gọi là khoáng chất.
Các khoáng chất ở dạng thô được gọi là ores. Ví dụ: vàng, bạc, sắt, v.v. (quặng sắt được hiển thị trong hình dưới đây) -

Quặng, được khai thác từ trái đất, thường bị nhiễm một lượng lớn tạp chất như trộn với một số nguyên tố, đất, cát, v.v., được gọi là ‘gangue’.
Dựa trên bản chất phản ứng và sự khai thác từ quặng, kim loại có thể được phân loại thành:

Giới thiệu
Carbon đóng vai trò rất quan trọng đối với mọi sinh vật.
Lượng cacbon trong vỏ trái đất chỉ là 0,02%, có sẵn ở dạng khoáng chất như cacbonat, hydro-cacbonat, than đá và dầu mỏ.
Sự hiện diện của cacbon trong bầu khí quyển của trái đất là 0,03%, ở dạng cacbon đioxit.
Hợp chất của cacbon
Hầu hết tất cả các hợp chất cacbon (trừ một số ít) là chất dẫn điện kém.
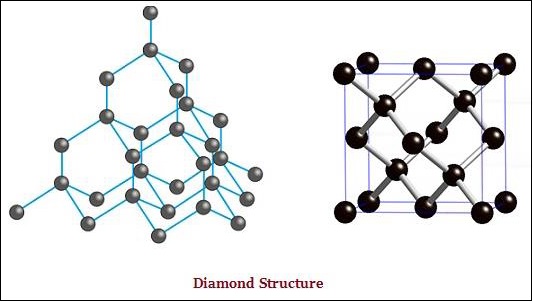
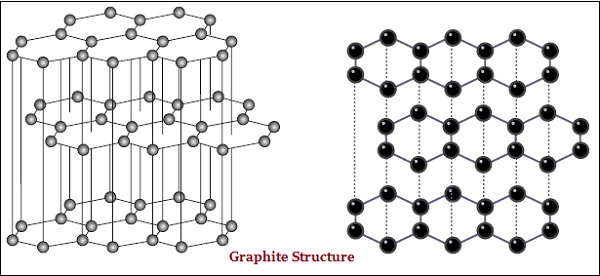
Cả kim cương và than chì đều được hình thành bởi các nguyên tử cacbon; tuy nhiên, sự khác biệt nằm giữa chúng ở cách mà các nguyên tử cacbon được liên kết với nhau.
Trong kim cương, mỗi nguyên tử cacbon, được liên kết với bốn nguyên tử cacbon khác và tạo thành một cấu trúc ba chiều cứng nhắc (xem hình bên dưới).
Trong than chì, mỗi nguyên tử cacbon, được liên kết với ba nguyên tử cacbon khác trong cùng một mặt phẳng, tạo ra một mảng lục giác (xem hình bên dưới) -
Ngoài ra còn có sự khác biệt trong một số cấu trúc vật lý của kim cương và than chì.
Kim cương là chất cứng nhất được biết đến trong khi than chì là chất trơn và trơn.
Graphit là chất dẫn điện tốt trong khi kim cương thì không.
Bảng sau minh họa cấu trúc của các hợp chất của cacbon và hydro -
| Tên | Công thức | Kết cấu |
|---|---|---|
| Mêtan | CH 4 |

|
| Etane | C 2 H 6 |

|
| Propan | C 3 H 8 |

|
| Butan | C 4 H 10 |

|
| Pentane | C 5 H 12 |

|
| Hexane | C 6 H 14 |

|
Các hợp chất có công thức phân tử giống hệt nhau, nhưng cấu trúc khác nhau, được gọi là structural isomers (xem cấu trúc Butan cho bên dưới).

Các hydrocacbon no được gọi là alkanes.
Các hydrocacbon không no, bao gồm một hoặc nhiều liên kết đôi, được gọi là alkenes.
Các hydrocacbon không no, bao gồm một hoặc nhiều liên kết ba, được gọi là alkynes.
Sử dụng rượu làm nhiên liệu
Cây mía chuyển đổi rất hiệu quả ánh sáng mặt trời thành năng lượng hóa học và nước ép của nó có thể được sử dụng để chế biến mật đường.
Khi mật mía được lên men, nó tạo ra rượu (etanol).
Một số quốc gia hiện đang sử dụng cồn như một chất phụ gia trong xăng, vì nó là một loại nhiên liệu sạch hơn.
Những rượu này, khi đốt cháy trong không khí vừa đủ (oxy), chỉ tạo ra carbon dioxide và nước.
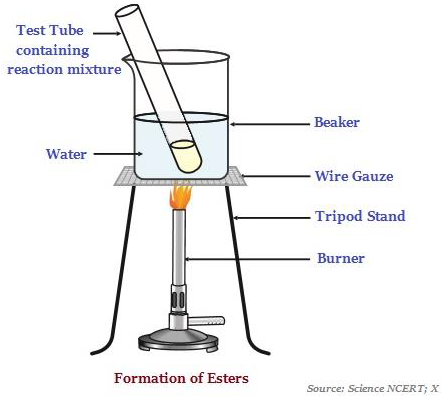
Este
Este là những chất có mùi ngọt, thường được tạo thành bởi phản ứng của một axit và một rượu (xem hình ảnh bên dưới - minh họa sự hình thành của este).
Khi este phản ứng với sự có mặt của axit hoặc bazơ, nó sẽ tạo ra rượu và axit cacboxylic.
Phản ứng của este với axit hoặc bazơ, được gọi là saponification bởi vì nó được sử dụng để điều chế xà phòng.
Các phân tử của xà phòng thường là muối natri hoặc muối kali của axit cacboxylic mạch dài.
Điều thú vị là phần cuối ion của xà phòng hòa tan trong nước trong khi chuỗi cacbon hòa tan trong dầu. Đặc điểm điển hình này của các phân tử xà phòng tạo thành cấu trúc được gọi làmicelles (xem hình ảnh dưới đây)

Trong mixen, một đầu của các phân tử hướng về giọt dầu trong khi đầu ion vẫn ở bên ngoài.
Micelle xà phòng giúp hòa tan chất bẩn trong nước; tương tự như vậy, quần áo được giặt sạch.
Mặt khác, chất tẩy rửa thường là muối amoni hoặc sulphonat của axit cacboxylic mạch dài, vẫn có tác dụng ngay cả trong nước cứng.
Chất tẩy rửa thường được sử dụng để làm dầu gội đầu và một số sản phẩm khác để làm sạch quần áo.
Giới thiệu
Có khoảng 115 nguyên tố đã được chúng ta biết đến cho đến ngày nay.
Dựa trên tính chất của chúng, tất cả các nguyên tố được sắp xếp theo thứ tự, được gọi là bảng tuần hoàn.
Johann Wolfgang Döbereiner, một nhà khoa học người Đức, lần đầu tiên cố gắng sắp xếp các nguyên tố vào năm 1817.
John Newlands, một nhà khoa học người Anh, cũng đã cố gắng sắp xếp các nguyên tố khi đó được biết đến (năm 1866).
John Newlands đã theo thứ tự khối lượng nguyên tử tăng dần để sắp xếp các nguyên tố.
Newlands bắt đầu với nguyên tố có khối lượng nguyên tử thấp nhất (chẳng hạn như hydro) và kết thúc ở thori, nguyên tố thứ 56 (vào thời của ông).

Sự sắp xếp các phần tử của Newlands được gọi là “Định luật Bát phân”, như trong cách sắp xếp của ông, mỗi tám phần tử có các đặc tính tương tự như phần thứ nhất. Ví dụ các tính chất của liti và natri giống nhau.
| Sa (làm) | lại (lại) | Ga (mi) | Ma (fa) | Pa (vậy) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H | Li | Là | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
| Co & Ni | Cu | Zn | Y | Trong | Như | Se |
| Br | Rb | Sr | Ce & La | Zr |
Newlands cũng so sánh nó với các quãng tám trong âm nhạc (xem bảng ở trên).
Trong âm nhạc Ấn Độ, bảy nốt nhạc là - sa, re, ga, ma, pa, da, ni; tuy nhiên, ở phương Tây, các nốt nhạc là - do, re, mi, fa, so, la, ti.
Hơn nữa, để phù hợp với một số phần tử vào Bảng của mình, Newlands đặt hai phần tử vào cùng một ô (xem bảng đưa ra ở trên - coban & niken được giữ trong cùng một ô), nhưng kỹ thuật này không hoạt động, vì chúng có các thuộc tính khác nhau.
Tuy nhiên, định luật về quãng tám có giới hạn, chỉ áp dụng được cho canxi; và, sau canxi, mỗi nguyên tố thứ tám không có các đặc tính tương tự như nguyên tố đầu tiên.
Bảng tuần hoàn của Mendeléev
Dmitri Ivanovich Mendeléev, một nhà hóa học người Nga, người đã cố gắng sắp xếp thành công các nguyên tố.
Mendeléev đã sắp xếp các nguyên tố dựa trên tính chất cơ bản (nguyên tố) của chúng, khối lượng nguyên tử, cũng như tính chất hóa học giống nhau.
Trong thời Mendeleev, chỉ có 63 nguyên tố được biết đến.
Bảng tuần hoàn của Mendeléev bao gồm các cột dọc được gọi là ‘groups’ và các hàng ngang được gọi là ‘periods.’

Định luật tuần hoàn của Mendeléev phát biểu rằng
'Tính chất của các nguyên tố là hàm tuần hoàn của khối lượng nguyên tử của chúng'.
Mendeléev đã sắp xếp trình tự theo kiểu đảo ngược để các nguyên tố có tính chất tương tự có thể được nhóm lại với nhau.
Mendeléev đã để lại khoảng trống cho một số nguyên tố, những nguyên tố này chưa được phát hiện vào thời điểm đó; ông đã mạnh dạn dự đoán về sự tồn tại của các nguyên tố trong tương lai.
Một trong những hạn chế lớn nhất của công thức Tuần hoàn của Mendeléev là - không có vị trí cố định nào được gán cho hydro trong Bảng tuần hoàn.
Bảng tuần hoàn hiện đại
Năm 1913, Henry Moseley, một nhà vật lý người Anh đã phát hiện ra rằng số nguyên tử của một nguyên tố là một tính chất cơ bản hơn so với khối lượng nguyên tử của nó.
Dựa trên khám phá của Moseley, Định luật tuần hoàn của Mendeléev đã được sửa đổi và số nguyên tử được sử dụng làm cơ sở của Bảng tuần hoàn hiện đại.
Luật định kỳ hiện đại quy định -
'Tính chất của các nguyên tố là một hàm tuần hoàn của số nguyên tử của chúng.'
18 cột dọc được gọi là 'groups'và 7 hàng ngang được gọi là 'thời kỳ' được xác định trong Bảng tuần hoàn hiện đại.
Trong Bảng tuần hoàn hiện đại, các nguyên tố được sắp xếp sao cho nó thể hiện tính tuần hoàn của các tính chất như kích thước nguyên tử, hóa trị hoặc khả năng kết hợp và đặc tính kim loại và phi kim loại (của các nguyên tố).
Trong Bảng tuần hoàn hiện đại, đặc tính kim loại giảm dần trong một khoảng thời gian và tăng dần theo nhóm.
Mặt khác, các phi kim loại có tính âm điện, vì chúng có xu hướng tạo liên kết bằng cách thu nhận các electron.
Trong Bảng tuần hoàn hiện đại, các phi kim loại được đặt ở phía bên tay phải (từ trên xuống).
Giới thiệu
Quần áo chúng ta mặc được làm từ vải và vải được làm từ sợi, được lấy từ các nguồn tự nhiên hoặc nhân tạo.
Nguồn tự nhiên của sợi là bông, len, tơ tằm, vv, được lấy từ thực vật hoặc động vật.
Các sợi tổng hợp được tạo ra bởi con người; do đó, chúng được gọi là sợi tổng hợp hoặc sợi nhân tạo.
Sợi tổng hợp thường là một chuỗi các đơn vị nhỏ liên kết với nhau; mỗi đơn vị nhỏ là một chất hóa học.
Các loại sợi tổng hợp
Tơ nhân tạo thường được gọi là Rayon.
Rayon (sợi) thu được bằng cách xử lý hóa học bột gỗ.
Sợi, được điều chế từ than, nước và không khí, được gọi là Nylon.

Nylon là sợi tổng hợp hoàn toàn đầu tiên.
Polyester is also a synthetic fiber; it is wrinkle free fiber. E.g. Terylene.
PET is one of the familiar form of polyesters and it is used for making utensils, bottles, films, wires, and many other useful products.
Polyester (Poly + ester) is made up of the repeating units of a chemical known as an ester.
Plastic is also a sort of polymer like the synthetic fiber.
Polythene (Poly + ethene) is a common example of a plastic.
There are some plastics, which when molded once, cannot be softened by heating; therefore, these are known as thermosetting plastics. E.g. Bakelite and melamine.
Bakelite is a poor conductor of heat and electricity; therefore, it is used in making electrical switches, handles of various utensils, etc.
Melamine resists fire and can tolerate heat better than other plastics; therefore, it is used for making floor tiles, kitchenware, and fabrics.
A material, which gets decomposed through the natural processes, e.g. action by bacteria, is known as biodegradable.
A material, which cannot be easily decomposed by natural processes, is known as non-biodegradable.
Plastic is not an environment friendly.
Introduction
The resources, which are present in unlimited quantity in nature and are not likely to be exhausted by human activities, are known as Inexhaustible Natural Resources. E.g. sunlight, air.
The resources, which are present in limited quantity in nature and are likely to be exhausted by human activities, are known as Exhaustible Natural Resources. E.g. forests, wildlife, minerals, coal, petroleum, natural gas etc.
Exhaustible natural resources were formed from the dead remains of living organisms (fossils); therefore, these natural resources are also known as fossil fuels. E.g. coal, petroleum and natural gas.
Coal
Coal is hard as stone and black in color.
Coal is one of the fuels used to cook food.

Coal is used in thermal power plants to produce electricity.
Under high pressure and high temperature, the dead plants those got buried inside the Earth, got slowly converted into coal.
Coal contains mainly carbon.
The slow process of conversion of dead vegetation into coal is known as carbonization.
Coal is formed from the remains of vegetation; therefore, it is also known as fossil fuel.
When coal burns, it produces mainly carbon dioxide gas.
When coal is processed in industry, it produces some useful products such as coke, coal tar, and coal gas.
Coke is a hard, porous, and black substance.
Coke is pure form of carbon.
Coke is largely used in the manufacturing of steel and in the extraction of many metals.
Coal tar is a black, thick liquid with unpleasant smell.
Coal tar is mixture of about 200 substances.
The products, those are obtained from coal tar, are used as starting materials for manufacturing various substances used in everyday life and in industry. E.g. explosives, paints, roofing materials, synthetic dyes, drugs, perfumes, plastics, photographic materials, etc.
Naphthalene balls, obtained from coal tar, are used to repel moths and other insects.
Bitumen, obtained from petroleum product, is used in place of coal-tar for metalling the roads.
During the processing of coal to get coke, coal gas is obtained.
In 1810, for the first time in London, UK, coal gas was used for street lighting and in 1820, in New York, USA.
At present, coal gas is used as a source of heat.
Petroleum
Petrol and diesel are obtained from a natural resource known as petroleum.
Petroleum was formed from the organisms living in the sea.
Over millions of years (the dead organisms buried inside the earth), in the presence high temperature, high pressure, and in the absence of air, the dead organisms transformed into petroleum and natural gas.
In 1859, the world’s first oil well was drilled in Pennsylvania, USA.
In 1867, oil was stuck at Makum in Assam, India.
In India, petroleum is largely found in Assam, Gujarat, Mumbai High, Maharashtra, and in the river basins of Godavari and Krishna.
The following image illustrates the layer of gas and oil −

Petroleum is a mixture of various constituents such as petrol, petroleum gas, diesel, lubricating oil, paraffin wax, etc.
The process of separating the various constituents of petroleum is known as refining.
The different useful substances, which are obtained from the petroleum and natural gas, are known as ‘Petrochemicals.’
Petrochemicals are used in the manufacturing of detergents, fibers (polyester, nylon, acrylic etc.), polythene and other man-made plastics.
Hydrogen gas, which is obtained from natural gas, is used in the production of fertilizers (urea).
Because of having the great commercial importance, petroleum is also known as ‘black gold.’
Natural gas is normally stored under high pressure and hence known as Compressed Natural Gas (CNG).
CNG is used for power generation and fuel for vehicles.
The following table illustrates various constituents of petroleum and their uses −
| Các thành phần của dầu mỏ | Sử dụng |
|---|---|
| Khí dầu mỏ ở dạng lỏng (LPG) | Nhiên liệu cho gia đình và công nghiệp |
| Xăng dầu | Nhiên liệu động cơ, nhiên liệu hàng không, dung môi giặt khô |
| Dầu diesel | Nhiên liệu cho xe có động cơ hạng nặng, máy phát điện |
| Dầu hỏa | Nhiên liệu cho bếp lò, đèn và máy bay phản lực |
| Dầu bôi trơn | Bôi trơn |
| Sáp parafin | Thuốc mỡ, nến, Vaseline, v.v. |
| Bitum | Sơn, bề mặt đường |
Giới thiệu
Một quá trình hóa học trong đó một chất phản ứng với oxy và tỏa nhiệt được gọi là combustion.
Chất trải qua quá trình đốt cháy được gọi là combustible hoặc là fuel.
Nhiên liệu có thể ở dạng rắn, lỏng hoặc khí.
Trong quá trình đốt cháy, ánh sáng cũng được phát ra dưới dạng flame hoặc như một glow.

Các chất bốc hơi trong thời gian cháy, sinh ra ngọn lửa.
Có ba vùng khác nhau gồm vùng tối ngọn lửa, vùng phát sáng và vùng không phát sáng.

Các chất khác nhau bắt lửa ở các nhiệt độ khác nhau.
Nhiệt độ thấp nhất mà tại đó một chất bắt lửa được gọi là ignition temperature.
Một que diêm chứa antimon trisulphide và kali clorat.
Bề mặt cọ xát của diêm có chứa bột thủy tinh và một ít phốt pho đỏ.
Phốt pho đỏ ít nguy hiểm hơn nhiều.
Khi que diêm đập vào bề mặt cọ xát, một số phốt pho đỏ chuyển thành phốt pho trắng; Quá trình phản ứng ngay lập tức với kali clorat có trong đầu que diêm và tạo ra đủ nhiệt để đốt cháy antimon trisulphide; tương tự như vậy, quá trình đốt cháy bắt đầu.
Các chất có nhiệt độ bắt lửa rất thấp và có thể dễ dàng bắt lửa với ngọn lửa, được gọi là inflammable substances. Ví dụ. xăng, cồn, khí dầu mỏ hóa lỏng (LPG), v.v.
Bình cứu hỏa
Water là bình chữa cháy thông dụng nhất.
Nước, như một chất chữa cháy, chỉ hoạt động khi những thứ như gỗ và giấy đang cháy.

Nếu thiết bị điện bị cháy, nước có thể dẫn điện và làm hỏng những thiết bị cố gắng dập lửa.
Nước cũng không phải là chất chữa cháy tốt cho các đám cháy liên quan đến dầu và xăng.
Đối với các đám cháy liên quan đến thiết bị điện và vật liệu dễ cháy như xăng, Carbon Dioxide (CO2) là chất chữa cháy tốt nhất.

Một trong những cách để lấy CO2 là giải phóng nhiều hóa chất dạng bột khô như natri bicacbonat (muối nở) hoặc kali bicromat.
Phốt pho cháy trong không khí ở nhiệt độ thường.
Nhiệt lượng sinh ra khi đốt cháy hoàn toàn 1 kg nhiên liệu được gọi là calorific value.
Nhiệt trị của nhiên liệu được đo bằng một đơn vị gọi là kilojoule trên kg (kJ / kg).
The following table illustrates the Calorific Values of Different Fuels −
| Nhiên liệu | Nhiệt lượng (kJ / kg) |
|---|---|
| Bánh phân bò | 6000-8000 |
| Gỗ | 17000-22000 |
| Than đá | 25000-33000 |
| Xăng dầu | 45000 |
| Dầu hỏa | 45000 |
| Dầu diesel | 45000 |
| Mêtan | 50000 |
| CNG | 50000 |
| LPG | 55000 |
| Khí sinh học | 35000-40000 |
| Hydrogen | 150000 |
Đốt cháy hầu hết các loại nhiên liệu carbon dioxide trong môi trường.
Tăng nồng độ carbon dioxide trong không khí rất có thể là nguyên nhân global warming.
Sự gia tăng nhiệt độ của bầu khí quyển của trái đất được gọi là Global Warming.
Sự nóng lên toàn cầu làm tan chảy các sông băng ở hai cực, dẫn đến mực nước biển dâng cao và cuối cùng gây ra lũ lụt ở các vùng ven biển.
Ôxít của lưu huỳnh và nitơ hòa tan trong nước mưa và tạo thành axit; loại mưa như vậy được gọi làacid rain.