Chimica Parte 2 - Guida rapida
introduzione
La chimica è una branca delle scienze naturali che studia la struttura, la composizione e le proprietà mutevoli delle materie.
La chimica studia la parte più piccola di una materia, cioè l'atomo (insieme a tutte le sue proprietà) fino ai materiali più grandi (ad esempio oro, argento, ferro, ecc.) E le loro proprietà.
La chimica studia anche le forze intermolecolari (che forniscono alla materia le proprietà generali) e le interazioni tra le sostanze attraverso le reazioni chimiche.

Nel 1998, il professor Raymond Chang ha definito la chimica come -
"Chimica" per indicare lo studio della materia e dei cambiamenti che essa subisce.
Si ritiene che lo studio della chimica sia iniziato con la teoria dei quattro elementi proposta da Aristotele.
La teoria dei quattro elementi afferma che "fuoco, aria, terra e acqua erano gli elementi fondamentali da cui tutto è formato come combinazione".
A causa del suo lavoro classico, vale a dire “The Sceptical Chymist,” Robert Boyle, è conosciuto come il padre fondatore della chimica.
Boyle formulò una legge, divenne popolare come "Legge di Boyle".
La legge di Boyle è una legge sperimentale sui gas che analizza la relazione tra la pressione di un gas e il volume del rispettivo contenitore.
Sostenendo la sua legge, Boyle ha respinto la classica teoria dei "quattro elementi".
Gli scienziati americani Linus Pauling e Gilbert N. Lewis hanno proposto collettivamente la teoria elettronica dei legami chimici e degli orbitali molecolari.
Le Nazioni Unite hanno dichiarato il 2011 "Anno internazionale della chimica".
La materia è definita in chimica come tutto ciò che ha massa e volume a riposo e occupa anche spazio.
Il matter è costituito da particelle.
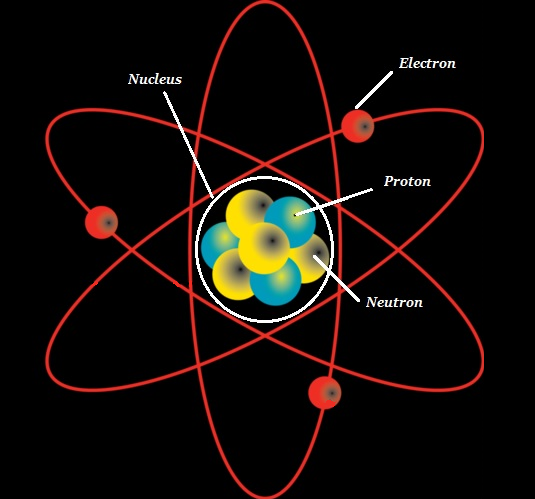
Il atom è l'unità fondamentale della chimica.
L'atomo è costituito da un nucleo denso noto come atomic nucleus ed è circondato da uno spazio noto come electron cloud.
Il nucleo (di un atomo) è composto da protons (+ve charged particles) e neutrons (neutral or uncharged particles); collettivamente, questi due sono noti comenucleons (come mostrato nell'immagine sotto).
Un elemento chimico è una forma pura di una sostanza; è costituito da un singolo tipo di atomo.
La tavola periodica è la rappresentazione standardizzata di tutti gli elementi chimici disponibili.
Un composto è una forma pura di una sostanza; è composto da più di un elemento.
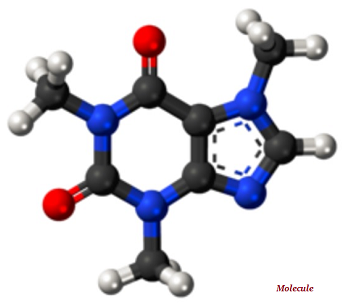
Una molecola è la parte più piccola indivisibile di una sostanza chimica pura; molecola ha un insieme distintivo di proprietà chimiche (vedere l'immagine sotto riportata).
La tabella seguente illustra i rami della chimica:
| Ramo | Sub-ramo | Definizione |
|---|---|---|
| Physical Chemistry | Chimica fisica | Studio delle proprietà fisiche delle molecole |
| Cinetica chimica | Studio delle velocità delle reazioni chimiche | |
| Elettrochimica | Studio dell'interazione di atomi, molecole, ioni e corrente elettrica (ovvero trasferimento di elettroni tra l'elettrodo e l'elettrolita o la specie) | |
| Chimica delle superfici | studio delle reazioni chimiche alle superfici (delle sostanze) | |
| Termochimica | Studia la relazione tra l'azione chimica e la quantità di calore assorbita | |
| Chimica quantistica | Studio dell'applicazione della meccanica quantistica a modelli fisici | |
| Spettroscopia | Studio di spettri di luce o radiazione | |
| Fotochimica | studio degli effetti chimici causati dalla luce | |
| Organic Chemistry | Chimica organica | Studio della struttura, delle proprietà e della preparazione dei composti chimici (carbonio) (es. Combustibili, plastica, additivi alimentari e farmaci) |
| Stereochimica | Studio della disposizione spaziale relativa degli atomi (in molecole) | |
| Chimica organica fisica | studio della struttura e della reattività (interrelazione) in molecole organiche | |
| Chimica dei polimeri | Studio di molecole polimeriche (composizione e creazione) | |
| Chimica organometallica | Studio di sostanze chimiche che contengono legami (soprattutto tra un carbonio e un metallo) | |
| Chimica medicinale | Studio della progettazione, sviluppo e sintesi di farmaci e medicinali | |
| Inorganic chemistry | Chimica inorganica | Studio di tutti i materiali che non sono organici (come minerali, metalli, catalizzatori, strutture cristalline, ecc.) |
| Chimica organometallica | Studio di composti chimici contenenti legami (soprattutto tra carbonio e metallo) | |
| Chimica allo stato solido | Studio di composti chimici che contengono legami tra carbonio e metallo | |
| Chimica nucleare | Studio di sostanze radioattive | |
| Geochimica | Studio della composizione chimica della terra (es. Rocce, minerali e atmosfera) | |
| Chimica bioinorganica | Studio delle interazioni tra ioni metallici e tessuto vivente | |
| Chimica di coordinamento | ||
| Biochemistry | Biochimica | Studio della reazione chimica (e dei cambiamenti) negli esseri viventi |
| Biochimica molecolare | Studio delle biomolecole e delle loro funzioni | |
| Biochimica clinica | Studio dei cambiamenti chimici negli esseri viventi, causati da malattie diverse | |
| Biologia molecolare | Studio dei diversi tipi di DNA, RNA e biosintesi proteica (e loro relazioni) | |
| Biochimica agraria | Studio di chimica della fauna (es. Piante) | |
| Analytical Chemistry | Studio di metodi sperimentali standardizzati in chimica (cioè determinazione quantitativa delle proprietà chimiche di una sostanza) | |
| Astrochemistry | Studio delle reazioni di elementi chimici e molecole presenti nell'universo | |
| Cosmochemistry | Studio della composizione chimica delle materie presenti nell'universo | |
| Environmental chemistry | Studio dei fenomeni chimici e biochimici che avvengono nell'ambiente |
introduzione
Il processo di emissione di particelle dai nuclei a causa dell'instabilità nucleare; è noto come radioattività.
La sostanza che rilascia tale energia / raggi è nota come sostanza radioattiva.
I raggi invisibili rilasciati da tale sostanza radioattiva sono noti come raggi radioattivi.
Allo stesso modo, la radioattività è un fenomeno nucleare che si verifica (naturalmente) a causa dell'instabilità nucleare degli atomi.
Nel 1896 Henri Becquerel osservò per la prima volta i fenomeni della radioattività, ma il termine "radioattività" fu coniato da Marie Curie.
Marie Curie ha scoperto gli elementi radioattivi, vale a dire il polonio e il radio, nel 1898.
Per la sua scoperta, Marie Curie ha vinto il Premio Nobel.
Raggi radioattivi
Dopo lunghi anni di esperimenti, Ernest Rutherford insieme al suo collega (Hans Geiger e il suo allievo Ernest Marsden), scoprirono i raggi alfa, beta e gamma.
Questi raggi sono emessi come risultato della disintegrazione degli atomi.
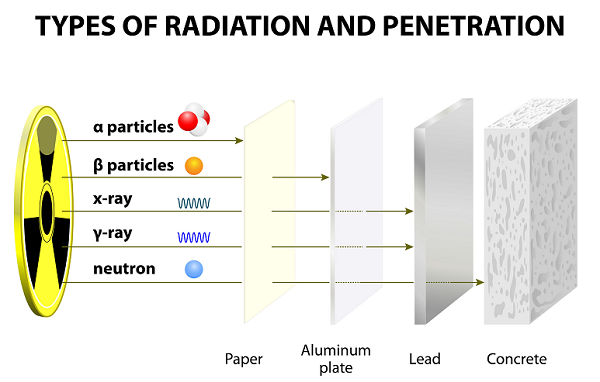
Particelle alfa (α)
Le particelle alfa sono solitamente composte da due protoni e due neutroni, che sono strettamente legati insieme.
Le particelle alfa vengono rilasciate durante il decadimento radioattivo (o decadimento alfa) dai radionuclidi del nucleo.
Le particelle alfa sono identiche al nucleo del normale atomo di elio o dell'atomo di elio doppiamente ionizzato.
In confronto ad altre particelle (cioè Gamma e Beta), le particelle alfa sono pesanti e lente. Pertanto, le particelle alfa hanno una portata molto piccola nell'aria.
A causa della bassa velocità, le particelle alfa hanno poteri di penetrazione molto deboli; queste particelle vengono addirittura fermate da un sottile foglio di carta (vedi immagine sopra).
A causa della doppia carica positiva, le particelle alfa sono altamente ionizzanti.
Particelle beta (β)
Le particelle beta sono gli elettroni in rapido movimento emessi da alcuni radionuclidi durante il decadimento radioattivo (noto anche come decadimento beta).
Le particelle beta sono di peso molto più leggero e trasportano una singola carica negativa.
Le particelle beta sono raramente ionizzanti rispetto alle particelle alfa.
A causa del peso più leggero, le particelle beta possono viaggiare molto più lontano delle particelle alfa; tuttavia, le particelle beta possono essere bloccate da diversi fogli di carta o da un foglio di alluminio.
Le particelle beta sono caricate negativamente e vengono attratte da particelle caricate positivamente.
Particelle gamma (ү)
Le particelle gamma sono il fascio di alta energia ovvero l'energia elettromagnetica (fotone) emessa dagli elementi radioattivi durante il decadimento radioattivo.
Tra tutte e tre le particelle (alfa, beta e gamma), le particelle gamma sono i fotoni più energetici.
Le particelle gamma, che sono la forma della radiazione elettromagnetica (EMR), provengono dal nucleo.
Le lunghezze d'onda della gamma sono le più corte tra tutte e tre.
Le particelle gamma non hanno carica e sono neutre; pertanto, non sono influenzati dai campi magnetici ed elettrici.
Usi degli elementi radioattivi
Gli elementi radioattivi sono usati in -
Campo medico (trattamento di molte malattie)
Processo industriale
Produzione di energia - Reattori nucleari
introduzione
Le reazioni nucleari rilasciano un'enorme quantità di energia (nota come energia nucleare), che viene utilizzata per produrre elettricità in una centrale nucleare.

L'energia nucleare normalmente prodotta da nuclear fission, nuclear fusion, e nuclear decay.
Nel 1938, i chimici tedeschi Otto Hahn, Fritz Strassmann e il fisico austriaco Lise Meitner condussero gli esperimenti in cui i prodotti dell'uranio bombardato da neutroni. Come risultato di questo esperimento, il neutrone relativamente piccolo ha diviso il nucleo dei massicci atomi di uranio in due pezzi più o meno uguali e ha rilasciato un'enorme energia.
Gli esperimenti nucleari di Otto Hahn e dei suoi colleghi sono popolari come fissione nucleare.
Fissione nucleare
Il processo di fissione nucleare produce neutroni liberi e fotoni gamma, mentre facendo ciò rilascia anche una grande quantità di energia.
La fissione nucleare è una reazione esotermica, che può rilasciare grandi quantità di energia sotto forma di radiazione elettromagnetica e energia cinetica.
La fissione nucleare, a volte, può avvenire naturalmente (cioè senza bombardamento di neutroni) come un tipo di decadimento radioattivo.
Tipi di fissione nucleare
Di seguito sono riportati i principali tipi di fissione nucleare:
Chain Reaction and
Fission Reaction
Discutiamoli in breve -
Reazione a catena
Quando una singola reazione nucleare provoca una o più reazioni nucleari successive, è nota come reazione a catena.
Tale reazione a catena aumenta la possibilità di una serie di reazioni nucleari che si auto-propagano.
Le reazioni nucleari a catena rilasciano milioni di volte più energia per reazione rispetto a qualsiasi altra reazione chimica; pertanto, è anche noto come reazione a catena esplosiva o incontrollata.
Quando un atomo pesante sperimenta la fissione nucleare, normalmente si rompe in due o più frammenti di fissione. Durante il processo, vengono emessi diversi neutroni liberi, raggi gamma e neutrini e alla fine viene rilasciata una grande quantità di energia.
Di seguito sono riportati i due esempi di reazione a catena:
235 U + → frammenti di fissione neutronica + 2,4 neutroni + 192,9 MeV
235 Pu + → frammenti di fissione dei neutroni + 2,9 neutroni + 198,9 MeV
Nella bomba atomica viene utilizzata la tecnologia della reazione a catena, poiché richiedeva una fonte di energia costante.
Reazioni di fissione
La reazione di fissione in cui i neutroni (prodotti dalla fissione di atomi di carburante) vengono utilizzati per indurre ancora più fissione per il rilascio di energia sostenibile, è nota come reazioni di fissione.
Tali reazioni sono lente e controllabili; pertanto, noto anche come reazione a catena controllata.
Il reattore nucleare che produce energia (elettricità) è un esempio ideale di reazione a catena controllata.
In base alle proprietà e al tipo di utilizzo, la fissione / reazione a catena controllata è classificata come:
Power reactors
Research reactors
Breeder reactors
Questi reattori di potenza generalmente convertono l'energia cinetica dei prodotti di fissione in calore; inoltre, il calore viene utilizzato per riscaldare un fluido di lavoro che aziona un motore termico, che alla fine genera energia meccanica o elettrica.
Componenti di base del reattore nucleare
Di seguito sono riportati i componenti essenziali di un reattore nucleare:
Nuclear fuels- Come l'uranio ( 233 U, 235 U), il torio (Th 232 ), il plutonio (Pu 239 ).
Moderators- Utilizzato per controllare i neutroni emessi. Ad esempio acqua pesante, berillio, grafite, ecc.
Coolant- Viene utilizzato per raffreddare il reattore. Ad esempio acqua, vapore, elio, CO 2 , aria, metalli fusi, ecc.
Control rods- Viene utilizzato per avviare e arrestare la reazione di fissione. Ad esempio, vengono utilizzate barre di cadmio o boro a tale scopo.
Fusione nucleare
Il processo mediante il quale due nuclei leggeri vengono fusi per formare un nucleo pesante è noto come fusione nucleare; durante questo processo, viene rilasciata un'enorme quantità di energia nota come energia nucleare.
Il miglior esempio di fusione nucleare è: bomba all'idrogeno.
Una bomba all'idrogeno è circa 1.000 volte più potente di una bomba atomica.
introduzione
Il materiale (che potrebbe essere un elemento, un composto o una lega) che è tipicamente duro, lucido, opaco e ha la proprietà di condurre calore ed elettricità, è noto come metallo.
I metalli si trovano naturalmente nella crosta terrestre in forma impura, cioè i minerali. E viene estratto attraverso il processo di mining.
Tra tutti i 118 elementi conosciuti (della tavola periodica), circa 91 elementi sono metalli.

Caratteristiche dei metalli
Di seguito sono riportate le caratteristiche significative dei metalli:
I metalli sono generalmente malleabili: significa che la loro forma può essere modificata in modo permanente senza rompersi e rompersi.
I metalli sono fusibili - significa; può essere fuso o sciolto facilmente.
I metalli sono duttili - significa; può essere dato qualsiasi forma anche un foglio sottile o un filo.
I metalli sono un buon conduttore di calore ed elettricità; heaver, il piombo è un'eccezione, poiché non trasporta elettricità.
I metalli reagiscono naturalmente con vari non metalli e formano composti. I metalli possono reagire con basi e acidi. Ad esempio 4 Na + O 2 → 2 Na 2 O (ossido di sodio), ecc.
Leghe
Una lega è un prodotto della miscela di due o più elementi in cui domina il metallo.
Per produrre o fabbricare un prodotto desiderabile, vengono mescolati diversi metalli (in rapporti diversi) (cioè leghe). Ad esempio, le leghe di ferro, ovvero l'acciaio inossidabile, la ghisa, le lamiere di lega, ecc. Contribuiscono in larga misura sia in quantità che in valore commerciale.
I metalli sono solitamente leghe realizzate con lo scopo di renderlo più resistente alla corrosione, meno fragile, per dare colori attraenti, ecc.
Terminologie metalliche
Base Metal- In chimica, il significato di metallo di base è: il metallo che può essere facilmente ossidato o corroso e che reagisce facilmente con HCl (acido cloridrico diluito) e forma idrogeno. Ad esempio ferro, nichel, zinco, piombo, ecc.
Ferrous Metal- "Ferroso" è una parola latina, che significa la sostanza "contenente ferro". Ad esempio acciaio, ecc.
Heavy Metal- Il metallo che è molto più denso del metallo normale è classificato come metallo pesante. I metalli pesanti sono tossici o velenosi a basse concentrazioni. Ad esempio mercurio (Hg), arsenico (As), cromo (Cr), cadmio (Cd), tallio (Tl) e piombo (Pb).
Precious Metal- Gli elementi metallici, che hanno un raro elemento chimico metallico di alto valore economico, sono classificati come metalli preziosi. Ad esempio platino, oro, argento, palladio, ecc.
Noble Metal- I metalli resistenti alla corrosione o all'ossidazione. Ad esempio rutenio (Ru), rodio (Rh), palladio (Pd), ecc.
Applicazione dei metalli
Di seguito sono riportate le applicazioni significative dei metalli:
Poiché i metalli sono un buon conduttore di calore ed elettricità; pertanto, viene utilizzato come filo elettrico e in molti altri apparecchi elettrici inclusi motori elettrici, ecc. Es. rame, argento, alluminio, ecc.
I metalli pesanti vengono utilizzati nella costruzione di ponti, piscine e per molti scopi simili.
Molti metalli vengono utilizzati per produrre vari articoli per la casa, come utensili, pentole, stufe, ecc.
I metalli sono spesso usati per fabbricare molti tipi di strumenti che vanno da un semplice cacciavite a un pesante rullo per aste.
I metalli preziosi hanno un bell'aspetto e sono attraenti (es. Oro, argento, ecc.); quindi, sono usati come ornamenti.
Alcuni metalli specifici vengono utilizzati per i dissipatori di calore che proteggono le apparecchiature sensibili dal surriscaldamento.
I metalli radioattivi (es. Uranio e plutonio) sono usati nella generazione di energia nucleare.
Il mercurio è un metallo che rimane in forma liquida a temperatura ambiente; è usato nel termometro.
Il ramo della scienza e della tecnologia che studia le proprietà dei metalli e la loro produzione e purificazione è noto come metallurgy.
La sostanza inorganica solida presente in natura è nota come a mineral.
Il materiale solido naturale da cui è possibile estrarre minerali o metalli preziosi è noto come ore.
La tabella seguente illustra i principali elementi e i loro minerali:
| Elemento | Minerali | Composizione chimica |
|---|---|---|
| Alluminio | Bauxite | Al 2 O 3 2H 2 O |
| Corindone | Al 2 O 3 | |
| Kryolite | Na 3 AlF 6 | |
| Dispore | Al 2 O 3 .H 2 O | |
| Rame | Pirite di rame | CuFe 2 |
| Malachite | 2CuCO 3 Cu (OH) 2 | |
| Ferro | Ematite | Fe 2 O 3 |
| Magnetite | Fe 3 O 4 | |
| Siderite | FeCO 3 | |
| Sodio | Carbonato di sodio | Na 2 CO 3 |
| Cloruro di sodio | NaCl | |
| Nitrato di sodio | NaNO 3 | |
| Solfato di sodio | Na 2 SO 4 | |
| Potassio | Cloruro di potassio | KCl |
| Carbonato di potassio | K 2 CO 3 | |
| Nitrato di potassio | KNO 3 | |
| Magnesio | Magnesite | MgCO 3 |
| Dolomite | CaMg (CO 3 ) 2 | |
| Sale di Epsom | MgSO 4 | |
| Calcio | Carbonato di calcio | CaCO 3 |
| Lattina | Cassiterite | SnO 2 |
| Piombo | Galena | PbS |
| Cerussite | PbCO 3 | |
| Anglesite | PbSO 4 | |
| Argento | Argentite | Ag 2 S |
| Tetraedrite | Sb 4 S 3 | |
| Zinco | Carbonato di zinco (noto come calamina) | ZnCO 3 |
| Solfuro di zinco | ZnS | |
| Mercurio | Cinabro | HgS |
| Manganese | Pirolusite | MnO 2 |
| Fosforo | Fosforite | Ca 3 (PO 4 ) 2 |
| Fluorapatite | Ca 5 (PO 4 ) 3 F | |
| Clorapatite | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Oro | Calaverite | AuTe 2 |
| Sylvanite | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| Antimonio | Stibnite | Sb 2 S 3 |
| Stibiconite | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Cobalto | Cobaltite | CoAsS |
| Nichel | Pentlandite | ((Ni, Fe) S) |
| Cromo | Cromite | (FeCr 2 O 4 ) |
introduzione
Il sodio è un metallo alcalino morbido, argenteo e altamente reattivo.
Nella tavola periodica, il sodio è contenuto nel gruppo 1, poiché ha un singolo elettrone nel suo guscio esterno.
Il simbolo del sodio è 'Na,'che è stato effettivamente preso dalla parola latina ‘natrium.’
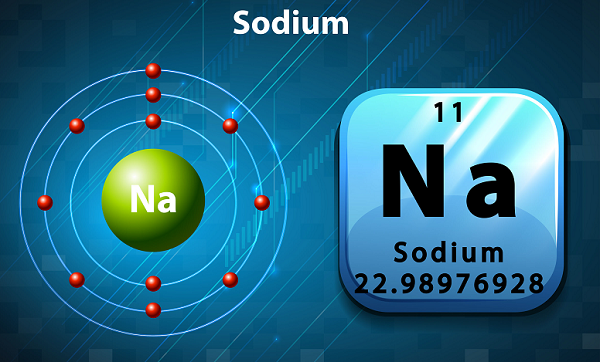
In termini di abbondanza, il sodio è il sesto elemento presente nella crosta terrestre.
Il sodio esiste in vari minerali tra cui feldspati, sodalite e salgemma (NaCl).
Nel 1807 Humphry Davy isolò per la prima volta il sodio mediante l'elettrolisi dell'idrossido di sodio.
Nel tempo si conoscono 20 isotopi del sodio, ma tra tutti solo 23 Na sono stabili.
Caratteristiche salienti del sodio
Di seguito sono riportate le principali caratteristiche dell'elemento sodio:
Sodio metallico un elemento morbido che può essere facilmente tagliato con un coltello.
Il sodio è un buon conduttore di calore ed elettricità.
A causa della bassa massa atomica e dell'ampio raggio atomico, il sodio è uno degli elementi meno densi (terzo elemento meno denso - i primi due sono litio e potassio).
Il sodio può galleggiare sull'acqua.
Il sodio lungo i suoi composti emette una luce gialla (vedi immagine sotto).

I composti del sodio hanno un'importanza commerciale molto elevata e sono molto richiesti nelle industrie del vetro, della carta, del sapone e dei tessuti.
Composti di sodio
Di seguito sono riportati alcuni degli esempi significativi di composti di sodio:
Sale da cucina - (NaCl)
Carbonato di sodio - (Na 2 CO 3 )
Bicarbonato di sodio - (NaHCO 3 )
Soda caustica - (NaOH)
Nitrato di sodio - (NaNO 3 )
Tiosolfato di sodio - (Na 2 S 2 O 3 · 5H 2 O)
Borace - (Na 2 B 4 O 7 · 10H 2 O)
Presenza di sodio
La crosta terrestre contiene circa il 2,27% di sodio.
Il sodio è il 5 ° metallo più abbondante; altri quattro sono alluminio, ferro, calcio e magnesio.
Nell'acqua oceanica, si trovano circa 1,08 × 104 milligrammi di sodio per litro.
Il sodio non si trova come elemento puro, poiché è altamente reattivo.
Usi di sodio
Di seguito sono riportati i principali usi del sodio:
Il cloruro di sodio è molto utile per antigelo e antigelo, nonché come conservante.
In cucina si usa il bicarbonato di sodio.
Il sodio e alcuni dei suoi composti sono usati nei medicinali.
Rispetto al potassio (che è uno ione migliore), il sodio è più frequentemente utilizzato a causa del suo prezzo inferiore e del suo peso atomico.
Nella chimica organica, l'idruro di sodio viene utilizzato come varie reazioni.
Il sodio metallico è utilizzato principalmente per la produzione di boroidruro di sodio, trifenilfosfina di sodio, azide, indaco, ecc.
In alcuni reattori veloci, il sodio liquido viene utilizzato come fluido termovettore a causa della proprietà di una buona conduttività termica.
Il sodio è anche un minerale essenziale per la salute umana, poiché regola la pressione sanguigna, il volume sanguigno, l'equilibrio osmotico e il valore del pH.
La quantità minima di 500 milligrammi di sodio è richiesta ogni giorno per un corpo umano sano.
introduzione
Il calcio è un morbido elemento alcalino giallo-grigiastro che si trova in gran parte nella crosta terrestre.
Il simbolo del calcio è “Ca” e il numero atomico è “20.”
Il calcio libero esiste a malapena in natura, poiché è altamente reattivo.
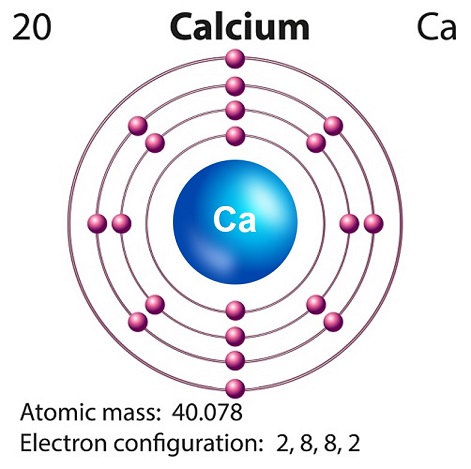
Il calcio è prodotto solitamente nella nucleosintesi della supernova.
Caratteristiche salienti del calcio
Il calcio è uno dei metalli più abbondanti in massa che si trovano in molti animali.
Il calcio è un costituente molto importante di denti, ossa e conchiglie.
Il carbonato di calcio e il citrato di calcio sono i principali integratori alimentari necessari per una buona salute.
L'Organizzazione Mondiale della Sanità (OMS) ha elencato il calcio come i medicinali essenziali.
Rispetto ad altri metalli, lo ione calcio e la maggior parte degli altri composti di calcio hanno una bassa tossicità.
Se il calcio viene a contatto con l'acqua o l'acido, reagisce con essi e diventa pericoloso.
Se il calcio entra in contatto con l'aria, reagisce rapidamente e forma un rivestimento grigio-bianco di nitruro di calcio e ossido di calcio.
La maggior parte dei sali di calcio sono normalmente incolori.
Quando il calcio brucia, il colore della sua fiamma appare rosso mattone (vedere l'immagine sotto riportata).

Il calcio metallico ha una resistività elettrica comparativamente maggiore dell'alluminio o del rame.
Evento
Il calcio si trova solitamente nelle rocce sedimentarie.
I minerali (sedimentari) in cui si trova il calcio sono la calcite, la dolomite e il gesso.
Il calcio si trova anche nelle rocce ignee e metamorfiche principalmente nei minerali silicati, come anfiboli, plagioclasi, pirosseni e granati.
Il calcio si trova anche in molti dei prodotti alimentari, ovvero latticini, mandorle, nocciole, semi di soia, broccoli, foglie di tarassaco, fichi e in molti altri.
Composti di calcio
Ossido di calcio - CaO
Idrossido di calcio - Ca (OH) 2
Cloruro di calcio - CaCl 2
Ipoclorito di calcio (polvere sbiancante) - Ca (ClO) 2
Fosfato di calcio - Ca 3 (PO 4 ) 2
Usi del calcio
Il calcio ha un'ampia gamma di utilizzo, tra cui significativi sono:
Il carbonato di calcio (CaCO 3 ) viene utilizzato nella produzione di cemento.
Il carbonato di calcio (CaCO 3 ) viene anche utilizzato nella produzione di dentifricio.
Negli insetticidi viene utilizzato arseniato di calcio (Ca 3 (AsO 4 ) 2 ).
Il cloruro di calcio (CaCl 2 ) viene utilizzato nella rimozione del ghiaccio e nel controllo della polvere.
Il citrato di calcio (Ca 3 (C 6 H 5 O 7 ) 2 ) è comunemente usato come conservante alimentare.
Il gluconato di calcio (Ca (C 6 H 11 O 7 ) 2 ) è usato frequentemente come additivo alimentare così come nelle pillole vitaminiche.
L'ipoclorito di calcio (Ca (OCl) 2 ) è generalmente utilizzato come disinfettante per piscine, come agente sbiancante.
introduzione
Il metallo con proprietà di colore bianco-argenteo, morbido, non magnetico e duttile, è noto come alluminio.
Il simbolo dell'alluminio è ‘Al’ e il suo numero atomico è ‘13.’
L'elemento chimico alluminio appartiene al gruppo del boro.

- La bauxite è il principale minerale di alluminio.
Caratteristiche salienti dell'alluminio
Il metallo di alluminio è un elemento chimicamente reattivo.
L'alluminio ha il potenziale per resistere alla corrosione e il processo di questa resistività è noto come passivazione.
L'alluminio è un metallo relativamente resistente, leggero, morbido, malleabile e duttile.
L'alluminio non è magnetico e non si accende facilmente.
Una pellicola di alluminio è un ottimo riflettore della luce visibile, poiché riflette oltre il 90 percento dei raggi in arrivo.
L'alluminio reagisce comunemente con l'acqua e forma idrogeno.
L'alluminio è il metallo a bassa densità e ha la proprietà di resistere alla corrosione.
L'alluminio ha la proprietà di conducibilità termica ed elettrica e quindi è un buon conduttore.
Presenza di alluminio
L'alluminio costituisce (circa) l'8% della crosta terrestre.
Dopo l'ossigeno e il silicio, l'alluminio è il terzo elemento più abbondante; tuttavia, è il metallo più abbondante nella crosta.
Quando l'idrogeno si fonde con il magnesio, crea alluminio stabile.
L'alluminio si trova naturalmente negli stati di ossidi o silicati.
Composti di alluminio
Di seguito sono riportati i principali composti di alluminio:
Allumina - Al 2 O 3
Cloruro di alluminio - AlCl 3
Solfato di alluminio - Al 2 (SO 4 ) 3
Idrossido di alluminio - Al (OH) 3
Carburo di alluminio - Al 4 C 3
Utilizzo dell'alluminio
L'alluminio ha un'ampia gamma di utilizzi nell'industria e nella vita di tutti i giorni; significativi di loro sono -
L'alluminio è utilizzato nelle industrie di trasporto, come ferrovia, automobili, aerei, veicoli spaziali, camion, navi marine, biciclette, ecc.
L'alluminio viene utilizzato negli imballaggi di alcuni materiali specifici.
L'alluminio è utilizzato nella costruzione di porte, finestre, cavi da costruzione, guaine, coperture, ecc.
L'alluminio è ampiamente utilizzato nella produzione di cavi elettrici.
L'alluminio è utilizzato nella produzione di elettrodomestici e molti altri articoli per la casa, come utensili da cucina.
L'alluminio è utilizzato nelle mazze da baseball, negli orologi e in molti altri simili.
L'alluminio è utilizzato nelle apparecchiature fotografiche.
L'alluminio è utilizzato negli apparecchi elettronici.
L'alluminio è usato come riflettore della luce, poiché è un buon riflettore della luce; fondamentalmente, alcuni dei materiali sono rivestiti in alluminio appositamente per riflettere la luce.
L'alluminio è utilizzato nella produzione di idrogeno gassoso per reazione con acido cloridrico.
L'alluminio è utilizzato nella produzione di strumenti musicali.
introduzione
Il magnesio è un elemento solido grigio lucido.
Il simbolo del magnesio è ‘Mg’ e il numero atomico è ‘12.’

Con circa l'80% della quota di mercato mondiale, la Cina è il più grande fornitore di magnesio.
Caratteristiche salienti del magnesio
La densità del magnesio è due terzi della densità dell'alluminio.
Tra tutti i metalli alcalini della Terra, il magnesio ha il punto di fusione più basso (cioè circa 1.202 ° F) e il punto di ebollizione più basso (circa 1.994 ° F).
Il magnesio di solito reagisce con l'acqua a temperatura ambiente.
A volte, il magnesio viene utilizzato anche come accenditore per la termite.
Il magnesio, quando brucia nell'aria, produce una luce bianca brillante, che include anche forti lunghezze d'onda ultraviolette.

Il magnesio, quando brucia, produce un'intensa luce bianca e brillante (vedi immagine sopra).
Presenza di magnesio
In massa, il magnesio è l'ottavo elemento più abbondante che si trova nella crosta terrestre.
Il magnesio si trova solitamente in grandi depositi di magnesite, dolomite e altri minerali simili.
Lo ione magnesio solubile si trova nell'acqua minerale.
Dopo il sodio e il cloro, il magnesio è il terzo elemento più abbondante disciolto nell'acqua di mare.
Il magnesio si trova naturalmente solo in combinazione con alcuni altri elementi.
In massa, il magnesio è il 11 esimo elemento più abbondante nel corpo umano ed è essenziale per tutte le cellule ed enzimi.
Gli ioni magnesio interagiscono frequentemente con i composti polifosfati inclusi ATP, DNA e RNA.
Composti di magnesio
Di seguito sono riportati i principali composti del magnesio:
Carbonato di magnesio - MgCO 3
Cloruro di magnesio - MgCl 2
Citrato di magnesio - C 6 H 6 MgO 7
Idrossido di magnesio - Mg (OH) 2
Ossido di magnesio - MgO
Solfato di magnesio - MgSO 4
Solfato di magnesio eptaidrato - (MgSO 4 · 7H 2 O)
Il solfato di magnesio eptaidrato è comunemente noto come Epsom salt.
Usi di magnesio
Il magnesio ha un'ampia gamma di utilizzo nelle nostre vite; tuttavia, alcuni usi significativi del magnesio sono:
Dopo il ferro e l'alluminio, il magnesio è il terzo elemento più comunemente usato.
Il magnesio è utilizzato soprattutto in materiali super resistenti e leggeri e leghe.
Il magnesio è utilizzato anche come materiali per motori nell'industria aeronautica.
Il magnesio è utilizzato anche per purificare i solventi; come nella preparazione dell'etanolo super-secco.
Molti dei grandi marchi automobilistici tra cui Mercedes, Porsche, BMW, Volkswagen, Chevrolet, ecc. Usano il magnesio per realizzare le loro auto di alta qualità.
A causa del peso ridotto e delle buone proprietà elettriche e meccaniche, il magnesio è comunemente utilizzato nella produzione di laptop e tablet, telefoni cellulari, fotocamere e molti altri componenti elettronici.
Il solfito di magnesio viene solitamente utilizzato nella produzione di carta.
introduzione
Il manganese è un elemento chimico che di solito si trova in combinazione con il ferro.
Il simbolo del manganese è ‘Mn’ e il numero atomico è ’25.’
Il manganese è un metallo molto importante per l'uso industriale.

Nel 1774, Johan Gottlieb Gahn, isolò per la prima volta un campione impuro di metallo di manganese nel 1774.
Caratteristiche del manganese
Di seguito sono riportate le principali caratteristiche e caratteristiche del manganese:
Simile al ferro, il manganese è un metallo grigio-argenteo.
Il manganese può essere ossidato facilmente, ma è molto difficile fonderlo, poiché è molto duro e fragile.
Nell'aria, il manganese si appanna lentamente (ossidazione).
Il manganese è un elemento che fa parte del gruppo del ferro.
Presenza di manganese
Il manganese è il 12 ° elemento più abbondante della crosta terrestre.
Il suolo di solito contiene circa 7–9000 ppm di manganese con una media di 440 ppm.
L'acqua di mare ha solo circa 10 ppm di manganese; mentre l'atmosfera contiene circa 0,01 µg / m3.
La pirolusite (MnO 2 ) è il minerale più importante del manganese.
Composti di manganese
Di seguito sono riportati i principali composti del manganese:
Ossido di manganese (II) - MnO
Ossido di manganese (I) - Mn 2 O 3
Biossido di manganese - MnO 2
Cloruro di manganese - MnCl 2
Permanganato di potassio - KMnO 4
Solfato di manganese (II) - MnSO 4
Carbonato di manganese (II) - MnCO 3
Solfuro di manganese (II) - MnS
Nitrato di manganese (II) - Mn (NO 3 ) 2
Bromuro di manganese (II) - MnBr 2
Eptoossido di manganese - Mn 2 O 7
Decacarbonile dimanganese - C 10 O 10 Mn 2
Manganese (II) ioduro - MnI 2
Fluoruro di manganese (II) - MnF 2
Usi del manganese
Di seguito sono riportati i principali usi del manganese:
Il manganese è uno dei componenti più essenziali della produzione dell'acciaio.
La fosfatazione al manganese è comunemente utilizzata per la prevenzione della ruggine e della corrosione sull'acciaio.
In biologia, gli ioni manganese (II) agiscono come cofattori per la grande varietà di enzimi.
Manganese is also important in the oxygen-evolving phenomenon of photosynthetic plants.
Manganese dioxide is also used in the manufacture of oxygen and chlorine and in drying black paints.
Introduction
Iron is the most common element found in largely in outer as well inner core of the earth.
The symbol of iron is ‘Fe’ and atomic number is ‘26.’

Iron is one of the earliest known elements that is being used by human beings.
Salient Features of Iron
Following are the major features of iron −
Pure iron element is soft, ductile, and malleable.
The boiling point of iron ranges between 15330C and 24500C.
Iron easily gets attracted towards magnet.
In dry air, iron remains inactive and does not react (with air); however, in moist air, it reacts and forms rust.
Pure iron normally does not react with pure water; however, it reacts easily with ordinary of polluted water and rust forms.
Iron reacts with halogen and Sulphur to form halide and sulphide accordingly.
Occurrence of Iron
The inner and outer cores of the earth are largely made up of iron and nickel.
Most likely, iron is the most abundantly available element of the earth; however, it is the fourth most abundantly available element of the crust.
Types of Iron
Following are the major types iron −
Hematite - Fe2O3
Magnetite - Fe3O4
Siderite - FeCO3
Compounds of Iron
Following are the major compounds of iron −
Iron (II) oxide - FeO
Iron (III) chloride - FeCl3
Iron (III) oxide-hydroxide - Fe(OH)3
Iron (II) sulfide - FeS
Iron (II) chloride - FeCl2
Iron phosphate - FePO4
Ferrate (VI) - (FeO4)2-
Iron (II) acetate - Fe(C2H3O2)2
Iron (III) sulfide - Fe2S3
Iron (III) chromate - Fe2(CrO4)3
Iron (II) hydroxide - Fe(OH)2
Iron (III) acetate - C14H27Fe3O
Iron (II) oxalate - FeC2O4
Iron (II) fluride - FeF2
Uses of Iron
Among all the metals, iron is most widely used (about 90 percent of world’s total metal production).
In most of the heavy industries, iron is the most essential element.
Industries like railway, ship building, automobile, engineering construction, etc., everywhere, iron is essentially required.
Introduction
Copper is a soft, ductile, and malleable metal.
Copper has very high thermal and electrical conductivity.
The symbol of copper is ‘Cu’ and atomic number is ’29.’

Copper is known to people since (about) c. 8000 BC.
Copper is the first metal, which was smelted from its ore around c. 5000 BC.
Salient Features of Copper
Copper was the first metal that cast into a shape (in a mold).
Copper was the first metal that successful alloyed with another metal, e.g. copper alloyed with tin and resultantly bronze is prepared. It is done about c. 3500 BC.
First metal to be purposefully alloyed with another metal, tin, to create bronze, c. 3500 BC.
Copper has a natural reddish-orange color; it is visible once the its surface is exposed.
Copper is a very good conductor of electricity and heat.
Copper is an element of group 11 of the periodic table.
Copper normally does not react with water; however, it does react slowly with atmospheric oxygen and form a layer of brown-black copper oxide.
The brown-black copper oxide usually protects the underlying metal from further corrosion just like passivation.
Passivation is a process of use of a light coat of a protective material, such as metal oxide, which is used to create a protective shell against the corrosion.
Occurrence of Copper
Copper is commonly found in the earth’s crust.
In 1857, the largest mass of elemental copper (weighing about 420 tones) discovered. It was found on the Keweenaw Peninsula located in Michigan, US.
Alloys of Copper
The metal alloys, which have the copper as their major constituent, is known as copper alloys.
Copper alloys are highly resistant to corrosion.
The best (traditional) example of copper alloy is bronze (made by mixing tin and brass).
Following are the major alloys of copper −
Brass
Bronze
Auricupride
Chinese silver
Corinthian bronze
Electrum, Green gold
Grey gold
Niello
Panchaloha
Rose, red, and pink gold
Spangold
Shibuichi
Tibetan silver
White gold
Compounds of Copper
Following are the major compounds of the copper −
Cupric acetate - Cu(CH3COO)2
Copper(I) oxide - Cu2O
Copper(II) oxide - CuO
Copper(II) chloride - CuCl2
Dicopper chloride trihydroxide - Cu2(OH)3Cl
Copper(I) chloride - CuCl
Copper(II) nitrate - Cu(NO3)2
Copper Cyanide - CuCN
Uses of Copper
Copper is largely used in making electric wires.
Copper is used in electric motors.
Copper is used in roofing, plumbing, and in many other industries.
Copper paint is used in painting boats and many other materials.
Many of the home appliances are made up of either pure copper or its alloys.
Introduction
Silver is a soft, lustrous transition, and white metal.
Silver has the highest electrical and thermal conductivity; and, it has also the highest reflectivity of any metal.

The symbol of silver is ‘Ag’ and atomic number is ’47.’
Salient Features of Silver
Silver is a precious metal used since long time by human beings.
Silver is an element of group 11 of the periodic table.
Silver has an excellent white metallic luster commonly used in a high polish.
As silver has no color; therefore, it has high reflectivity (of light).
Silver has very high electrical and thermal conductivity. Its electric conductivity is the highest – higher than copper.
Among all the metals, silver also has the lowest contact resistance.
Occurrence of Silver
The metal silver is usually found in the Earth's crust in the pure form.
Silver also found as an alloy with the gold and some other metals.
Silver is also found in some minerals, such as argentite and chlorargyrite.
Silver is largely produced as a byproduct of gold, copper, zinc, lead, etc.
Alloys of Silver
Following are the major alloys of silver −
Argentium sterling silver
Britannia silver
Doré bullion
Electrum
Goloid
Platinum sterling
Sterling silver
Tibetan silver
Compounds of Silver
Following are the major compound of silver −
Silver chloride - AgCl
Silver iodide - Agl
Silver bromide - AgBr
Silver oxide - Ag2O
Silver sulfide - Ag2S
Silver fluoride - AgF
Silver cyanide - AgCN
Silver carbonate - Ag2CO3
Silver acetate - AgC2H3O2
Silver sulfate - Ag2SO4
Silver chromate - Ag2CrO4
Silver oxalate - Ag2C2O4
Silver chlorate - AgClO3
Uses of Silver
Following are the major uses of silver −
From the ancient period, silver is being used in making coins.
Silver is also used in making ornaments.
Many of the home pots and other utensils were also used to be made by silver.
Silver has also medicinal use, as it is used as an antibiotic coating in medical devices.
Because of having very high electric conductivity, silver is commonly used in some electronic devices.
Besides, silver has many other uses, such as in photography, in chemical equipment, nanoparticles, etc.
Introduction
Gold is a bright, reddish yellow, soft, dense, malleable, and ductile metal naturally found in the earth’s crust.
The symbol of gold is ‘Au’ and atomic number is ‘79.’

Gold is (chemically) a transition metal and belongs to group 11 of the periodic table.
Salient Features of Gold
Gold, which remains in a solid state under standard conditions, is the least reactive element.
Gold is resistant to most of the acids.
Gold does dissolve in aqua regia; aqua regia is a mixture of nitric acid and hydrochloric acid.
However, gold is insoluble in nitric acid.
Gold usually dissolves in alkaline solutions of cyanide.
Cyanide solutions are commonly used in mining and electroplating.
Gold also dissolves in mercury and forms ‘amalgam alloys.’
Gold does not react with oxygen at any temperature.
Occurrence of Gold
Gold commonly occurs as a free element i.e. in the natural form.
Gold occurs as nuggets or else found in in rocks, grains, in veins, and in some other alluvial deposits.
Gold also occurs in a solid solution forms with the native element such as silver (as electrum).
At some places, gold also naturally alloyed with copper and palladium.
Alloys of Gold
Following are the major alloys of gold −
Colored gold
Crown gold
Electrum
Rose gold
Tumbaga
White gold
Compounds of Gold
Following are the major compounds of the gold −
Gold (III) chloride - AuCl3
Gold (I) chloride - AuCl
Cyanide - CN
Chloroauric acid - HAuCl4
Gold (III) oxide - Au2O3
Gold bromide - AuBr
Aqua regia - HNO3+3HCl
Gold bromide - AuBr3
Gold (III) hydroxide - AuH3O3
Gold fluoride - AuF3
Gold (V) fluoride - AuF5
Gold sulfide - Au2S
Fulminating gold
Gold salts
Gold heptafluoride
Uses of Gold
Gold is one of the oldest elements that human being have been using for thousands of years.
As it is highly precious and provides a beautiful look, hence it is characteristically used in making ornaments.
As per the recent trend (of the world), about 50% gold is used in making jewelry, 40% used in investments, and remaining 10% is used in industry.
Introduction
Platinum is a malleable, ductile, dense, and highly unreactive chemical element.
The symbol of platinum is ‘Pt’ and its atomic number is ‘78.’

The name of platinum is derived from a Spanish term i.e. ‘platina,’ which means "little silver."
Platinum is the most precious and the rarest metal (element) on the earth.
Salient Features of Platinum
Following are the important features of the platinum −
Platinum is a silver white metal.
Platinum is an element of group 10 of the periodic table.
Platinum is one of the rarest elements in the crust of the earth.
Platinum is one of the least reactive elements.
Platinum has six natural isotopes.
Platinum is one of the most highly valuable and precious metals.
Platinum is characteristically resists corrosion in all conditions. Because of this reason, it is considered as noble metal.
Platinum is normally insoluble in nitric and hydrochloric acid, but dissolves in hot aqua regia.
After dissolving into the hot aqua regia, platinum gives aqueous chloroplatinic acid (see the image given below).

Occurrence of Platinum
Platinum is commonly found as the native (natural) platinum and as alloy with the other platinum-group.
Platinum usually occurs in the ores of nickel and copper.
Platinum also occurs naturally in the alluvial sands (commonly found in rivers).
Platinum occurs with the concentration of only (about) 0.005 ppm in the Earth's crust.
Alloys of Platinum
Platinum-iridium is one of the most significant alloys of platinum.
Compounds of Platinum
Following are the major compounds of platinum −
Platinum (II) chloride - Pt Cl2
Platinum (IV) chloride - PtCl4
Adam’s catalyst - PtO2
Platinum hexafluoride - PtF6
Potassium tetrachloropla - K2PtCl4
Krogmann’s salt - K2Pt(CN)4Br
Chloroplatinic acid - H2PtCl6
Sodium hexachloropl - Na2PtCl6
Aqua regia - HNO3+3HCl
Uses of Platinum
Platinum is used largely for vehicle emissions control devices.
Platinum is used in petroleum refining and many other chemical productions.
Platinum is used in electronic devices, such as in hard disk (drives).
Platinum is also used in jewelry.
Apart from all these usages, platinum is also used in medicine (anti-cancer drugs), glassmaking equipment, electrodes, turbine engines, investment, etc.
introduzione
Nella tavola periodica, lo zinco è il primo elemento del gruppo 12.
Il simbolo dello zinco è ‘Zn’ e il numero atomico è ‘30.’
In termini di disponibilità, lo zinco è il 24 ° elemento più abbondante trovato nella crosta terrestre e ha cinque isotopi stabili.

Il minerale di zinco più comune è la sfalerite (blenda di zinco), che è un minerale di solfuro di zinco.
Andreas Sigismund Marggraf, il chimico tedesco, scoprì per primo lo zinco metallico puro nel 1746.
È interessante notare che gli alchimisti bruciarono lo zinco nell'aria e formarono qualcosa di diverso e lo chiamarono "philosopher's wool" o "white snow. "
Caratteristiche salienti dello zinco
Il colore dello zinco è bianco-bluastro ed è un metallo brillante e diamagnetico.
Il metallo di zinco è normalmente duro e fragile; tuttavia, quando la temperatura aumenta da 100 ° C, diventa malleabile.
Quando la temperatura aumenta di 210 ° C, il metallo di zinco diventa nuovamente fragile e può essere facilmente polverizzato battendolo.
Lo zinco è un conduttore di elettricità.
Presenza di zinco
Lo zinco si trova solitamente in associazione con altri metalli di base come rame e piombo.
La sfalerite è una forma di solfuro di zinco ed è il minerale più pesantemente estratto.
La sfalerite contiene circa il 60-62% di zinco.
Leghe di zinco
Di seguito sono riportate le principali leghe di zinco:
Brass
Argento nichel
Argento tedesco
Composti di zinco
Di seguito sono riportati i principali composti di zinco:
Ossido di zinco - ZnO
Solfuro di zinco - ZnS
Alogenuri di zinco - ZnF 2
Nitrato di zinco - Zn (NO 3 ) 2
Clorato di zinco - Zn (ClO 3 ) 2
Solfato di zinco - ZnSO 4
Fosfato di zinco - Zn 3 (PO 4 ) 2
Molibdato di zinco - ZnMoO 4
Cromato di zinco - ZnCrO 4
Arsenito di zinco - Zn (AsO 2 ) 2
Acetato di zinco - Zn (O 2 CCH 3 ) 2
Usi dello zinco
Lo zinco è uno degli elementi più importanti per la salute pubblica.
Lo zinco è ampiamente utilizzato come agente anticorrosivo e rivestimento di materiali in ferro e acciaio.
Lo zinco è comunemente usato come anodo o combustibile della batteria zinco-aria.
L'ossido di zinco è ampiamente utilizzato come pigmento bianco (vedere l'immagine sotto riportata) nelle vernici.

L'ossido di zinco è anche usato come catalizzatore nella produzione di gomma.
Lo zinco è un elemento essenziale per la nostra salute; è normalmente utilizzato come materiale supplementare nelle forme come ossido di zinco, acetato di zinco o gluconato di zinco.
Lo zinco è normalmente un materiale antiossidante.
La carenza di zinco nel corpo umano può causare disturbi depressivi maggiori.
Dopo la lesione corporea, lo zinco viene utilizzato per accelerare il processo di guarigione.
Lo zinco piritione è comunemente usato negli shampoo per prevenire la forfora.
Lo zinco chelato viene solitamente utilizzato nei dentifrici e nei collutori (liquidi), poiché previene l'alitosi.
Lo zinco protegge anche la pelle dalle scottature solari, quindi viene utilizzato nelle lozioni per il corpo.
introduzione
Il mercurio è un elemento chimico, comunemente noto come 'quicksilver. "
In precedenza, il mercurio era chiamato come 'hydrargyrum. "
Il simbolo del mercurio è ‘Hg’ e il numero atomico è ‘80.’

Il pigmento rosso vermiglio viene estratto macinando cinabro naturale o solfuro mercurico sintetico.
Caratteristiche salienti del mercurio
Il mercurio è un metallo pesante e bianco-argenteo.
Mercurio normalmente disponibile allo stato liquido; in condizioni normali, è solo il pochissimo elemento metallico che rimane allo stato liquido a temperatura ambiente.
Il mercurio è un cattivo conduttore di calore, ma è un buon conduttore di elettricità.
Il punto di congelamento del mercurio è -38,83 0 C e il punto di ebollizione è 356,73 0 C.
Avvelenamento da mercurio causato dall'ingestione di qualsiasi forma di mercurio. È anche causato dall'inalazione di vapori di mercurio.
Il mercurio dissolve molti metalli tra cui oro e argento per formare amalgami.
Presenza di mercurio
Il mercurio è uno degli elementi più rari nella crosta terrestre.
I minerali di mercurio più ricchi trasportano circa il 2,5% di mercurio (in termini di massa).
Il mercurio si trova come elemento nativo (naturale) o nei minerali di corderoite, cinabro, stonite vivente, ecc.
Mercurio si trova nella regione della giovane cintura montuosa; la cintura che continua a costringere le rocce più dense alla crosta terrestre. Ad esempio, regione vulcanica o anche regioni termali.
Leghe di mercurio
L'amalgama è la principale lega di mercurio.
Composti di mercurio
Di seguito sono riportati i principali composti del mercurio:
Cloruro di mercurio (II) - HgCl 2
Ossido di mercurio (II) - HgO
Solfuro di mercurio - HgS
Mercurio (I) - cloruro - Hg 2 Cl 2
Dimetilmer - C 2 H 6 Hg
Nitrato di mercurio (II) - Hg (NO 3 ) 2
Acetato di mercurio (II) - C 4 H 6 O 4 Hg
Solfato di mercurio (II) - HgSO 4
Mercurio (I) ioduro - Hg 2 I 2
Seleniuro di mercurio - HgSe
Mercurio (II) fulminato - Hg (CNO) 2
Bromuro di mercurio (II) - HgBr 2
Mercurio (II) ioduro - HgI 2
Ossido di mercurio (I) - Hg 2 O
Mercurio (I) fluoruro - Hg 2 F 2
Amidocloruro mercurico - ClH 2 HgN
Dietilmercurio - C 4 H 10 Hg
Usi di mercurio
Il mercurio è ampiamente utilizzato nelle industrie chimiche.
Il mercurio è utilizzato nelle applicazioni elettriche ed elettroniche.
Il mercurio è usato nei termometri che usiamo per misurare la temperatura.
Il mercurio insieme ai suoi composti sono comunemente usati in vari medicinali.
introduzione
Il plutonio è fondamentalmente un metallo attinide e sembra grigio-argenteo.
L'elemento, il cui numero atomico è compreso tra 89 e 103, è noto come elemento attinide.
Il simbolo del plutonio è ‘Pu’ e il numero atomico è ‘94.’

Il plutonio possiede normalmente sei allotropi.
Il plutonio prende il nome da 'Pluto. "
Il plutonio fu scoperto per la prima volta nel 1940 da un gruppo di scienziati, vale a dire Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan e Arthur C. Wahl.
Caratteristiche salienti del plutonio
Il plutonio è un elemento chimico radioattivo.
Il plutonio quando esposto all'aria si appanna e quando si ossida forma un rivestimento opaco.
Il plutonio reagisce con molti elementi tra cui alogeni, azoto, carbonio, silicio e idrogeno.
A causa del processo di fissione, i neutroni vengono rilasciati e convertono i nuclei di uranio-238 in plutonio-239.
Il plutonio-239 e il plutonio-241 sono entrambi fissili e quindi possono sostenere una reazione nucleare a catena. È molto ben applicabile alle armi nucleari e ai reattori nucleari.
Il punto di fusione del plutonio è 640 ° C e il suo punto di ebollizione è 3228 ° C.
Il rilascio del nucleo di elio (un nucleo ad alta energia) è la forma più comune di decadimento radioattivo per il plutonio.
Presenza di plutonio
Il plutonio si trova naturalmente solo in tracce all'interno dei depositi di uranio.
Il plutonio viene anche estratto bruciando l'uranio (durante lo sviluppo dell'energia nucleare).
Leghe di plutonio
Di seguito sono riportate le principali leghe di plutonio:
Il plutonio-gallio è una delle leghe importanti del plutonio e del gallio.
Il plutonio-gallio è usato nelle fosse delle armi nucleari.
Il plutonio-gallio ha la proprietà di una dilatazione termica molto bassa.
Alcune altre leghe di plutonio sono:
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Composti di plutonio
Ossido di plutonio (IV) - PuO 2
Cloruro di plutonio (III) - PuCl 3
Tetrafluoruro di plutonio - PuF 4
Usi del plutonio
L'isotopo plutonio-239 è uno degli elementi significativi nello sviluppo delle armi nucleari.
Il plutonio è usato come combustibile nelle centrali nucleari.
introduzione
L'uranio è il metallo della serie degli attinidi della tavola periodica.
Il simbolo dell'uranio è ‘U’ e il numero atomico è ’92.’
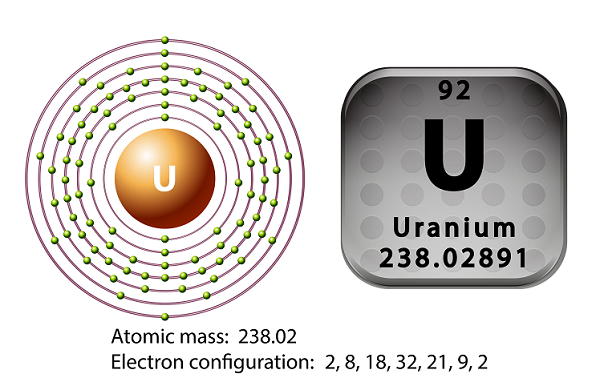
Nel 1789, Martin Heinrich Klaproth aveva scoperto l'elemento uranio e lo aveva chiamato dopo il nome di Urano.
Caratteristiche salienti dell'uranio
L'uranio è un metallo bianco-argenteo.
Un atomo di uranio ha 92 elettroni e 92 protoni, di cui 6 sono elettroni di valenza.
A causa della presenza di isotopi instabili, l'uranio è un elemento radioattivo debole.
L'uranio-238 è l'isotopo più comune dell'uranio.
L'uranio si trova naturalmente in concentrazioni molto basse, cioè poche parti per milione nella roccia, nel suolo e nell'acqua.
L'uranio decade gradualmente (lentamente) emettendo la sua particella alfa.
L'uranio ha una scarsa conduttività elettrica (quindi un cattivo conduttore di elettricità).
L'uranio è malleabile, duttile e marginalmente paramagnetico
Presenza di uranio
L'uranio si trova (naturalmente) come uranio-238, uranio-235 e uranio-234.
L'emivita dell'uranio-238 è di circa 4,47 miliardi di anni, quasi l'età della Terra e l'emivita dell'uranio-235 è di circa 704 milioni di anni.
Leghe di uranio
Di seguito sono riportate le principali leghe di uranio:
Staballoy
Idruro di uranio
Composti di uranio
Di seguito sono riportati i principali composti dell'uranio:
Nitruro di uranio - U 2 N 3
Pentafluoruro di uranio - UF 5
Carburo di uranio - UC
Fluoruro di uranile - UO 2 F 2
Biossido di uranio - UO 2
Esafluoruro di uranio - UF 6
Ossido di triuranio - U 3 O 8
Tetrafluoruro di uranio - UF 4
Triossido di uranio - UO 3
Tetracloruro di uranio - Ucl 4
Nitrato di uranile - UO 2 (NO 3 ) 2
Usi dell'uranio
L'uranio è utilizzato come fonte di energia nei sottomarini nucleari (soprattutto dai militari).
L'uranio è utilizzato nella fabbricazione di armi nucleari.
L'uranio è anche usato come zavorra per le navi.
introduzione
Il piombo è un elemento chimico pesante (metallo) cioè ha un'alta densità.
Il simbolo del piombo è ‘Pb’ e il numero atomico è ‘82.’

Il piombo ha la tendenza a legarsi; allo stesso modo, può formare catene, legami, anelli e strutture poliedriche.
Caratteristiche salienti del piombo
Il piombo è un metallo morbido e malleabile; ha un punto di fusione relativamente basso.
Il piombo è un elemento relativamente poco reattivo e ha la tendenza a formare un legame di alleanza.
Quando il piombo viene tagliato, appare una tinta bianco-bluastra.
Durante la combustione, il piombo dà una fiamma bianco-bluastra (vedere l'immagine sotto riportata).

I composti di piombo si trovano tipicamente nello stato di ossidazione +2.
Presenza di piombo
Il piombo è noto ai popoli preistorici dell'Asia occidentale.
Il piombo si trova nella crosta terrestre; si trova raramente nelle profondità della terra.
Il piombo si trova solitamente in combinazione con lo zolfo.
La galena è il principale minerale contenente piombo, che si trova principalmente con i minerali di zinco.
Leghe di piombo
Di seguito sono riportate le principali leghe di piombo:
Molybdochalkos (rame)
Saldatura (stagno)
Terne (stagno)
Composti di piombo
Di seguito sono riportati i principali composti del piombo:
Monossido di piombo - PbO
Biossido di piombo - PbO 2
Usi di piombo
Il piombo è stato utilizzato nella fabbricazione di proiettili per centinaia di anni.
Il piombo è comunemente usato come guaina protettiva per i cavi subacquei (solo perché ha la proprietà di resistenza alla corrosione).
I fogli di piombo sono anche usati come metalli architettonici, specialmente nel materiale di copertura.
Il piombo è utilizzato anche nelle batterie ad acido.
I composti di piombo sono comunemente come agenti coloranti e semiconduttori.
I composti di piombo sono utilizzati anche in plastica, candele, vetro, ecc.
Il piombo è comunemente usato nel cloruro di polivinile (cioè utilizzato nel rivestimento di cavi elettrici).
Precauzione
La presenza di piombo (di qualità eccessiva) nel corpo può causare gravi danni al cervello e ai reni; può anche causare la morte alla fine.
introduzione
Il torio è uno dei metalli attinidi radioattivi che si trovano naturalmente in grandi quantità.
Il simbolo del torio è ‘Th’ e il numero atomico è ’90.’

Nel 1829, un mineralogista norvegese Morten Thrane Esmark, scoprì per la prima volta il torio.
Jöns Jacob Berzelius, il chimico svedese, lo identificò e lo chiamò "torio" dal nome di "Thor", il dio nordico del tuono.
Caratteristiche salienti del torio
Il torio è un metallo attinide radioattivo paramagnetico e morbido.
Il colore del torio metallico è argenteo; quando esposto all'aria, annerisce e forma anidride.
Tutti gli isotopi del torio sono instabili ed è un debole elemento radioattivo.
Tra tutti gli elementi radioattivi significativi, l'emivita del torio è la più lunga, ovvero circa 14,05 miliardi di anni.
Il punto di fusione del torio è di circa 1750 ° C.
Presenza di torio
Il torio è un elemento primordiale che esisteva nella sua forma attuale da prima che si formasse la Terra.
Il torio, che si trova nella crosta terrestre, viene raffinato dalle sabbie monazite.
La monazite presente in grandi quantità in tutto il mondo è la fonte più importante di torio.
Leghe di torio
Mag-Thor e torio-alluminio sono le leghe più significative di torio, magnesio e alluminio.
Composti di torio
Di seguito sono riportati i principali composti del torio:
Biossido di torio - ThO 2
Solfuro di torio (IV) - ThS 2
Ioduro di torio (IV) - ThI 4
Tetrafluoruro di torio - ThF 4
Torio (IV cloruro - ThCl 4
Carburo di torio (IV) - ThC
Alcuni altri sono -
Thorite
Nitrato di torio (IV)
Ortosilicato di torio (IV)
Usi del torio
Il torio è normalmente utilizzato nella saldatura ad arco con gas di tungsteno (GTAW) perché (torio) aumenta la resistenza alle alte temperature degli elettrodi di tungsteno e di conseguenza migliora la stabilità dell'arco.
Nelle apparecchiature elettroniche, l'applicazione del rivestimento di torio sul filo di tungsteno, aumenta l'emissione di elettroni dei catodi riscaldati.
Nell'industria chimica, vale a dire il biossido di torio ‘thoria’ è comunemente usato.
introduzione
Nella tavola periodica, l'idrogeno è l'elemento più leggero, il suo peso atomico è solo 1,008.
Il simbolo dell'idrogeno è ‘H’ e il numero atomico è ‘1.’

All'inizio del XVI secolo, l'idrogeno gassoso fu prodotto artificialmente per la prima volta dalla reazione di acidi e metalli.
Henry Cavendish riconobbe per la prima volta l'idrogeno gassoso come una sostanza discreta durante il periodo 1766-81, poiché produce acqua quando viene bruciato.
Caratteristiche salienti dell'idrogeno
Nel loro stato plasmatico, le stelle non rimanenti sono principalmente composte da idrogeno.
A temperatura e pressione standard, l'idrogeno appare come gas biatomico incolore, insapore, inodore, non metallico, non tossico e altamente combustibile.
La formula molecolare dell'idrogeno è H 2 .
Sulla terra, l'idrogeno esiste in forme molecolari, ad esempio l'acqua o altri composti organici.
L'idrogeno svolge anche un ruolo importante nelle reazioni acido-base.
L'idrogeno gassoso è altamente infiammabile nell'aria.
Le fiamme di idrogeno-ossigeno puro irradiano luce ultravioletta; inoltre, con una miscela di ossigeno elevata sono quasi invisibili ad occhio nudo.
L'idrogeno può reagire con quasi tutti gli elementi ossidanti.
A temperatura ambiente, l'idrogeno normalmente reagisce spontaneamente e in modo vizioso con il cloro e il fluoro e forma i corrispondenti alogenuri di idrogeno.
Presenza di idrogeno
Costituito all'incirca dal 75% circa di tutta la massa barionica, l'idrogeno è la sostanza chimica di sussistenza più abbondante nell'universo.
In tutto l'universo, l'idrogeno si trova tipicamente negli stati atomico e plasma; tuttavia, le proprietà sono molto diverse da quelle dell'idrogeno molecolare.
Sulla terra, l'idrogeno esiste come gas biatomico, cioè H 2 .
A causa della leggerezza, l'idrogeno fuoriesce facilmente dall'atmosfera terrestre.
L'idrogeno è il terzo elemento più abbondante che si trova sulla superficie terrestre, ma si trova in gran parte sotto forma di idrocarburi e acqua.
Composti di idrogeno
Di seguito sono riportati i principali composti dell'idrogeno:
Acqua - H 2 O
Ammoniaca - NH 3
Cloruro di idrogeno - HCl
Fluoruro di idrogeno - HF
Acido solfidrico - H 2 S
Metano - CH 4
Idrossido - OH -
Bromuro di idrogeno - HBr
Ioduro di idrogeno - HI
Acido cianidrico - HCN
Fosfina - PH 3
Seleniuro di idrogeno - H 2 Se
Metanolo - CH 3 OH
Litio idruro - LiH
Bicarbonato - HCO 3
Tellururo di idrogeno - H 2 Te
Idrogeno liquido - H 2
Cianuro - CN
Idruro di calcio - CaH 2
Acqua pesante - D 2 O
Diborane - B 2 H 6
Idruro di sodio - NaH
Potassio idruro - KH
Usi dell'idrogeno
La maggior quantità di H 2 viene utilizzata nella lavorazione di combustibili fossili e nella produzione di ammoniaca.
L'idrogeno (H 2 ) è ampiamente utilizzato nelle industrie petrolifere e chimiche.
L'H 2 è tipicamente usato come agente idrogenante, specialmente per aumentare il livello di saturazione di grassi e oli insaturi.
L'H 2 è anche utilizzato come gas di protezione nelle procedure di saldatura, come la saldatura a idrogeno atomico, ecc.
introduzione
L'elio è il secondo elemento più leggero (dopo l'idrogeno) e il secondo più abbondante nell'universo.
Il simbolo dell'elio è ‘He’ e il numero atomico è ‘2.’

Nella tavola periodica, l'elio è il primo nel gruppo dei gas nobili.
L'elio prende il nome dal nome del dio greco del sole, "Helios. "
Caratteristiche salienti dell'elio
L'elio è un gas incolore, inodore, insapore, inerte, non tossico e monoatomico.
Il punto di ebollizione (-268,9 ° C) dell'elio è il più basso tra tutti gli elementi.
L'elio è tipicamente composto da due elettroni in orbitali atomici e circondato da un nucleo, che consiste di due protoni e due neutroni.
Presenza di elio
La maggior parte dell'elio trovato nell'universo appartiene a helium-4, e si ritiene che si sia formato durante il Big Bang.
La maggior parte del nuovo elio viene tipicamente creato dalla fusione nucleare dell'idrogeno nelle stelle, incluso il Sole.
Sebbene ci sia una continua creazione di nuovo elio; tuttavia la disponibilità di elio sulla terra è sostanzialmente bassa perché essendo l'elemento leggero, fuoriesce facilmente nello spazio.
Nell'eterosfera (atmosfera esterna) della terra, l'elio è uno degli elementi più abbondanti (gas).
Nella crosta terrestre, l'elio si trova tipicamente in grandi quantità nei minerali di uranio e torio.
Composti di elio
Di seguito sono riportati i principali composti dell'elio:
Disodio elide - Na 2 He
Cristobalite He II (Silicati) - SiO 2 He
Dielio arsenolite - As 4 O 6 • 2He
Isotopi dell'elio
Ci sono circa nove isotopi noti dell'elio, ma i seguenti due sono gli isotopi più stabili:
Elio-3 e
Helium-4
Usi di elio
A causa della bassa densità, basso punto di ebollizione, bassa solubilità, alta conduttività termica, l'elio è un elemento ampiamente utilizzato; l'esempio più diffuso è: l'uso dell'elio nel pallone.
La maggior parte dell'elio ha applicazioni criogeniche, come il raffreddamento dei magneti superconduttori utilizzati negli scanner MRI medici e negli spettrometri NMR.
L'elio è anche usato come gas protettivo nella crescita dei cristalli di silicio e germanio.
L'elio è utilizzato anche nella gascromatografia e nella produzione di titanio e zirconio.
L'elio è utilizzato nelle gallerie del vento supersoniche.
L'elio viene anche applicato come gas di protezione nei processi di saldatura ad arco.
introduzione
L'ossigeno è il membro del gruppo 16 nella tavola periodica; tuttavia, il più delle volte, viene trattato in modo diverso dal suo gruppo.
Il simbolo dell'ossigeno è ‘O’ e il numero atomico è ‘8.’

L'ossigeno ha circa nove allotropi e l'allotropo più comune è l'ossigeno biatomico (cioè O 2 ). Un altro allotropo importante è l'ozono, ovvero O 3 .
L'ossigeno, per la prima volta, è stato notato dal farmacista svedese Carl Wilhelm Scheele.
Caratteristiche salienti dell'ossigeno
L'ossigeno è tipicamente classificato come membro del gruppo "calcogeno".
La parola "calcogeno" deriva da una parola greca "khalkόs, "Che significa" rame "e la parola latino-greca"Genēs, "Che significa nato o prodotto.
L'ossigeno è un gas altamente reattivo (o elemento non metallico); quindi, è un agente ossidante che forma prontamente ossidi con la maggior parte degli elementi e dei composti.
L'ossigeno ha sei elettroni di valenza.
Il punto di fusione dell'ossigeno è -218,8 0 C e il punto di ebollizione è -183 0 C.
Presenza di ossigeno
Con circa il 20,8 percento di quota (nei costituenti atmosferici terrestri totali), l'ossigeno è il secondo elemento classificato dell'atmosfera terrestre.
L'ossigeno si trova quasi nella sfera della terra, vale a dire atmosfera, idrosfera e litosfera.
Durante il processo di fotosintesi, l'ossigeno libero viene prodotto da tutte le piante verdi.
L'ossigeno si presenta come minerali di rame costituenti.
Un corpo umano contiene circa il 65% di ossigeno.
In massa, quasi la metà della crosta terrestre è composta da ossigeno (cioè i suoi ossidi).
In massa, l'ossigeno è il terzo elemento più abbondante che si trova nell'universo; il primo e il secondo sono idrogeno ed elio di conseguenza.
L'ossigeno (cioè O 2 ) è un gas biatomico incolore e inodore.
L'ossigeno si dissolve molto facilmente in acqua; tuttavia, la solubilità dell'ossigeno nell'acqua dipende dalla temperatura.
Composti di ossigeno
Di seguito sono riportati i principali composti dell'ossigeno:
Oxide
Peroxide
Anidride carbonica - CO 2
Idrossido - OH -
Ozono - O 3
Ossido di mercurio (II) - HgO
Clorato - ClO 3
Ossido di alluminio - Al 2 O 3
Monossido di carbonio - CO
Ipoclorito - ClO -
Biossido di silicio - SiO 2
Acido ipofluoroso - HOF
Perossido di sodio - Na 2 O 2
Clorato di potassio - KClO 3
Difluoruro di ossigeno - OF 2
Ossido di sodio - Na 2 O
Usi dell'ossigeno
L'ossigeno (O 2 ) è il requisito più essenziale per la respirazione, senza di esso la vita non può essere immaginata.
L'ossigeno è usato in medicina.
L'ossigenoterapia è tipicamente utilizzata per trattare alcune malattie, come enfisema, polmonite, alcuni disturbi cardiaci, ecc.
Alcune delle attività subacquee, come le immersioni subacquee, i sottomarini, ecc. Utilizzano anche ossigeno artificiale.

Anche gli aerei, gli alpinisti, ecc. Usano ossigeno artificiale.
L'ossigeno viene utilizzato anche in alcune industrie, ad esempio la fusione del minerale di ferro in acciaio - in questo processo viene utilizzato circa il 55% dell'ossigeno.
introduzione
Il carbonio è un elemento non metallico e tetravalente.
Mezzi tetravalenti: il carbonio rende disponibili quattro elettroni per formare i legami chimici covalenti.
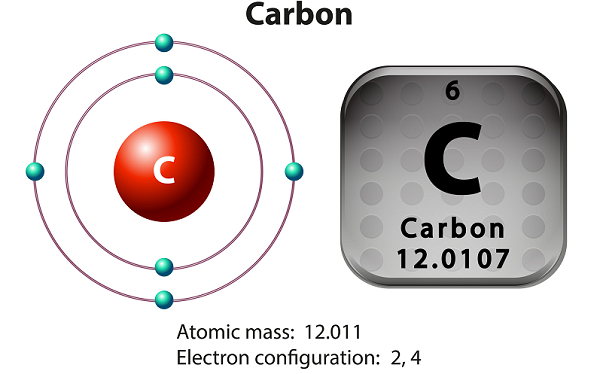
Il carbonio ha tre isotopi che si trovano in natura: 12 C, 13 C e 14 C.
Tra questi, 12 C e 13 C sono stabili, ma 14 C è un isotopo radioattivo. L'emivita di 14 ° C è di circa 5.730 anni.
Caratteristiche salienti del carbonio
Le proprietà fisiche del carbonio dipendono in gran parte dai suoi allotropi.
I principali allotropi del carbonio sono grafite, diamante e carbonio amorfo.
La grafite è opaca, nera e molto morbida; quindi, ha usato per formare una striscia sulla carta.
Diamante molto duro (il materiale più duro presente in natura) e trasparente.
La grafite è un buon conduttore di elettricità.
Il diamante è un cattivo conduttore di elettricità.
Il carbonio molto probabilmente ha il punto di sublimazione più alto tra tutti gli elementi.
Presenza di carbonio
In termini di massa, il carbonio è il quarto elemento chimico più abbondante nell'universo (dopo l'idrogeno, l'elio e l'ossigeno).
Il carbonio è disponibile in abbondanza nel Sole, nelle stelle, nelle comete e nelle atmosfere della maggior parte dei pianeti.
Il carbonio si trova nell'atmosfera terrestre e si dissolve nell'acqua.
Gli idrocarburi, come il carbone, il petrolio e il gas naturale, contengono tutti carbonio.
Il carbonio si trova anche negli idrati di metano, che si trovano nelle regioni polari e sotto i mari.
Alcune delle rocce arricchite di carbonio sono carbone, calcare, dolomite, ecc.
Il carbone è molto ricco di carbonio; quindi, è la più grande fonte commerciale di carbonio minerale.
Il carbone condivide circa 4.000 gigatonnellate o l'80% del combustibile fossile totale.
Composti di carbonio
Di seguito sono riportati i principali composti del carbonio:
Cianogeno - CN 2
Acido cianidrico - HCN
Cianammide - CN 2 H 2
Acido isocianico - HNCO
Cloruro di cianogeno - CNCl
Isocianato di clorosolfonile - CNClO 3 S
Cloruro cianurico - NCCl 3
Disolfuro di carbonio - CS 2
Solfuro di carbonile - OCS
Monosolfuro di carbonio - CS
Usi del carbonio
A seconda delle gocce assegnate, il carbonio viene utilizzato in un'ampia gamma di applicazioni.
Il carbonio è uno degli elementi più essenziali della vita senza di esso, non possiamo immaginare la vita sulla terra.
Il combustibile fossile, vale a dire gas metano e petrolio greggio (petrolio), carbone, ecc. Sono utilizzati nella vita di tutti i giorni.
Grafite, combinata con l'argilla, utilizzata nella produzione del "piombo" utilizzato nelle matite.
Il carbone di legna viene anche utilizzato come materiale da disegno in opere d'arte, fusione del ferro, barbecue, ecc.
Il diamante è solitamente usato in gioielleria.
I diamanti industriali sono utilizzati negli strumenti di taglio, foratura e lucidatura per la lavorazione dei metalli e della pietra.
Gli idrocarburi fossili e la fibra di carbonio sono usati per produrre plastica.
introduzione
L'azoto è un elemento chimico del gruppo 15 della tavola periodica; tra tutti gli elementi del gruppo 15, è l'elemento più leggero.
Il simbolo dell'azoto è ‘N’ e il numero atomico è 7.

Nel 1772, il medico scozzese Daniel Rutherford, scoprì e isolò per primo il carbonio.
Tuttavia, il nome "azoto" fu dato per la prima volta da Jean-Antoine-Claude Chaptal nel 1790.
Caratteristiche salienti dell'azoto
L'azoto ha due isotopi stabili, ovvero 14 N e 15 N.
Gli atomi di azoto liberi normalmente reagiscono facilmente con la maggior parte degli elementi e formano nitruri.
Le molecole di N 2 sono gas incolore, inodore, insapore e diamagnetico in condizioni standard.
Il punto di fusione di N 2 è −210 0 C e il punto di ebollizione è −196 0 C.
I composti dell'azoto si scambiano ripetutamente tra l'atmosfera e gli organismi viventi, creando un ciclo dell'azoto.
Presenza di azoto
L'azoto è l'elemento più abbondantemente trovato sulla terra, poiché costituisce circa il 78,1% dell'intero volume dell'atmosfera terrestre.
Gas azoto, che è un gas industriale, in gran parte prodotto dalla distillazione frazionata di aria liquida.
Composti di azoto
Di seguito sono riportati i principali composti dell'azoto:
Ammonio - NH 4+
Ammoniaca - NH 3
Acido nitrico - HNO 3
Nitrito - NO 2-
Biossido di azoto - NO 2
Pentroossido di diazoto - N 2 O 5
Idrazina - N 2 H 4
Diazoto - N 2
Cianuro - CN
Nitrato di ammonio - (NH 4 ) (NO 3 )
Tricloruro di azoto - NCl 3
Trifluoruro di azoto - NF 3
Triioduro di azoto - NI 3
Piridina - C 5 H 5 N
Ione nitronio - NO 2+
Acido idrazoico - HN 3
Solfato di ammonio - (NH 4 ) 2 SO 4
Usi di azoto
I composti dell'azoto sono ampiamente utilizzati in un'ampia gamma di campi e industrie.
L'azoto puro viene utilizzato come additivo alimentare.
Utilizzato nei sistemi antincendio in particolare per le apparecchiature informatiche.
Utilizzato anche nella produzione di acciaio inossidabile.
L'azoto viene anche utilizzato per gonfiare i pneumatici di alcuni aerei e auto da corsa.
L'azoto liquido viene utilizzato come refrigerante.
Le leggi della natura relative alla chimica sono note come leggi chimiche.
Le reazioni chimiche, normalmente, sono amministrate da determinate leggi, che vengono osservate e formulate a parole diventano concetti fondamentali in chimica.
Di seguito sono riportate le leggi chimiche significative:
| Legislazione | Spiegazione |
|---|---|
| Legge di Avogadro | "Volumi uguali di tutti i gas, alla stessa temperatura e pressione, hanno lo stesso numero di molecole" |
| Legge di Beer-Lambert, (o semplicemente legge di Beer o legge di Lambert-Beer) | "Spiega l'attenuazione della luce alle proprietà del materiale attraverso cui passa (la luce)" |
| Legge di Boyle | "La pressione assoluta esercitata da una data massa di un gas ideale è inversamente proporzionale al volume che occupa se la temperatura e la quantità di gas rimangono invariate all'interno di un sistema chiuso" |
| Legge di Carlo (nota anche come Legge del volume) | "Quando la pressione su un campione di un gas secco viene mantenuta costante, la temperatura Kelvin e il volume saranno direttamente correlati" |
| Leggi di diffusione di Fick | Descrive la "diffusione" (del flusso) |
| Legge di Gay-Lussac | "Tutti i gas hanno la stessa espansività termica media a pressione costante nello stesso intervallo di temperatura" |
| Principio di Le Chatelier ("La legge dell'equilibrio") | "Quando un sistema in equilibrio è soggetto a variazioni di concentrazione, temperatura, volume o pressione, il sistema si riadatta per contrastare (parzialmente) l'effetto del cambiamento applicato e viene stabilito un nuovo equilibrio" |
| Legge di Henry | "La legge calcola la concentrazione di gas nella soluzione sotto pressione" |
| Legge di Hess | "Il cambiamento di entalpia in una reazione chimica (significa, il calore di reazione a pressione costante) è indipendente dal percorso tra lo stato iniziale e quello finale" |
| Legge di conservazione dell'energia | "L'energia non può essere né creata né distrutta" |
| Legge di Raoult | "La tensione di vapore parziale di ciascun componente di una miscela ideale di liquidi è uguale alla tensione di vapore del componente puro moltiplicata per la sua frazione molare nella miscela" |
| Legge di Faraday Elettrolisi | "La quantità di sostanza prodotta su un elettrodo è direttamente proporzionale alla quantità di elettricità passata" |
| Teoria atomica | "La materia è composta da unità distinte note come atomi" |
| Teoria di Köhler | "Spiega il processo in cui il vapore acqueo si condensa e forma le gocce di nuvola liquida" |
| Equazione di Van 't Hoff | "Descrive il cambiamento nella costante di equilibrio di una reazione chimica" |
| Teoria dello stato di transizione | "Le velocità di reazione delle reazioni chimiche elementari" |
| Legge di Grotthuss-Draper | "Descrive che la luce che viene assorbita da un sistema / superficie può portare un cambiamento fotochimico" |
| Teoria cinetica dei gas | "Descrive il comportamento di un ipotetico gas ideale" |
| Principio di Aufbau | "Spiega che gli elettroni in orbita attorno agli atomi riempiono prima i livelli di energia più bassi e poi i livelli più alti e così via" |
| Regola di Hund | "Spiega che ogni orbitale in un sottolivello è occupato singolarmente prima che qualsiasi orbitale sia occupato doppiamente" |
| Teoria delle collisioni | "Sulla base della teoria cinetica dei gas, la teoria delle collisioni descrive che le reazioni chimiche in fase gassosa si verificano quando le molecole entrano in collisione con sufficiente energia cinetica" |
introduzione
Molto probabilmente il rame è stato il primo elemento, che è stato estratto e utilizzato dagli esseri umani.
La prova del primo utilizzo del rame è stata trovata in Anatolia, che appartiene al 6.000 a.C.
Il piombo era molto probabilmente il secondo elemento che gli esseri umani iniziano a utilizzare.
Il più antico manufatto di piombo conosciuto è la statuetta, che è stata trovata in un tempio di Osiride, Abydos, Egitto.
La statuetta del tempio di Osiride appartiene a (circa) 3.800 a.C.
Il più antico tesoro d'oro conosciuto è stato scoperto a Varna, Necropolis (Bulgaria).
Questo tesoro d'oro appartiene a (circa) 4.400 a.C.
La scoperta dell'argento è quasi la stessa dell'oro; le sue prove sono state trovate in Asia Minore.
Alcune prove dicono che il ferro era conosciuto da (circa) 5.000 aC.
I più antichi oggetti in ferro conosciuti, usati dagli esseri umani, sono stati trovati in Egitto (appartiene al 4000 a.C.).
La tabella seguente illustra gli elementi significativi con la loro data di scoperta e scopre:
| Elemento | Discoverer | Discovery Date |
|---|---|---|
| Copper | Middle East (Place) | About 9,000 BCE |
| Lead | Egypt (Place) | About 7,000 BCE |
| Gold | Bulgaria (Place) | About 6,000 BCE |
| Silver | Asia Minor (Place) | About 5,000 BCE |
| Iron | Egypt (Place) | About 5,000 BCE |
| Tin | About 3,500 BCE | |
| Sulfur | Chinese/India | About 2,000 BCE |
| Mercury | Egypt | 2,000 BCE |
| Phosphorus | H. Brand | 1669 |
| Cobalt | G. Brandt | 1735 |
| Platinum | A. de Ulloa | 1748 |
| Nickel | F. Cronstedt | 1751 |
| Bismuth | C.F. Geoffroy | 1753 |
| Magnesium | J. Black | 1755 |
| Hydrogen | H. Cavendish | 1766 |
| Oxygen | W. Scheele | 1771 |
| Nitrogen | D. Rutherford | 1772 |
| Barium | W. Scheele | 1772 |
| Chlorine | W. Scheele | 1774 |
| Manganese | W. Scheele | 1774 |
| Molybdenum | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirconium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Beryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Boron | L. Gay-Lussac and L.J. Thénard | 1808 |
| Fluorine | A. M. Ampère | 1810 |
| Iodine | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S. L Hermann, F. Stromeyer, and J.C.H. Roloff | 1817 |
| Selenium | J. Berzelius and G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | H.C.Ørsted | 1825 |
| Bromine | J. Balard and C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen and G. R. Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich and T. Richter | 1863 |
| Helium | P. Janssen and N. Lockyer | 1868 |
| Neon | W. Ramsay and W. Travers | 1898 |
| Xenon | W. Ramsay and W. Travers | 1898 |
| Fermium | A. Ghiorso et al | 1952 |
| Nobelium | E. D. Donets, V. A. Shchegolev and V. A. Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris and P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
The following table illustrates significant elements and their valence −
| Element | Valence | Symbol | Atomic No. |
|---|---|---|---|
| Hydrogen | -1, +1 | H | 1 |
| Helium | 0 | He | 2 |
| Lithium | 1 | Li | 3 |
| Beryllium | 2 | Be | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Carbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oxygen | -1, -2, 0, 2, 1, | O | 8 |
| Fluorine | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminum | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphorus | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlorine | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Ca | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganese | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Iron | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Copper | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | As | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Bromine | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |