Điện tử cơ bản - Vật liệu
Vật chất được tạo thành từ các phân tử bao gồm các nguyên tử. Theo lý thuyết của Bohr, “nguyên tử bao gồm hạt nhân mang điện tích dương và một số electron mang điện tích âm quay quanh hạt nhân theo nhiều quỹ đạo khác nhau”. Khi một electron được nâng từ trạng thái thấp hơn lên trạng thái cao hơn, nó được cho làexcited. Trong khi kích thích, nếu điện tử bị tách hoàn toàn khỏi hạt nhân, nguyên tử được cho là bị ion hóa. Vì vậy, quá trình nâng nguyên tử từ trạng thái bình thường lên trạng thái ion hóa này được gọi làionization.
Hình sau cho thấy cấu trúc của một nguyên tử.
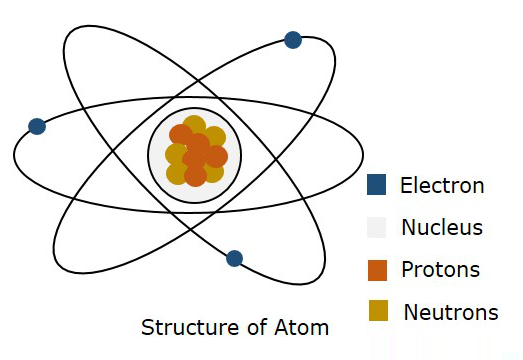
Theo mô hình của Bohr, một electron được cho là chuyển động trong một Orbit, trong khi theo cơ học lượng tử, một electron được cho là ở đâu đó trong không gian tự do của nguyên tử, được gọi là Orbital. Lý thuyết cơ học lượng tử này đã được chứng minh là đúng. Do đó, ranh giới ba chiều nơi có thể tìm thấy một điện tử được gọi làAtomic Orbital.
Số lượng tử
Mỗi quỹ đạo, nơi một điện tử di chuyển, khác nhau về năng lượng và hình dạng của nó. Các mức năng lượng của các obitan có thể được biểu diễn bằng cách sử dụng tập hợp các tích phân và nửa tích phân rời rạc được gọi là các số lượng tử. Có bốn số lượng tử được sử dụng để xác định một hàm sóng.
Số lượng tử chính
Số lượng tử đầu tiên mô tả một electron là Principal quantum number. Biểu tượng của nó làn. Nó chỉ định kích thước hoặc thứ tự (mức năng lượng) của số. Khi giá trị của n tăng lên thì khoảng cách trung bình từ electron đến hạt nhân cũng tăng lên, năng lượng của electron cũng tăng theo. Mức năng lượng chính có thể hiểu là một lớp vỏ.
Số lượng tử Momentum góc
Số lượng tử này có lnhư biểu tượng của nó. L này cho biết hình dạng của quỹ đạo. Nó nằm trong khoảng từ 0 đến n-1.
l = 0, 1, 2… n-1
Đối với vỏ đầu tiên, n = 1.
tức là, với n-1, l = 0 là giá trị duy nhất có thể có của l khi n = 1.
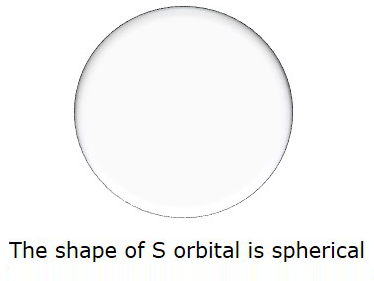
Vì vậy, khi l = 0, nó được gọi là Squỹ đạo. Hình chóp S là hình cầu. Hình sau biểu diễn hình chóp S.
Nếu n = 2 thì l = 0, 1 vì đây là hai giá trị có thể có của n = 2.
Chúng ta biết rằng nó là quỹ đạo S đối với l = 0, nhưng nếu l = 1, nó là P quỹ đạo.
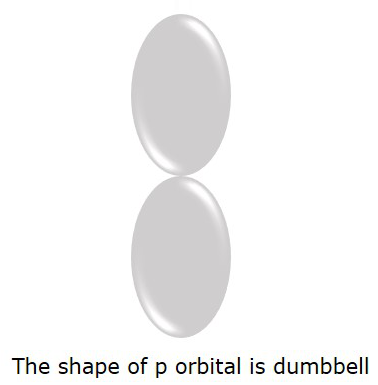
Quỹ đạo P nơi các điện tử có nhiều khả năng được tìm thấy là dumbbellhình dạng. Nó được hiển thị trong hình sau.
Số lượng tử từ tính
Số lượng tử này được ký hiệu là mlbiểu thị sự định hướng của một quỹ đạo xung quanh hạt nhân. Các giá trị của m l phụ thuộc vào l.
$$ m_ {l} = \ int (-l \: \: to \: + l) $$
Với l = 0, m l = 0 biểu thị quỹ đạo S.
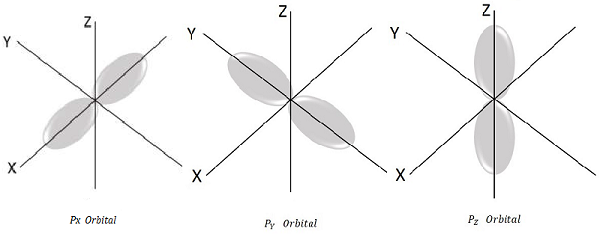
Với l = 1, m l = -1, 0, +1, đây là ba giá trị có thể có và điều này đại diện cho quỹ đạo P.
Do đó chúng ta có ba obitan P như trong hình sau.
Spin số lượng tử
Điều này được đại diện bởi msvà electron ở đây, quay trên trục. Chuyển động quay của electron có thể là theo chiều kim đồng hồ hoặc ngược chiều kim đồng hồ như hình dưới đây.
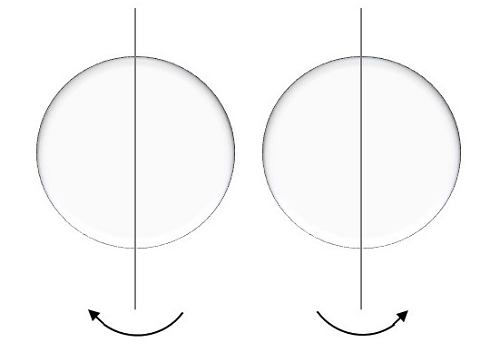
Các giá trị có thể có cho số lượng tử spin này sẽ giống như,
$$ m_ {s} = + \ frac {1} {2} \: \: lên $$
Đối với một chuyển động được gọi là spin up, kết quả là một nửa dương.
$$ m_ {s} = - \ frac {1} {2} \: \: giảm $$
Đối với chuyển động được gọi là quay xuống, kết quả là nửa âm.
Đây là bốn số lượng tử.
Nguyên tắc loại trừ Pauli
Theo Nguyên tắc Loại trừ Pauli, no two electrons in an atom can have the same set of four identical quantum numbers. Nó có nghĩa là, nếu bất kỳ hai electron nào có cùng giá trị n, s, ml (như chúng ta vừa thảo luận ở trên) thì giá trị l chắc chắn sẽ khác nhau trong chúng. Do đó, không có hai electron sẽ có cùng năng lượng.
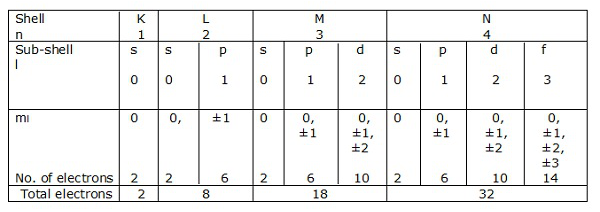
Vỏ điện tử
Nếu n = 1 là vỏ thì l = 0 là vỏ con.
Tương tự như vậy, n = 2 là shell và l = 0, 1 là sub-shell.
Vỏ của các electron ứng với n = 1, 2, 3… .. lần lượt được biểu diễn bằng K, L, M, N. Các vỏ con hoặc các obitan tương ứng với l = 0, 1, 2, 3, v.v. được ký hiệu lần lượt là s, p, d, f, v.v.
Hãy cùng chúng tôi xem xét cấu hình điện tử của cacbon, silic và germani (Nhóm IV - A).

Người ta quan sát thấy lớp vỏ con p ngoài cùng trong mỗi trường hợp chỉ chứa hai electron. Nhưng số electron có thể có là sáu. Do đó, có bốnvalence electronstrong mỗi vỏ ngoài nhất. Vì vậy, mỗi electron trong nguyên tử có năng lượng riêng. Sự sắp xếp nguyên tử bên trong các phân tử trong bất kỳ loại chất nào cũng gần như thế này. Nhưng khoảng cách giữa các nguyên tử khác nhau tùy theo vật chất.