Electronique de base - Matériaux
La matière est constituée de molécules constituées d'atomes. Selon la théorie de Bohr, «l'atome est constitué d'un noyau chargé positivement et d'un certain nombre d'électrons chargés négativement qui tournent autour du noyau sur diverses orbites». Lorsqu'un électron est élevé d'un état inférieur à un état supérieur, on dit qu'il estexcited. Pendant l'excitation, si l'électron est complètement éliminé du noyau, on dit que l'atome est ionisé. Ainsi, le processus d'élever l'atome de l'état normal à cet état ionisé est appelé commeionization.
La figure suivante montre la structure d'un atome.
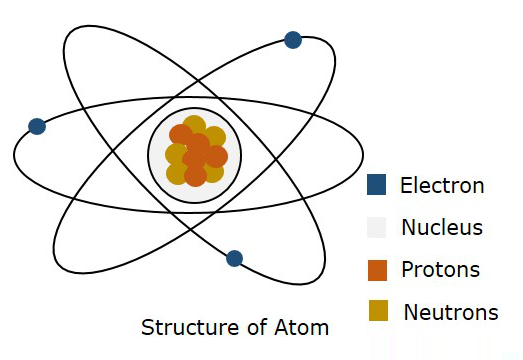
Selon le modèle de Bohr, on dit qu'un électron est déplacé dans un Orbit, alors que selon la mécanique quantique, on dit qu'un électron est quelque part dans l'espace libre de l'atome, appelé comme Orbital. Cette théorie de la mécanique quantique s'est avérée juste. Par conséquent, une frontière tridimensionnelle où un électron est susceptible de trouver est appeléeAtomic Orbital.
Nombres quantiques
Chaque orbitale, où un électron se déplace, diffère par son énergie et sa forme. Les niveaux d'énergie des orbitales peuvent être représentés à l'aide d'un ensemble discret d'intégrales et de demi-intégrales appelées nombres quantiques. Il existe quatre nombres quantiques utilisés pour définir une fonction d'onde.
Nombre quantique principal
Le premier nombre quantique qui décrit un électron est le Principal quantum number. Son symbole estn. Il spécifie la taille ou l'ordre (niveau d'énergie) du nombre. À mesure que la valeur de n augmente, la distance moyenne de l'électron au noyau augmente également, de même que l'énergie de l'électron augmente également. Le niveau d'énergie principal peut être compris comme une coquille.
Nombre quantique de moment angulaire
Ce nombre quantique a lcomme son symbole. Ce l indique la forme de l'orbitale. Il varie de 0 à n-1.
l = 0, 1, 2… n-1
Pour le premier shell, n = 1.
c'est-à-dire que pour n-1, l = 0 est la seule valeur possible de l lorsque n = 1.
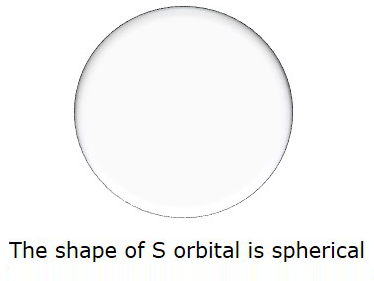
Ainsi, quand l = 0, il est appelé comme Sorbital. La forme du S est sphérique. La figure suivante représente la forme de S.
Si n = 2, alors l = 0, 1 car ce sont les deux valeurs possibles pour n = 2.
On sait qu'il s'agit d'une orbite S pour l = 0, mais si l = 1, c'est P orbital.
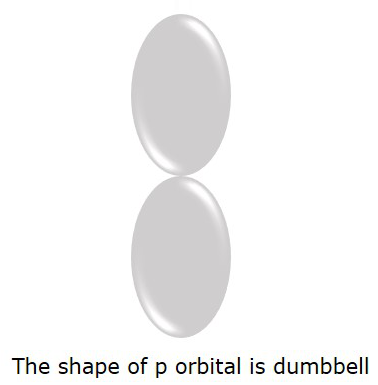
L'orbitale P où les électrons sont plus susceptibles de trouver se trouve dumbbellforme. Il est illustré dans la figure suivante.
Numéro quantique magnétique
Ce nombre quantique est noté mlqui représente l'orientation d'une orbitale autour du noyau. Les valeurs de m l dépendent de l.
$$ m_ {l} = \ int (-l \: \: à \: + l) $$
Pour l = 0, m l = 0, cela représente une orbitale S.
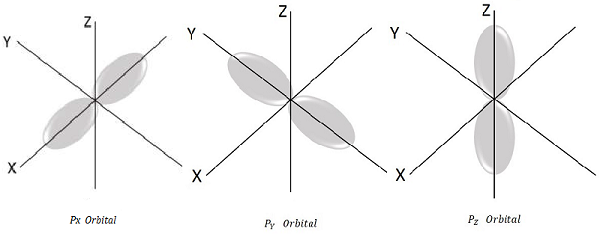
Pour l = 1, m l = -1, 0, +1 ce sont les trois valeurs possibles et cela représente P orbitale.
Par conséquent, nous avons trois orbitales P comme le montre la figure suivante.
Numéro Spin Quantum
Ceci est représenté par mset l'électron ici, tourne sur l'axe. Le mouvement de la rotation de l'électron pourrait être soit dans le sens horaire, soit dans le sens anti-horaire, comme indiqué ci-dessous.
Les valeurs possibles pour ce nombre quantique de spin seront comme,
$$ m_ {s} = + \ frac {1} {2} \: \: up $$
Pour un mouvement appelé spin up, le résultat est la moitié positive.
$$ m_ {s} = - \ frac {1} {2} \: \: down $$
Pour un mouvement appelé spin down, le résultat est négatif de moitié.
Ce sont les quatre nombres quantiques.
Principe d'exclusion de Pauli
Selon le principe d'exclusion de Pauli, no two electrons in an atom can have the same set of four identical quantum numbers. Cela signifie que si deux électrons ont les mêmes valeurs de n, s, ml (comme nous venons de le voir ci-dessus), alors la valeur l serait certainement différente en eux. Par conséquent, deux électrons n'auront pas la même énergie.
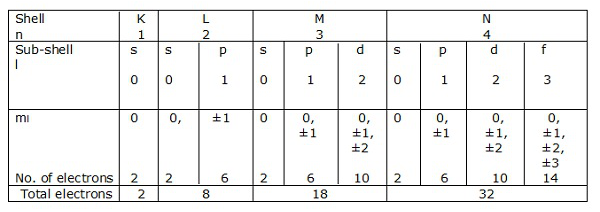
Coques électroniques
Si n = 1 est un shell, alors l = 0 est un sous-shell.
De même, n = 2 est un shell, et l = 0, 1 est un sous-shell.
Les couches d'électrons correspondant à n = 1, 2, 3… .. sont représentées respectivement par K, L, M, N. Les sous-coques ou les orbitales correspondant à l = 0, 1, 2, 3 etc. sont désignées respectivement par s, p, d, f etc.
Regardons les configurations électroniques du carbone, du silicium et du germanium (groupe IV - A).

On observe que la sous-couche p la plus externe dans chaque cas ne contient que deux électrons. Mais le nombre d'électrons possible est de six. Par conséquent, il y a quatrevalence electronsdans chaque coquille la plus extérieure. Ainsi, chaque électron dans un atome a une énergie spécifique. La disposition atomique à l'intérieur des molécules dans n'importe quel type de substance est presque comme ça. Mais l'espacement entre les atomes diffère d'un matériau à l'autre.