रसायन विज्ञान भाग 1 - त्वरित गाइड
परिचय
इस ब्रह्मांड में पाई जाने वाली हर चीज कुछ सामग्रियों से बनी है, वैज्ञानिकों ने उनका नामकरण किया है “matter.” उदाहरण के लिए, हम जो भोजन करते हैं, जो हवा हम सांस लेते हैं, पत्थर, बादल, तारे, पौधे, जानवर, पानी, धूल, सब कुछ पदार्थ के रूप में वर्गीकृत किया जाता है।
पदार्थ के कण के लक्षण
पदार्थ के कण बहुत छोटे होते हैं, सामान्य रूप से, नग्न आंखों से दिखाई नहीं देते हैं।

पदार्थ के कण लगातार चलते रहते हैं, जिसे इस रूप में जाना जाता है “kinetic energy.”
कणों की गतिज ऊर्जा सीधे तापमान पर निर्भर करती है, जैसे-जैसे तापमान बढ़ता है, गति की गति भी बढ़ती जाती है।
पदार्थ के कण बल को आकर्षित करते हैं; इसलिए, वे एक दूसरे को आकर्षित करते हैं।
कणों का आकर्षित बल कणों को एक साथ रखता है; हालाँकि, आकर्षित करने की शक्ति एक मामले से दूसरे प्रकार में भिन्न होती है।
द्रव्य की अवस्थाएं
पदार्थ के तीन निम्न अवस्थाएँ हैं -
Solid State
Liquid State
Gaseous State

आइए उनकी संक्षिप्त चर्चा करें -
ठोस अवस्था
सभी ठोस पदार्थों की एक निश्चित आकृति, अलग-अलग सीमाएँ और निश्चित मात्राएँ होती हैं।
अधिकांश ठोस पदार्थों में नगण्य संपीडन होता है।
बाहरी बल के अधीन होने पर सभी ठोस पदार्थों में अपना आकार बनाए रखने की स्वाभाविक प्रवृत्ति होती है।
ठोस सामग्री को लागू बल के तहत तोड़ा जा सकता है, लेकिन उनके आकार को बदलना बहुत मुश्किल है, क्योंकि वे कठोर हैं।
तरल अवस्था
ठोस पदार्थों के विपरीत, तरल पदार्थ का कोई निश्चित आकार नहीं होता है; हालाँकि, उनके पास एक निश्चित आयतन है।
तरल पदार्थ कंटेनर के आकार को लेते हैं जिसमें वे रखे जाते हैं।
तरल पदार्थ में प्रवाह और आकार बदलने की संपत्ति होती है।
गैसीय अवस्था
हवा के रूप में पदार्थ, जो न तो ठोस होता है और न ही तरल, गैस के रूप में जाना जाता है। उदाहरण के लिए, ऑक्सीजन, नाइट्रोजन, हाइड्रोजन, आदि।
ठोस के विपरीत, गैस का निश्चित आकार और आकार नहीं होता है।
गैसों, जैसे कि तरलीकृत पेट्रोलियम गैस (एलपीजी - खाना पकाने में उपयोग किया जाता है); संपीड़ित प्राकृतिक गैस (CNG - वाहनों में ईंधन के रूप में उपयोग किया जाता है), आदि में उच्च संपीड़ितता है; इसलिए, गैस की बड़ी मात्रा को एक छोटे सिलेंडर में संपीड़ित किया जा सकता है और इसे आसानी से ले जाया जा सकता है।
गैसें, आम तौर पर, अन्य गैसों में बहुत तेजी से फैलने की संपत्ति दिखाती हैं। यही कारण है कि हम दूर से (या तो अच्छा या बुरा) सूँघ सकते हैं।
पदार्थ अपने राज्य को बदल सकते हैं
पानी तीनों अवस्थाओं में मौजूद हो सकता है, जैसे बर्फ ठोस; तरल के रूप में पानी (H2O); और गैस के रूप में जल वाष्प। निम्नलिखित आरेख विभिन्न राज्यों में पानी के परिवर्तन को दर्शाता है -

तापमान, जिस पर ठोस पिघल जाता है और तरल में बदल जाता है (दिए गए वायुमंडलीय दबाव पर), के रूप में जाना जाता है “melting point.”
एक ठोस का पिघलने बिंदु इसके कणों के बीच आकर्षण बल की ताकत का संकेत है।
बर्फ का गलनांक 273.16 K यानी 0 0 C होता है।
पिघलने की प्रक्रिया (अर्थात ठोस अवस्था को तरल अवस्था में बदलना) के रूप में जानी जाती है fusion।
उष्मीय ऊर्जा की मात्रा, जो किसी ठोस पदार्थ को 1 किलो तरल पदार्थ को दिए गए वायुमंडलीय दबाव में तरल पदार्थों में बदलने के लिए आवश्यक है, इसे किस नाम से जाना जाता है? latent heat संलयन का।
जिस तापमान पर दिए गए वायुमंडलीय दबाव पर एक तरल पदार्थ उबलना शुरू होता है, उसे कहा जाता है “boiling point.”
पानी का क्वथनांक 373 K यानी 100 0 C है।
तरल अवस्था (या इसके विपरीत) में परिवर्तन के बिना ठोस से गैस तक सीधे किसी पदार्थ की स्थिति का परिवर्तन के रूप में जाना जाता है “sublimation.”
घटना अर्थात किसी तरल पदार्थ को उसके क्वथनांक से नीचे किसी भी तापमान पर वाष्प में बदलने के रूप में जाना जाता है “evaporation.”
ठोस कार्बन डाइऑक्साइड (CO 2 ) उच्च दबाव में संग्रहीत होता है।

एक बार दबाव 1 वायुमंडल में कम हो जाने पर सॉलिड सीओ 2 सीधे गैसीय अवस्था में परिवर्तित हो जाता है।
Atmosphere(एटीएम) गैस द्वारा निकाले गए दबाव को मापने की एक इकाई है और दबाव की इकाई पास्कल (पा) है; 1 वातावरण = 1.01 × 105 पा।
पदार्थ की चौथी अवस्था
Plasma वह राज्य है जिसमें सुपर ऊर्जावान और सुपर उत्साहित कण होते हैं।

सुपर उत्साहित कण आयनित गैसों के रूप में पाए जाते हैं। जैसे फ्लोरोसेंट ट्यूब (जिसमें हीलियम गैस होती है) और नियोन साइन बल्ब (जिसमें नीयन गैस होती है) में प्लाज्मा होता है।
परिचय
एक शुद्ध पदार्थ वह है जिसमें एकल प्रकार के कण या कण होते हैं।

बिना किसी अवांछनीय पदार्थ के दो या अधिक शुद्ध घटकों के मिश्रण के रूप में जाना जाता है Mixtures, उदाहरण के लिए, पानी, खनिज, मिट्टी आदि।
दो या अधिक पदार्थों के एक सजातीय मिश्रण के रूप में जाना जाता है solution। उदाहरण के लिए, नींबू पानी, सोडा पानी आदि।
समाधान किसी भी रूप में हो सकता है जैसे - यह तरल, ठोस या गैसीय में हो सकता है।
Alloysमिश्रण का एक और उदाहरण है जिसमें धातुओं के सजातीय मिश्रण होते हैं; उन्हें भौतिक तरीकों से अपने घटकों में अलग नहीं किया जा सकता है। उदाहरण के लिए, पीतल जस्ता (लगभग 30%) और तांबा (लगभग 70%) का मिश्रण है।
समाधान की महत्वपूर्ण विशेषताएं
समाधान आम तौर पर एक सजातीय मिश्रण है।
एक समाधान के कण व्यास में 1 एनएम (10-9 मीटर) से भी छोटे होते हैं और इसलिए, ये नग्न आंखों से दिखाई नहीं देते हैं।
प्रकाश का मार्ग एक समाधान में दिखाई नहीं देता है।
निस्पंदन की सरल प्रक्रिया द्वारा भंग कणों को मिश्रण से अलग नहीं किया जा सकता है।
विघटित होने पर विघटित कण नीचे नहीं बैठते हैं।
किसी दिए गए तापमान पर, जब किसी घोल में अधिक घोल नहीं डाला जा सकता है, तो इसे इस रूप में जाना जाता है ‘saturated solution.’
किसी दिए गए तापमान पर, संतृप्त घोल में मौजूद विघटित कणों की मात्रा को कहा जाता है solubility.’
निलंबन
एक निलंबन एक विषम मिश्रण है जिसमें विलेय कण विलीन नहीं होते हैं, बल्कि मध्यम के पूरे बल्क में निलंबित रहते हैं, इसे इस रूप में जाना जाता है ‘suspension.’
सस्पेंशन की महत्वपूर्ण विशेषताएं
एक निलंबन के कण नग्न आंखों से स्पष्ट रूप से दिखाई देते हैं।

निलंबन के कण प्रकाश की एक किरण को बिखेरते हैं जो इसके माध्यम से गुजरता है और इसी तरह, इसका मार्ग दिखाई देता है।
निस्पंदन की सरल प्रक्रिया द्वारा सलामी कणों को मिश्रण से अलग किया जा सकता है।
कोलाइड
एक विषम मिश्रण के रूप में जाना जाता है ‘colloid.’ जैसे धुंध, कोहरा, धुआं, फेस क्रीम इत्यादि।

कोलाइड कणों का आकार नग्न आंखों से देखने के लिए बहुत छोटा है।
कोलाइड के कण काफी बड़े होते हैं जो प्रकाश के एक बीम को बिखेरते हैं और इसके मार्ग को दिखाई देते हैं।
निस्पंदन की सरल प्रक्रिया द्वारा कोलाइड कणों को मिश्रण से अलग नहीं किया जा सकता है।
विशेष निस्पंदन तकनीक यानी centrifugation, कोलाइडल कणों को अलग करने के लिए इस्तेमाल किया जा सकता है।
क्रोमैटोग्राफी
मिश्रण के घटकों को अलग करने की प्रक्रिया को कहा जाता है chromatography; आमतौर पर इसका उपयोग रंग पृथक्करण के लिए किया जाता है।
क्रोमैटोग्राफी तकनीक का उपयोग उन विलेय के पृथक्करण के लिए किया जाता है जो एक ही विलायक में घुलते हैं।
आसवन
हीटिंग और कूलिंग साधनों द्वारा एक तरल को शुद्ध करने की प्रक्रिया को आसवन के रूप में जाना जाता है।
क्रिस्टलीकरण
एक घोल से एक शुद्ध ठोस को अलग करने वाली प्रक्रिया को विलयन के रूप में जाना जाता है ‘crystallization.’
तत्वों
1661 में, रॉबर्ट बॉयल पहले वैज्ञानिक थे जिन्होंने इस शब्द का इस्तेमाल किया था element; एंटोनी लॉरेंट लावोसियर, एक फ्रांसीसी रसायनज्ञ, पहले व्यक्ति थे जिन्होंने प्रयोगात्मक रूप से शब्द तत्व को परिभाषित किया था।
तत्व पदार्थ का एक मूल रूप है जिसे रासायनिक प्रतिक्रिया द्वारा सरल पदार्थों में नहीं तोड़ा जा सकता है।
तत्वों को सामान्य रूप से वर्गीकृत किया जा सकता है metals, non-metals, तथा metalloids।
धातु
एक ठोस सामग्री, जो आम तौर पर कठिन, नमनीय, निंदनीय, चमकदार और अच्छी विद्युत और तापीय चालकता के साथ उपयोग करने योग्य होती है, metal। जैसे सोना, चांदी, तांबा, एल्युमिनियम इत्यादि।

Mercury एकमात्र ऐसी धातु है जो कमरे के तापमान पर तरल रहती है।
नांमेटल
सभी तत्व या पदार्थ, जो धातु नहीं हैं, गैर-धातु के रूप में जाने जाते हैं। जैसे हाइड्रोजन, ऑक्सीजन, आयोडीन, कार्बन इत्यादि।
गैर-धातुओं में रंगों की विविधता होती है और वे ऊष्मा और बिजली के खराब संवाहक होते हैं।
गैर-धातुएं चमकदार, सुकोमल या निंदनीय नहीं हैं।
यौगिक
एक पदार्थ, जो दो या अधिक तत्वों से बना होता है, के रूप में जाना जाता है ‘compound.’
यौगिक एक निश्चित अनुपात में दो या दो से अधिक तत्वों के रासायनिक संयोजन का परिणाम है।

एक यौगिक के गुण इसके घटक तत्वों से किसी भी तरह भिन्न होते हैं, जबकि, एक मिश्रण के गुण इसके निर्माण तत्वों या यौगिकों के समान होते हैं।
परिचय
500 ईसा पूर्व के आसपास, एक भारतीय दार्शनिक महर्षि कणाद ने पहली बार मामले के अविभाज्य हिस्से की अवधारणा को पोस्ट किया और इसे नाम दिया ‘pramanu.’
1808 में, John Dalton शब्द का इस्तेमाल किया ‘atom’ और पोस्ट किया गया atomic theory पदार्थ का अध्ययन।

डाल्टन का परमाणु सिद्धांत
डाल्टन के परमाणु सिद्धांत के अनुसार, सभी पदार्थ, चाहे एक तत्व, एक यौगिक या मिश्रण छोटे कणों से बना होता है जिन्हें परमाणु कहा जाता है।
डाल्टन के परमाणु सिद्धांत के अनुसार, सभी मामले, चाहे वे तत्व, यौगिक, या मिश्रण हों, छोटे परमाणुओं के रूप में जाने जाने वाले कणों से बने होते हैं।
डाल्टन के परमाणु सिद्धांत की प्रमुख विशेषताएं
सभी पदार्थ परमाणुओं के रूप में जाने जाने वाले बहुत छोटे कणों से बने होते हैं।
परमाणु एक अविभाज्य कण है, जिसे रासायनिक प्रतिक्रिया के माध्यम से बनाया या नष्ट नहीं किया जा सकता है।
किसी तत्व के सभी परमाणु द्रव्यमान और रासायनिक गुणों में समान होते हैं जबकि, विभिन्न तत्वों के परमाणुओं में विभिन्न द्रव्यमान और रासायनिक गुण होते हैं।
एक यौगिक बनाने के लिए, परमाणुओं को छोटी संपूर्ण संख्याओं के अनुपात में संयोजित किया जाता है।
किसी दिए गए कंपाउंड में, परमाणुओं की सापेक्ष संख्या और प्रकार स्थिर होते हैं।
परमाणु भार
एक रासायनिक तत्व के परमाणु का द्रव्यमान; यह परमाणु द्रव्यमान इकाइयों (प्रतीक यू है ) में व्यक्त किया गया है ।
परमाणु द्रव्यमान परमाणु में मौजूद प्रोटॉन और न्यूट्रॉन की संख्या के लगभग बराबर है।
एक परमाणु द्रव्यमान इकाई, कार्बन -12 के एक परमाणु के द्रव्यमान के ठीक एक-बारहवें (1/12 वें) के बराबर एक द्रव्यमान इकाई है और सभी तत्वों के सापेक्ष परमाणु द्रव्यमान की गणना कार्बन -12 के एक परमाणु के संबंध में की गई है।
अणु
किसी तत्व या यौगिक का सबसे छोटा कण, जो स्वतंत्र रूप से मौजूद होने में सक्षम है और संबंधित पदार्थ के सभी गुणों को दर्शाता है।

एक अणु, सामान्य रूप से, दो या दो से अधिक परमाणुओं का एक समूह होता है जो रासायनिक रूप से एक साथ बंधे होते हैं।
अणु बनाने के लिए एक ही तत्व या अलग-अलग तत्वों के परमाणु एक साथ जुड़ सकते हैं (रासायनिक बंधन के साथ)।
अणु का गठन करने वाले परमाणुओं की संख्या को इसके रूप में जाना जाता है atomicity।
आयन
एक आवेशित कण को कहा जाता है ion; यह या तो हो सकता हैnegative charge या positive charge।
धनात्मक आवेशित आयन को a के रूप में जाना जाता है ‘cation’।
नकारात्मक रूप से आवेशित आयन को a के रूप में जाना जाता है ‘anion.’
रासायनिक सूत्र
एक यौगिक का रासायनिक सूत्र अपने घटक तत्वों और प्रत्येक संयोजन तत्व के परमाणुओं की संख्या को प्रदर्शित करता है।

एक यौगिक का रासायनिक सूत्र इसकी संरचना का प्रतीकात्मक प्रतिनिधित्व है।
किसी तत्व की संयोजन क्षमता को इसके रूप में जाना जाता है ‘valency.’
मॉलिक्यूलर मास्स
किसी पदार्थ के आणविक द्रव्यमान की गणना संबंधित पदार्थों के अणु में सभी परमाणुओं के परमाणु द्रव्यमान का योग करके की जाती है। उदाहरण के लिए, पानी के आणविक द्रव्यमान की गणना निम्नानुसार की जाती है -
हाइड्रोजन का परमाणु द्रव्यमान = 1u
ऑक्सीजन का परमाणु द्रव्यमान = 16 यू
पानी में हाइड्रोजन के दो परमाणु और ऑक्सीजन के एक परमाणु होते हैं।
पानी का आणविक द्रव्यमान = 2 × 1+ 1 × 16 = 18 u ( u आणविक द्रव्यमान का प्रतीक है)।
फॉर्मूला यूनिट मास
किसी पदार्थ के सूत्र इकाई द्रव्यमान की गणना किसी यौगिक की सूत्र इकाई में सभी परमाणुओं के परमाणु द्रव्यमान का योग करके की जाती है।
Avogadro Constant या Avogadro नंबर
एवोगैड्रो एक इतालवी वैज्ञानिक थे जिन्होंने एवोगैड्रो संख्या (जिसे एवोगैड्रो कॉन्स्टेंट के रूप में भी जाना जाता है) की अवधारणा दी थी।
किसी भी पदार्थ के 1 मोल में मौजूद कण (परमाणु, अणु, या आयन) की संख्या निश्चित होती है, और इसका मान हमेशा गणना के रूप में होता है 6.022 × 1023।
1896 में, विल्हेम ओस्टवाल्ड ने 'तिल;' की अवधारणा पेश की थी। हालांकि, 1967 में बड़ी संख्या में रिपोर्टिंग का एक सरल तरीका प्रदान करने के लिए तिल इकाई को स्वीकार किया गया था।
मास के संरक्षण का कानून
एक रासायनिक प्रतिक्रिया के दौरान, अभिकारकों और उत्पादों के द्रव्यमान का योग अपरिवर्तित रहता है, जिसे इस रूप में जाना जाता है ‘Law of Conservation of Mass.’
निश्चित अनुपात का कानून
एक शुद्ध रासायनिक यौगिक में, इसके तत्व हमेशा द्रव्यमान द्वारा एक निश्चित अनुपात में मौजूद होते हैं, जिसे के रूप में जाना जाता है ‘Law of Definite Proportions.’
परिचय
1900 तक, यह पता चला कि परमाणु एक सरल, अविभाज्य कण नहीं था, बल्कि इसमें उप-परमाणु कण होते हैं।
J.J. Thomson अर्थात् उप-परमाणु कण की खोज की ‘electron.’

जेजे थॉमसन पहले व्यक्ति थे जिन्होंने प्रस्तावित किया था model एक परमाणु की संरचना के लिए।
1886 में, ई। गोल्डस्टीन ने एक गैस डिस्चार्ज में नए विकिरणों की उपस्थिति की खोज की और उन्हें नाम दिया canal rays.
एक अन्य सकारात्मक चार्ज उप-परमाणु कण को नहर की किरणों के प्रयोगों के साथ खोजा गया और इसे नाम दिया गया proton।
थॉमसन का मॉडल ऑफ एटम
थॉमसन ने प्रस्तावित किया कि एक परमाणु में एक धनात्मक आवेशित क्षेत्र होता है और इसमें इलेक्ट्रॉन (ऋणात्मक आवेश) सन्निहित होते हैं (जैसा कि नीचे दी गई छवि में दिखाया गया है)।

इसके अलावा, थॉमसन ने कहा कि नकारात्मक और सकारात्मक शुल्क परिमाण में बराबर हैं। इस प्रकार, परमाणु एक पूरे के रूप में विद्युत रूप से तटस्थ है।
रदरफोर्ड के मॉडल ऑफ एटम
ई। रदरफोर्ड परमाणु भौतिकी के 'पिता' के रूप में लोकप्रिय हैं।

रदरफोर्ड को मोटे तौर पर रेडियोधर्मिता और उनके खोज पर काम करने के लिए जाना जाता है nucleus सोने के पन्नी प्रयोग के साथ एक परमाणु (जैसा कि नीचे दी गई छवि में दिखाया गया है।

रदरफोर्ड ने कहा कि एक परमाणु में, एक धनात्मक आवेशित केंद्र होता है जिसे जाना जाता है nucleus।
रदरफोर्ड ने कहा कि परमाणु के लगभग सभी द्रव्यमान नाभिक में मौजूद होते हैं।
रदरफोर्ड के अनुसार, इलेक्ट्रॉन अच्छी तरह से परिभाषित कक्षाओं में नाभिक के चारों ओर घूमते हैं।
बोहर का मॉडल एटम
नील बोहर ने रदरफोर्ड के मॉडल को आगे बढ़ाया और उनकी कमियों को सुधार दिया।

बोहर के अनुसार, केवल कुछ विशेष कक्षाओं को इलेक्ट्रॉन की असतत कक्षाओं के रूप में जाना जाता है, परमाणु के अंदर की अनुमति है।
बोह्र ने कहा कि इलेक्ट्रॉन असतत कक्षाओं में परिक्रमा करते हुए ऊर्जा को विकीर्ण नहीं करते हैं।
बोह्र नाम की कक्षाओं या गोले को ऊर्जा के स्तर (जैसा कि नीचे दी गई छवि में दिखाया गया है)।

बोहर ने इन कक्षाओं या गोले को K, L, M, N, ... या संख्याओं, n = 1,2,3,4, ... द्वारा दर्शाया है।
न्यूट्रॉन
1932 में, जे। चाडविक ने एक नए उप-परमाणु कण यानी न्यूट्रॉन की खोज की।
न्यूट्रॉन के पास कोई चार्ज नहीं है और एक प्रोटॉन के बराबर द्रव्यमान है।
न्यूट्रॉन हाइड्रोजन को छोड़कर सभी परमाणुओं के केंद्रक में मौजूद होते हैं।
विभिन्न कक्षाओं (गोले) में वितरित इलेक्ट्रॉन
किसी गोले में मौजूद इलेक्ट्रॉनों की अधिकतम संख्या सूत्र द्वारा दी जा सकती है 2n2।
‘n’ कक्षा संख्या या ऊर्जा स्तर सूचकांक है, अर्थात 1, 2, 3,…।
दिए गए सूत्र के अनुसार -
पहली कक्षा यानी K-shellहोगा = 2 × 1 2 = 2
दूसरी कक्षा यानी L-shellहोगा = 2 × 2 2 = 8
तीसरी कक्षा यानी M-shellहोगा = 2 × 3 2 = 18
चौथी कक्षा यानी N-shellहोगा = 2 × 4 2 = 32
इसी तरह, इलेक्ट्रॉनों की अधिकतम संख्या जिसे सबसे बाहरी कक्षा में समायोजित किया जा सकता है, 8 है।
इलेक्ट्रॉनों को किसी दिए गए शेल में नहीं भरा जाता है, जब तक कि आंतरिक शेल भरे नहीं जाते हैं। इसका मतलब है, गोले एक कदम-वार तरीके से भरे हुए हैं; आंतरिक शेल से बाहरी शेल तक शुरू।
वैलेंस
इलेक्ट्रॉनों, जो एक परमाणु के सबसे बाहरी शेल में मौजूद होते हैं, के रूप में जाने जाते हैं valence इलेक्ट्रॉनों।
बोह्र-बूरी मॉडल के अनुसार, एक परमाणु के सबसे बाहरी खोल में अधिकतम 8 इलेक्ट्रॉन हो सकते हैं।
परमाणु क्रमांक
एक परमाणु के नाभिक में मौजूद प्रोटॉन की कुल संख्या के रूप में जाना जाता है atomic number।
एक परमाणु के प्रोटॉनों की संख्या परमाणु संख्या निर्धारित करती है।
परमाणु संख्या को निरूपित किया जाता है ‘Z’।
प्रोटॉन और न्यूट्रॉन को सामूहिक रूप से जाना जाता है nucleons।
जन अंक
एक परमाणु के नाभिक में मौजूद प्रोटॉन और न्यूट्रॉन की कुल संख्या के रूप में जाना जाता है mass number।
आइसोटोप
एक ही तत्व के परमाणु, एक ही परमाणु संख्या लेकिन विभिन्न द्रव्यमान संख्याओं को समस्थानिक के रूप में जाना जाता है। जैसे हाइड्रोजन परमाणु में प्रोटिओम, ड्यूटेरियम और ट्रिटियम नामक तीन समस्थानिक होते हैं।
एक परमाणु के समस्थानिकों के रासायनिक गुण समान होते हैं लेकिन उनके भौतिक गुण भिन्न होते हैं।
isobars
अलग-अलग परमाणु संख्या वाले विभिन्न तत्वों के परमाणुओं, जिनकी द्रव्यमान संख्या समान होती है, उन्हें इसोबर्स के रूप में जाना जाता है। उदा। कैल्शियम की परमाणु संख्या 20and है आर्गन की परमाणु संख्या 18 है; इसके अलावा, इन परमाणुओं में इलेक्ट्रॉनों की संख्या अलग-अलग है, लेकिन इन दोनों तत्वों की द्रव्यमान संख्या 40 है।
परिचय
एक प्रक्रिया जिसमें एक या एक से अधिक रासायनिक पदार्थ अन्य रासायनिक पदार्थों के साथ प्रतिक्रिया करते हैं और एक या एक से अधिक विभिन्न पदार्थों में परिवर्तित होते हैं, रासायनिक प्रतिक्रिया के रूप में जाना जाता है।
रासायनिक समीकरण
एक रासायनिक समीकरण एक रासायनिक प्रतिक्रिया का प्रतीकात्मक प्रदर्शन है; इसे प्रतीकों और सूत्रों के माध्यम से दर्शाया जाता है। उदाहरण के लिए
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
मैग्नीशियम और ऑक्सीजन पदार्थ को अभिकारक के रूप में जाना जाता है और प्रतिक्रिया के परिणामस्वरूप, मैग्नीशियम ऑक्साइड को उत्पाद के रूप में जाना जाता है।
याद रखें, रासायनिक प्रतिक्रिया के उत्पादों में मौजूद तत्वों का कुल द्रव्यमान अभिकारकों में मौजूद तत्वों के कुल द्रव्यमान के बराबर होना चाहिए।
रासायनिक प्रतिक्रिया के पहले और बाद में प्रत्येक तत्व के परमाणुओं की संख्या हमेशा समान रहती है।
रासायनिक प्रतिक्रिया के प्रकार
निम्नलिखित रासायनिक प्रतिक्रिया के प्रमुख प्रकार हैं -
Combination Reaction
Decomposition Reaction
Displacement Reaction
आइए उनमें से प्रत्येक पर संक्षिप्त में चर्चा करें -
संयोजन प्रतिक्रिया
जब दो या दो से अधिक पदार्थ (अर्थात तत्व या यौगिक) एक एकल उत्पाद बनाने के लिए प्रतिक्रिया करते हैं, तो ऐसी प्रतिक्रिया के रूप में जाना जाता है combination reaction। उदाहरण के लिए
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
जैसा कि उपरोक्त प्रतिक्रिया में चित्रित किया गया है, कैल्शियम ऑक्साइड और पानी ने एक एकल उत्पाद बनाने के लिए प्रतिक्रिया (या संयुक्त) की, जिसे कैल्शियम हाइड्रॉक्साइड के रूप में जाना जाता है।
रासायनिक प्रतिक्रिया जिसमें उत्पाद के निर्माण के साथ-साथ ऊष्मा भी निकलती है, के रूप में जानी जाती है exothermic chemical reactions।
अपघटन प्रतिक्रिया
प्रतिक्रिया, जिसमें एक एकल अभिकारक सरल उत्पादों में टूट जाता है, एक अपघटन प्रतिक्रिया के रूप में जाना जाता है। उदाहरण के लिए

ऊपर दी गई प्रतिक्रिया में, फेरस सल्फेट क्रिस्टल (अर्थात FeSO 4 , 7H 2 O), गर्म होने पर, यह पानी खो देता है और क्रिस्टल का रंग बदल जाता है। अंत में, यह फेरिक ऑक्साइड (Fe 2 O 3 ), सल्फर डाइऑक्साइड (SO 2 ) और सल्फर ट्राइऑक्साइड (SO 3 ) में विघटित हो जाता है ।
विस्थापन प्रतिक्रिया
प्रतिक्रिया, जिसमें एक तत्व किसी अन्य तत्व को विस्थापित या हटाता है, विस्थापन प्रतिक्रिया के रूप में जाना जाता है। उदाहरण के लिए
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
ऊपर दी गई प्रतिक्रिया में, तांबा सल्फेट के घोल से लोहा विस्थापित हो जाता है और लौह सल्फेट बनता है।
ऑक्सीकरण और न्यूनीकरण
यदि कोई पदार्थ एक प्रतिक्रिया के दौरान ऑक्सीजन प्राप्त करता है, तो इसे के रूप में जाना जाता है oxidation। दूसरी ओर, एक प्रतिक्रिया में, यदि कोई पदार्थ ऑक्सीजन खो देता है, तो इसे के रूप में जाना जाता हैreduction। उदाहरण के लिए

ऊपर दी गई प्रतिक्रिया में, कॉपर ऑक्साइड ऑक्सीजन खो देता है और इसलिए कम हो जाता है (यानी कमी); दूसरी ओर, हाइड्रोजन ऑक्सीजन प्राप्त करता है और इसलिए ऑक्सीकरण (यानी ऑक्सीकरण)।
जंग
जब किसी धातु पर तात्कालिक वातावरण में पाए जाने वाले पदार्थों, जैसे नमी, अम्ल इत्यादि का आक्रमण होता है, तो उसे इस रूप में जाना जाता है corrosion। जैसे चांदी पर काला लेप, तांबे पर हरी कोटिंग, आदि।

बासी होना
जब वसा और तेल ऑक्सीकरण हो रहे हैं, तो प्रक्रिया को कठोरता के रूप में जाना जाता है। उनकी गंध, स्वाद, रंग आदि भी बदल जाते हैं; इसी तरह, इसने भोजन को उपभोग के लिए असुरक्षित बना दिया।
परिचय
हम भोजन को खट्टा और कड़वा स्वाद देते हैं, यह केवल क्रमशः एसिड और ठिकानों की उपस्थिति के कारण है।
लिटमस समाधान
लिटमस, जिसे लाइकेन से निकाला जाता है, में बैंगनी रंग होता है (नीचे दी गई छवि देखें), लेकिन स्थिति यह है कि यह न तो अम्लीय है और न ही बुनियादी, यानी तटस्थ है।

लिटमस मूल रूप से एक पौधा थालोफाइटा से संबंधित है, और रासायनिक प्रयोग में, इसे आमतौर पर एक संकेतक के रूप में उपयोग किया जाता है।
पदार्थ, जो गंध अम्लीय या बुनियादी मीडिया में बदलते हैं, के रूप में जाना जाता है olfactory संकेतक।
पानी के घोल में अम्ल या क्षार
एचसीएल में हाइड्रोजन आयन पानी की उपस्थिति के कारण उत्पन्न होते हैं। दूसरे, HCl अणुओं से H + आयन का पृथक्करण पानी की अनुपस्थिति में नहीं किया जा सकता है। रासायनिक सूत्र नीचे चित्रित किया गया है
HCl + H2O → H3O+ + Cl–
इसके अलावा, हाइड्रोजन आयन अकेले मौजूद नहीं हो सकते हैं, लेकिन वे पानी के अणुओं की उपस्थिति में मौजूद हो सकते हैं। इसलिए, हाइड्रोजन आयनों को H + (aq) या हाइड्रोनियम आयन (H 3 O + ) के रूप में दिखाया जाता है । रासायनिक सूत्र है -
H+ + H2O → H3O+
पानी में घुलनशील क्षार के रूप में जाना जाता है alkalis। लेकिन सभी आधार पानी में घुलनशील नहीं हैं।
यदि पानी को एक केंद्रित एसिड में जोड़ा जाता है, तो गर्मी उत्पन्न होती है।
प्रति यूनिट आयतन में आयनों (यानी H 3 O + / OH–) की सांद्रता में पानी के साथ एक अम्ल या क्षार को कम करने और इस प्रक्रिया के रूप में जाना जाता हैdilution।
पी एच स्केल
एक घोल में हाइड्रोजन आयन सांद्रता को मापने के लिए प्रयोग किया जाता है pH scale।
‘p’ पीएच में खड़ा है ‘potenz’, यह एक जर्मन शब्द है, जिसका अर्थ है ‘power’.
पीएच मान को केवल एक संख्या के रूप में लिया जाता है, जो एक समाधान के अम्लीय या मूल प्रकृति को इंगित करता है। इसलिए, यदि हाइड्रोनियम आयन की सांद्रता अधिक है, तो pH का मान कम होगा।
पीएच पैमाने का मान बीच होता है ‘0’ तथा ’14;’ इसलिए, यदि pH मान को '0' मापा जाता है, तो इसका मतलब है - यह बहुत है acidic और अगर यह 14 है, तो इसका मतलब है - यह बहुत alkaline।
पीएच पैमाने का तटस्थ मूल्य है ‘7’.
पीएच पैमाने पर, 7 से कम मूल्य एक अम्लीय समाधान का प्रतिनिधित्व करते हैं और 7 से अधिक मूल्य एक बुनियादी समाधान का प्रतिनिधित्व करते हैं।
आम तौर पर सामान्य संकेतक के साथ लगाए गए कागज का उपयोग पीएच को मापने के लिए किया जाता है (नीचे दी गई छवि देखें) -
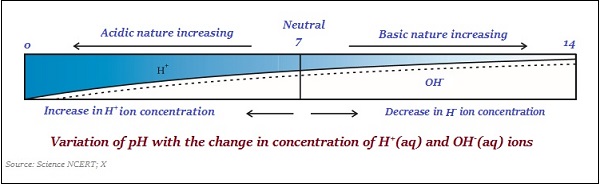
इसी तरह, अम्ल और क्षार पदार्थ की ताकत मुख्य रूप से क्रमशः उत्पादित H + आयनों और OH - आयनों की संख्या पर निर्भर करती है।
निम्नलिखित छवि मोटे तौर पर दिखाता है (रंग में भिन्नता) कुछ सामान्य पदार्थों का पीएच मान -

हर दिन जीवन में पीएच का महत्व
मानव शरीर का पीएच मान 7.0 और 7.8 के बीच होता है।
एक मानव शरीर का पेट हाइड्रोक्लोरिक एसिड का उत्पादन करता है जो भोजन के पाचन में मदद करता है; आश्चर्यजनक रूप से, यह वैसे भी पेट को नुकसान नहीं पहुंचाता है।
हालांकि, जब पेट बहुत अधिक एसिड (अपच के रूप में जाना जाता है) पैदा करता है, तो यह दर्द और जलन का कारण बनता है। इस दर्द से राहत पाने के लिए, डॉक्टर एंटीसिड्स के रूप में जाने वाले आधारों के उपयोग का सुझाव देते हैं।
ये एंटासिड एसिड की बढ़ी हुई मात्रा को बेअसर और नियंत्रित करते हैं।
दांत, जो कैल्शियम फॉस्फेट से बने होते हैं, शरीर का सबसे कठोर पदार्थ है। हालांकि, जब मुंह में पीएच कम हो जाता है (5.5 से नीचे), तो यह दांतों को मजबूत करता है।
नमक, सामान्य रूप से, हाइड्रोक्लोरिक एसिड और सोडियम हाइड्रोक्साइड समाधान के संयोजन से बनता है; और, संयोजन को सोडियम क्लोराइड के रूप में जाना जाता है।
जब वर्षा जल का पीएच मान 5.6 से कम मापा जाता है, तो इसे निम्न के रूप में जाना जाता है acid rain।
जब एसिड वर्षा नदियों में बहती है, तो यह नदी के पानी के पीएच को भी कम करती है
अम्लीय नदी का पानी जलीय जीवन के अस्तित्व के लिए खतरा है।
ब्लीचिंग पाउडर
ब्लीचिंग पाउडर को सूखे स्लेड चूने [सीए (ओएच) 2 ] पर क्लोरीन की क्रिया द्वारा निर्मित किया जाता है और इसे CaOCl 2 के रूप में दर्शाया जाता है ।
ब्लीचिंग पाउडर का उपयोग आम तौर पर कपड़ा उद्योग, कागज कारखाने, रासायनिक उद्योग और पीने के पानी कीटाणुरहित करने में किया जाता है।
बेकिंग सोडा
बेकिंग सोडा का उपयोग आमतौर पर रसोई में स्वादिष्ट खस्ता खाद्य पदार्थों को पकाने के लिए किया जाता है। यह कुछ खाद्य पदार्थों को भी तेजी से पकाता है।
बेकिंग सोडा का रासायनिक नाम सोडियम हाइड्रोजेनकार्बोनेट है और सूत्र NaHCO 3 है ।
धुलाई का सोडा
सोडियम कार्बोनेट के पुन: उपयोग से सोडा धोने में परिणाम होता है।
वाशिंग सोडा का रासायनिक सूत्र Na 2 CO 3 .10H 2 O है।
वॉशिंग सोडा का उपयोग आमतौर पर कांच, साबुन और कागज उद्योगों में किया जाता है।
प्लास्टर ऑफ पेरिस
प्लास्टर ऑफ़ पेरिस एक सफ़ेद पाउडर है जिसका उपयोग डॉक्टर अस्थि-भंग हड्डियों को सहारा देने के लिए करते हैं।
प्लास्टर ऑफ पेरिस का रासायनिक नाम कैल्शियम सल्फेट हेमहाइड्रेट है और रासायनिक सूत्र 2CaSO 4। 6। 2 है ।
परिचय
धातुओं को उनके रासायनिक और भौतिक गुणों के आधार पर गैर-धातुओं से अलग किया जा सकता है।
धातुओं की संपत्ति जिसके द्वारा उन्हें पतली चादर में पीटा जा सकता है, के रूप में जाना जाता है malleability।
धातु की संपत्ति जिसके द्वारा इसे तारों में खींचा जा सकता है, के रूप में जाना जाता है ductility।
धातु सामान्य रूप से कठोर, निंदनीय, चमकदार, नमनीय, ध्वनिहीन और ऊष्मा और विद्युत के सुचालक होते हैं। जैसे लोहा, तांबा, कैल्शियम, एल्यूमीनियम, मैग्नीशियम, आदि।

वे सामग्री, जो उष्मीय नहीं हैं और ऊष्मा और विद्युत के खराब संवाहक हैं, के रूप में जानी जाती हैं non-metals। जैसे सल्फर, कार्बन, ऑक्सीजन, फास्फोरस, आदि।
कुछ धातुएँ, जैसे कि sodium तथा potassium नरम हैं और चाकू से काटा जा सकता है।
Mercury एकमात्र धातु है, जो कमरे के तापमान पर तरल अवस्था में रहती है।
जब सल्फर डाइऑक्साइड पानी में घुल जाता है, तो सल्फ्यूरस एसिड बनता है। चित्रण - सल्फर डाइऑक्साइड (एसओ 2 ) + पानी (एच 2 ओ) → सल्फ्यूरस एसिड (एच 2 एसओ 3 )।
अधातुओं के ऑक्साइड प्रकृति में अम्लीय होते हैं।
सल्फ्यूरस एसिड नीले लिटमस पेपर लाल को बदलता है।
फास्फोरस एक बहुत ही प्रतिक्रियाशील गैर-धातु है और हवा के संपर्क में आने पर यह आग पकड़ लेता है।
वायुमंडलीय ऑक्सीजन के साथ फास्फोरस के संपर्क को रोकने के लिए, फास्फोरस को पानी में संग्रहीत किया जाता है।
जलने पर, धातु आसानी से ऑक्सीजन के साथ प्रतिक्रिया करते हैं और धातु के आक्साइड का उत्पादन करते हैं, ये प्रकृति में मूल हैं।
गैर-धातुएं ऑक्सीजन के साथ प्रतिक्रिया करती हैं और गैर-धातु ऑक्साइड का उत्पादन करती हैं; ये प्रकृति में अम्लीय हैं।
कुछ धातुएं पानी के साथ प्रतिक्रिया करती हैं और धातु हाइड्रॉक्साइड और हाइड्रोजन गैस का उत्पादन करती हैं।
Nonmetals आम तौर पर पानी के साथ प्रतिक्रिया नहीं करते हैं।
धातु भी एसिड के साथ प्रतिक्रिया करते हैं और हाइड्रोजन गैस और धातु लवण का उत्पादन करते हैं।
गैर-धातुएं आमतौर पर एसिड के साथ प्रतिक्रिया नहीं करती हैं।
धातु और अधातु का उपयोग
धातु का उपयोग मशीनरी, हवाई जहाज, ऑटोमोबाइल, ट्रेन, उपग्रह, औद्योगिक गैजेट, खाना पकाने के बर्तन, पानी के बॉयलर, आदि बनाने में किया जाता है।
गैर-धातुओं का उपयोग उर्वरकों में पौधों के विकास में सुधार के लिए किया जाता है।
गैर-धातु का उपयोग जल शोधन में किया जाता है।
पटाखे में गैर-धातुओं का उपयोग किया जाता है।
परिचय
एक ठोस सामग्री, जो आम तौर पर कठोर, निंदनीय, चमकदार, सुपाच्य और नमनीय होती है, धातुओं के रूप में जानी जाती है। जैसे लोहा, तांबा, एल्यूमीनियम, मैग्नीशियम, सोडियम, सीसा, जस्ता, आदि।
आम तौर पर, धातुओं में अच्छी विद्युत और तापीय चालकता होती है।

धातु, उनकी शुद्ध अवस्था में, एक चमकदार सतह होती है, जिसे जाना जाता है metallic luster।
धातुओं को पतली चादर में पीटा जा सकता है; इस संपत्ति के रूप में जाना जाता हैmalleability।
धातुओं को पतली तारों में खींचने की संपत्ति के रूप में जाना जाता है ductility। ईजी गोल्ड सबसे नमनीय धातु है।
चांदी और तांबा सबसे अच्छा गर्मी कंडक्टर हैं।
गैर-धातु
अधातुएँ सामान्यतः ठोस या गैस अवस्थाओं में पाई जाती हैं। हालांकि, ब्रोमीन एक अपवाद है जो तरल अवस्था में पाया जाता है।
गैर-धातुओं के कुछ प्रमुख उदाहरण कार्बन, सल्फर, आयोडीन, ऑक्सीजन, हाइड्रोजन, आदि हैं।

धातु और अधातु के तथ्य
पारा को छोड़कर सभी धातुएं कमरे के तापमान पर ठोस रूप में मौजूद होती हैं।
गैलियम और सीज़ियम में बहुत कम गलनांक होता है; ये दोनों धातुएं हथेली पर भी पिघल जाती हैं।
आयोडीन एक गैर-धातु है, लेकिन यह चमकदार है (चमकदार धातु की संपत्ति है)।
कार्बन एक गैर-धातु है जो विभिन्न रूपों में मौजूद हो सकता है। प्रत्येक रूप को एक एलोट्रोप कहा जाता है।
हीरा कार्बन का एक अलॉट्रोप है और यह ज्ञात सबसे कठोर प्राकृतिक पदार्थ है।
हीरे का गलनांक और क्वथनांक बहुत अधिक होता है।
ग्रेफाइट भी कार्बन का आबंटोप है; यह विद्युत का संवाहक है।
अल्कली धातुएं, जैसे कि लिथियम, पोटेशियम, सोडियम, नरम धातुओं के उदाहरण हैं, क्योंकि उन्हें चाकू से काटा जा सकता है।
ऑक्सीजन के साथ संयुक्त होने पर लगभग सभी धातुएं धातु आक्साइड बनाती हैं।
विभिन्न धातुओं की प्रतिक्रिया की अलग-अलग आवृत्ति होती है; कुछ धीमी गति से प्रतिक्रिया करते हैं, लेकिन कुछ बहुत तेजी से प्रतिक्रिया करते हैं। उदाहरण के लिए, पोटेशियम और सोडियम बहुत प्रतिक्रियाशील होते हैं और वे खुले में रखे जाने पर ही आग पकड़ते हैं।
इसलिए, पोटेशियम और सोडियम को मिट्टी के तेल में डुबो कर रखा जाता है ताकि वे आग न पकड़ सकें।
हालांकि, सभी धातुओं में से, सोडियम (सबसे अधिक संभावना), सबसे प्रतिक्रियाशील धातु है।
Anodizing एल्यूमीनियम की एक मोटी सुरक्षात्मक ऑक्साइड परत बनाने की एक प्रक्रिया है और यह जंग से बचाता है।
पृथ्वी के क्रस्ट (ऊपरी परत) में प्राकृतिक रूप से पाए जाने वाले तत्व या यौगिक खनिज के रूप में जाने जाते हैं।
कच्चे रूप में खनिजों के रूप में जाना जाता है ores। जैसे सोना, चांदी, लोहा आदि (नीचे दी गई छवि में दिखाया गया लौह अयस्क) -

पृथ्वी से निकाले गए अयस्कों को आमतौर पर बड़ी मात्रा में अशुद्धियों से दूषित किया जाता है, जैसे कि कुछ तत्वों, मिट्टी, रेत, आदि के साथ मिलाया जाता है। ‘gangue’।
प्रतिक्रियाशील प्रकृति और अयस्कों से निष्कर्षण के आधार पर धातुओं को वर्गीकृत किया जा सकता है -

परिचय
कार्बन सभी जीवित प्राणियों के लिए बहुत महत्वपूर्ण भूमिका निभाता है।
पृथ्वी की पपड़ी में कार्बन की मात्रा केवल 0.02% है, जो कि कार्बोनेट, हाइड्रोजन-कार्बोनेट, कोयला और पेट्रोलियम जैसे खनिजों के रूप में उपलब्ध है।
पृथ्वी के वातावरण में कार्बन की उपस्थिति कार्बन डाइऑक्साइड के रूप में 0.03% है।
कार्बन के यौगिक
लगभग सभी कार्बन यौगिक (कुछ को छोड़कर) बिजली के खराब कंडक्टर हैं।
हीरा और ग्रेफाइट दोनों कार्बन परमाणुओं द्वारा बनते हैं; हालाँकि, यह अंतर उन दोनों के बीच होता है जिस तरह से कार्बन परमाणुओं को एक दूसरे से बंधे होते हैं।
हीरे में, कार्बन का प्रत्येक परमाणु, चार अन्य कार्बन परमाणुओं के साथ जुड़ा होता है और एक कठोर त्रि-आयामी संरचना बनाता है (नीचे दी गई छवि देखें)।
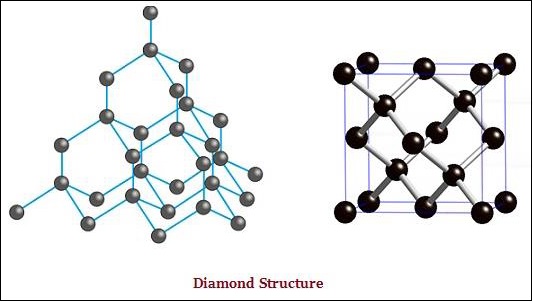
ग्रेफाइट में, कार्बन के प्रत्येक परमाणु, एक ही विमान में तीन अन्य कार्बन परमाणुओं से बंधे होते हैं, जो एक हेक्सागोनल सरणी देता है (नीचे दी गई छवि देखें) -
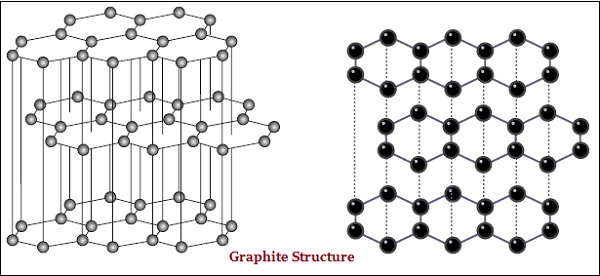
हीरे और ग्रेफाइट की कुछ भौतिक संरचना में भी अंतर है।
हीरा सबसे कठोर पदार्थ है, जबकि ग्रेफाइट चिकना और फिसलन वाला पदार्थ है।
ग्रेफाइट बिजली का सुचालक है जबकि हीरा नहीं है।
निम्नलिखित तालिका कार्बन और हाइड्रोजन के यौगिकों की संरचनाओं को दर्शाती है -
| नाम | सूत्र | संरचना |
|---|---|---|
| मीथेन | सीएच 4 |

|
| एटैन | सी 2 एच 6 |

|
| प्रोपेन | सी 3 एच 8 |

|
| बुटान | सी 4 एच 10 |

|
| पेंटेन | सी 5 एच 12 |

|
| हेक्सेन | सी 6 एच 14 |

|
यौगिक, जिसमें समान आणविक सूत्र होते हैं, लेकिन विभिन्न संरचनाएं, के रूप में जानी जाती हैं structural isomers (नीचे दिए गए ब्यूटेन की संरचना देखें)।

संतृप्त हाइड्रोकार्बन के रूप में जाना जाता है alkanes।
असंतृप्त हाइड्रोकार्बन, जिसमें एक या अधिक दोहरे बॉन्ड शामिल होते हैं, के रूप में जाना जाता है alkenes।
असंतृप्त हाइड्रोकार्बन, जिसमें एक या अधिक ट्रिपल बॉन्ड होते हैं, के रूप में जाना जाता है alkynes।
अल्कोहल का ईंधन के रूप में उपयोग
गन्ने के पौधे बहुत ही कुशल सूर्य के प्रकाश को रासायनिक ऊर्जा में परिवर्तित करते हैं और इसके रस का उपयोग गुड़ तैयार करने के लिए किया जा सकता है।
जब गुड़ को किण्वित किया जाता है, तो यह शराब (इथेनॉल) पैदा करता है।
कुछ देश अब पेट्रोल में एक योजक के रूप में शराब का उपयोग करते हैं, क्योंकि यह एक स्वच्छ ईंधन है।
पर्याप्त मात्रा में हवा (ऑक्सीजन) में जलने पर ये अल्कोहल केवल कार्बन डाइऑक्साइड और पानी को जन्म देता है।
एस्टर
एस्टर मीठे-महक वाले पदार्थ हैं, जो आमतौर पर एक एसिड और अल्कोहल की प्रतिक्रिया से बनते हैं (नीचे दी गई छवि देखें - एस्टर के गठन को दर्शाते हुए)।
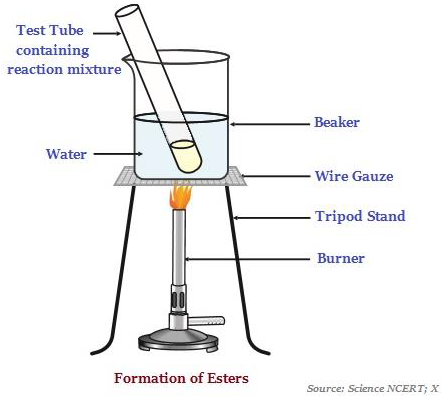
जब एस्टर एक एसिड या बेस की उपस्थिति में प्रतिक्रिया करता है, तो यह शराब और कार्बोक्जिलिक एसिड वापस देता है।
एक एसिड या आधार के साथ एस्टर की प्रतिक्रिया के रूप में जाना जाता है saponification क्योंकि इसका उपयोग साबुन बनाने में किया जाता है।
साबुन के अणु सामान्य रूप से लंबी श्रृंखला वाले कार्बोक्जिलिक एसिड के सोडियम या पोटेशियम लवण होते हैं।
दिलचस्प है, साबुन का आयनिक-अंत पानी में घुल जाता है जबकि कार्बन श्रृंखला तेल में घुल जाती है। साबुन के अणुओं की यह विशिष्ट विशेषताएं संरचनाओं के रूप में जानी जाती हैंmicelles (नीचे दी गई छवि देखें)

मिसेलस में, अणुओं का एक छोर तेल की छोटी बूंद की ओर होता है जबकि आयनिक-अंत बाहर रहता है।
साबुन मिसेल पानी में गंदगी को भंग करने में मदद करता है; इसी तरह, कपड़े साफ हो जाते हैं।
दूसरी ओर, डिटर्जेंट आमतौर पर लंबी श्रृंखला कार्बोक्जिलिक एसिड के अमोनियम या सल्फोनेट लवण होते हैं, जो कठिन पानी में भी प्रभावी रहते हैं।
कपड़े की सफाई के लिए शैंपू और कुछ अन्य उत्पादों को बनाने के लिए डिटर्जेंट का उपयोग किया जाता है।
परिचय
लगभग 115 तत्व आज तक हमें ज्ञात हैं।
उनके गुणों के आधार पर, सभी तत्वों को क्रम में व्यवस्थित किया जाता है, जिसे आवधिक तालिका के रूप में जाना जाता है।
जर्मन वैज्ञानिक जोहान वोल्फगैंग डोबेरिनर ने पहली बार 1817 में तत्वों की व्यवस्था करने का प्रयास किया था।
अंग्रेज वैज्ञानिक जॉन न्यूलैंड्स ने भी तत्कालीन ज्ञात तत्वों (1866 में) की व्यवस्था करने का प्रयास किया।
जॉन न्यूलैंड्स ने तत्वों की व्यवस्था के लिए परमाणु द्रव्यमान बढ़ाने के आदेश का पालन किया था।
न्यूलैंड्स सबसे कम परमाणु द्रव्यमान (जैसे हाइड्रोजन) वाले तत्व से शुरू हुआ और थोरियम पर समाप्त हुआ, जो 56 वां तत्व था (उसके समय)।

तत्वों की न्यूलैंड की व्यवस्था को "ऑक्टेव्स के कानून" के रूप में जाना जाता है, क्योंकि उनकी व्यवस्था में प्रत्येक आठ तत्व में पहले के समान गुण थे। उदा। लिथियम और सोडियम के गुण समान पाए गए।
| सा (करो) | पुनः (पुनः) | Ga (mi) | मा (fa) | पा (इसलिए) | दा (ला) | नी (ती) |
|---|---|---|---|---|---|---|
| एच | ली | होना | ख | सी | एन | हे |
| एफ | ना | मिलीग्राम | अल | सी | पी | रों |
| क्लोरीन | क | सीए | सीआर | ती | एम.एन. | फ़े |
| सह & नी | घन | Zn | Y | में | जैसा | से |
| बीआर | Rb | एसआर | Ce और ला | zr |
न्यूलैंड्स ने इसकी तुलना संगीत में पाए जाने वाले अष्टक के साथ की (ऊपर दी गई तालिका देखें)।
भारतीय संगीत में, सात संगीत नोट हैं - सा, रे, गा, मा, पा, दा, नी; हालाँकि, पश्चिम में, संगीत नोट हैं - डू, री, एमआई, फ़े, सो, ला, टी।
इसके अलावा, अपनी तालिका में कुछ तत्वों को फिट करने के लिए, न्यूलैंड्स ने दो तत्वों को एक ही सेल में रखा (ऊपर दी गई तालिका देखें - कोबाल्ट और निकल को एक ही सेल में रखा गया), लेकिन यह तकनीक काम नहीं करती थी, क्योंकि उनके पास अलग-अलग गुण होते हैं।
हालांकि, ऑक्टेव के कानून में सीमा थी, जैसा कि केवल कैल्शियम तक लागू था; और, कैल्शियम के बाद हर आठवें तत्व में पहले के समान गुण नहीं थे।
मेंडलीव की आवर्त सारणी
दिमित्री इवानोविच मेंडलेव, एक रूसी रसायनज्ञ, जिन्होंने तत्वों की व्यवस्था करने का सफलतापूर्वक प्रयास किया।
मेंडेलीव ने अपनी (तत्वों) मौलिक संपत्ति, परमाणु द्रव्यमान, साथ ही रासायनिक गुणों की समानता के आधार पर तत्वों की व्यवस्था की।
मेंडेलीव के समय में, केवल 63 तत्व ज्ञात थे।
मेंडलीव की आवर्त सारणी में लंबवत स्तंभ होते हैं जिन्हें जाना जाता है ‘groups’ और क्षैतिज पंक्तियों के रूप में जाना जाता है ‘periods.’

मेंडेलीव के आवधिक कानून कहता है कि
At तत्वों के गुण उनके परमाणु द्रव्यमानों का आवधिक कार्य हैं ’।
मेंडलीव ने अनुक्रम को उल्टे फैशन में व्यवस्थित किया ताकि समान गुणों वाले तत्वों को एक साथ समूहीकृत किया जा सके।
मेंडलीव ने कुछ तत्वों के लिए जगह छोड़ी, जो उस समय नहीं खोजे गए थे; उन्होंने भविष्य के तत्वों के अस्तित्व के बारे में साहसपूर्वक भविष्यवाणी की।
मेंडलीव के आवर्त सूत्र की सबसे बड़ी सीमा है - आवर्त सारणी में हाइड्रोजन को कोई नियत स्थान नहीं दिया गया है।
आधुनिक आवर्त सारणी
1913 में, एक अंग्रेज भौतिक विज्ञानी हेनरी मोसले ने पाया कि किसी तत्व की परमाणु संख्या उसके परमाणु द्रव्यमान की तुलना में अधिक मौलिक गुण है।
मोसले की खोज के आधार पर, मेंडेलीव के आवधिक कानून को संशोधित किया गया और परमाणु संख्या को आधुनिक आवर्त सारणी के आधार के रूप में अपनाया गया।
आधुनिक आवधिक कानून कहता है -
'तत्वों के गुण उनके परमाणु संख्या का एक आवधिक कार्य हैं।'
18 वर्टिकल कॉलम 'groups' तथा 7 'पीरियड्स' के रूप में जानी जाने वाली क्षैतिज पंक्तियों को आधुनिक आवर्त सारणी में परिभाषित किया गया है।
आधुनिक आवर्त सारणी में, तत्वों को इस तरह से व्यवस्थित किया जाता है कि यह परमाणु आकार, वैधता या संयोजन क्षमता और धातु और गैर-धातु विशेषताओं (तत्वों का) जैसे गुणों की आवधिकता को दर्शाता है।
आधुनिक आवर्त सारणी में, धातु का चरित्र एक अवधि में घट जाता है और समूह को बढ़ा देता है।
दूसरी ओर, गैर-धातुएं इलेक्ट्रोनगेटिव हैं, क्योंकि वे इलेक्ट्रॉनों को प्राप्त करके बांड बनाते हैं।
आधुनिक आवर्त सारणी में, गैर-धातुओं को दाईं ओर (ऊपर से) रखा जाता है।
परिचय
हमारे द्वारा पहने जाने वाले कपड़े कपड़ों से बने होते हैं और कपड़े फाइबर से बने होते हैं, जो प्राकृतिक या कृत्रिम स्रोतों से प्राप्त होते हैं।
रेशों का प्राकृतिक स्रोत कपास, ऊन, रेशम आदि हैं, जो पौधों या जानवरों से प्राप्त होते हैं।
सिंथेटिक फाइबर मानव द्वारा बनाए जाते हैं; इसलिए, इन्हें सिंथेटिक या मानव निर्मित फाइबर कहा जाता है।
एक सिंथेटिक फाइबर आमतौर पर छोटी इकाइयों की एक श्रृंखला होती है जो एक साथ जुड़ जाती हैं; प्रत्येक छोटी इकाई एक रासायनिक पदार्थ है।
सिंथेटिक फाइबर के प्रकार
कृत्रिम रेशम को आमतौर पर कहा जाता है Rayon।
रेयन (फाइबर) लकड़ी के गूदे के रासायनिक उपचार द्वारा प्राप्त किया गया था।
कोयला, पानी और हवा से तैयार किया गया फाइबर के रूप में जाना जाता है Nylon।

नायलॉन पहला पूरी तरह से सिंथेटिक फाइबर था।
Polyesterएक सिंथेटिक फाइबर भी है; यह शिकन मुक्त फाइबर है। जैसे टेरलीन।
पीईटी पॉलीस्टरों के परिचित रूप में से एक है और इसका उपयोग बर्तन, बोतलें, फिल्मों, तारों और कई अन्य उपयोगी उत्पादों को बनाने के लिए किया जाता है।
पॉलिस्टर (Poly + ester) एक रसायन की दोहराई जाने वाली इकाइयों से बना है जिसे एस्टर के रूप में जाना जाता है।
प्लास्टिक भी सिंथेटिक फाइबर की तरह बहुलक का एक प्रकार है।
पॉलिथीन (Poly + ethene) प्लास्टिक का एक सामान्य उदाहरण है।
कुछ प्लास्टिक हैं, जो जब एक बार ढल जाते हैं, तो उन्हें गर्म करके नरम नहीं किया जा सकता है; इसलिए, ये थर्मोसेटिंग प्लास्टिक के रूप में जाने जाते हैं। जैसे बैकेलाइट और मेलमाइन।
बैकेलाइट गर्मी और बिजली का एक गरीब कंडक्टर है; इसलिए, इसका उपयोग इलेक्ट्रिकल स्विच, विभिन्न बर्तनों के हैंडल आदि बनाने में किया जाता है।
Melamine आग का विरोध करता है और अन्य प्लास्टिक की तुलना में बेहतर गर्मी सहन कर सकता है; इसलिए, इसका उपयोग फर्श टाइल्स, बरतन और कपड़े बनाने के लिए किया जाता है।
एक सामग्री, जो प्राकृतिक प्रक्रियाओं के माध्यम से विघटित हो जाती है, जैसे बैक्टीरिया द्वारा कार्रवाई, बायोडिग्रेडेबल के रूप में जाना जाता है।
एक सामग्री, जिसे प्राकृतिक प्रक्रियाओं द्वारा आसानी से विघटित नहीं किया जा सकता है, को गैर-बायोडिग्रेडेबल के रूप में जाना जाता है।
प्लास्टिक पर्यावरण के अनुकूल नहीं है।
परिचय
संसाधन, जो प्रकृति में असीमित मात्रा में मौजूद हैं और मानव गतिविधियों द्वारा समाप्त होने की संभावना नहीं है, के रूप में जाना जाता है Inexhaustible Natural Resources। जैसे धूप, हवा।
संसाधन, जो प्रकृति में सीमित मात्रा में मौजूद हैं और मानव गतिविधियों द्वारा समाप्त होने की संभावना है, के रूप में जाना जाता है Exhaustible Natural Resources। जैसे वन, वन्यजीव, खनिज, कोयला, पेट्रोलियम, प्राकृतिक गैस आदि।
जीवित प्राणियों (जीवाश्म) के मृत अवशेषों से अत्यधिक प्राकृतिक संसाधनों का निर्माण किया गया; इसलिए, इन प्राकृतिक संसाधनों के रूप में भी जाना जाता हैfossil fuels। जैसे कोयला, पेट्रोलियम और प्राकृतिक गैस।
कोयला
कोयला पत्थर जैसा कठोर और रंग काला होता है।
कोयला खाना पकाने के लिए उपयोग किए जाने वाले ईंधन में से एक है।

थर्मल पावर प्लांट में कोयले का इस्तेमाल बिजली उत्पादन के लिए किया जाता है।
उच्च दबाव और उच्च तापमान के तहत, मृत पौधे जिन्हें पृथ्वी के अंदर दफन किया गया था, धीरे-धीरे कोयले में परिवर्तित हो गए।
कोयले में मुख्य रूप से कार्बन होता है।
मृत वनस्पतियों को कोयले में बदलने की धीमी प्रक्रिया को जलकर कोयलाकरण कहा जाता है।
वनस्पति के अवशेषों से कोयला बनता है; इसलिए, इसे जीवाश्म ईंधन के रूप में भी जाना जाता है।
जब कोयला जलता है, तो यह मुख्य रूप से कार्बन डाइऑक्साइड गैस पैदा करता है।
जब कोयले को उद्योग में संसाधित किया जाता है, तो यह कोक, कोयला टार और कोयला गैस जैसे कुछ उपयोगी उत्पादों का उत्पादन करता है।
Coke एक कठोर, झरझरा और काला पदार्थ है।
कोक कार्बन का शुद्ध रूप है।
कोक का उपयोग बड़े पैमाने पर स्टील के निर्माण और कई धातुओं के निष्कर्षण में किया जाता है।
अप्रिय गंध के साथ कोयला टार एक काला, मोटा तरल है।
कोयला टार लगभग 200 पदार्थों का मिश्रण है।
उत्पाद, जिन्हें कोयला टार से प्राप्त किया जाता है, का उपयोग रोजमर्रा की जिंदगी में और उद्योग में उपयोग किए जाने वाले विभिन्न पदार्थों के निर्माण के लिए सामग्री के रूप में किया जाता है। जैसे विस्फोटक, पेंट, छत सामग्री, सिंथेटिक डाई, ड्रग्स, इत्र, प्लास्टिक, फोटोग्राफिक सामग्री, आदि।
Naphthalene ballsकोयला टार से प्राप्त, कीटों और अन्य कीड़ों को पीछे हटाने के लिए उपयोग किया जाता है।
Bitumenपेट्रोलियम उत्पाद से प्राप्त किया जाता है, जिसका उपयोग सड़कों के निर्माण के लिए कोयला-टार के स्थान पर किया जाता है।
कोयल प्राप्त करने के लिए कोयले के प्रसंस्करण के दौरान, coal gas पाया जाता है।
1810 में, लंदन, ब्रिटेन में पहली बार, कोयला गैस का उपयोग स्ट्रीट लाइटिंग के लिए और 1820 में, न्यूयॉर्क, यूएसए में किया गया था।
वर्तमान में, कोयला गैस का उपयोग ऊष्मा के स्रोत के रूप में किया जाता है।
पेट्रोलियम
पेट्रोल और डीजल एक प्राकृतिक संसाधन से प्राप्त होते हैं जिसे पेट्रोलियम कहा जाता है।
पेट्रोलियम का निर्माण समुद्र में रहने वाले जीवों से हुआ था।
लाखों साल (धरती के अंदर दबे हुए मृत जीव), उच्च तापमान, उच्च दबाव और हवा के अभाव में मृत जीव पेट्रोलियम और प्राकृतिक गैस में बदल गए।
1859 में अमेरिका के पेंसिल्वेनिया में दुनिया का पहला तेल का कुआँ ड्रिल किया गया था।
1867 में, तेल असम, भारत के माकुम में अटक गया था।
भारत में, पेट्रोलियम मुख्य रूप से असम, गुजरात, मुंबई उच्च, महाराष्ट्र और गोदावरी और कृष्णा के नदी घाटियों में पाया जाता है।
निम्न छवि गैस और तेल की परत को दर्शाती है -

पेट्रोलियम विभिन्न घटकों जैसे पेट्रोल, पेट्रोलियम गैस, डीजल, चिकनाई तेल, पैराफिन मोम, आदि का मिश्रण है।
पेट्रोलियम के विभिन्न घटकों को अलग करने की प्रक्रिया को कहा जाता है refining।
विभिन्न उपयोगी पदार्थ, जो पेट्रोलियम और प्राकृतिक गैस से प्राप्त होते हैं, 'पेट्रोकेमिकल्स' के रूप में जाने जाते हैं।
पेट्रोकेमिकल्स का उपयोग डिटर्जेंट, फाइबर (पॉलिएस्टर, नायलॉन, एक्रिलिक आदि), पॉलिथीन और अन्य मानव निर्मित प्लास्टिक के निर्माण में किया जाता है।
हाइड्रोजन गैस, जो प्राकृतिक गैस से प्राप्त होती है, का उपयोग उर्वरकों (यूरिया) के उत्पादन में किया जाता है।
महान वाणिज्यिक महत्व होने के कारण, पेट्रोलियम के रूप में भी जाना जाता है ‘black gold.’
प्राकृतिक गैस को आम तौर पर उच्च दबाव में संग्रहीत किया जाता है और इसलिए इसे जाना जाता है Compressed Natural Gas (CNG)।
सीएनजी का उपयोग बिजली उत्पादन और वाहनों के ईंधन के लिए किया जाता है।
The following table illustrates various constituents of petroleum and their uses −
| पेट्रोलियम का निर्माण | उपयोग |
|---|---|
| तरल रूप में पेट्रोलियम गैस (एलपीजी) | घर और उद्योग के लिए ईंधन |
| पेट्रोल | मोटर ईंधन, विमानन ईंधन, सूखी सफाई के लिए विलायक |
| डीज़ल | भारी मोटर वाहनों, विद्युत जनरेटर के लिए ईंधन |
| मिटटी तेल | स्टोव, लैंप और जेट विमान के लिए ईंधन |
| ग्रीस | स्नेहन |
| पैराफिन मोम | मलहम, मोमबत्तियाँ, वैसलीन, आदि। |
| अस्फ़ाल्ट | पेंट, सड़क सरफेसिंग |
परिचय
एक रासायनिक प्रक्रिया जिसमें एक पदार्थ ऑक्सीजन के साथ प्रतिक्रिया करता है और गर्मी को दूर करता है combustion।
दहन से गुजरने वाले पदार्थ को कहा जाता है combustible या fuel।
ईंधन ठोस, तरल या गैस के रूप में हो सकता है।
दहन के दौरान, प्रकाश को या तो एक के रूप में बंद कर दिया जाता है flame या एक के रूप में glow।

जो पदार्थ जलते समय वाष्पीकरण करते हैं, वे ज्वाला देते हैं।
एक लौ डार्क जोन, चमकदार क्षेत्र और गैर-चमकदार क्षेत्र के तीन अलग-अलग क्षेत्र हैं।

विभिन्न पदार्थ अलग-अलग तापमान पर आग पकड़ते हैं।
सबसे कम तापमान जिस पर कोई पदार्थ आग पकड़ता है, उसे इसके रूप में जाना जाता है ignition temperature।
एक मैच में एंटीमनी ट्रिसुलफाइड और पोटेशियम क्लोरेट होते हैं।
मैच की रगड़ की सतह में पाउडर ग्लास और थोड़ा लाल फास्फोरस होता है।
रेड फास्फोरस बहुत कम खतरनाक है।
जब मैच स्टिक को रगड़ सतह के खिलाफ मारा जाता है, तो कुछ लाल फास्फोरस सफेद फॉस्फोरस में परिवर्तित हो जाता है; प्रक्रिया तुरंत माणिक्य सिर में मौजूद पोटेशियम क्लोरेट के साथ प्रतिक्रिया करती है और सुरमा ट्रिसुलफाइड को प्रज्वलित करने के लिए पर्याप्त गर्मी पैदा करती है; इसी तरह, दहन शुरू होता है।
जिन पदार्थों में बहुत कम प्रज्वलन तापमान होता है और जो आग की लपट से आसानी से आग पकड़ सकते हैं, उन्हें इस रूप में जाना जाता है inflammable substances। ई। जी। पेट्रोल, शराब, द्रवीकृत पेट्रोलियम गैस (एलपीजी), आदि।
अग्निशामक
Water सबसे आम आग बुझाने की कल है।
पानी, आग बुझाने के यंत्र के रूप में, केवल तब काम करता है जब लकड़ी और कागज जैसी चीजें आग पर होती हैं।

यदि बिजली के उपकरण में आग लगी है, तो पानी बिजली का संचालन कर सकता है और आग को बुझाने की कोशिश कर रहा है।
तेल और पेट्रोल से लगी आग के लिए पानी भी अच्छा नहीं है।
आग के लिए जिसमें बिजली के उपकरण और ज्वलनशील पदार्थ जैसे कि पेट्रोल, कार्बन डाइऑक्साइड (CO2) सबसे अच्छा बुझाने वाला होता है।

CO2 प्राप्त करने के तरीकों में से एक है, सोडियम बाइकार्बोनेट (बेकिंग सोडा) या पोटेशियम बाइकार्बोनेट जैसे रसायनों के बहुत सारे सूखे पाउडर को छोड़ना।
फास्फोरस कमरे के तापमान पर हवा में जलता है।
ईंधन के 1 किलो के पूर्ण दहन पर उत्पादित ऊष्मा ऊर्जा की मात्रा को इसके रूप में जाना जाता है calorific value।
ईंधन के कैलोरी मान को किलोजूल प्रति किलोग्राम (kJ / kg) नामक इकाई में मापा जाता है।
The following table illustrates the Calorific Values of Different Fuels −
| ईंधन | कैलोरी मान (केजे / किग्रा) |
|---|---|
| गाय का गोबर केक | 6000-8000 |
| लकड़ी | 17,000-22,000 |
| कोयला | 25,000-33,000 |
| पेट्रोल | 45,000 |
| मिटटी तेल | 45,000 |
| डीज़ल | 45,000 |
| मीथेन | 50000 |
| सीएनजी | 50000 |
| रसोई गैस | 55000 |
| बायोगैस | 35,000-40,000 |
| हाइड्रोजन | 150000 |
अधिकांश ईंधन रिलीज का दहन carbon dioxide पर्यावरण में।
हवा में कार्बन डाइऑक्साइड की बढ़ती एकाग्रता सबसे अधिक संभावित कारण है global warming।
पृथ्वी के वातावरण के तापमान में वृद्धि के रूप में जाना जाता है Global Warming।
ग्लोबल वार्मिंग के कारण ध्रुवीय ग्लेशियरों का पिघलना होता है, जो समुद्र के स्तर में वृद्धि का कारण बनता है जो अंततः तटीय क्षेत्रों में बाढ़ का कारण बनता है।
सल्फर और नाइट्रोजन के ऑक्साइड बारिश के पानी में घुलते हैं और एसिड बनाते हैं; इस तरह की बारिश को कहा जाता हैacid rain।