Chimie Partie 2 - Guide rapide
introduction
La chimie est une branche des sciences naturelles qui étudie la structure, la composition et les propriétés changeantes des matières.
La chimie étudie la plus petite partie d'une matière, c'est-à-dire l'atome (avec toutes ses propriétés), les grands matériaux (par exemple l'or, l'argent, le fer, etc.) et leurs propriétés.
La chimie étudie également les forces intermoléculaires (qui fournissent à la matière les propriétés générales) et les interactions entre les substances à travers les réactions chimiques.

En 1998, le professeur Raymond Chang a défini la chimie comme -
«Chimie» pour signifier l'étude de la matière et les changements qu'elle subit.
On pense que l'étude de la chimie a commencé avec la théorie des quatre éléments proposée par Aristote.
La théorie des quatre éléments déclare que «le feu, l'air, la terre et l'eau étaient les éléments fondamentaux à partir desquels tout est formé comme une combinaison».
En raison de son travail classique à savoir “The Sceptical Chymist,” Robert Boyle, est connu comme le père fondateur de la chimie.
Boyle a formulé une loi, est devenue populaire sous le nom de «loi de Boyle».
La loi de Boyle est une loi expérimentale des gaz qui analyse la relation entre la pression d'un gaz et le volume du conteneur respectif.
En défendant sa loi, Boyle a rejeté la théorie classique des «quatre éléments».
Les scientifiques américains Linus Pauling et Gilbert N. Lewis ont proposé collectivement la théorie électronique des liaisons chimiques et des orbitales moléculaires.
Les Nations Unies ont déclaré 2011 «Année internationale de la chimie».
La matière est définie en chimie comme tout ce qui a une masse et un volume au repos et qui prend également de l'espace.
le matter est composé de particules.
le atom est l'unité fondamentale de la chimie.
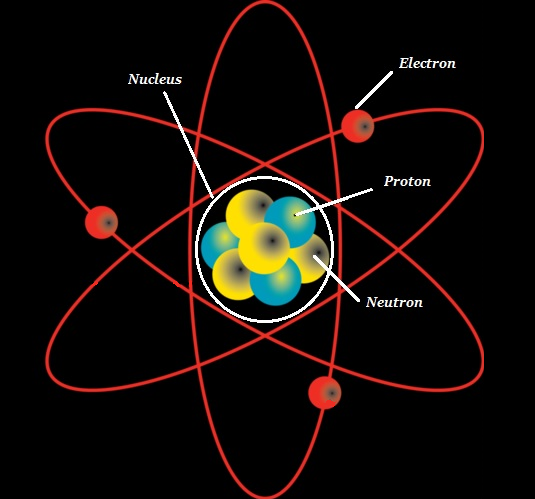
L'atome se compose d'un noyau dense connu sous le nom de atomic nucleus et il est entouré d'un espace connu sous le nom de electron cloud.
Le noyau (d'un atome) est composé de protons (+ve charged particles) et neutrons (neutral or uncharged particles); collectivement, ces deux sont connus commenucleons (comme indiqué dans l'image ci-dessous).
Un élément chimique est une forme pure d'une substance; il se compose d'un seul type d'atome.
Le tableau périodique est la représentation normalisée de tous les éléments chimiques disponibles.
Un composé est une forme pure d'une substance; il se compose de plus d'un élément.
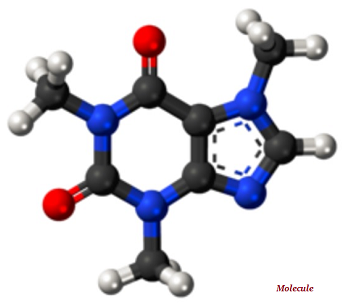
Une molécule est la plus petite partie indivisible d'une substance chimique pure; molécule a un ensemble distinctif de propriétés chimiques (voir l'image ci-dessous).
Le tableau suivant illustre les branches de la chimie -
| Branche | Sous-branche | Définition |
|---|---|---|
| Physical Chemistry | Chimie physique | Etude des propriétés physiques des molécules |
| Cinétique chimique | Etude des taux de réactions chimiques | |
| Électrochimie | Etude de l'interaction des atomes, des molécules, des ions et du courant électrique (ie transfert d'électrons entre l'électrode et l'électrolyte ou l'espèce) | |
| Chimie de surface | étude des réactions chimiques aux surfaces (des substances) | |
| Thermochimie | Etudier la relation entre l'action chimique et la quantité de chaleur absorbée | |
| Chimie quantique | Etude d'application de la mécanique quantique dans les modèles physiques | |
| Spectroscopie | Etude des spectres de lumière ou de rayonnement | |
| Photochimie | étude des effets chimiques causés par la lumière | |
| Organic Chemistry | Chimie organique | Étude de la structure, des propriétés et de la préparation des composés chimiques (carbone) (par exemple, carburants, plastiques, additifs alimentaires et médicaments) |
| Stéréochimie | Etude de la disposition spatiale relative des atomes (en molécules) | |
| Chimie organique physique | étude de la structure et de la réactivité (interrelation) dans les molécules organiques | |
| Chimie des polymères | Etude de molécules polymères (composition et création) | |
| Chimie organométallique | Etude des produits chimiques contenant des liaisons (notamment entre un carbone et un métal) | |
| Chimie médicale | Etude de la conception, du développement et de la synthèse des médicaments et des médicaments | |
| Inorganic chemistry | Chimie inorganique | Etude de tous les matériaux non organiques (tels que minéraux, métaux, catalyseurs, structures cristallines, etc.) |
| Chimie organométallique | Etude de composés chimiques contenant des liaisons (notamment entre le carbone et le métal) | |
| Chimie du solide | Etude des composés chimiques contenant des liaisons entre le carbone et le métal | |
| Chimie nucléaire | Etude des substances radioactives | |
| Géochimie | Etude de la composition chimique de la terre (ex: roches, minéraux et atmosphère) | |
| Chimie bio-organique | Etude des interactions entre les ions métalliques et les tissus vivants | |
| Chimie de coordination | ||
| Biochemistry | Biochimie | Etude de la réaction chimique (et des changements) chez les êtres vivants |
| Biochimie moléculaire | Etude des biomolécules et de leurs fonctions | |
| Biochimie clinique | Étude des changements chimiques chez les êtres vivants, causés par différentes maladies | |
| Biologie moléculaire | Etude des différents types de biosynthèse d'ADN, d'ARN et de protéines (et leurs relations) | |
| Biochimie agricole | Etude de la chimie de la faune (ie des plantes) | |
| Analytical Chemistry | Étude de méthodes expérimentales normalisées en chimie (c.-à-d. Détermination quantitative des propriétés chimiques d'une substance) | |
| Astrochemistry | Etude des réactions des éléments chimiques et des molécules présentes dans l'univers | |
| Cosmochemistry | Etude de la composition chimique des matières présentes dans l'univers | |
| Environmental chemistry | Étude des phénomènes chimiques et biochimiques qui se produisent dans l'environnement |
introduction
Le processus d'émission de particules à partir des noyaux en raison de l'instabilité nucléaire; est connue sous le nom de radioactivité.
La substance qui libère cette énergie / ces rayons est connue sous le nom de substance radioactive.
Les rayons invisibles libérés par une telle substance radioactive sont appelés rayons radioactifs.
De même, la radioactivité est un phénomène nucléaire qui se produit (naturellement) en raison de l'instabilité nucléaire des atomes.
En 1896, Henri Becquerel a observé pour la première fois les phénomènes de radioactivité, mais le terme «radioactivité» a été inventé par Marie Curie.
Marie Curie a découvert les éléments radioactifs à savoir le polonium et le radium en 1898.
Pour sa découverte, Marie Curie a remporté le prix Nobel.
Rayons radioactifs
Après de longues années d'expérience, Ernest Rutherford et son collègue (Hans Geiger et son élève Ernest Marsden) ont découvert les rayons alpha, bêta et gamma.
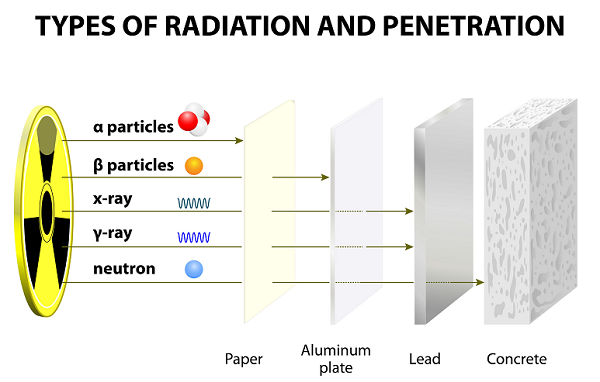
Ces rayons sont émis à la suite de la désintégration des atomes.
Particules alpha (α)
Les particules alpha sont généralement composées de deux protons et de deux neutrons, qui sont étroitement liés.
Les particules alpha sont libérées pendant la désintégration radioactive (ou la désintégration alpha) des radionucléides du noyau.
Les particules alpha sont identiques au noyau d'un atome d'hélium normal ou d'un atome d'hélium doublement ionisé.
En comparaison avec d'autres particules (ie Gamma et Beta), les particules alpha sont lourdes et lentes. Par conséquent, les particules alpha ont une très petite portée dans l'air.
En raison de leur vitesse lente, les particules Alpha ont des pouvoirs de pénétration très faibles; ces particules sont même arrêtées par une fine feuille de papier (voir image ci-dessus).
En raison de la double charge positive, les particules alpha sont hautement ionisantes.
Particules bêta (β)
Les particules bêta sont les électrons à déplacement rapide émis par certains radionucléides pendant la désintégration radioactive (également appelée désintégration bêta).
Les particules bêta sont beaucoup plus légères et portent une seule charge négative.
Les particules bêta sont rarement ionisantes que les particules alpha.
En raison de leur poids plus léger, les particules bêta peuvent voyager beaucoup plus loin que les particules alpha; cependant, les particules bêta peuvent être arrêtées par plusieurs feuilles de papier ou une feuille d'aluminium.
Les particules bêta sont chargées négativement et sont attirées vers les particules chargées positivement.
Particules gamma (ү)
Les particules gamma sont le faisceau d'énergie élevée, à savoir l'énergie électromagnétique (photon) émise par les éléments radioactifs lors de la désintégration radioactive.
Parmi les trois particules (alpha, bêta et gamma), les particules gamma sont les photons les plus énergétiques.
Les particules gamma, qui sont sous forme de rayonnement électromagnétique (REM), proviennent du noyau.
Les longueurs d'onde du gamma sont les plus courtes parmi les trois.
Les particules gamma n'ont pas de charge et elles sont neutres; par conséquent, ils ne sont pas affectés par les champs magnétiques et électriques.
Utilisations des éléments radioactifs
Les éléments radioactifs sont utilisés dans -
Domaine médical (traitement de nombreuses maladies)
Processus industriel
Production d'énergie - Réacteurs nucléaires
introduction
Les réactions nucléaires libèrent une énorme quantité d'énergie (appelée énergie nucléaire), qui est utilisée pour produire de l'électricité dans une centrale nucléaire.

L'énergie nucléaire normalement produite par nuclear fission, nuclear fusion, et nuclear decay.
En 1938, les chimistes allemands Otto Hahn, Fritz Strassmann et la physicienne autrichienne Lise Meitner ont mené les expériences dans lesquelles les produits de l'uranium bombardé par neutrons. À la suite de cette expérience, le neutron relativement petit a divisé le noyau des atomes d'uranium massifs en deux morceaux à peu près égaux et a libéré une énergie massive.
Les expériences nucléaires d'Otto Hahn et de ses collègues sont populaires en tant que fission nucléaire.
Fission nucléaire
Le processus de fission nucléaire produit des neutrons libres et des photons gamma, ce qui libère également une très grande quantité d'énergie.
La fission nucléaire est une réaction exothermique, qui peut libérer de grandes quantités d'énergie sous forme de rayonnement électromagnétique ainsi que d'énergie cinétique.
La fission nucléaire, parfois, peut se produire naturellement (c'est-à-dire sans bombardement neutronique) en tant que type de désintégration radioactive.
Types de fission nucléaire
Voici les principaux types de fission nucléaire -
Chain Reaction and
Fission Reaction
Discutons-en brièvement -
Réaction en chaîne
Lorsqu'une seule réaction nucléaire provoque une ou plusieurs réactions nucléaires ultérieures, on parle de réaction en chaîne.
Une telle réaction en chaîne augmente la possibilité d'une série auto-propagée de réactions nucléaires.
Les réactions nucléaires en chaîne libèrent des millions de fois plus d'énergie par réaction que toute autre réaction chimique; par conséquent, il est également connu sous le nom de réaction en chaîne explosive ou incontrôlée.
Lorsqu'un atome lourd subit une fission nucléaire, il se brise normalement en deux fragments de fission ou plus. Au cours du processus, plusieurs neutrons libres, rayons gamma et neutrinos sont émis, et finalement une grande quantité d'énergie est libérée.
Voici les deux exemples de réaction en chaîne -
235 U + → fragments de fission de neutrons + 2,4 neutrons + 192,9 MeV
235 Pu + → fragments de fission de neutrons + 2,9 neutrons + 198,9 MeV
Dans la bombe atomique, la technologie de réaction en chaîne est utilisée, car elle nécessite une source d'énergie cohérente.
Réactions de fission
La réaction de fission dans laquelle les neutrons (produits par fission d'atomes de combustible) sont utilisés pour induire encore plus de fission pour la libération d'énergie durable, est connue sous le nom de réactions de fission.
Ces réactions sont lentes et contrôlables; par conséquent, également connu sous le nom de réaction en chaîne contrôlée.
Le réacteur nucléaire produisant de l'électricité (électricité) est un exemple idéal de réaction en chaîne contrôlée.
Sur la base des propriétés et du type d'utilisation, la fission / réaction en chaîne contrôlée est classée comme -
Power reactors
Research reactors
Breeder reactors
Ces réacteurs de puissance convertissent généralement l'énergie cinétique des produits de fission en chaleur; en outre, la chaleur est utilisée pour chauffer un fluide de travail qui entraîne un moteur thermique, qui génère finalement une puissance mécanique ou électrique.
Composants de base du réacteur nucléaire
Voici les composants essentiels d'un réacteur nucléaire -
Nuclear fuels- Tels que l'uranium ( 233 U, 235 U), le thorium (Th 232 ), le plutonium (Pu 239 ).
Moderators- Utilisé pour contrôler les neutrons émis. Par exemple eau lourde, béryllium, graphite, etc.
Coolant- Il est utilisé pour refroidir le réacteur. Par exemple, l'eau, la vapeur, l'hélium, le CO 2 , l'air, les métaux fondus, etc.
Control rods- Il est utilisé pour exécuter et arrêter la réaction de fission. Par exemple, des tiges de cadmium ou de bore sont utilisées à cette fin.
La fusion nucléaire
Le processus par lequel deux noyaux légers sont fusionnés pour former un noyau lourd est connu sous le nom de fusion nucléaire; au cours de ce processus, une énorme quantité d'énergie est libérée, appelée énergie nucléaire.
Le meilleur exemple de fusion nucléaire est la bombe à hydrogène.
Une bombe à hydrogène est environ 1 000 fois plus puissante qu'une bombe atomique.
introduction
Le matériau (qui pourrait être un élément, un composé ou un alliage) qui est typiquement dur, brillant, opaque et qui a la propriété de conduire la chaleur et l'électricité, est appelé métal.
Les métaux se trouvent naturellement dans la croûte terrestre sous forme impure, c'est-à-dire des minerais. Et, il est extrait par le processus d'extraction.
Parmi tous les 118 éléments connus (du tableau périodique), environ 91 éléments sont des métaux.

Caractéristiques des métaux
Voici les caractéristiques importantes des métaux -
Les métaux sont généralement malléables - cela signifie que leur forme peut être modifiée de manière permanente sans se casser ni se fissurer.
Les métaux sont fusibles - cela signifie; il peut être fondu ou fondu facilement.
Les métaux sont ductiles - cela signifie; il peut avoir n'importe quelle forme, même une feuille mince ou un fil.
Les métaux sont de bons conducteurs de chaleur et d'électricité; plus lourd, le plomb est une exception, car il ne transporte pas d'électricité.
Les métaux réagissent naturellement avec divers non-métaux et forment des composés. Les métaux peuvent réagir avec les bases et les acides. Par exemple 4 Na + O 2 → 2 Na 2 O (oxyde de sodium), etc.
Alliages
Un alliage est un produit du mélange de deux ou plusieurs éléments dans lequel le métal domine.
Afin de produire ou de fabriquer un produit souhaitable, différents métaux (dans des proportions différentes) sont mélangés (c'est-à-dire des alliages). Par exemple, les alliages de fer, à savoir l'acier inoxydable, la fonte, les tôles d'alliage, etc. contribuent pour une large part à la fois en quantité et en valeur commerciale.
Les métaux sont généralement des alliages dans le but de le rendre plus résistant à la corrosion, moins cassant, pour donner des couleurs attrayantes, etc.
Terminologies métalliques
Base Metal- En chimie, la signification du métal de base est - le métal qui peut être facilement oxydé ou corrodé et réagit facilement avec HCl (acide chlorhydrique dilué) et forme de l'hydrogène. Par exemple, le fer, le nickel, le zinc, le plomb, etc.
Ferrous Metal- «Ferreux» est un mot latin, qui signifie la substance «contenant du fer». Par exemple, l'acier, etc.
Heavy Metal- Le métal qui est beaucoup plus dense que le métal normal est classé comme métal lourd. Les métaux lourds sont toxiques ou toxiques à de faibles concentrations. Par exemple, le mercure (Hg), l'arsenic (As), le chrome (Cr), le cadmium (Cd), le thallium (Tl) et le plomb (Pb).
Precious Metal- Les éléments métalliques, qui ont un élément chimique métallique rare de haute valeur économique, sont classés comme métaux précieux. Par exemple platine, or, argent, palladium, etc.
Noble Metal- Les métaux résistants à la corrosion ou à l'oxydation. Par exemple, le ruthénium (Ru), le rhodium (Rh), le palladium (Pd), etc.
Application des métaux
Voici les applications importantes des métaux -
Comme les métaux sont de bons conducteurs de chaleur et d'électricité; par conséquent, il est utilisé comme fil électrique et dans de nombreux autres appareils électriques, y compris les moteurs électriques, etc. Par exemple, le cuivre, l'argent, l'aluminium, etc.
Les métaux lourds sont utilisés dans la construction de ponts, de piscines et à de nombreuses fins.
De nombreux métaux sont utilisés pour fabriquer divers articles pour la maison, tels que des ustensiles, des casseroles, des poêles, etc.
Les métaux sont fréquemment utilisés pour fabriquer de nombreux types d'outils allant d'un simple tournevis à un lourd rouleau à tige.
Les métaux précieux ont une belle apparence et ils sont attrayants (par exemple, l'or, l'argent, etc.); par conséquent, ils sont utilisés comme ornements.
Certains métaux spécifiques sont utilisés pour les dissipateurs de chaleur qui protègent les équipements sensibles de la surchauffe.
Les métaux radioactifs (par exemple l'uranium et le plutonium) sont utilisés dans la production d'énergie nucléaire.
Le mercure est un métal qui reste sous forme liquide à température ambiante; il est utilisé dans le thermomètre.
La branche de la science et de la technologie qui étudie les propriétés des métaux et leur production et purification est connue sous le nom de metallurgy.
Une substance inorganique solide d'origine naturelle est connue sous le nom de mineral.
Un matériau solide naturel à partir duquel un minéral ou un métal précieux peut être extrait est connu sous le nom de ore.
Le tableau suivant illustre les principaux éléments et leurs minerais -
| Élément | Minerais | Composition chimique |
|---|---|---|
| Aluminium | Bauxite | Al 2 O 3 2H 2 O |
| Corindon | Al 2 O 3 | |
| Kryolite | Na 3 AlF 6 | |
| Dyspore | Al 2 O 3 .H 2 O | |
| Cuivre | Pyrite de cuivre | CuFeS 2 |
| Malachite | 2CuCO 3 Cu (OH) 2 | |
| Le fer | Hématite | Fe 2 O 3 |
| Magnétite | Fe 3 O 4 | |
| Sidérite | FeCO 3 | |
| Sodium | Le carbonate de sodium | Na 2 CO 3 |
| Chlorure de sodium | NaCl | |
| Nitrate de sodium | NaNO 3 | |
| Sulfate de sodium | Na 2 SO 4 | |
| Potassium | Chlorure de potassium | KCl |
| Carbonate de potassium | K 2 CO 3 | |
| Nitrate de potassium | KNO 3 | |
| Magnésium | Magnésite | MgCO 3 |
| Dolomie | CaMg (CO 3 ) 2 | |
| Sel d'Epsom | MgSO 4 | |
| Calcium | Carbonate de calcium | CaCO 3 |
| Étain | Cassitérite | SnO 2 |
| Conduire | Galène | PbS |
| Cerussite | PbCO 3 | |
| Anglesite | PbSO 4 | |
| argent | Argentite | Ag 2 S |
| Tétraédrite | Sb 4 S 3 | |
| Zinc | Carbonate de zinc (connu sous le nom de calamine) | ZnCO 3 |
| Sulfure de zinc | ZnS | |
| Mercure | Cinabre | HgS |
| Manganèse | Pyrolusite | MnO 2 |
| Phosphoreux | Phosphorite | Ca 3 (PO 4 ) 2 |
| Fluorapatite | Ca 5 (PO 4 ) 3 F | |
| Chlorapatite | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Or | Calaverite | AuTe 2 |
| Sylvanite | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 Au 2 | |
| Antimoine | Stibnite | Sb 2 S 3 |
| Stibiconite | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Cobalt | Cobaltite | CoAsS |
| Nickel | Pentlandite | ((Ni, Fe) S) |
| Chrome | Chromite | (FeCr 2 O 4 ) |
introduction
Le sodium est une couleur douce et argentée et un métal alcalin hautement réactif.
Dans le tableau périodique, le sodium est conservé dans le groupe 1, car il a un seul électron dans sa coquille externe.
Le symbole du sodium est 'Na,'qui a été en fait tiré du mot latin ‘natrium.’
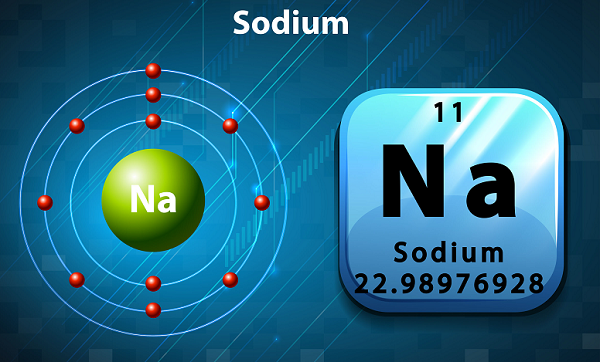
En termes d'abondance, le sodium est le sixième élément présent dans la croûte terrestre.
Le sodium existe dans divers minéraux, notamment les feldspaths, la sodalite et le sel gemme (NaCl).
En 1807, Humphry Davy a d'abord isolé le sodium par électrolyse de l'hydroxyde de sodium.
À l'heure actuelle, 20 isotopes du sodium sont connus, mais parmi tous, seul 23 Na est stable.
Principales caractéristiques du sodium
Voici les principales caractéristiques de l'élément sodium -
Le métal de sodium est un élément mou qui peut être facilement coupé avec un couteau.
Le sodium est un bon conducteur de chaleur et d'électricité.
En raison de sa faible masse atomique et de son grand rayon atomique, le sodium est l'un des éléments les moins denses (troisième élément le moins dense - les deux premiers sont le lithium et le potassium).
Le sodium peut flotter sur l'eau.
Le sodium le long de ses composés brillent en jaune (voir l'image ci-dessous).

Les composés de sodium ont une importance commerciale très élevée et ont une forte demande dans les industries du verre, du papier, du savon et des textiles.
Composés de sodium
Voici quelques exemples significatifs de composés de sodium -
Sel de table - (NaCl)
Carbonate de soude - (Na 2 CO 3 )
Bicarbonate de soude - (NaHCO 3 )
Soude caustique - (NaOH)
Nitrate de sodium - (NaNO 3 )
Thiosulfate de sodium - (Na 2 S 2 O 3 · 5H 2 O)
Borax - (Na 2 B 4 O 7 · 10H 2 O)
Présence de sodium
La croûte terrestre contient environ 2,27% de sodium.
Le sodium est le 5 e métal le plus abondant; quatre autres sont l'aluminium, le fer, le calcium et le magnésium.
Dans l'eau océanique, environ 1,08 × 104 milligrammes de sodium par litre.
Le sodium ne se trouve pas sous forme d'élément pur, car il est très réactif.
Utilisations du sodium
Voici les principales utilisations du sodium -
Le chlorure de sodium est très utile pour l'antigivrage et le dégivrage ainsi que comme conservateur.
En cuisine, le bicarbonate de sodium est utilisé.
Le sodium et certains de ses composés sont utilisés dans les médicaments.
Par rapport au potassium (qui est un meilleur ion), le sodium est plus fréquemment utilisé en raison de son prix et de son poids atomique inférieurs.
En chimie organique, l'hydrure de sodium est utilisé dans diverses réactions.
Le sodium métallique est principalement utilisé pour la production de borohydrure de sodium, de triphénylphosphine de sodium, d'azide, d'indigo, etc.
Dans certains réacteurs rapides, le sodium liquide est utilisé comme fluide caloporteur en raison de sa propriété de bonne conductivité thermique.
Le sodium est également un minéral essentiel pour la santé humaine, car il régule la pression artérielle, le volume sanguin, l'équilibre osmotique et la valeur du pH.
La quantité minimale de 500 milligrammes de sodium est requise chaque jour pour un corps humain en bonne santé.
introduction
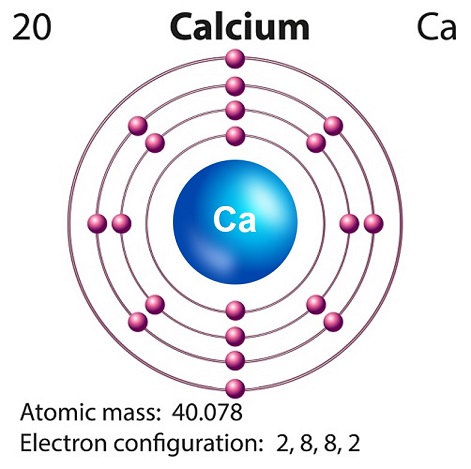
Le calcium est un élément alcalin doux jaune grisâtre qui se trouve en grande partie dans la croûte terrestre.
Le symbole du calcium est “Ca” et le numéro atomique est “20.”
Le calcium libre existe à peine dans la nature, car il est très réactif.
Le calcium est généralement produit lors de la nucléosynthèse des supernovae.
Principales caractéristiques du calcium
Le calcium est l'un des métaux les plus abondants en masse que l'on trouve chez de nombreux animaux.
Le calcium est un constituant très important des dents, des os et des coquilles.
Le carbonate de calcium et le citrate de calcium sont les principaux compléments alimentaires nécessaires à une bonne santé.
L'Organisation mondiale de la santé (OMS) a répertorié le calcium comme médicament essentiel.
En comparaison avec d'autres métaux, l'ion calcium et la plupart des autres composés calciques ont une faible toxicité.
Si le calcium entre en contact avec de l'eau ou de l'acide, il réagit avec eux et devient dangereux.
Si le calcium entre en contact avec l'air, il réagit rapidement et forme une couche gris-blanc de nitrure de calcium et d'oxyde de calcium.
La plupart des sels de calcium sont normalement incolores.
Lorsque le calcium brûle, la couleur de sa flamme apparaît rouge brique (voir l'image ci-dessous).

Le métal de calcium a une résistivité électrique comparativement plus élevée que l'aluminium ou le cuivre.
Occurrence
Le calcium se trouve généralement dans les roches sédimentaires.
Les minéraux (sédimentaires) dans lesquels le calcium se trouve sont la calcite, la dolomite et le gypse.
Le calcium se trouve également dans les roches ignées et métamorphiques principalement dans les minéraux silicatés, tels que les amphiboles, les plagioclases, les pyroxènes et les grenats.
Le calcium se trouve également dans de nombreux produits alimentaires, à savoir les produits laitiers, les amandes, les noisettes, les graines de soja, le brocoli, les feuilles de pissenlit, les figues et bien d'autres.
Composés de calcium
Oxyde de calcium - CaO
Hydroxyde de calcium - Ca (OH) 2
Chlorure de calcium - CaCl 2
Hypochlorite de calcium (poudre de blanchiment) - Ca (ClO) 2
Phosphate de calcium - Ca 3 (PO 4 ) 2
Utilisations du calcium
Le calcium a un large éventail d'utilisations, dont les principaux sont -
Le carbonate de calcium (CaCO 3 ) est utilisé dans la fabrication du ciment.
Le carbonate de calcium (CaCO 3 ) est également utilisé dans la fabrication de dentifrice.
Dans les insecticides, l'arséniate de calcium (Ca 3 (AsO 4 ) 2 ) est utilisé.
Le chlorure de calcium (CaCl 2 ) est utilisé dans le déglaçage ainsi que dans le contrôle des poussières.
Le citrate de calcium (Ca 3 (C 6 H 5 O 7 ) 2 ) est couramment utilisé comme conservateur alimentaire.
Le gluconate de calcium (Ca (C 6 H 11 O 7 ) 2 ) est fréquemment utilisé comme additif alimentaire ainsi que dans les comprimés de vitamines.
L'hypochlorite de calcium (Ca (OCl) 2 ) est généralement utilisé comme désinfectant de piscine, comme agent de blanchiment.
introduction
Le métal de couleur blanc argenté, doux, non magnétique et ductile, est connu sous le nom d'aluminium.
Le symbole de l'aluminium est ‘Al’ et son numéro atomique est ‘13.’
L'élément chimique aluminium appartient au groupe du bore.

- La bauxite est le principal minerai d'aluminium.
Principales caractéristiques de l'aluminium
Le métal aluminium est un élément chimiquement réactif.
L'aluminium a le potentiel de résister à la corrosion et le processus de cette résistivité est connu sous le nom de passivation.
L'aluminium est un métal relativement durable, léger, doux, malléable et ductile.
L'aluminium n'est pas magnétique et ne s'enflamme pas facilement.
Un film d'aluminium est un très bon réflecteur de la lumière visible, car il réfléchit plus de 90% des rayons entrants.
L'aluminium réagit généralement avec l'eau et forme de l'hydrogène.
L'aluminium est un métal de faible densité et il a la propriété de résister à la corrosion.
L'aluminium a la propriété de conductivité thermique et électrique et par conséquent, c'est un bon conducteur.
Présence d'aluminium
L'aluminium représente (environ) 8% de la croûte terrestre.
Après l'oxygène et le silicium, l'aluminium est le troisième élément le plus abondant; cependant, c'est le métal le plus abondant de la croûte.
Lorsque l'hydrogène fusionne avec le magnésium, il crée de l'aluminium stable.
Aluminium naturellement présent dans les états oxydes ou silicates.
Composés d'aluminium
Voici les principaux composés d'aluminium -
Alumine - Al 2 O 3
Chlorure d'aluminium - AlCl 3
Sulfate d'aluminium - Al 2 (SO 4 ) 3
Hydroxyde d'aluminium - Al (OH) 3
Carbure d'aluminium - Al 4 C 3
Utilisation de l'aluminium
L'aluminium a un large éventail d'utilisations dans les industries ainsi que dans la vie quotidienne; les plus importants sont -
L'aluminium est utilisé dans les industries du transport, telles que les chemins de fer, les automobiles, les avions, les engins spatiaux, les camions, les navires, les bicyclettes, etc.
L'aluminium est utilisé dans l'emballage de certains matériaux spécifiques.
L'aluminium est utilisé dans les constructions de portes, fenêtres, fils de construction, revêtement, toiture, etc.
L'aluminium est largement utilisé dans la fabrication de fils électriques.
L'aluminium est utilisé dans la fabrication d'appareils ménagers et de nombreux autres articles ménagers, tels que les ustensiles de cuisine.
L'aluminium est utilisé dans les battes de baseball, les montres et bien d'autres objets de ce genre.
L'aluminium est utilisé dans les équipements photographiques.
L'aluminium est utilisé dans les appareils électroniques.
L'aluminium est utilisé comme réflecteur de lumière, car c'est un bon réflecteur de lumière; fondamentalement, certains des matériaux sont revêtus d'aluminium spécialement pour réfléchir la lumière.
L'aluminium est utilisé dans la production d'hydrogène gazeux par réaction avec l'acide chlorhydrique.
L'aluminium est utilisé dans la fabrication d'instruments de musique.
introduction
Le magnésium est un élément solide gris brillant.
Le symbole du magnésium est ‘Mg’ et le numéro atomique est ‘12.’

Avec environ 80% du marché mondial, la Chine est le premier fournisseur de magnésium.
Principales caractéristiques du magnésium
La densité du magnésium est deux tiers de la densité de l'aluminium.
Parmi tous les métaux alcalins de la Terre, le magnésium a le point de fusion le plus bas (soit environ 1 202 0 F) et le point d'ébullition le plus bas (environ 1 994 0 F).
Le magnésium réagit généralement avec l'eau à température ambiante.
Parfois, le magnésium est également utilisé comme allumeur pour la thermite.
Le magnésium, lorsqu'il brûle dans l'air, produit une lumière blanche brillante, qui comprend également de fortes longueurs d'onde ultraviolettes.

Le magnésium, lorsqu'il brûle, produit une lumière intense et blanche (voir l'image ci-dessus).
Présence de magnésium
En masse, le magnésium est le huitième élément le plus abondant de la croûte terrestre.
Le magnésium se trouve généralement dans de grands gisements de magnésite, de dolomite et d'autres minéraux similaires.
L'ion magnésium soluble se trouve dans l'eau minérale.
Après le sodium et le chlore, le magnésium est le troisième élément le plus abondant dissous dans l'eau de mer.
Le magnésium ne se produit naturellement qu'en combinaison avec certains autres éléments.
En masse, le magnésium est le 11 e élément le plus abondant dans le corps humain et il est essentiel à toutes les cellules et enzymes.
Les ions magnésium interagissent fréquemment avec les composés polyphosphatés, notamment l'ATP, l'ADN et l'ARN.
Composés de magnésium
Voici les principaux composés du magnésium -
Carbonate de magnésium - MgCO 3
Chlorure de magnésium - MgCl 2
Citrate de magnésium - C 6 H 6 MgO 7
Hydroxyde de magnésium - Mg (OH) 2
Oxyde de magnésium - MgO
Sulfate de magnésium - MgSO 4
Sulfate de magnésium heptahydraté - (MgSO 4 · 7H 2 O)
Le sulfate de magnésium heptahydraté est communément appelé Epsom salt.
Usages de magnésium
Le magnésium a un large éventail d'utilisations dans nos vies; cependant, certaines utilisations importantes du magnésium sont -
Après le fer et l'aluminium, le magnésium est le troisième élément le plus utilisé.
Le magnésium est particulièrement utilisé dans les matériaux et alliages ultra-résistants et légers.
Le magnésium est également utilisé comme matériau de moteur dans l'industrie aéronautique.
Le magnésium est également utilisé pour purifier les solvants; comme dans la préparation de l'éthanol super-sec.
Beaucoup de grandes marques automobiles, notamment Mercedes, Porsche, BMW, Volkswagen, Chevrolet, etc. utilisent du magnésium pour fabriquer leurs voitures de haute qualité.
En raison de son faible poids et de ses bonnes propriétés électriques et mécaniques, le magnésium est couramment utilisé dans la fabrication d'ordinateurs portables et de tablettes, de téléphones mobiles, d'appareils photo et de nombreux autres composants électroniques.
Le sulfite de magnésium est généralement utilisé dans la fabrication du papier.
introduction
Le manganèse est un élément chimique que l'on trouve généralement en combinaison avec le fer.
Le symbole du manganèse est ‘Mn’ et le numéro atomique est ’25.’
Le manganèse est un métal très important pour l'usage industriel.

En 1774, Johan Gottlieb Gahn isola pour la première fois un échantillon impur de manganèse métallique en 1774.
Caractéristiques du manganèse
Voici les principales caractéristiques et caractéristiques du manganèse -
Semblable au fer, le manganèse est un métal gris argenté.
Le manganèse peut être oxydé facilement, mais il est très difficile de le fusionner, car il est très dur et cassant.
Dans l'air, le manganèse se ternit lentement (oxydation).
Le manganèse est un élément qui fait partie du groupe du fer.
Présence de manganèse
Le manganèse est le 12 e élément le plus abondant de la croûte terrestre.
Le sol contient généralement environ 7 à 9 000 ppm de manganèse avec une moyenne de 440 ppm.
L'eau de mer ne contient qu'environ 10 ppm de manganèse; tandis que l'atmosphère contient environ 0,01 µg / m3.
La pyrolusite (MnO 2 ) est le minerai de manganèse le plus important.
Composés de manganèse
Voici les principaux composés du manganèse -
Oxyde de manganèse (II) - MnO
Oxyde de manganèse (I) - Mn 2 O 3
Dioxyde de manganèse - MnO 2
Chlorure de manganèse - MnCl 2
Permanganate de potassium - KMnO 4
Sulfate de manganèse (II) - MnSO 4
Carbonate de manganèse (II) - MnCO 3
Sulfure de manganèse (II) - MnS
Nitrate de manganèse (II) - Mn (NO 3 ) 2
Bromure de manganèse (II) - MnBr 2
Heptoxyde de manganèse - Mn 2 O 7
Dimanganèse décacarbonyle - C 10 O 10 Mn 2
Iodure de manganèse (II) - MnI 2
Fluorure de manganèse (II) - MnF 2
Utilisations du manganèse
Voici les principales utilisations du manganèse -
Le manganèse est l'un des constituants les plus essentiels de la production d'acier.
La phosphatation au manganèse est couramment utilisée pour la prévention de la rouille et de la corrosion sur l'acier.
En biologie, les ions manganèse (II) agissent comme cofacteurs pour la grande variété d'enzymes.
Le manganèse est également important dans le phénomène d'évolution de l'oxygène des plantes photosynthétiques.
Le dioxyde de manganèse est également utilisé dans la fabrication d'oxygène et de chlore et dans le séchage des peintures noires.
introduction
Le fer est l'élément le plus commun trouvé en grande partie dans le noyau externe et interne de la terre.
Le symbole du fer est ‘Fe’ et le numéro atomique est ‘26.’

Le fer est l'un des premiers éléments connus qui est utilisé par les êtres humains.
Principales caractéristiques du fer
Voici les principales caractéristiques du fer -
L'élément en fer pur est doux, ductile et malléable.
Le point d'ébullition du fer varie entre 1533 0 C et 2450 0 C.
Le fer est facilement attiré vers l'aimant.
Dans l'air sec, le fer reste inactif et ne réagit pas (avec l'air); cependant, dans l'air humide, il réagit et forme de la rouille.
Le fer pur ne réagit normalement pas avec l'eau pure; cependant, il réagit facilement avec les formes ordinaires d'eau polluée et de rouille.
Le fer réagit avec l'halogène et le soufre pour former un halogénure et un sulfure en conséquence.
Présence de fer
Les noyaux intérieurs et extérieurs de la terre sont en grande partie constitués de fer et de nickel.
Très probablement, le fer est l'élément le plus abondant de la terre; cependant, c'est le quatrième élément le plus abondamment disponible de la croûte.
Types de fer
Voici les principaux types de fer -
Hématite - Fe 2 O 3
Magnétite - Fe 3 O 4
Sidérite - FeCO 3
Composés de fer
Voici les principaux composés du fer -
Oxyde de fer (II) - FeO
Chlorure de fer (III) - FeCl 3
Oxyde-hydroxyde de fer (III) - Fe (OH) 3
Sulfure de fer (II) - FeS
Chlorure de fer (II) - FeCl 2
Iron phosphate - FePO4
Ferrate (VI) - (FeO4)2-
Iron (II) acetate - Fe(C2H3O2)2
Iron (III) sulfide - Fe2S3
Iron (III) chromate - Fe2(CrO4)3
Iron (II) hydroxide - Fe(OH)2
Iron (III) acetate - C14H27Fe3O
Iron (II) oxalate - FeC2O4
Iron (II) fluride - FeF2
Uses of Iron
Among all the metals, iron is most widely used (about 90 percent of world’s total metal production).
In most of the heavy industries, iron is the most essential element.
Industries like railway, ship building, automobile, engineering construction, etc., everywhere, iron is essentially required.
Introduction
Copper is a soft, ductile, and malleable metal.
Copper has very high thermal and electrical conductivity.
The symbol of copper is ‘Cu’ and atomic number is ’29.’

Copper is known to people since (about) c. 8000 BC.
Copper is the first metal, which was smelted from its ore around c. 5000 BC.
Salient Features of Copper
Copper was the first metal that cast into a shape (in a mold).
Copper was the first metal that successful alloyed with another metal, e.g. copper alloyed with tin and resultantly bronze is prepared. It is done about c. 3500 BC.
First metal to be purposefully alloyed with another metal, tin, to create bronze, c. 3500 BC.
Copper has a natural reddish-orange color; it is visible once the its surface is exposed.
Copper is a very good conductor of electricity and heat.
Copper is an element of group 11 of the periodic table.
Copper normally does not react with water; however, it does react slowly with atmospheric oxygen and form a layer of brown-black copper oxide.
The brown-black copper oxide usually protects the underlying metal from further corrosion just like passivation.
Passivation is a process of use of a light coat of a protective material, such as metal oxide, which is used to create a protective shell against the corrosion.
Occurrence of Copper
Copper is commonly found in the earth’s crust.
In 1857, the largest mass of elemental copper (weighing about 420 tones) discovered. It was found on the Keweenaw Peninsula located in Michigan, US.
Alloys of Copper
The metal alloys, which have the copper as their major constituent, is known as copper alloys.
Copper alloys are highly resistant to corrosion.
The best (traditional) example of copper alloy is bronze (made by mixing tin and brass).
Following are the major alloys of copper −
Brass
Bronze
Auricupride
Chinese silver
Corinthian bronze
Electrum, Green gold
Grey gold
Niello
Panchaloha
Rose, red, and pink gold
Spangold
Shibuichi
Tibetan silver
White gold
Compounds of Copper
Following are the major compounds of the copper −
Cupric acetate - Cu(CH3COO)2
Copper(I) oxide - Cu2O
Copper(II) oxide - CuO
Copper(II) chloride - CuCl2
Dicopper chloride trihydroxide - Cu2(OH)3Cl
Copper(I) chloride - CuCl
Copper(II) nitrate - Cu(NO3)2
Copper Cyanide - CuCN
Uses of Copper
Copper is largely used in making electric wires.
Copper is used in electric motors.
Copper is used in roofing, plumbing, and in many other industries.
Copper paint is used in painting boats and many other materials.
Many of the home appliances are made up of either pure copper or its alloys.
Introduction
Silver is a soft, lustrous transition, and white metal.
Silver has the highest electrical and thermal conductivity; and, it has also the highest reflectivity of any metal.

The symbol of silver is ‘Ag’ and atomic number is ’47.’
Salient Features of Silver
Silver is a precious metal used since long time by human beings.
Silver is an element of group 11 of the periodic table.
Silver has an excellent white metallic luster commonly used in a high polish.
As silver has no color; therefore, it has high reflectivity (of light).
Silver has very high electrical and thermal conductivity. Its electric conductivity is the highest – higher than copper.
Among all the metals, silver also has the lowest contact resistance.
Occurrence of Silver
The metal silver is usually found in the Earth's crust in the pure form.
Silver also found as an alloy with the gold and some other metals.
Silver is also found in some minerals, such as argentite and chlorargyrite.
Silver is largely produced as a byproduct of gold, copper, zinc, lead, etc.
Alloys of Silver
Following are the major alloys of silver −
Argentium sterling silver
Britannia silver
Doré bullion
Electrum
Goloid
Platinum sterling
Sterling silver
Tibetan silver
Compounds of Silver
Following are the major compound of silver −
Silver chloride - AgCl
Silver iodide - Agl
Silver bromide - AgBr
Silver oxide - Ag2O
Silver sulfide - Ag2S
Silver fluoride - AgF
Silver cyanide - AgCN
Silver carbonate - Ag2CO3
Silver acetate - AgC2H3O2
Silver sulfate - Ag2SO4
Silver chromate - Ag2CrO4
Silver oxalate - Ag2C2O4
Silver chlorate - AgClO3
Uses of Silver
Following are the major uses of silver −
From the ancient period, silver is being used in making coins.
Silver is also used in making ornaments.
Many of the home pots and other utensils were also used to be made by silver.
Silver has also medicinal use, as it is used as an antibiotic coating in medical devices.
Because of having very high electric conductivity, silver is commonly used in some electronic devices.
Besides, silver has many other uses, such as in photography, in chemical equipment, nanoparticles, etc.
Introduction
Gold is a bright, reddish yellow, soft, dense, malleable, and ductile metal naturally found in the earth’s crust.
The symbol of gold is ‘Au’ and atomic number is ‘79.’

Gold is (chemically) a transition metal and belongs to group 11 of the periodic table.
Salient Features of Gold
Gold, which remains in a solid state under standard conditions, is the least reactive element.
Gold is resistant to most of the acids.
Gold does dissolve in aqua regia; aqua regia is a mixture of nitric acid and hydrochloric acid.
However, gold is insoluble in nitric acid.
Gold usually dissolves in alkaline solutions of cyanide.
Cyanide solutions are commonly used in mining and electroplating.
Gold also dissolves in mercury and forms ‘amalgam alloys.’
Gold does not react with oxygen at any temperature.
Occurrence of Gold
Gold commonly occurs as a free element i.e. in the natural form.
Gold occurs as nuggets or else found in in rocks, grains, in veins, and in some other alluvial deposits.
Gold also occurs in a solid solution forms with the native element such as silver (as electrum).
At some places, gold also naturally alloyed with copper and palladium.
Alloys of Gold
Following are the major alloys of gold −
Colored gold
Crown gold
Electrum
Rose gold
Tumbaga
White gold
Compounds of Gold
Following are the major compounds of the gold −
Gold (III) chloride - AuCl3
Gold (I) chloride - AuCl
Cyanide - CN
Chloroauric acid - HAuCl4
Gold (III) oxide - Au2O3
Gold bromide - AuBr
Aqua regia - HNO3+3HCl
Gold bromide - AuBr3
Gold (III) hydroxide - AuH3O3
Gold fluoride - AuF3
Gold (V) fluoride - AuF5
Gold sulfide - Au2S
Fulminating gold
Gold salts
Gold heptafluoride
Uses of Gold
Gold is one of the oldest elements that human being have been using for thousands of years.
As it is highly precious and provides a beautiful look, hence it is characteristically used in making ornaments.
As per the recent trend (of the world), about 50% gold is used in making jewelry, 40% used in investments, and remaining 10% is used in industry.
Introduction
Platinum is a malleable, ductile, dense, and highly unreactive chemical element.
The symbol of platinum is ‘Pt’ and its atomic number is ‘78.’

The name of platinum is derived from a Spanish term i.e. ‘platina,’ which means "little silver."
Platinum is the most precious and the rarest metal (element) on the earth.
Salient Features of Platinum
Following are the important features of the platinum −
Platinum is a silver white metal.
Platinum is an element of group 10 of the periodic table.
Platinum is one of the rarest elements in the crust of the earth.
Platinum is one of the least reactive elements.
Platinum has six natural isotopes.
Platinum is one of the most highly valuable and precious metals.
Platinum is characteristically resists corrosion in all conditions. Because of this reason, it is considered as noble metal.
Platinum is normally insoluble in nitric and hydrochloric acid, but dissolves in hot aqua regia.
After dissolving into the hot aqua regia, platinum gives aqueous chloroplatinic acid (see the image given below).

Occurrence of Platinum
Platinum is commonly found as the native (natural) platinum and as alloy with the other platinum-group.
Platinum usually occurs in the ores of nickel and copper.
Platinum also occurs naturally in the alluvial sands (commonly found in rivers).
Platinum occurs with the concentration of only (about) 0.005 ppm in the Earth's crust.
Alloys of Platinum
Platinum-iridium is one of the most significant alloys of platinum.
Compounds of Platinum
Following are the major compounds of platinum −
Platinum (II) chloride - Pt Cl2
Platinum (IV) chloride - PtCl4
Adam’s catalyst - PtO2
Platinum hexafluoride - PtF6
Potassium tetrachloropla - K2PtCl4
Krogmann’s salt - K2Pt(CN)4Br
Chloroplatinic acid - H2PtCl6
Sodium hexachloropl - Na2PtCl6
Aqua regia - HNO3+3HCl
Uses of Platinum
Platinum is used largely for vehicle emissions control devices.
Platinum is used in petroleum refining and many other chemical productions.
Platinum is used in electronic devices, such as in hard disk (drives).
Platinum is also used in jewelry.
Apart from all these usages, platinum is also used in medicine (anti-cancer drugs), glassmaking equipment, electrodes, turbine engines, investment, etc.
introduction
Dans le tableau périodique, le zinc est le premier élément du groupe 12.
Le symbole du zinc est ‘Zn’ et le numéro atomique est ‘30.’
En termes de disponibilité, le zinc est le 24 e élément le plus abondant de la croûte terrestre et il possède cinq isotopes stables.

Le minerai de zinc le plus courant est la sphalérite (zinc blende), qui est un minéral sulfure de zinc.
Andreas Sigismund Marggraf, le chimiste allemand, a découvert le zinc métallique pur pour la première fois en 1746.
Fait intéressant, les alchimistes ont brûlé du zinc dans l'air et ont formé quelque chose de différent et ils l'ont nommé "philosopher's wool" ou "white snow. "
Principales caractéristiques du zinc
La couleur du zinc est blanc bleuté et c'est un métal brillant et diamagnétique.
Le zinc métallique est normalement dur et cassant; cependant, lorsque la température augmente à partir de 100 0 C, il devient malléable.
Lorsque la température augmente de 210 0 C, alors le zinc métallique redevient cassant et peut être pulvérisé facilement par battage.
Le zinc est un conducteur d'électricité.
Présence de zinc
Le zinc se trouve généralement en association avec certains autres métaux de base tels que le cuivre et le plomb.
La sphalérite est une forme de sulfure de zinc et c'est le minerai le plus extrait.
La sphalérite contient environ 60 à 62% de zinc.
Alliages de zinc
Voici les principaux alliages de zinc -
Brass
Argent nickel
Argent allemand
Composés de zinc
Voici les principaux composés du zinc -
Oxyde de zinc - ZnO
Sulfure de zinc - ZnS
Halogénures de zinc - ZnF 2
Nitrate de zinc - Zn (NO 3 ) 2
Chlorate de zinc - Zn (ClO 3 ) 2
Sulfate de zinc - ZnSO 4
Phosphate de zinc - Zn 3 (PO 4 ) 2
Molybdate de zinc - ZnMoO 4
Chromate de zinc - ZnCrO 4
Arsénite de zinc - Zn (AsO 2 ) 2
Acétate de zinc - Zn (O 2 CCH 3 ) 2
Utilisations du zinc
Le zinc est l'un des éléments les plus importants pour la santé publique.
Le zinc est largement utilisé comme agent anticorrosion et comme revêtement de fer et d'acier.
Le zinc est couramment utilisé comme anode ou comme combustible de la batterie zinc-air.
L'oxyde de zinc est largement utilisé comme pigment blanc (voir l'image ci-dessous) dans les peintures.

L'oxyde de zinc est également utilisé comme catalyseur dans la fabrication du caoutchouc.
Le zinc est un élément essentiel à notre santé; il est normalement utilisé comme matières supplémentaires sous des formes telles que l'oxyde de zinc, l'acétate de zinc ou le gluconate de zinc.
Le zinc est normalement un matériau antioxydant.
Une carence en zinc dans le corps humain peut provoquer un trouble dépressif majeur.
Après la blessure corporelle, le zinc est utilisé pour accélérer le processus de guérison.
Le pyrithione de zinc est couramment utilisé dans les shampooings pour prévenir les pellicules.
Le zinc chélaté est généralement utilisé dans les dentifrices et les bains de bouche (liquides), car il prévient la mauvaise haleine.
Le zinc protège également la peau des coups de soleil, par conséquent, il est utilisé dans les lotions pour le corps.
introduction
Le mercure est un élément chimique, généralement connu sous le nom de 'quicksilver».
Auparavant, le mercure était nommé 'hydrargyrum».
Le symbole du mercure est ‘Hg’ et le numéro atomique est ‘80.’

Le pigment rouge vermillon est extrait par broyage de cinabre naturel ou de sulfure mercurique synthétique.
Principales caractéristiques du mercure
Le mercure est un métal lourd et blanc argenté.
Mercure généralement disponible à l'état liquide; dans des conditions normales, seuls les quelques éléments métalliques restent à l'état liquide à température ambiante.
Le mercure est le mauvais conducteur de la chaleur, mais c'est un bon conducteur de l'électricité.
Le point de congélation du mercure est de -38,83 0 C et le point d'ébullition de 356,73 0 C.
Empoisonnement au mercure causé par l'ingestion de toute forme de mercure. Elle est également causée par l'inhalation de vapeurs de mercure.
Le mercure dissout de nombreux métaux, y compris l'or et l'argent, pour former des amalgames.
Présence de mercure
Le mercure est l'un des éléments les plus rares de la croûte terrestre.
Les minerais de mercure les plus riches contiennent environ 2,5% de mercure (en termes de masse).
Le mercure se trouve soit sous forme d'élément natif (naturel)) soit dans les minéraux de cordéroite, cinabre, livingstonite, etc.
Mercure se trouve dans la région de la jeune ceinture de montagnes; la ceinture qui continue de forcer les roches plus denses à la croûte terrestre. Par exemple, une région volcanique ou même des régions de sources chaudes.
Alliages de mercure
L'amalgame est le principal alliage de mercure.
Composés de mercure
Voici les principaux composés du mercure -
Chlorure de mercure (II) - HgCl 2
Oxyde de mercure (II) - HgO
Sulfure de mercure - HgS
Mercure (I) - chlorure - Hg 2 Cl 2
Diméthylmer - C 2 H 6 Hg
Nitrate de mercure (II) - Hg (NO 3 ) 2
Acétate de mercure (II) - C 4 H 6 O 4 Hg
Sulfate de mercure (II) - HgSO 4
Iodure de mercure (I) - Hg 2 I 2
Séléniure de mercure - HgSe
Fulminate de mercure (II) - Hg (CNO) 2
Bromure de mercure (II) - HgBr 2
Iodure de mercure (II) - HgI 2
Oxyde de mercure (I) - Hg 2 O
Fluorure de mercure (I) - Hg 2 F 2
Amidochlorure mercurique - ClH 2 HgN
Diéthylmercure - C 4 H 10 Hg
Utilisations du mercure
Le mercure est largement utilisé dans les industries chimiques.
Le mercure est utilisé dans les applications électriques et électroniques.
Le mercure est utilisé dans les thermomètres que nous utilisons pour mesurer la température.
Le mercure et ses composés sont couramment utilisés dans divers médicaments.
introduction
Le plutonium est essentiellement un métal actinide et il ressemble à un gris argenté.
L'élément, dont le numéro atomique est compris entre 89 et 103, est appelé élément actinide.
Le symbole du plutonium est ‘Pu’ et le numéro atomique est ‘94.’

Le plutonium possède normalement six allotropes.
Le plutonium est nommé d'après 'Pluto».
Le plutonium a été découvert pour la première fois en 1940, par un groupe de scientifiques, à savoir Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan et Arthur C. Wahl.
Principales caractéristiques du plutonium
Le plutonium est un élément chimique radioactif.
Le plutonium lorsqu'il est exposé à l'air, il se ternit et lorsqu'il s'oxyde, il forme une couche terne.
Le plutonium réagit avec de nombreux éléments, notamment les halogènes, l'azote, le carbone, le silicium et l'hydrogène.
En raison du processus de fission, les neutrons sont libérés et convertissent les noyaux d'uranium-238 en plutonium-239.
Le plutonium-239 et le plutonium-241 sont tous deux fissiles et peuvent donc entretenir une réaction nucléaire en chaîne. Il est très bien applicable dans les armes nucléaires et les réacteurs nucléaires.
Le point de fusion du plutonium est de 640 0 C et son point d'ébullition est de 3228 0 C.
La libération de noyau d'hélium (une énergie élevée) est la forme la plus courante de désintégration radioactive du plutonium.
Présence de plutonium
Le plutonium ne se trouve naturellement qu'à l'état de traces dans les gisements d'uranium.
Le plutonium est également extrait en brûlant l'uranium (tout en développant l'énergie nucléaire).
Alliages de plutonium
Voici les principaux alliages de plutonium -
Le plutonium-gallium est l'un des alliages importants du plutonium ainsi que du gallium.
Le plutonium-gallium est utilisé dans les puits d’armes nucléaires.
Le plutonium-gallium a la propriété d'une très faible dilatation thermique.
Certains autres alliages de plutonium sont -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Composés de plutonium
Oxyde de plutonium (IV) - PuO 2
Chlorure de plutonium (III) - PuCl 3
Tétrafluorure de plutonium - PuF 4
Utilisations du plutonium
L'isotope plutonium-239 est l'un des éléments importants du développement des armes nucléaires.
Le plutonium est utilisé comme combustible dans les centrales nucléaires.
introduction
L'uranium est le métal de la série des actinides du tableau périodique.
Le symbole de l'uranium est ‘U’ et le numéro atomique est ’92.’
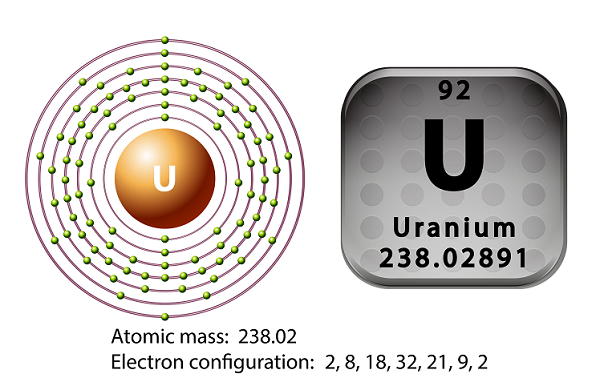
En 1789, Martin Heinrich Klaproth avait découvert l'élément uranium et l'avait nommé d'après le nom d'Uranus.
Principales caractéristiques de l'uranium
L'uranium est un métal blanc argenté.
Un atome d'uranium a 92 électrons ainsi que 92 protons, dont 6 sont des électrons de valence.
En raison de la présence d'isotopes instables, l'uranium est un élément radioactif faible.
L'uranium 238 est l'isotope le plus courant de l'uranium.
L'uranium est naturellement présent à de très faibles concentrations, c'est-à-dire quelques parties par million dans la roche, le sol et l'eau.
L'uranium se désintègre progressivement (lentement) en émettant sa particule alpha.
L'uranium a une mauvaise conductivité électrique (donc un mauvais conducteur d'électricité).
L'uranium est malléable, ductile et légèrement paramagnétique
Présence d'uranium
L'uranium se trouve (naturellement) sous forme d'uranium-238, d'uranium-235 et d'uranium-234.
La demi-vie de l'uranium-238 est d'environ 4,47 milliards d'années presque l'âge de la Terre et la demi-vie de l'uranium-235 est d'environ 704 millions d'années.
Alliages d'uranium
Voici les principaux alliages d'uranium -
Staballoy
Hydrure d'uranium
Composés d'uranium
Voici les principaux composés de l'uranium -
Nitrure d'uranium - U 2 N 3
Pentafluorure d'uranium - UF 5
Carbure d'uranium - UC
Fluorure d'uranyle - UO 2 F 2
Dioxyde d'uranium - UO 2
Hexafluorure d'uranium - UF 6
Oxtoxyde de triuranium - U 3 O 8
Tétrafluorure d'uranium - UF 4
Trioxyde d'uranium - UO 3
Tétrachlorure d'uranium - Ucl 4
Nitrate d'uranyle - UO 2 (NO 3 ) 2
Utilisations de l'uranium
L'uranium est utilisé comme source d'énergie dans les sous-marins nucléaires (en particulier par les militaires).
L'uranium est utilisé dans la fabrication d'armes nucléaires.
L'uranium est également utilisé comme ballasts pour les navires.
introduction
Le plomb est un élément chimique lourd (métal), c'est-à-dire qu'il a une densité élevée.
Le symbole du plomb est ‘Pb’ et le numéro atomique est ‘82.’

Le plomb a tendance à se lier; de même, il peut former des chaînes, des liaisons, des cycles et des structures polyédriques.
Principales caractéristiques du plomb
Le plomb est un métal mou et malléable; il a un point de fusion relativement bas.
Le plomb est un élément relativement peu réactif et il a tendance à former un lien d'alliance.
Lorsque le plomb est coupé, il apparaît dans une teinte blanc bleuâtre.
En brûlant, le plomb donne une flamme blanc bleuâtre (voir l'image ci-dessous).

Les composés du plomb se trouvent généralement à l'état d'oxydation +2.
Occurrence de plomb
Le plomb est connu des peuples préhistoriques d'Asie occidentale.
Le plomb se trouve dans la croûte terrestre; on le trouve rarement au fond de la terre.
Le plomb est généralement associé au soufre.
La galène est le principal minéral plombifère, principalement présent dans les minerais de zinc.
Alliages de plomb
Voici les principaux alliages de plomb -
Molybdochalkos (cuivre)
Soudure (étain)
Terne (étain)
Composés de plomb
Voici les principaux composés du plomb -
Monoxyde de plomb - PbO
Dioxyde de plomb - PbO 2
Utilisations du plomb
Le plomb est utilisé dans la fabrication de balles depuis des centaines d'années.
Le plomb est couramment utilisé comme gaine de protection pour les câbles sous-marins (uniquement parce qu'il a la propriété de résistance à la corrosion).
Les feuilles de plomb sont également utilisées comme métaux architecturaux, en particulier dans les matériaux de toiture.
Le plomb est également utilisé dans les batteries acides.
Les composés de plomb sont couramment utilisés comme agents colorants et semi-conducteurs.
Les composés de plomb sont également utilisés dans le plastique, les bougies, le verre, etc.
Le plomb est couramment utilisé dans le polychlorure de vinyle (c'est-à-dire utilisé dans le revêtement des cordons électriques).
Précaution
La présence de plomb (de qualité excessive) dans le corps peut causer de graves dommages au cerveau et aux reins; il peut même causer la mort en dernier lieu.
introduction
Le thorium est l'un des métaux actinides radioactifs qui se produisent naturellement en grandes quantités.
Le symbole du thorium est ‘Th’ et le numéro atomique est ’90.’

En 1829, un minéralogiste norvégien Morten Thrane Esmark, découvrit le thorium pour la première fois.
Jöns Jacob Berzelius, le chimiste suédois, l'a identifié et nommé «thorium» d'après le nom de «Thor», le dieu nordique du tonnerre.
Principales caractéristiques du thorium
Le thorium est un métal actinide radioactif paramagnétique et doux.
La couleur du métal thorium est argentée; lorsqu'il est exposé à l'air, il ternit en noir et forme du dioxyde.
Tous les isotopes du thorium sont instables et c'est un élément radioactif faible.
Parmi tous les éléments radioactifs significatifs, la demi-vie du thorium est la plus longue, soit environ 14,05 milliards d'années.
Le point de fusion du thorium est d'environ 1750 0 C.
Présence de thorium
Le thorium est un élément primordial qui existe dans sa forme actuelle depuis avant la formation de la Terre.
Le thorium, trouvé dans la croûte terrestre, est raffiné à partir des sables monazites.
La monazite, présente en grandes quantités dans le monde, est la source la plus importante de thorium.
Alliages de thorium
Le Mag-Thor et le thorium-aluminium sont les alliages les plus importants de thorium, de magnésium et d'aluminium.
Composés de thorium
Voici les principaux composés du thorium -
Dioxyde de thorium - ThO 2
Sulfure de thorium (IV) - ThS 2
Iodure de thorium (IV) - ThI 4
Tétrafluorure de thorium - ThF 4
Thorium (chlorure IV - ThCl 4
Carbure de thorium (IV) - ThC
Certains autres sont -
Thorite
Nitrate de thorium (IV)
Orthosilicate de thorium (IV)
Utilisations du thorium
Le thorium est normalement utilisé dans le soudage à l'arc au tungstène gazeux (GTAW) car il (thorium) augmente la résistance à haute température des électrodes de tungstène et améliore en conséquence la stabilité de l'arc.
Dans les équipements électroniques, l'application d'un revêtement de thorium sur un fil de tungstène augmente l'émission d'électrons des cathodes chauffées.
Dans l'industrie chimique, le dioxyde de thorium à savoir ‘thoria’ est couramment utilisé.
introduction
Dans le tableau périodique, l'hydrogène est l'élément le plus léger, son poids atomique n'est que de 1,008.
Le symbole de l'hydrogène est ‘H’ et le numéro atomique est ‘1.’

Au début du 16 e siècle, l'hydrogène gazeux a d'abord été produit artificiellement par la réaction d'acides et de métaux.
Henry Cavendish a d'abord reconnu l'hydrogène gazeux comme une substance distincte pendant la période de 1766 à 1781, car il produit de l'eau lorsqu'il est brûlé.
Principales caractéristiques de l'hydrogène
Dans leur état de plasma, les étoiles non restantes sont principalement composées d'hydrogène.
À température et pression standard, l'hydrogène apparaît comme un gaz diatomique incolore, insipide, inodore, non métallique, non toxique et hautement combustible.
La formule moléculaire de l'hydrogène est H 2 .
Sur terre, l'hydrogène existe sous des formes moléculaires, par exemple l'eau ou d'autres composés organiques.
L'hydrogène joue également un rôle important dans les réactions acide-base.
L'hydrogène gazeux est hautement inflammable dans l'air.
Les flammes d'hydrogène-oxygène purs rayonnent de la lumière ultraviolette; en outre, avec un mélange d'oxygène élevé sont presque invisibles à l'œil nu.
L'hydrogène peut réagir avec presque tous les éléments oxydants.
À température ambiante, l'hydrogène réagit normalement spontanément et violemment avec le chlore et le fluor et forme les halogénures d'hydrogène correspondants.
Présence d'hydrogène
Composé d'environ 75% de toute la masse baryonique, l'hydrogène est la subsistance chimique la plus abondamment trouvée dans l'univers.
Dans tout l'univers, l'hydrogène se trouve généralement dans les états atomique et plasma; cependant, les propriétés sont très différentes de celles de l'hydrogène moléculaire.
Sur terre, l'hydrogène existe sous forme de gaz diatomique, c'est-à-dire H 2 .
En raison de son poids léger, l'hydrogène s'échappe facilement de l'atmosphère terrestre.
L'hydrogène est le troisième élément le plus abondant à la surface de la Terre, mais se trouve en grande partie sous forme d'hydrocarbures et d'eau.
Composés d'hydrogène
Voici les principaux composés de l'hydrogène -
Eau - H 2 O
Ammoniac - NH 3
Chlorure d'hydrogène - HCl
Fluorure d'hydrogène - HF
Sulfure d'hydrogène - H 2 S
Méthane - CH 4
Hydroxyde - OH -
Bromure d'hydrogène - HBr
Iodure d'hydrogène - HI
Cyanure d'hydrogène - HCN
Phosphine - PH 3
Séléniure d'hydrogène - H 2 Se
Méthanol - CH 3 OH
Hydrure de lithium - LiH
Bicarbonate - HCO 3
Tellurure d'hydrogène - H 2 Te
Hydrogène liquide - H 2
Cyanure - CN
Hydrure de calcium - CaH 2
Eau lourde - D 2 O
Diborane - B 2 H 6
Hydrure de sodium - NaH
Hydrure de potassium - KH
Utilisations de l'hydrogène
La plus grande quantité de H 2 est utilisée dans le traitement des combustibles fossiles ainsi que dans la production d'ammoniac.
L'hydrogène (H 2 ) est largement utilisé dans les industries pétrolière et chimique.
H 2 est typiquement utilisé comme agent hydrogénant, en particulier pour augmenter le niveau de saturation des graisses et huiles insaturées.
Le H 2 est également utilisé comme gaz de protection dans les procédures de soudage, telles que le soudage à l'hydrogène atomique, etc.
introduction
L'hélium est le deuxième élément le plus léger (après l'hydrogène) et le deuxième élément le plus abondant de l'univers.
Le symbole de l'hélium est ‘He’ et le numéro atomique est ‘2.’

Dans le tableau périodique, l'hélium est le premier du groupe des gaz rares.
L'hélium est nommé d'après le nom du dieu grec du Soleil, 'Helios».
Principales caractéristiques de l'hélium
L'hélium est un gaz incolore, inodore, insipide, inerte, non toxique et monoatomique.
Le point d'ébullition (-268,9 0 C) de l'hélium est le plus bas de tous les éléments.
L'hélium est généralement composé de deux électrons dans les orbitales atomiques et entouré d'un noyau, qui se compose de deux protons et de deux neutrons.
Présence d'hélium
La plupart de l'hélium trouvé dans l'univers appartient à helium-4, et on pense qu'il s'est formé pendant le Big Bang.
Une part importante du nouvel hélium est généralement créée par la fusion nucléaire de l'hydrogène dans les étoiles, y compris le Soleil.
Bien qu'il y ait création continue de nouvel hélium; néanmoins, la disponibilité de l'hélium sur la terre est sensiblement faible car étant l'élément léger, il s'échappe facilement dans l'espace.
Dans l'hétérosphère (atmosphère extérieure) de la Terre, l'hélium est l'un des éléments (gaz) les plus abondamment trouvés.
Dans la croûte terrestre, l'hélium se trouve généralement en grandes quantités dans les minéraux de l'uranium et du thorium.
Composés d'hélium
Voici les principaux composés de l'hélium -
Hélide disodique - Na 2 He
Cristobalite He II (Silicates) - SiO 2 He
Arsénolite de dihélium - As 4 O 6 • 2He
Isotopes de l'hélium
Il existe environ neuf isotopes connus de l'hélium, mais les deux suivants sont les isotopes les plus stables -
Hélium-3 et
Helium-4
Utilisations de l'hélium
En raison de sa faible densité, de son point d'ébullition bas, de sa faible solubilité et de sa conductivité thermique élevée, l'hélium est un élément largement utilisé; l'exemple le plus populaire est - l'utilisation d'hélium en ballon.
La majeure partie de l'hélium a des applications cryogéniques, telles que le refroidissement des aimants supraconducteurs utilisés dans les scanners IRM médicaux et les spectromètres RMN.
L'hélium est également utilisé comme gaz protecteur dans la croissance des cristaux de silicium et de germanium.
L'hélium est également utilisé dans la chromatographie en phase gazeuse et dans la production de titane et de zirconium.
L'hélium est utilisé dans les souffleries supersoniques.
L'hélium est également appliqué comme gaz de protection dans les procédés de soudage à l'arc.
introduction
L'oxygène est le membre du groupe 16 sur le tableau périodique; cependant, la plupart du temps, il est traité différemment de son groupe.
Le symbole de l'oxygène est ‘O’ et le numéro atomique est ‘8.’

L'oxygène a environ neuf allotropes et l'allotrope le plus courant est l'oxygène diatomique (c'est-à-dire O 2 ). Un autre allotrope important est l'ozone, c'est-à-dire l'O 3 .
L'oxygène, pour la première fois, a été remarqué par le pharmacien suédois Carl Wilhelm Scheele.
Principales caractéristiques de l'oxygène
L'oxygène est typiquement classé comme membre du groupe «chalcogène».
Le mot "chalcogène" est dérivé d'un mot grec "khalkόs», Qui signifie« cuivre »et le mot latin-grec«Genēs», Qui signifie né ou produit.
L'oxygène est un gaz hautement réactif (ou élément non métallique); par conséquent, c'est un agent oxydant qui forme facilement des oxydes avec la plupart des éléments et des composés.
L'oxygène a six électrons de valence.
Le point de fusion de l'oxygène est de -218,8 0 C et le point d'ébullition est de -183 0 C.
Occurrence d'oxygène
Avec une part d'environ 20,8% (dans la totalité des constituants atmosphériques de la Terre), l'oxygène est le deuxième élément classé de l'atmosphère terrestre.
L'oxygène se produit presque dans la sphère terrestre, à savoir l'atmosphère, l'hydrosphère et la lithosphère.
Pendant le processus de photosynthèse, de l'oxygène libre est produit par toutes les plantes vertes.
L'oxygène se présente sous forme de minerais de cuivre constitutifs.
Un corps humain contient environ 65% d'oxygène.
En masse, près de la moitié de la croûte terrestre est composée d'oxygène (c'est-à-dire de ses oxydes).
En masse, l'oxygène est le troisième élément le plus abondant que l'on trouve dans l'univers; le premier et le second sont en conséquence l'hydrogène et l'hélium.
L'oxygène (c'est-à-dire O 2 ) est un gaz diatomique incolore et inodore.
L'oxygène se dissout très facilement dans l'eau; cependant, la solubilité de l'oxygène dans l'eau dépend de la température.
Composés d'oxygène
Voici les principaux composés de l'oxygène -
Oxide
Peroxide
Dioxyde de carbone - CO 2
Hydroxyde - OH -
Ozone - O 3
Oxyde de mercure (II) - HgO
Chlorate - ClO 3
Oxyde d'aluminium - Al 2 O 3
Monoxyde de carbone - CO
Hypochlorite - ClO -
Dioxyde de silicium - SiO 2
Acide hypofluoreux - HOF
Peroxyde de sodium - Na 2 O 2
Chlorate de potassium - KClO 3
Difluorure d'oxygène - OF 2
Oxyde de sodium - Na 2 O
Utilisations de l'oxygène
L'oxygène (O 2 ) est le besoin le plus essentiel de la respiration, sans lui, la vie ne peut être imaginée.
L'oxygène est utilisé en médecine.
L'oxygénothérapie est généralement utilisée pour traiter certaines maladies, telles que l'emphysème, la pneumonie, certains troubles cardiaques, etc.
Certaines activités sous-marines, telles que la plongée sous-marine, les sous-marins, etc. utilisent également de l'oxygène artificiel.

Les avions, les alpinistes, etc. utilisent également de l'oxygène artificiel.
L'oxygène est également utilisé dans certaines industries, par exemple la fusion du minerai de fer en acier - dans ce processus, environ 55% de l'oxygène est utilisé.
introduction
Le carbone est un élément non métallique et tétravalent.
Tétravalent signifie - le carbone rend quatre électrons disponibles pour former les liaisons chimiques covalentes.
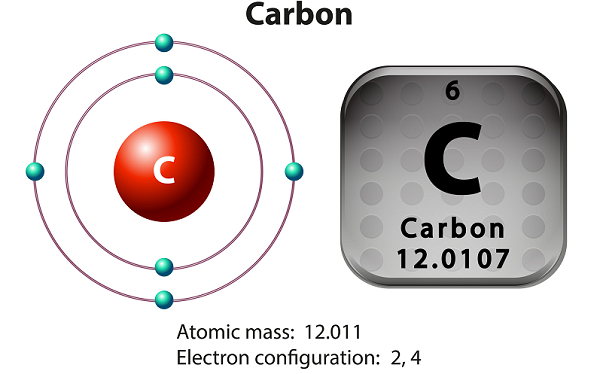
Le carbone a trois isotopes qui se produisent naturellement - à savoir 12 C, 13 C et 14 C.
Parmi eux, le 12 C et le 13 C sont stables, mais le 14 C est un isotope radioactif. La demi-vie du 14 C est d'environ 5 730 ans.
Principales caractéristiques du carbone
Les propriétés physiques du carbone dépendent largement de ses allotropes.
Les principaux allotropes du carbone sont le graphite, le diamant et le carbone amorphe.
Le graphite est opaque, noir et très doux; par conséquent, il formait une strie sur le papier.
Diamant très dur (le matériau naturel le plus dur) et transparent.
Le graphite est un bon conducteur d'électricité.
Le diamant est un mauvais conducteur d'électricité.
Le carbone a très probablement le point de sublimation le plus élevé parmi tous les éléments.
Présence de carbone
En termes de masse, le carbone est le quatrième élément chimique le plus abondant dans l'univers (après l'hydrogène, l'hélium et l'oxygène).
Le carbone est disponible en abondance dans le Soleil, les étoiles, les comètes et dans les atmosphères de la plupart des planètes.
Le carbone se trouve dans l'atmosphère terrestre et se dissout dans l'eau.
Les hydrocarbures, tels que le charbon, le pétrole et le gaz naturel, contiennent tous du carbone.
Le carbone se trouve également dans les hydrates de méthane, que l'on trouve dans les régions polaires et sous les mers.
Certaines des roches enrichies en carbone sont du charbon, du calcaire, de la dolomite, etc.
Le charbon est très riche en carbone; c'est donc la plus grande source commerciale de carbone minéral.
Le charbon partage environ 4 000 gigatonnes ou 80% du total des combustibles fossiles.
Composés de carbone
Voici les principaux composés de carbone -
Cyanogène - CN 2
Cyanure d'hydrogène - HCN
Cyanamide - CN 2 H 2
Acide isocyanique - HNCO
Chlorure de cyanogène - CNCl
Isocyanate de chlorosulfonyle - CNClO 3 S
Chlorure cyanurique - NCCl 3
Disulfure de carbone - CS 2
Sulfure de carbonyle - OCS
Monosulfure de carbone - CS
Utilisations du carbone
En fonction des allotrops, le carbone est utilisé dans une gamme d'applications.
Le carbone est l'un des éléments les plus essentiels de la vie sans lui, on ne peut pas imaginer la vie sur terre.
Les combustibles fossiles à savoir le méthane et le pétrole brut (pétrole), le charbon, etc. sont utilisés dans la vie quotidienne.
Graphite, combiné avec de l'argile, utilisé dans la fabrication de «plomb» utilisé dans les crayons.
Le charbon de bois est également utilisé comme matériau de dessin dans les œuvres d'art, la fonte du fer, les grillades au barbecue, etc.
Le diamant est généralement utilisé dans les bijoux.
Les diamants industriels sont utilisés dans les outils de coupe, de perçage et de polissage pour l'usinage des métaux et de la pierre.
Les hydrocarbures fossiles et la fibre de carbone sont utilisés dans la fabrication du plastique.
introduction
L'azote est un élément chimique du groupe des 15 du tableau périodique; parmi tous les éléments du groupe 15, c'est l'élément le plus léger.
Le symbole de l'azote est ‘N’ et le numéro atomique est 7.

En 1772, le médecin écossais Daniel Rutherford a découvert et isolé le carbone pour la première fois.
Cependant, le nom d'azote a été donné pour la première fois par Jean-Antoine-Claude Chaptal en 1790.
Principales caractéristiques de l'azote
L'azote a deux isotopes stables, à savoir le 14 N et le 15 N.
Les atomes d'azote libres réagissent normalement facilement avec la plupart des éléments et forment des nitrures.
Les molécules de N 2 sont un gaz incolore, inodore, insipide et diamagnétique dans des conditions standard.
Le point de fusion de N 2 est de -210 0 C et le point d'ébullition de -196 0 C.
Les composés azotés s'échangent de manière répétitive entre l'atmosphère et les organismes vivants, créant un cycle de l'azote.
Apparition d'azote
L'azote est l'élément le plus abondant sur Terre, car il constitue environ 78,1% du volume total de l'atmosphère terrestre.
L'azote gazeux, qui est un gaz industriel, produit en grande partie par distillation fractionnée de l'air liquide.
Composés d'azote
Voici les principaux composés de l'azote -
Ammonium - NH 4+
Ammoniac - NH 3
Acide nitrique - HNO 3
Nitrite - NON 2-
Dioxyde d'azote - NO 2
Pentroxyde de diazote - N 2 O 5
Hydrazine - N 2 H 4
Dinitrogène - N 2
Cyanure - CN
Nitrate d'ammonium - (NH 4 ) (NO 3 )
Trichlorure d'azote - NCl 3
Trifluorure d'azote - NF 3
Triiodure d'azote - NI 3
Pyridine - C 5 H 5 N
Ion nitronium - NO 2+
Acide hydrazoïque - HN 3
Sulfate d'ammonium - (NH 4 ) 2 SO 4
Utilisations de l'azote
Les composés azotés sont largement utilisés dans un large éventail de domaines et d'industries.
L'azote pur est utilisé comme additif alimentaire.
Utilisé dans les systèmes d'extinction d'incendie en particulier pour les équipements informatiques.
Également utilisé dans la fabrication d'acier inoxydable.
L'azote est également utilisé pour gonfler les pneus de certains avions et voitures de course.
L'azote liquide est utilisé comme réfrigérant.
Les lois de la nature liées à la chimie sont appelées lois chimiques.
Les réactions chimiques, normalement, sont administrées par certaines lois, qui sont observées et formulées avec des mots qui deviennent des concepts fondamentaux en chimie.
Voici les lois chimiques importantes -
| Lois | Explication |
|---|---|
| Loi d'Avogadro | «Des volumes égaux de tous les gaz, à la même température et pression, ont le même nombre de molécules» |
| Loi de Beer – Lambert, (ou simplement loi de Beer ou loi Lambert – Beer) | "Explique l'atténuation de la lumière aux propriétés du matériau à travers lequel elle (la lumière) passe" |
| La loi de Boyle | "La pression absolue exercée par une masse donnée d'un gaz parfait est inversement proportionnelle au volume qu'il occupe si la température et la quantité de gaz restent inchangées dans un système fermé" |
| Loi de Charles (également connue sous le nom de loi du volume) | "Lorsque la pression sur un échantillon de gaz sec est maintenue constante, la température Kelvin et le volume seront directement liés" |
| Les lois de la diffusion de Fick | Décrit la «diffusion» (du flux) |
| Loi de Gay-Lussac | "Tous les gaz ont la même expansivité thermique moyenne à pression constante sur la même plage de température" |
| Principe de Le Chatelier ("La loi d'équilibre") | «Lorsqu'un système à l'équilibre est soumis à un changement de concentration, de température, de volume ou de pression, le système se réajuste pour contrer (partiellement) l'effet du changement appliqué et un nouvel équilibre est établi» |
| Loi de Henry | "La loi calcule la concentration de gaz dans la solution sous pression" |
| Loi de Hess | "Le changement d'enthalpie dans une réaction chimique (c'est-à-dire la chaleur de réaction à pression constante) est indépendant de la voie entre les états initial et final" |
| Loi de conservation de l'énergie | "L'énergie ne peut être ni créée ni détruite" |
| Loi de Raoult | "La pression de vapeur partielle de chaque composant d'un mélange idéal de liquides est égale à la pression de vapeur du composant pur multipliée par sa fraction molaire dans le mélange" |
| Électrolyse de la loi de Faraday | "La quantité de substance produite au niveau d'une électrode est directement proportionnelle à la quantité d'électricité passée" |
| Théorie atomique | "La matière est composée d'unités distinctes appelées atomes" |
| Théorie de Köhler | "Explique le processus par lequel la vapeur d'eau se condense et forme les gouttes de nuage liquide" |
| Équation de Van 't Hoff | "Décrit le changement de la constante d'équilibre d'une réaction chimique" |
| Théorie de l'état de transition | «Les vitesses de réaction des réactions chimiques élémentaires» |
| Loi de Grotthuss-Draper | «Il décrit que la lumière absorbée par un système / une surface peut apporter un changement photochimique» |
| Théorie cinétique des gaz | "Décrit le comportement d'un gaz idéal hypothétique" |
| Principe d'Aufbau | "Explique que les électrons en orbite autour des atomes remplissent d'abord les niveaux d'énergie les plus bas, puis les seconds niveaux supérieurs et ainsi de suite" |
| Règle de Hund | "Explique que chaque orbitale d'un sous-niveau est occupée individuellement avant qu'une orbitale ne soit doublement occupée" |
| Théorie des collisions | «Sur la base de la théorie cinétique des gaz, la théorie des collisions décrit que les réactions chimiques en phase gazeuse se produisent lorsque des molécules entrent en collision avec une énergie cinétique suffisante» |
introduction
Très probablement, le cuivre était le premier élément, qui a été extrait et utilisé par les humains.
La preuve de la première utilisation du cuivre a été trouvée en Anatolie, qui appartient à 6000 avant notre ère.
Le plomb était probablement le deuxième élément que les humains commencent à utiliser.
Le plus ancien artefact de plomb connu est une statuette, qui a été trouvée dans un temple d'Osiris, Abydos, Égypte.
La statuette du temple d'Osiris appartient à (environ) 3800 avant notre ère.
Le plus ancien trésor d'or connu a été découvert à Varna, Nécropole (Bulgarie).
Ce trésor d'or appartient à (environ) 4400 avant notre ère.
La découverte de l'argent est presque la même que celle de l'or; ses preuves ont été trouvées en Asie Mineure.
Certaines preuves indiquent que le fer était connu depuis (environ) 5000 ans avant notre ère.
Les plus anciens objets en fer connus, qui ont été utilisés par les humains, ont été trouvés en Égypte (appartient à 4000 avant notre ère).
Le tableau suivant illustre les éléments significatifs avec leur date de découverte et découvre -
| Élément | Découvreur | Date de découverte |
|---|---|---|
| Cuivre | Moyen-Orient (lieu) | Environ 9000 avant notre ère |
| Conduire | Egypte (lieu) | Environ 7000 avant notre ère |
| Or | Bulgarie (Lieu) | Environ 6000 ans avant notre ère |
| argent | Asie mineure (lieu) | Environ 5000 ans avant notre ère |
| Le fer | Egypte (lieu) | Environ 5000 ans avant notre ère |
| Étain | Environ 3500 avant notre ère | |
| Soufre | Chinois / Inde | Environ 2000 avant notre ère |
| Mercure | Egypte | 2000 avant notre ère |
| Phosphore | H. Marque | 1669 |
| Cobalt | G. Brandt | 1735 |
| Platine | A. de Ulloa | 1748 |
| Nickel | F. Cronstedt | 1751 |
| Bismuth | CF Geoffroy | 1753 |
| Magnésium | J. Black | 1755 |
| Hydrogène | H. Cavendish | 1766 |
| Oxygène | W. Scheele | 1771 |
| Azote | D. Rutherford | 1772 |
| Baryum | W. Scheele | 1772 |
| Chlore | W. Scheele | 1774 |
| Manganèse | W. Scheele | 1774 |
| Molybdène | W. Scheele | 1781 |
| Tungstène | W. Scheele | 1781 |
| Zirconium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titane | W. Gregor | 1791 |
| Chrome | N. Vauquelin | 1797 |
| Béryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Bore | L. Gay-Lussac et LJ Thénard | 1808 |
| Fluor | AM Ampère | 1810 |
| Iode | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S.L Hermann, F. Stromeyer et JCH Roloff | 1817 |
| Sélénium | J. Berzelius et G. Gahn | 1817 |
| Silicium | J. Berzelius | 1823 |
| Aluminium | HCØrsted | 1825 |
| Brome | J. Balard et C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthane | G. Mosander | 1838 |
| Rubidium | R. Bunsen et GR Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich et T. Richter | 1863 |
| Hélium | P. Janssen et N. Lockyer | 1868 |
| Néon | W. Ramsay et W. Travers | 1898 |
| Xénon | W. Ramsay et W. Travers | 1898 |
| Fermium | A. Ghiorso et coll. | 1952 |
| Nobelium | ED Donets, VA Shchegolev et VA Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris et P. Eskola | 1970 |
| Tennessine | Y. Oganessian et coll. | 2010 |
Le tableau suivant illustre les éléments significatifs et leur valence -
| Élément | Valence | symbole | N ° atomique |
|---|---|---|---|
| Hydrogène | -1, +1 | H | 1 |
| Hélium | 0 | Il | 2 |
| Lithium | 1 | Li | 3 |
| Béryllium | 2 | Être | 4 |
| Bore | 3, 2, 1 | B | 5 |
| Carbone | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Azote | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | sept |
| Oxygène | -1, -2, 0, 2, 1, | O | 8 |
| Fluor | -dix | F | 9 |
| Néon | 0 | Ne | dix |
| Sodium | -1, 1 | N / a | 11 |
| Magnésium | 2 | Mg | 12 |
| Aluminium | 3, 1 | Al | 13 |
| Silicium | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphore | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Soufre | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlore | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Californie | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titane | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chrome | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganèse | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Le fer | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Cuivre | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Géorgie | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | Comme | 33 |
| Sélénium | -2, 6, 4, 2, 1 | Se | 34 |
| Brome | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Oui | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdène | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technétium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthénium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| argent | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | CD | 48 |
| Indium | 3, 2, 1 | Dans | 49 |
| Étain | -4, 4, 2 | Sn | 50 |
| Antimoine | -3, 5, 3 | Sb | 51 |
| Tellure | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iode | -1, 0, 7, 5, 3, 1 | je | 53 |
| Xénon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Césium | -1, 1 | Cs | 55 |
| Baryum | 2 | Ba | 56 |
| Lanthane | 3, 2 | La | 57 |
| Cérium | 4, 3, 2 | Ce | 58 |
| Praséodyme | 4, 3, 2 | Pr | 59 |
| Néodyme | 4, 3, 2 | Nd | 60 |
| Prométhium | 3 | PM | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | UE | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Euh | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutétium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantale | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungstène | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhénium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Ré | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platine | 6, 5, 4, 2, 0 | Pt | 78 |
| Or | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercure | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Conduire | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | À | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pennsylvanie | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Américium | 7, 6, 5, 4, 3, 2 | Un m | 95 |
Le numéro atomique définit le nombre de protons trouvés dans le noyau d'un élément.
Le nombre total de protons et de neutrons (trouvés dans le noyau) est calculé comme le nombre de masse atomique.
Le tableau suivant illustre certains des éléments significatifs avec leur numéro atomique, leur masse atomique et leurs symboles -
| Élément | Numéro atomique | Masse atomique (g mol-1) | symbole |
|---|---|---|---|
| Hydrogène | 1 | 1,0079 | H |
| Hélium | 2 | 4,00 | Il |
| Lithium | 3 | 6,94 | Li |
| Béryllium | 4 | 9.01 | Être |
| Bore | 5 | 10,81 | B |
| Carbone | 6 | 12.01 | C |
| Azote | sept | 14,0067 | N |
| Oxygène | 8 | 16.00 | O |
| Fluor | 9 | 19.00 | F |
| Néon | dix | 20.1797 | Ne |
| Sodium | 11 | 22,989768 | N / a |
| Magnésium | 12 | 24.3050 | Mg |
| Aluminium | 13 | 26,981539 | Al |
| Silicium | 14 | 28.0855 | Si |
| Phosphore | 15 | 30,973762 | P |
| Soufre | 16 | 32,066 | S |
| Chlore | 17 | 35,4527 | Cl |
| Argon | 18 | 39,948 | Ar |
| Potassium | 19 | 39,0983 | K |
| Calcium | 20 | 40,078 | Californie |
| Scandlum | 21 | 44,955910 | Sc |
| Titane | 22 | 47,867 | Ti |
| Vanadium | 23 | 50,9415 | V |
| Chrome | 24 | 51,9961 | Cr |
| Manganèse | 25 | 54,93805 | Mn |
| Le fer | 26 | 55.845 | Fe |
| Cobalt | 27 | 58,93320 | Co |
| Nickel | 28 | 58,6934 | Ni |
| Cuivre | 29 | 63,546 | Cu |
| Zinc | 30 | 65,39 | Zn |
| Gallium | 31 | 69,723 | Géorgie |
| Germanium | 32 | 72,61 | Ge |
| Arsenic | 33 | 74,92159 | Comme |
| Sélénium | 34 | 78,96 | Se |
| Brome | 35 | 79,904 | Br |
| Krypton | 36 | 83,80 | Kr |
| Rubidium | 37 | 85,4678 | Rb |
| Strontium | 38 | 87,62 | Sr |
| Yttrium | 39 | 88.90585 | Oui |
| Zirconium | 40 | 91,224 | Zr |
| Niobium | 41 | 92,90638 | Nb |
| Molybdène | 42 | 95,94 | Mo |
| Technétium | 43 | 97,9072 | Te |
| Ruthénium | 44 | 101,07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106,42 | Pd |
| argent | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | CD |
| Indium | 49 | 114,818 | Dans |
| Étain | 50 | 118,710 | Sn |
| Antimoine | 51 | 121,760 | Sb |
| Tellure | 52 | 127,60 | Te |
| Iode | 53 | 126.90447 | je |
| Xénon | 54 | 131,29 | Xe |
| Césium | 55 | 132.90543 | Cs |
| Baryum | 56 | 137,327 | Ba |
| Lanthane | 57 | 138,9055 | La |
| Cérium | 58 | 140,115 | Ce |
| Praséodyme | 59 | 140,90765 | Pr |
| Néodyme | 60 | 144,24 | Nd |
| Prométhium | 61 | 144,9127 | PM |
| Samarium | 62 | 150,36 | Sm |
| Europium | 63 | 151,965 | UE |
| Gadolinium | 64 | 157,25 | Gd |
| Terbium | 65 | 158,92534 | Tb |
| Dysprosium | 66 | 162,50 | Dy |
| Holmium | 67 | 164,93032 | Ho |
| Erbium | 68 | 167,26 | Euh |
| Thulium | 69 | 168,93421 | Tm |
| Ytterbium | 70 | 173,04 | Yb |
| Lutétium | 71 | 174,967 | Lu |
| Hafnium | 72 | 178,49 | Hf |
| Tantale | 73 | 180,9479 | Ta |
| Tungstène | 74 | 183,84 | W |
| Rhénium | 75 | 186,207 | Ré |
| Osmium | 76 | 190,23 | Os |
| Iridium | 77 | 192,217 | Ir |
| Platine | 78 | 195,08 | Pt |
| Or | 79 | 196,96654 | Au |
| Mercure | 80 | 200,59 | Hg |
| Thallium | 81 | 204,3833 | Tl |
| Conduire | 82 | 207,2 | Pb |
| Bismuth | 83 | 208,98037 | Bi |
| Polonium | 84 | 208,9824 | Po |
| Astatine | 85 | 209,9871 | À |
| Radon | 86 | 222,0176 | Rn |
| Francium | 87 | 223,0197 | Fr |
| Radium | 88 | 226,0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232,0381 | Th |
| Protactinium | 91 | 231,0388 | Pennsylvanie |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237,0482 | Np |
| Plutonium | 94 | 244,0642 | Pu |
| Américium | 95 | 243,0614 | Un m |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251,0796 | Cf |
| Einsteinium | 99 | 252,083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258,10 | Maryland |
| Nobelium | 102 | 259,1009 | Non |
| Lawrencium | 103 | 262,11 | G / D |
| Unnilquadium | 104 | 261,11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118 * | Unh |
| Unnilseptium | 107 | 262,12 | Uns |
Jacobus Henricus van 't Hoff (un scientifique des Pays-Bas) a été la première personne à recevoir le prix Nobel de chimie en 1901.
Jacobus Henricus a reçu le prix Nobel pour son travail, à savoir «les lois de la dynamique chimique et de la pression osmotique dans les solutions».
À partir de 1901 à 2016, au total 174 scientifiques (de chimie) ont reçu le prix Nobel.
À l'époque, quatre femmes ont reçu le prix Nobel de chimie.
Marie Curie était la première dame qui a reçu le prix Nobel de chimie.
Le tableau suivant illustre le nom des personnes qui ont reçu le prix Nobel de chimie ainsi que leurs travaux (pour lesquels ils ont reçu le prix) -
| Nom | Pays (année) | Espace de travail |
|---|---|---|
| Svante August Arrhenius | Suède (1903) | Théorie électrolytique de la dissociation |
| Sir William Ramsay | Royaume-Uni (1904) | Découverte des éléments gazeux inertes dans l'air |
| Ernest Rutherford | Royaume-Uni / Nouvelle-Zélande (1908) | Chimie des substances radioactives |
| Maria Skłodowska-Curie | Pologne / France (1911) | Découverte des éléments radium et polonium |
| Alfred Werner | Suisse (1913) | Liaison des atomes dans les molécules |
| Théodore William Richards | États-Unis (1914) | Déterminations du poids atomique |
| Walter Norman Haworth | Royaume-Uni (1937) | Enquêtes sur les glucides et la vitamine C |
| Paul Karrer | Suisse (1937) | recherches sur les caroténoïdes, les flavines et les vitamines A et B2 |
| Adolf Friedrich Johann Butenandt | Allemagne (1939) | Travailler sur les hormones sexuelles |
| Otto Hahn | Allemagne (1944) | Découverte de la fission de noyaux lourds |
| John Howard Northrop et Wendell Meredith Stanley | États-Unis (1946) | Préparation d'enzymes et de protéines virales sous forme pure |
| Vincent du Vigneaud | États-Unis (1955) | Première synthèse d'une hormone polypeptidique |
| Sir Cyril Norman Hinshelwood et Nikolay Nikolaevich Semenov | Royaume-Uni et Union soviétique (1956) | Mécanisme des réactions chimiques |
| Frédéric Sanger | Royaume-Uni (1958) | La structure des protéines (en particulier l'insuline) |
| Willard Frank Libby | États-Unis (1960) | Méthode d'utilisation du carbone 14 pour la détermination de l'âge |
| Melvin Calvin | États-Unis (1961) | Assimilation du dioxyde de carbone dans les plantes |
| Karl Ziegler et Giulio Natta | Allemagne et Italie (1963) | Chimie et technologie des hauts polymères |
| Dorothy Crowfoot Hodgkin | Royaume-Uni (1964) | Déterminations par techniques radiographiques |
| Paul J. Flory | États-Unis (1974) | Chimie physique des macromolécules |
| Paul Berg | États-Unis (1980) | ADN recombinant |
| Aaron Klug | Royaume-Uni (1982) | Développement de la microscopie électronique cristallographique |
| Henry Taube | États-Unis (1983) | Mécanismes des réactions de transfert d'électrons |
| Robert Bruce Merrifield | États-Unis (1984) | Méthodologie de synthèse chimique sur matrice solide |
| Elias James Corey | États-Unis (1990) | Méthodologie de la synthèse organique |
| Richard R. Ernst | Suisse (1991) | Méthodologie de la spectroscopie par résonance magnétique nucléaire (RMN) à haute résolution |
| Kary B. Mullis | États-Unis (1993) | Méthode de réaction en chaîne par polymérase (PCR) |
| George A. Olah | États-Unis et Hongrie (1994) | Chimie du carbocation |
| Peter Agre | États-Unis (2003) | Découverte des canaux d'eau (membranes cellulaires) |
| Roger D. Kornberg | États-Unis (2006) | Base moléculaire de la transcription eucaryote |
| Gerhard Ertl | Allemagne (2007) | Processus chimiques sur des surfaces solides |
| Venkatraman Ramakrishnan, Thomas A. Steitz et Ada E. Yonath | 2009 | Structure et fonction du ribosome |
| Tomas Lindahl, Paul L. Modrich et Aziz Sancar | 2015 | Réparation de l'ADN |
| Jean-Pierre Sauvage, Fraser Stoddart et Ben Feringa | 2016 | Conception et synthèse de machines moléculaires |