Química Parte 2 - Guia Rápido
Introdução
A Química é um ramo das Ciências Naturais que estuda a estrutura, a composição e as propriedades mutáveis das matérias.
A química estuda a menor parte de uma matéria, ou seja, o átomo (junto com todas as suas propriedades) até os grandes materiais (por exemplo, ouro, prata, ferro, etc.) e suas propriedades.
A química também estuda as forças intermoleculares (que fornecem à matéria as propriedades gerais) e as interações entre as substâncias por meio das reações químicas.

Em 1998, o professor Raymond Chang definiu química como -
"Química" significa o estudo da matéria e as mudanças que ela sofre.
Acredita-se que o estudo da química teve início com a teoria dos quatro elementos proposta por Aristóteles.
A teoria dos quatro elementos afirma que "fogo, ar, terra e água foram os elementos fundamentais a partir dos quais tudo é formado como combinação".
Por causa de seu trabalho clássico, a saber “The Sceptical Chymist,” Robert Boyle é conhecido como o pai fundador da química.
Boyle formulou uma lei, tornou-se popular como 'Lei de Boyle'.
A lei de Boyle é uma lei experimental dos gases que analisa a relação entre a pressão de um gás e o volume do respectivo recipiente.
Ao defender sua lei, Boyle rejeitou a teoria clássica dos “quatro elementos”.
Os cientistas americanos Linus Pauling e Gilbert N. Lewis propuseram coletivamente a teoria eletrônica das ligações químicas e orbitais moleculares.
As Nações Unidas declararam 2011 como o 'Ano Internacional da Química'.
A matéria é definida em química como qualquer coisa que tenha massa e volume em repouso e também ocupe espaço.
o matter é feito de partículas.
o atom é a unidade fundamental da química.
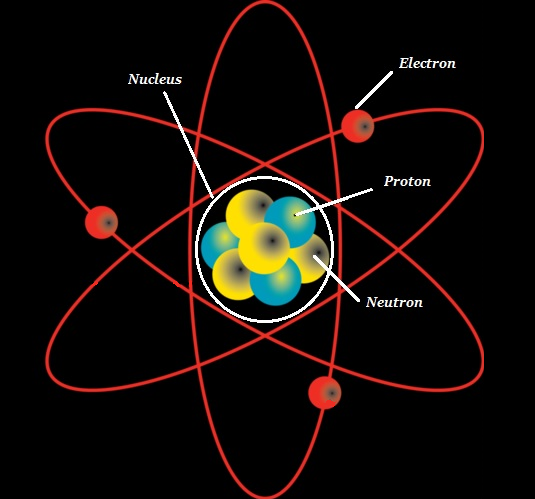
O átomo consiste em um núcleo denso conhecido como o atomic nucleus e é cercado por um espaço conhecido como o electron cloud.
O núcleo (de um átomo) é composto por protons (+ve charged particles) e neutrons (neutral or uncharged particles); coletivamente, esses dois são conhecidos comonucleons (como mostrado na imagem abaixo).
Um elemento químico é a forma pura de uma substância; consiste em um único tipo de átomo.
A tabela periódica é a representação padronizada de todos os elementos químicos disponíveis.
Um composto é a forma pura de uma substância; é composto por mais de um elemento.
Uma molécula é a menor parte indivisível de uma substância química pura; molécula tem um conjunto distinto de propriedades químicas (veja a imagem abaixo).
A tabela a seguir ilustra os ramos da química -
| Ramo | Sub-ramo | Definição |
|---|---|---|
| Physical Chemistry | Química Física | Estudo das propriedades físicas das moléculas |
| Cinética Química | Estudo das taxas de reações químicas | |
| Eletroquímica | Estudo da interação de átomos, moléculas, íons e corrente elétrica (ou seja, transferência de elétrons entre o eletrodo e o eletrólito ou espécie) | |
| Química de superfície | estudo de reações químicas em superfícies (de substâncias) | |
| Termoquímica | Estude a relação entre a ação química e a quantidade de calor absorvida | |
| Química Quântica | Estudo da aplicação da mecânica quântica em modelos físicos | |
| Espectroscopia | Estudo de espectros de luz ou radiação | |
| Fotoquímica | estudo dos efeitos químicos causados pela luz | |
| Organic Chemistry | Química orgânica | Estudo da estrutura, propriedades e preparação dos compostos químicos (carbono) (por exemplo, combustíveis, plásticos, aditivos alimentares e medicamentos) |
| Estereoquímica | Estudo do arranjo espacial relativo dos átomos (em moléculas) | |
| Química Físico Orgânica | estudo da estrutura e reatividade (inter-relacionamento) em moléculas orgânicas | |
| Química de Polímero | Estudo de moléculas de polímero (composição e criação) | |
| Química Organometálica | Estudo de produtos químicos que contêm ligações (especialmente entre um carbono e um metal) | |
| Química Medicinal | Estudo de concepção, desenvolvimento e síntese de drogas e medicamentos | |
| Inorganic chemistry | Química Inorgânica | Estudo de todos os materiais que não são orgânicos (como minerais, metais, catalisadores, estruturas cristalinas, etc.) |
| Química Organometálica | Estudo de compostos químicos contendo ligações (especialmente entre carbono e metal) | |
| Química de estado sólido | Estudo de compostos químicos que contêm ligações entre carbono e metal | |
| Química Nuclear | Estudo de substâncias radioativas | |
| Geoquímica | Estudo da composição química da terra (por exemplo, rochas, minerais e atmosfera) | |
| Química Bioinorgânica | Estudo das interações entre íons metálicos e tecido vivo | |
| Química de Coordenação | ||
| Biochemistry | Bioquímica | Estudo da reação química (e mudanças) em seres vivos |
| Bioquímica Molecular | Estudo de biomoléculas junto com suas funções | |
| Bioquímica Clínica | Estudo das alterações químicas nos seres vivos, causadas por diferentes doenças | |
| Biologia molecular | Estudo dos diferentes tipos de DNA, RNA e biossíntese de proteínas (e suas relações) | |
| Bioquímica agrícola | Estudo da química da fauna (ou seja, plantas) | |
| Analytical Chemistry | Estudo de métodos experimentais padronizados em química (ou seja, determinação quantitativa das propriedades químicas de uma substância) | |
| Astrochemistry | Estudo das reações de elementos químicos e moléculas encontradas no universo | |
| Cosmochemistry | Estudo da composição química das matérias encontradas no universo | |
| Environmental chemistry | Estudo dos fenômenos químicos e bioquímicos que ocorrem no meio ambiente |
Introdução
O processo de emissão de partículas dos núcleos devido à instabilidade nuclear; é conhecido como radioatividade.
A substância que libera essa energia / raios é conhecida como substância radioativa.
Os raios invisíveis liberados dessa substância radioativa são conhecidos como raios radioativos.
Da mesma forma, a radioatividade é um fenômeno nuclear que ocorre (naturalmente) devido à instabilidade nuclear dos átomos.
Em 1896, Henri Becquerel observou pela primeira vez o fenômeno da radioatividade, mas o termo "radioatividade" foi cunhado por Marie Curie.
Marie Curie descobriu os elementos radioativos, nomeadamente Polônio e Rádio, em 1898.
Por sua descoberta, Marie Curie ganhou o Prêmio Nobel.
Raios Radioativos
Após longos anos de experimentos, Ernest Rutherford junto com seu colega (Hans Geiger e seu aluno Ernest Marsden), descobriu os raios alfa, os raios beta e os raios gama.
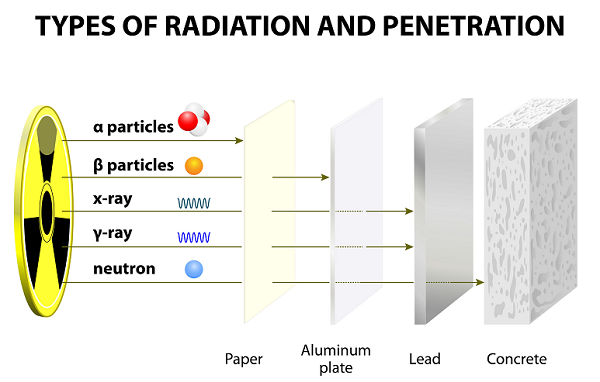
Esses raios emitidos como resultado da desintegração dos átomos.
Partículas Alfa (α)
As partículas alfa são geralmente compostas de dois prótons e dois nêutrons, que estão fortemente unidos.
Partículas alfa estão sendo liberadas durante o decaimento radioativo (ou decaimento alfa) dos radionuclídeos do núcleo.
As partículas alfa são idênticas ao núcleo do átomo de hélio normal ou do átomo de hélio duplamente ionizado.
Em comparação com outras partículas (ou seja, gama e beta), as partículas alfa são pesadas e lentas. Portanto, as partículas alfa têm um alcance muito pequeno no ar.
Por causa da velocidade lenta, as partículas Alfa têm poderes de penetração muito fracos; essas partículas são interrompidas até por uma folha de papel fina (veja a imagem dada acima).
Por terem carga positiva dupla, as partículas alfa são altamente ionizantes.
Partículas Beta (β)
Partículas beta são os elétrons que se movem rapidamente, emitidos por alguns radionuclídeos durante o decaimento radioativo (também conhecido como decaimento beta).
As partículas beta são muito mais leves e carregam uma única carga negativa.
As partículas beta raramente são ionizantes do que as partículas alfa.
Por terem peso mais leve, as partículas beta podem viajar muito mais longe do que as partículas alfa; no entanto, as partículas beta podem ser interrompidas por várias folhas de papel ou uma folha de alumínio.
As partículas beta têm carga negativa e são atraídas por partículas com carga positiva.
Partículas Gama (ү)
Partículas gama são o feixe de alta energia, ou seja, energia eletromagnética (fóton) emitida pelos elementos radioativos durante o decaimento radioativo.
Entre todas as três partículas (alfa, beta e gama), as partículas gama são os fótons mais energéticos.
Partículas gama, que são a forma de radiação eletromagnética (EMR), se originam do núcleo.
Os comprimentos de onda da gama são os mais curtos entre os três.
As partículas gama não têm carga e são neutras; portanto, eles não são afetados por campos magnéticos e elétricos.
Usos de elementos radioativos
Elementos radioativos são usados em -
Campo médico (tratamento de muitas doenças)
Processo industrial
Produção de energia - Reatores nucleares
Introdução
As reações nucleares liberam uma quantidade enorme de energia (conhecida como energia nuclear), que está sendo usada para produzir eletricidade em uma usina nuclear.

A energia nuclear normalmente produzida por nuclear fission, nuclear fusion, e nuclear decay.
Em 1938, os químicos alemães Otto Hahn, Fritz Strassmann e a física austríaca Lise Meitner conduziram os experimentos em que os produtos do urânio bombardeado com nêutrons. Como resultado desse experimento, o nêutron relativamente pequeno dividiu o núcleo dos átomos massivos de urânio em duas partes aproximadamente iguais e liberou energia massiva.
Os experimentos nucleares de Otto Hahn e seus colegas são populares como fissão nuclear.
Ficão nuclear
O processo de fissão nuclear produz nêutrons livres e fótons gama, enquanto isso também libera uma grande quantidade de energia.
A fissão nuclear é uma reação exotérmica, que pode liberar grandes quantidades de energia nas formas de radiação eletromagnética e também energia cinética.
A fissão nuclear, às vezes, pode ocorrer naturalmente (ou seja, sem bombardeio de nêutrons) como um tipo de decaimento radioativo.
Tipos de fissão nuclear
A seguir estão os principais tipos de fissão nuclear -
Chain Reaction and
Fission Reaction
Vamos discuti-los em breve -
Reação em cadeia
Quando uma única reação nuclear causa uma ou mais reações nucleares subsequentes, é conhecida como reação em cadeia.
Essa reação em cadeia aumenta a possibilidade de uma série de reações nucleares autopropagadas.
As reações em cadeia nuclear liberam milhões de vezes mais energia por reação do que qualquer outra reação química; portanto, também é conhecido como reação em cadeia explosiva ou não controlada.
Quando um átomo pesado experimenta a fissão nuclear, ele normalmente se divide em dois ou mais fragmentos de fissão. Durante o processo, vários nêutrons livres, raios gama e neutrinos são emitidos e, finalmente, uma grande quantidade de energia é liberada.
A seguir estão os dois exemplos de reação em cadeia -
235 U + → fragmentos de fissão de nêutrons + 2,4 nêutrons + 192,9 MeV
235 Pu + → fragmentos de fissão de nêutrons + 2,9 nêutrons + 198,9 MeV
Na bomba atômica, a tecnologia de reação em cadeia é usada, pois exigia uma fonte consistente de energia.
Reações de Fissão
A reação de fissão na qual nêutrons (produzidos pela fissão de átomos de combustível) são usados para induzir ainda mais fissão para a liberação de energia sustentável, é conhecida como reações de fissão.
Essas reações são lentas e controláveis; portanto, também conhecido como reação em cadeia controlada.
O reator nuclear de produção de energia (eletricidade) é um exemplo ideal de reação em cadeia controlada.
Com base nas propriedades e no tipo de uso, a fissão / reação em cadeia controlada é classificada como -
Power reactors
Research reactors
Breeder reactors
Esses reatores de potência geralmente convertem a energia cinética dos produtos da fissão em calor; além disso, o calor é usado para aquecer um fluido de trabalho que aciona uma máquina de calor, que, em última análise, gera energia mecânica ou elétrica.
Componentes básicos do reator nuclear
A seguir estão os componentes essenciais de um reator nuclear -
Nuclear fuels- Tal como urânio ( 233 U, 235 U), tório (Th 232 ), plutônio (Pu 239 ).
Moderators- Usado para controlar os nêutrons emitidos. Por exemplo, água pesada, berílio, grafite, etc.
Coolant- É usado para resfriar o reator. Por exemplo, água, vapor, hélio, CO 2 , ar, metais fundidos, etc.
Control rods- É usado para interromper a reação de fissão. Por exemplo, bastões de cádmio ou boro são usados para esse fim.
Fusão nuclear
O processo pelo qual dois núcleos leves são fundidos para formar um núcleo pesado é conhecido como fusão nuclear; durante esse processo, uma enorme quantidade de energia está sendo liberada, conhecida como energia nuclear.
O melhor exemplo de fusão nuclear é - bomba de hidrogênio.
Uma bomba de hidrogênio é cerca de 1.000 vezes mais poderosa do que uma bomba atômica.
Introdução
O material (que pode ser um elemento, composto ou liga) que é caracteristicamente duro, brilhante, opaco e tem a propriedade de conduzir calor e eletricidade é conhecido como metal.
Os metais são encontrados naturalmente na crosta terrestre na forma impura, ou seja, minérios. E, é extraído por meio de processo de mineração.
Entre todos os 118 elementos conhecidos (da tabela periódica), cerca de 91 elementos são metais.

Características de metais
A seguir estão as características significativas dos metais -
Os metais são geralmente maleáveis - ou seja, sua forma pode ser alterada permanentemente sem quebrar e rachar.
Os metais são fusíveis - isso significa; pode ser fundido ou derretido facilmente.
Os metais são dúcteis - isso significa; pode ter qualquer formato, mesmo uma folha fina ou arame.
Os metais são bons condutores de calor e eletricidade; Mais alto, o chumbo é uma exceção, pois não transporta eletricidade.
Os metais reagem naturalmente com vários não-metais e formam compostos. Os metais podem reagir com bases e ácidos. Por exemplo, 4 Na + O 2 → 2 Na 2 O (óxido de sódio), etc.
Ligas
Uma liga é um produto da mistura de dois ou mais elementos em que o metal domina.
Para produzir ou fabricar um produto desejável, metais diferentes (em proporções diferentes) são misturados (ou seja, ligas). Por exemplo, ligas de ferro, nomeadamente aço inoxidável, ferro fundido, chapas de liga, etc. contribuem com uma grande proporção tanto em quantidade como em valor comercial.
Os metais são geralmente feitos de ligas com o objetivo de torná-los mais resistentes à corrosão, menos quebradiços, para dar cores atraentes, etc.
Terminologias de Metal
Base Metal- Em química, o significado de metal básico é - o metal que pode ser facilmente oxidado ou corroído, bem como reage facilmente com HCl (ácido clorídrico diluído) e forma hidrogênio. Por exemplo, ferro, níquel, zinco, chumbo, etc.
Ferrous Metal- "Ferroso" é uma palavra latina, que significa a substância "contendo ferro". Por exemplo, aço, etc.
Heavy Metal- O metal que é muito mais denso do que o metal normal é classificado como metal pesado. Os metais pesados são tóxicos ou venenosos em baixas concentrações. Por exemplo, mercúrio (Hg), arsênio (As), cromo (Cr), cádmio (Cd), tálio (Tl) e chumbo (Pb).
Precious Metal- Os elementos metálicos, que possuem raro elemento químico metálico de alto valor econômico, são categorizados como metais preciosos. Por exemplo, platina, ouro, prata, paládio, etc.
Noble Metal- Os metais resistentes à corrosão ou oxidação. Por exemplo, rutênio (Ru), ródio (Rh), paládio (Pd), etc.
Aplicação de Metais
A seguir estão as aplicações significativas dos metais -
Como os metais são bons condutores de calor e eletricidade; portanto, é usado como fio elétrico e em muitos outros aparelhos elétricos, incluindo motores elétricos, etc. Por exemplo, cobre, prata, alumínio, etc.
Os metais pesados estão sendo usados na construção de pontes, piscinas e para muitos desses fins.
Muitos metais são usados para fabricar vários itens domésticos, como utensílios, potes, fogões, etc.
Os metais são freqüentemente usados para fabricar muitos tipos de ferramentas, desde uma simples chave de fenda até um pesado rolo de haste.
Os metais preciosos têm uma aparência bonita e são atraentes (por exemplo, ouro, prata, etc.); portanto, eles são usados como ornamentos.
Algum metal específico é usado para dissipadores de calor que protegem o equipamento sensível de superaquecimento.
Metais radioativos (por exemplo, urânio e plutônio) são usados na geração de energia nuclear.
O mercúrio é um metal que permanece na forma líquida à temperatura ambiente; ele é usado em termômetro.
O ramo da ciência e tecnologia que estuda as propriedades dos metais e sua produção e purificação é conhecido como metallurgy.
A substância inorgânica sólida de ocorrência natural é conhecida como um mineral.
O material sólido de ocorrência natural a partir do qual um mineral ou metal valioso pode ser extraído é conhecido como ore.
A tabela a seguir ilustra os principais elementos e seus minérios -
| Elemento | Minérios | Composição química |
|---|---|---|
| Alumínio | Bauxita | Al 2 O 3 2H 2 O |
| Corindo | Al 2 O 3 | |
| Kryolite | Na 3 AlF 6 | |
| Dispore | Al 2 O 3 .H 2 O | |
| Cobre | Pirita de cobre | CuFeS 2 |
| Malaquita | 2CuCO 3 Cu (OH) 2 | |
| Ferro | Hematita | Fe 2 O 3 |
| Magnetita | Fe 3 O 4 | |
| Siderite | FeCO 3 | |
| Sódio | Carbonato de Sódio | Na 2 CO 3 |
| Cloreto de Sódio | NaCl | |
| Nitrato de Sódio | NaNO 3 | |
| Sulfato de sódio | Na 2 SO 4 | |
| Potássio | Cloreto de Potássio | KCl |
| Carbonato de potássio | K 2 CO 3 | |
| Nitrato de potássio | KNO 3 | |
| Magnésio | Magnesita | MgCO 3 |
| Dolomite | CaMg (CO 3 ) 2 | |
| Sal Epsom | MgSO 4 | |
| Cálcio | Carbonato de cálcio | CaCO 3 |
| Lata | Cassiterita | SnO 2 |
| Conduzir | Galena | PbS |
| Cerussita | PbCO 3 | |
| Anglesite | PbSO 4 | |
| Prata | Argentino | Ag 2 S |
| Tetraedrito | Sb 4 S 3 | |
| Zinco | Carbonato de zinco (conhecido como calamina) | ZnCO 3 |
| Sulfeto de zinco | ZnS | |
| Mercúrio | Cinnabar | HgS |
| Manganês | Pirolusita | MnO 2 |
| Fósforo | Fosforito | Ca 3 (PO 4 ) 2 |
| Fluorapatita | Ca 5 (PO 4 ) 3 F | |
| Clorapatita | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Ouro | Calaverite | AuTe 2 |
| Sylvanite | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| Antimônio | Stibnite | Sb 2 S 3 |
| Estibiconita | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Cobalto | Cobaltita | CoAsS |
| Níquel | Pentlandita | ((Ni, Fe) S) |
| Cromo | Cromita | (FeCr 2 O 4 ) |
Introdução
O sódio é um metal alcalino macio, prateado e altamente reativo.
Na tabela periódica, o sódio é mantido no grupo 1, pois possui um único elétron em sua camada externa.
O símbolo do sódio é 'Na,'que na verdade foi tirado da palavra latina ‘natrium.’
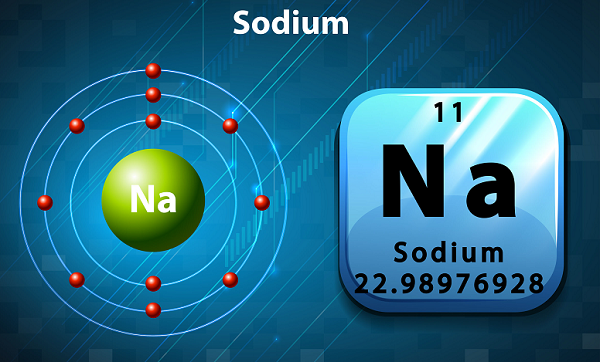
Em termos de abundância, o sódio é o sexto elemento encontrado na crosta terrestre.
O sódio existe em vários minerais, incluindo feldspatos, sodalita e sal-gema (NaCl).
Em 1807, Humphry Davy isolou o sódio pela primeira vez pela eletrólise do hidróxido de sódio.
Até o momento, 20 isótopos de sódio são conhecidos, mas entre todos, apenas 23 Na é estável.
Características salientes do sódio
A seguir estão as principais características do elemento sódio -
O sódio metálico é um elemento macio que pode ser facilmente cortado com uma faca.
O sódio é um bom condutor de calor e eletricidade.
Por ter baixa massa atômica e grande raio atômico, o sódio é um dos elementos menos densos (terceiro elemento menos denso - os dois primeiros são o lítio e o potássio).
O sódio pode flutuar na água.
O sódio ao longo de seus compostos tem um brilho amarelo (veja a imagem abaixo).

Os compostos de sódio têm grande importância comercial e alta demanda nas indústrias de vidro, papel, sabão e têxteis.
Compostos de Sódio
A seguir estão alguns dos exemplos significativos de compostos de sódio -
Sal de mesa - (NaCl)
Carbonato de sódio - (Na 2 CO 3 )
Bicarbonato de sódio - (NaHCO 3 )
Soda cáustica - (NaOH)
Nitrato de sódio - (NaNO 3 )
Tiossulfato de sódio - (Na 2 S 2 O 3 · 5H 2 O)
Bórax - (Na 2 B 4 O 7 · 10H 2 O)
Ocorrência de sódio
A crosta terrestre contém cerca de 2,27% de sódio.
Sódio é o 5 th mais abundante de metal; outros quatro são alumínio, ferro, cálcio e magnésio.
Na água oceânica, cerca de 1,08 × 104 miligramas de sódio por litro.
O sódio não se encontra como elemento puro, pois é altamente reativo.
Usos do sódio
A seguir estão os principais usos do sódio -
O cloreto de sódio é altamente útil para anticongelante e descongelante, bem como conservante.
Na culinária, o bicarbonato de sódio é usado.
O sódio e alguns de seus compostos são usados em medicamentos.
Em comparação com o potássio (que é um íon melhor), o sódio é mais utilizado devido ao seu menor preço e peso atômico.
Na química orgânica, o hidreto de sódio é usado como várias reações.
O sódio metálico é usado principalmente para a produção de boro-hidreto de sódio, trifenilfosfina de sódio, azida, índigo, etc.
Em alguns reatores rápidos, o sódio líquido é usado como fluido de transferência de calor por ter a propriedade de boa condutividade térmica.
O sódio também é um mineral essencial para a saúde humana, pois regula a pressão arterial, o volume sanguíneo, o equilíbrio osmótico e o valor do pH.
A quantidade mínima de 500 miligramas de sódio é necessária todos os dias para um corpo humano saudável.
Introdução
O cálcio é um elemento alcalino amarelo-acinzentado suave encontrado principalmente na crosta terrestre.
O símbolo do cálcio é “Ca” e o número atômico é “20.”
O cálcio livre quase não existe na natureza, pois é altamente reativo.
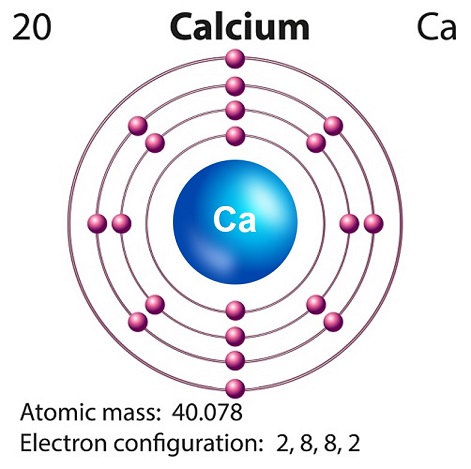
O cálcio é produzido geralmente na nucleossíntese de supernova.
Características salientes do cálcio
O cálcio é um dos metais mais abundantes em massa encontrado em muitos animais.
O cálcio é um constituinte muito importante dos dentes, ossos e conchas.
O carbonato de cálcio e o citrato de cálcio são os principais suplementos dietéticos necessários para uma boa saúde.
A Organização Mundial da Saúde (OMS) listou o cálcio como medicamento essencial.
Em comparação com outros metais, o íon cálcio e a maioria dos outros compostos de cálcio têm baixa toxicidade.
Se o cálcio entrar em contato com água ou ácido, ele reage com eles e se torna perigoso.
Se o cálcio entrar em contato com o ar, ele reage rapidamente e forma uma camada cinza-esbranquiçada de nitreto de cálcio e óxido de cálcio.
A maioria dos sais de cálcio são normalmente incolores.
Quando o cálcio queima, a cor de sua chama fica vermelha de tijolo (veja a imagem abaixo).

O metal de cálcio tem comparativamente uma resistividade elétrica mais alta do que o alumínio ou cobre.
Ocorrência
O cálcio ocorre geralmente em rochas sedimentares.
Os minerais (sedimentares) nos quais o cálcio é encontrado são calcita, dolomita e gesso.
O cálcio também é encontrado em rochas ígneas e metamórficas, principalmente em minerais silicatados, como anfibólios, plagioclásios, piroxênios e granadas.
O cálcio também é encontrado em muitos produtos alimentícios, como laticínios, amêndoas, avelãs, grãos de soja, brócolis, folhas de dente-de-leão, figos e em muitos mais.
Compostos de Cálcio
Óxido de cálcio - CaO
Hidróxido de cálcio - Ca (OH) 2
Cloreto de cálcio - CaCl 2
Hipoclorito de cálcio (pó clareador) - Ca (ClO) 2
Fosfato de cálcio - Ca 3 (PO 4 ) 2
Usos do cálcio
O cálcio tem uma ampla gama de uso, muitos deles são -
O carbonato de cálcio (CaCO 3 ) é usado na fabricação de cimento.
O carbonato de cálcio (CaCO 3 ) também é usado na fabricação de pasta de dente.
Em inseticidas, o arseniato de cálcio (Ca 3 (AsO 4 ) 2 ) é usado.
O cloreto de cálcio (CaCl 2 ) é usado na remoção de gelo e também no controle de poeira.
Citrato de cálcio (Ca 3 (C 6 H 5 O 7 ) 2 ) é comumente usado como conservante de alimentos.
O gluconato de cálcio (Ca (C 6 H 11 O 7 ) 2 ) é freqüentemente usado como aditivo alimentar e também em pílulas de vitaminas.
O hipoclorito de cálcio (Ca (OCl) 2 ) é geralmente usado como desinfetante de piscinas, como agente clareador.
Introdução
O metal com propriedade de cor branco prateado, macio, não magnético e dúctil é conhecido como alumínio.
O símbolo do alumínio é ‘Al’ e seu número atômico é ‘13.’
O elemento químico alumínio pertence ao grupo do boro.

- A bauxita é o principal minério do alumínio.
Características Salientes do Alumínio
O metal alumínio é um elemento quimicamente reativo.
O alumínio tem potencial para resistir à corrosão e o processo dessa resistividade é conhecido como passivação.
O alumínio é um metal comparativamente durável, leve, macio, maleável e dúctil.
O alumínio não é magnético e não se inflama facilmente.
Um filme de alumínio é um refletor muito bom da luz visível, pois reflete mais de 90% dos raios incidentes.
O alumínio geralmente reage com a água e forma hidrogênio.
O alumínio é o metal de baixa densidade e tem a propriedade de resistir à corrosão.
O alumínio tem a propriedade de calor e condutividade elétrica e, portanto, é um bom condutor.
Ocorrência de Alumínio
O alumínio constitui (cerca de) 8 por cento da crosta terrestre.
Depois do oxigênio e do silício, o alumínio é o terceiro elemento mais abundante; no entanto, é o metal mais abundante na crosta.
Quando o hidrogênio se funde com o magnésio, ele cria um alumínio estável.
Alumínio naturalmente encontrado em estados de óxidos ou silicatos.
Compostos de Alumínio
A seguir estão os principais compostos de alumínio -
Alumina - Al 2 O 3
Cloreto de alumínio - AlCl 3
Sulfato de alumínio - Al 2 (SO 4 ) 3
Hidróxido de alumínio - Al (OH) 3
Carboneto de alumínio - Al 4 C 3
Uso de Alumínio
O alumínio tem uma ampla gama de utilizações nas indústrias e também na vida cotidiana; significativo deles são -
O alumínio é usado nas indústrias de transporte, como ferrovias, automóveis, aeronaves, espaçonaves, caminhões, embarcações marítimas, bicicletas, etc.
O alumínio é usado na embalagem de alguns materiais específicos.
O alumínio é utilizado na construção de portas, janelas, arames, revestimentos, telhados, etc.
O alumínio é amplamente utilizado na fabricação de fios elétricos.
O alumínio é usado na fabricação de eletrodomésticos e muitos outros itens domésticos, como utensílios de cozinha.
O alumínio é usado em tacos de beisebol, relógios e muitos outros tipos de animais.
O alumínio é usado em equipamentos fotográficos.
O alumínio é usado em aparelhos eletrônicos.
O alumínio é usado como refletor de luz, pois é um bom refletor de luz; basicamente, alguns dos materiais são revestidos de alumínio especialmente para refletir a luz.
O alumínio é usado na produção de gás hidrogênio por reação com ácido clorídrico.
O alumínio é utilizado na fabricação de instrumentos musicais.
Introdução
O magnésio é um elemento sólido cinza brilhante.
O símbolo do magnésio é ‘Mg’ e o número atômico é ‘12.’

Com aproximadamente 80% do mercado mundial, a China é o maior fornecedor de magnésio.
Características salientes do magnésio
A densidade do magnésio é dois terços da densidade do alumínio.
Entre todos os metais alcalinos da Terra, o magnésio tem o ponto de fusão mais baixo (ou seja, cerca de 1.202 0 F) e o ponto de ebulição mais baixo (cerca de 1.994 0 F).
O magnésio geralmente reage com a água à temperatura ambiente.
Às vezes, o magnésio também é usado como um dispositivo de ignição para a termite.
O magnésio, quando queima no ar, produz uma luz branca brilhante, que também inclui fortes comprimentos de onda ultravioleta.

O magnésio, quando queima, produz uma luz branca e brilhante intensa (veja a imagem acima).
Ocorrência de magnésio
Em massa, o magnésio é o oitavo elemento mais abundante encontrado na crosta terrestre.
O magnésio é geralmente encontrado em grandes depósitos de magnesita, dolomita e outros minerais semelhantes.
O íon magnésio solúvel é encontrado na água mineral.
Depois do sódio e do cloro, o magnésio é o terceiro elemento mais abundante dissolvido na água do mar.
O magnésio ocorre naturalmente apenas em combinação com alguns outros elementos.
Por massa, o magnésio é o 11 th elemento mais abundante no corpo humano e é essencial para todas as células e enzimas.
Os íons de magnésio freqüentemente interagem com compostos polifosfato, incluindo ATP, DNA e RNA.
Compostos de Magnésio
A seguir estão os principais compostos de magnésio -
Carbonato de magnésio - MgCO 3
Cloreto de magnésio - MgCl 2
Citrato de magnésio - C 6 H 6 MgO 7
Hidróxido de magnésio - Mg (OH) 2
Óxido de magnésio - MgO
Sulfato de magnésio - MgSO 4
Sulfato de magnésio heptahidratado - (MgSO 4 · 7H 2 O)
O sulfato de magnésio heptahidratado é comumente conhecido como Epsom salt.
Usos de magnésio
O magnésio tem uma ampla gama de uso em nossas vidas; no entanto, alguns usos significativos de magnésio são -
Depois do ferro e do alumínio, o magnésio é o terceiro elemento mais comumente usado.
O magnésio é especialmente usado em ligas e materiais superfortes e leves.
O magnésio também é usado como material de motor na indústria aeronáutica.
O magnésio também é usado para purificar os solventes; tal como na preparação do etanol super-seco.
Muitas das grandes marcas automotivas, incluindo Mercedes, Porsche, BMW, Volkswagen, Chevrolet, etc. usam magnésio na fabricação de seus carros de alta qualidade.
Por ter baixo peso e boas propriedades elétricas e mecânicas, o magnésio é comumente usado na fabricação de laptops e tablets, telefones celulares, câmeras e muitos outros componentes eletrônicos.
O sulfito de magnésio é geralmente usado na fabricação de papel.
Introdução
O manganês é um elemento químico geralmente encontrado em combinação com o ferro.
O símbolo do manganês é ‘Mn’ e o número atômico é ’25.’
O manganês é um metal muito importante para o uso industrial.

Em 1774, Johan Gottlieb Gahn, pela primeira vez isolou uma amostra impura de metal manganês em 1774.
Características do manganês
A seguir estão as principais características e características do manganês -
Semelhante ao ferro, o manganês é um metal cinza prateado.
O manganês pode ser oxidado facilmente, mas é muito difícil fundi-lo, pois é muito duro e quebradiço.
No ar, o manganês fica manchado lentamente (oxidação).
O manganês é um elemento que faz parte do grupo do ferro.
Ocorrência de Manganês
O manganês é o 12 º elemento mais abundante da crosta terrestre.
O solo geralmente contém cerca de 7–9000 ppm de manganês com uma média de 440 ppm.
A água do mar tem apenas cerca de 10 ppm de manganês; enquanto que a atmosfera contém cerca de 0,01 µg / m3.
A pirolusita (MnO 2 ) é o minério mais importante de manganês.
Compostos de Manganês
A seguir estão os principais compostos de manganês -
Óxido de manganês (II) - MnO
Óxido de manganês (I) - Mn 2 O 3
Dióxido de manganês - MnO 2
Cloreto de manganês - MnCl 2
Permanganato de potássio - KMnO 4
Sulfato de manganês (II) - MnSO 4
Carbonato de manganês (II) - MnCO 3
Sulfeto de manganês (II) - MnS
Nitrato de manganês (II) - Mn (NO 3 ) 2
Brometo de manganês (II) - MnBr 2
Heptoxido de manganês - Mn 2 O 7
Decacarbonil de dimanganês - C 10 O 10 Mn 2
Iodeto de manganês (II) - MnI 2
Fluoreto de manganês (II) - MnF 2
Usos do manganês
A seguir estão os principais usos do manganês -
O manganês é um dos constituintes mais essenciais da produção de aço.
A fosfatação de manganês é comumente usada para a prevenção de ferrugem e corrosão em aço.
Em biologia, os íons manganês (II) atuam como cofatores para uma grande variedade de enzimas.
O manganês também é importante no fenômeno de evolução do oxigênio das plantas fotossintéticas.
O dióxido de manganês também é usado na fabricação de oxigênio e cloro e na secagem de tintas pretas.
Introdução
O ferro é o elemento mais comum encontrado principalmente no núcleo externo e interno da Terra.
O símbolo do ferro é ‘Fe’ e o número atômico é ‘26.’

O ferro é um dos primeiros elementos conhecidos que está sendo usado por seres humanos.
Características Salientes do Ferro
A seguir estão as principais características do ferro -
O elemento de ferro puro é macio, dúctil e maleável.
O ponto de ebulição do ferro varia entre 1533 0 C e 2450 0 C.
O ferro é facilmente atraído para o ímã.
No ar seco, o ferro permanece inativo e não reage (com o ar); no entanto, no ar úmido, ele reage e forma ferrugem.
O ferro puro normalmente não reage com a água pura; no entanto, ele reage facilmente com formas comuns de água poluída e ferrugem.
Ferro reage com halogênio e enxofre para formar haleto e sulfureto de acordo.
Ocorrência de Ferro
Os núcleos interno e externo da Terra são em grande parte compostos de ferro e níquel.
Muito provavelmente, o ferro é o elemento mais abundantemente disponível da terra; no entanto, é o quarto elemento mais abundantemente disponível da crosta.
Tipos de Ferro
A seguir estão os principais tipos de ferro -
Hematita - Fe 2 O 3
Magnetita - Fe 3 O 4
Siderita - FeCO 3
Compostos de Ferro
A seguir estão os principais compostos de ferro -
Óxido de ferro (II) - FeO
Cloreto de ferro (III) - FeCl 3
Óxido-hidróxido de ferro (III) - Fe (OH) 3
Sulfeto de ferro (II) - FeS
Cloreto de ferro (II) - FeCl 2
Fosfato de ferro - FePO 4
Ferrato (VI) - (FeO 4 ) 2-
Acetato de ferro (II) - Fe (C 2 H 3 O 2 ) 2
Sulfeto de ferro (III) - Fe 2 S 3
Cromato de ferro (III) - Fe 2 (CrO 4 ) 3
Hidróxido de ferro (II) - Fe (OH) 2
Acetato de ferro (III) - C 14 H 27 Fe 3 O
Oxalato de ferro (II) - FeC 2 O 4
Flureto de ferro (II) - FeF 2
Usos do Ferro
Entre todos os metais, o ferro é o mais amplamente utilizado (cerca de 90% da produção total de metal do mundo).
Na maioria das indústrias pesadas, o ferro é o elemento mais essencial.
Indústrias como ferrovias, construção naval, automóveis, construção de engenharia, etc., em todos os lugares, o ferro é essencialmente necessário.
Introdução
O cobre é um metal macio, dúctil e maleável.
O cobre tem uma condutividade térmica e elétrica muito alta.
O símbolo do cobre é ‘Cu’ e o número atômico é ’29.’

O cobre é conhecido pelas pessoas desde (cerca de) c. 8000 AC.
O cobre é o primeiro metal, que foi fundido de seu minério em torno de c. 5000 aC.
Características salientes do cobre
O cobre foi o primeiro metal a receber uma forma (em um molde).
O cobre foi o primeiro metal que foi ligado com sucesso a outro metal, por exemplo, cobre ligado a estanho e, conseqüentemente, o bronze foi preparado. É feito sobre c. 3500 AC.
Primeiro metal a ser propositalmente ligado a outro metal, o estanho, para criar o bronze, c. 3500 AC.
O cobre tem uma cor laranja avermelhada natural; é visível quando a sua superfície é exposta.
O cobre é um excelente condutor de eletricidade e calor.
O cobre é um elemento do grupo 11 da tabela periódica.
O cobre normalmente não reage com a água; no entanto, ele reage lentamente com o oxigênio atmosférico e forma uma camada de óxido de cobre marrom-escuro.
O óxido de cobre marrom-escuro geralmente protege o metal subjacente de corrosão adicional, assim como a passivação.
A passivação é o processo de utilização de uma leve camada de um material protetor, como óxido de metal, que é utilizado para criar uma casca protetora contra a corrosão.
Ocorrência de Cobre
O cobre é comumente encontrado na crosta terrestre.
Em 1857, foi descoberta a maior massa elementar de cobre (pesando cerca de 420 toneladas). Foi encontrado na Península Keweenaw, localizada em Michigan, EUA.
Ligas de Cobre
As ligas metálicas, que têm o cobre como principal constituinte, são conhecidas como ligas de cobre.
As ligas de cobre são altamente resistentes à corrosão.
O melhor exemplo (tradicional) de liga de cobre é o bronze (feito pela mistura de estanho e latão).
A seguir estão as principais ligas de cobre -
Brass
Bronze
Auricupride
Prata chinesa
Bronze de Corinto
Electrum, ouro verde
Ouro cinza
Niello
Panchaloha
Rosa, vermelho e ouro rosa
Spangold
Shibuichi
Prata tibetana
ouro Branco
Compostos de Cobre
A seguir estão os principais compostos do cobre -
Acetato cúprico - Cu (CH 3 COO) 2
Óxido de cobre (I) - Cu 2 O
Óxido de cobre (II) - CuO
Cloreto de cobre (II) - CuCl 2
Tri-hidróxido de cloreto de dicobre - Cu 2 (OH) 3 Cl
Cloreto de cobre (I) - CuCl
Nitrato de cobre (II) - Cu (NO 3 ) 2
Cianeto de cobre - CuCN
Usos do cobre
O cobre é amplamente utilizado na fabricação de fios elétricos.
O cobre é usado em motores elétricos.
O cobre é usado em telhados, encanamentos e em muitas outras indústrias.
A tinta de cobre é usada na pintura de barcos e muitos outros materiais.
Muitos dos eletrodomésticos são feitos de cobre puro ou suas ligas.
Introdução
A prata é uma transição macia e brilhante e metal branco.
A prata tem a maior condutividade elétrica e térmica; e, também tem a maior refletividade de qualquer metal.

O símbolo de prata é ‘Ag’ e o número atômico é ’47.’
Características salientes da prata
A prata é um metal precioso usado há muito tempo pelo ser humano.
A prata é um elemento do grupo 11 da tabela periódica.
Silver has an excellent white metallic luster commonly used in a high polish.
As silver has no color; therefore, it has high reflectivity (of light).
Silver has very high electrical and thermal conductivity. Its electric conductivity is the highest – higher than copper.
Among all the metals, silver also has the lowest contact resistance.
Occurrence of Silver
The metal silver is usually found in the Earth's crust in the pure form.
Silver also found as an alloy with the gold and some other metals.
Silver is also found in some minerals, such as argentite and chlorargyrite.
Silver is largely produced as a byproduct of gold, copper, zinc, lead, etc.
Alloys of Silver
Following are the major alloys of silver −
Argentium sterling silver
Britannia silver
Doré bullion
Electrum
Goloid
Platinum sterling
Sterling silver
Tibetan silver
Compounds of Silver
Following are the major compound of silver −
Silver chloride - AgCl
Silver iodide - Agl
Silver bromide - AgBr
Silver oxide - Ag2O
Silver sulfide - Ag2S
Silver fluoride - AgF
Silver cyanide - AgCN
Silver carbonate - Ag2CO3
Silver acetate - AgC2H3O2
Silver sulfate - Ag2SO4
Silver chromate - Ag2CrO4
Silver oxalate - Ag2C2O4
Silver chlorate - AgClO3
Uses of Silver
Following are the major uses of silver −
From the ancient period, silver is being used in making coins.
Silver is also used in making ornaments.
Many of the home pots and other utensils were also used to be made by silver.
Silver has also medicinal use, as it is used as an antibiotic coating in medical devices.
Because of having very high electric conductivity, silver is commonly used in some electronic devices.
Besides, silver has many other uses, such as in photography, in chemical equipment, nanoparticles, etc.
Introduction
Gold is a bright, reddish yellow, soft, dense, malleable, and ductile metal naturally found in the earth’s crust.
The symbol of gold is ‘Au’ and atomic number is ‘79.’

Gold is (chemically) a transition metal and belongs to group 11 of the periodic table.
Salient Features of Gold
Gold, which remains in a solid state under standard conditions, is the least reactive element.
Gold is resistant to most of the acids.
Gold does dissolve in aqua regia; aqua regia is a mixture of nitric acid and hydrochloric acid.
However, gold is insoluble in nitric acid.
Gold usually dissolves in alkaline solutions of cyanide.
Cyanide solutions are commonly used in mining and electroplating.
Gold also dissolves in mercury and forms ‘amalgam alloys.’
Gold does not react with oxygen at any temperature.
Occurrence of Gold
Gold commonly occurs as a free element i.e. in the natural form.
Gold occurs as nuggets or else found in in rocks, grains, in veins, and in some other alluvial deposits.
Gold also occurs in a solid solution forms with the native element such as silver (as electrum).
At some places, gold also naturally alloyed with copper and palladium.
Alloys of Gold
Following are the major alloys of gold −
Colored gold
Crown gold
Electrum
Rose gold
Tumbaga
White gold
Compounds of Gold
Following are the major compounds of the gold −
Gold (III) chloride - AuCl3
Gold (I) chloride - AuCl
Cyanide - CN
Chloroauric acid - HAuCl4
Gold (III) oxide - Au2O3
Gold bromide - AuBr
Aqua regia - HNO3+3HCl
Gold bromide - AuBr3
Gold (III) hydroxide - AuH3O3
Gold fluoride - AuF3
Gold (V) fluoride - AuF5
Gold sulfide - Au2S
Fulminating gold
Gold salts
Gold heptafluoride
Uses of Gold
Gold is one of the oldest elements that human being have been using for thousands of years.
As it is highly precious and provides a beautiful look, hence it is characteristically used in making ornaments.
As per the recent trend (of the world), about 50% gold is used in making jewelry, 40% used in investments, and remaining 10% is used in industry.
Introduction
Platinum is a malleable, ductile, dense, and highly unreactive chemical element.
The symbol of platinum is ‘Pt’ and its atomic number is ‘78.’

The name of platinum is derived from a Spanish term i.e. ‘platina,’ which means "little silver."
Platinum is the most precious and the rarest metal (element) on the earth.
Salient Features of Platinum
Following are the important features of the platinum −
Platinum is a silver white metal.
Platinum is an element of group 10 of the periodic table.
Platinum is one of the rarest elements in the crust of the earth.
Platinum is one of the least reactive elements.
Platinum has six natural isotopes.
Platinum is one of the most highly valuable and precious metals.
Platinum is characteristically resists corrosion in all conditions. Because of this reason, it is considered as noble metal.
Platinum is normally insoluble in nitric and hydrochloric acid, but dissolves in hot aqua regia.
After dissolving into the hot aqua regia, platinum gives aqueous chloroplatinic acid (see the image given below).

Occurrence of Platinum
Platinum is commonly found as the native (natural) platinum and as alloy with the other platinum-group.
Platinum usually occurs in the ores of nickel and copper.
Platinum also occurs naturally in the alluvial sands (commonly found in rivers).
Platinum occurs with the concentration of only (about) 0.005 ppm in the Earth's crust.
Alloys of Platinum
Platinum-iridium is one of the most significant alloys of platinum.
Compounds of Platinum
Following are the major compounds of platinum −
Platinum (II) chloride - Pt Cl2
Platinum (IV) chloride - PtCl4
Adam’s catalyst - PtO2
Platinum hexafluoride - PtF6
Potassium tetrachloropla - K2PtCl4
Krogmann’s salt - K2Pt(CN)4Br
Chloroplatinic acid - H2PtCl6
Sodium hexachloropl - Na2PtCl6
Aqua regia - HNO3+3HCl
Uses of Platinum
Platinum is used largely for vehicle emissions control devices.
Platinum is used in petroleum refining and many other chemical productions.
Platinum is used in electronic devices, such as in hard disk (drives).
Platinum is also used in jewelry.
Apart from all these usages, platinum is also used in medicine (anti-cancer drugs), glassmaking equipment, electrodes, turbine engines, investment, etc.
Introdução
Na tabela periódica, o zinco é o primeiro elemento do grupo 12.
O símbolo do zinco é ‘Zn’ e o número atômico é ‘30.’
Em termos de disponibilidade, o zinco é o 24 º elemento mais abundante na crosta terrestre e tem cinco isótopos estáveis.

O minério de zinco mais comum é a esfalerita (zinco blenda), que é um mineral de sulfeto de zinco.
Andreas Sigismund Marggraf, o químico alemão, descobriu o zinco metálico puro pela primeira vez em 1746.
Curiosamente, os alquimistas queimaram zinco no ar e formaram algo diferente e chamaram isso "philosopher's wool" ou "white snow. "
Características salientes do zinco
A cor do zinco é branco-azulado e é um metal brilhante e diamagnético.
O zinco metálico é normalmente duro e quebradiço; no entanto, a quando a temperatura aumenta de 100 0 C, que se torna maleável.
Quando a temperatura aumenta a 210 0 C, em seguida, o metal de zinco mais uma vez torna-se quebradiça e pode ser pulverizado facilmente por batimento.
O zinco é um condutor de eletricidade.
Ocorrência de Zinco
Zinco geralmente encontrado em associação com alguns outros metais básicos, como cobre e chumbo.
Esfalerita é uma forma de sulfeto de zinco e é o minério mais explorado.
Sphalerite contém cerca de 60 a 62% de zinco.
Ligas de Zinco
A seguir estão as principais ligas de zinco -
Brass
Níquel prata
Prata alemã
Compostos de Zinco
A seguir estão os principais compostos de zinco -
Óxido de zinco - ZnO
Sulfeto de zinco - ZnS
Halogenetos de zinco - ZnF 2
Nitrato de zinco - Zn (NO 3 ) 2
Clorato de zinco - Zn (ClO 3 ) 2
Sulfato de zinco - ZnSO 4
Fosfato de zinco - Zn 3 (PO 4 ) 2
Molibdato de zinco - ZnMoO 4
Cromato de zinco - ZnCrO 4
Arsenito de zinco - Zn (AsO 2 ) 2
Acetato de zinco - Zn (O 2 CCH 3 ) 2
Usos do zinco
O zinco é um dos elementos mais importantes para a saúde pública.
O zinco é amplamente utilizado como agente anticorrosivo e revestimento de materiais de ferro e aço.
O zinco é comumente usado como ânodo ou combustível da bateria de zinco-ar.
O óxido de zinco é amplamente utilizado como pigmento branco (veja a imagem abaixo) em tintas.

O óxido de zinco também é usado como catalisador na fabricação de borracha.
O zinco é um elemento essencial para nossa saúde; é normalmente usado como material suplementar nas formas de óxido de zinco, acetato de zinco ou gluconato de zinco.
O zinco é normalmente um material antioxidante.
A deficiência de zinco no corpo humano pode causar transtorno depressivo maior.
Após a lesão corporal, o zinco é usado para acelerar o processo de cicatrização.
A piritiona de zinco é comumente usada em xampus para prevenir a caspa.
O zinco quelatado costuma ser usado em dentifrícios e enxaguatórios bucais (líquidos), pois previne o mau hálito.
O zinco também protege a pele contra queimaduras solares, portanto, é usado em loções corporais.
Introdução
Mercúrio é um elemento químico, geralmente conhecido como 'quicksilver. '
Anteriormente, o mercúrio era denominado 'hydrargyrum. '
O símbolo do mercúrio é ‘Hg’ e o número atômico é ‘80.’

O vermelhão do pigmento vermelho é extraído pela moagem de cinabre natural ou sulfeto de mercúrio sintético.
Características Salientes de Mercúrio
O mercúrio é um metal pesado e branco prateado.
Mercúrio geralmente disponível no estado líquido; em condições normais, são poucos os elementos metálicos que permanecem no estado líquido à temperatura ambiente.
Mercúrio é um mau condutor de calor, mas é um bom condutor de eletricidade.
O ponto de congelamento do mercúrio é −38,83 0 C e o ponto de ebulição é 356,73 0 C.
Envenenamento por mercúrio causado pela ingestão de qualquer forma de mercúrio. Também é causado pela inalação de vapor de mercúrio.
O mercúrio dissolve muitos metais, incluindo ouro e prata, para formar amálgamas.
Ocorrência de Mercúrio
Mercúrio é um dos elementos mais raros da crosta terrestre.
Os minérios de mercúrio mais ricos contêm cerca de 2,5% de mercúrio (em termos de massa).
O mercúrio é encontrado como um elemento nativo (natural) ou em minerais corderoita, cinábrio, estonita viva, etc.
Mercúrio é encontrado na região do jovem cinturão de montanhas; o cinturão que segue forçando as rochas mais densas à crosta terrestre. Por exemplo, região vulcânica ou mesmo regiões de fontes termais.
Ligas de Mercúrio
O amálgama é a principal liga de mercúrio.
Compostos de Mercúrio
A seguir estão os principais compostos de Mercúrio -
Cloreto de mercúrio (II) - HgCl 2
Óxido de mercúrio (II) - HgO
Sulfeto de mercúrio - HgS
Mercúrio (I) - cloreto - Hg 2 Cl 2
Dimethylmer - C 2 H 6 Hg
Nitrato de mercúrio (II) - Hg (NO 3 ) 2
Acetato de mercúrio (II) - C 4 H 6 O 4 Hg
Sulfato de mercúrio (II) - HgSO 4
Iodeto de mercúrio (I) - Hg 2 I 2
Seleneto de mercúrio - HgSe
Fulminato de mercúrio (II) - Hg (CNO) 2
Brometo de mercúrio (II) - HgBr 2
Iodeto de mercúrio (II) - HgI 2
Óxido de mercúrio (I) - Hg 2 O
Fluoreto de mercúrio (I) - Hg 2 F 2
Amidocloreto de mercúrio - ClH 2 HgN
Dietilmercúrio - C 4 H 10 Hg
Usos de Mercúrio
O mercúrio é amplamente utilizado nas indústrias químicas.
O mercúrio é usado em aplicações elétricas e eletrônicas.
O mercúrio é usado nos termômetros que usamos para medir a temperatura.
O mercúrio junto com seus compostos são comumente usados em vários medicamentos.
Introdução
O plutônio é basicamente um metal actinídeo e tem uma aparência cinza-prateada.
O elemento, cujo número atômico varia entre 89 e 103, é conhecido como elemento actinídeo.
O símbolo do plutônio é ‘Pu’ e o número atômico é ‘94.’

O plutônio normalmente possui seis alótropos.
Plutônio é nomeado após 'Pluto. '
O plutônio foi descoberto pela primeira vez em 1940, por um grupo de cientistas nomeadamente Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan e Arthur C. Wahl.
Características salientes do plutônio
O plutônio é um elemento químico radioativo.
O plutônio, quando exposto ao ar, fica manchado e quando oxidado, forma um revestimento fosco.
O plutônio reage com muitos elementos, incluindo halogênios, nitrogênio, carbono, silício e hidrogênio.
Por causa do processo de fissão, os nêutrons são liberados e convertem núcleos de urânio-238 em plutônio-239.
O plutônio-239 e o plutônio-241 são físseis e, portanto, podem sustentar uma reação em cadeia nuclear. É muito bem aplicável em armas nucleares e reatores nucleares.
O ponto de fusão do plutônio é 640 0 C e seu ponto de ebulição é 3.228 0 C.
A liberação de núcleo de hélio (de alta energia) é a forma mais comum de decomposição radioativa do plutônio.
Ocorrência de plutônio
O plutônio encontrado naturalmente apenas em pequenas quantidades nos depósitos de urânio.
O plutônio também é extraído pela queima do urânio (durante o desenvolvimento da energia nuclear).
Ligas de Plutônio
A seguir estão as principais ligas de plutônio -
Plutônio-gálio é uma das ligas importantes de plutônio, bem como de gálio.
Plutônio-gálio é usado nos poços de armas nucleares.
Plutônio-gálio tem a propriedade de expansão térmica muito baixa.
Algumas outras ligas de plutônio são -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Compostos de Plutônio
Óxido de plutônio (IV) - PuO 2
Cloreto de plutônio (III) - PuCl 3
Tetrafluoreto de plutônio - PuF 4
Usos do plutônio
O isótopo plutônio-239 é um dos elementos significativos no desenvolvimento de armas nucleares.
O plutônio é usado como combustível nas usinas nucleares.
Introdução
O urânio é o metal da série actinídeo da tabela periódica.
O símbolo do urânio é ‘U’ e o número atômico é ’92.’
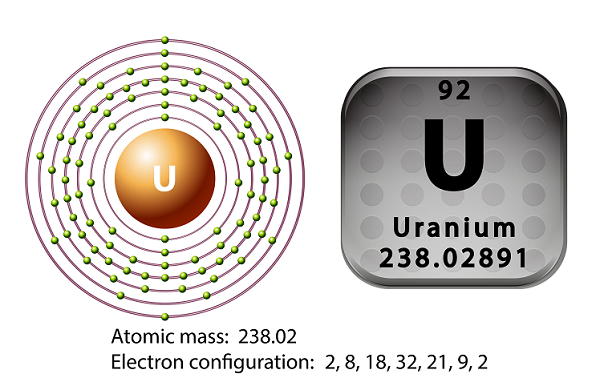
Em 1789, Martin Heinrich Klaproth descobriu o elemento urânio e o batizou com o nome de Urano.
Características salientes do urânio
O urânio é um metal branco prateado.
Um átomo de urânio tem 92 elétrons, bem como 92 prótons, dos quais 6 são elétrons de valência.
Por ter isótopos instáveis, o urânio é um elemento radioativo fraco.
O urânio-238 é o isótopo mais comum do urânio.
O urânio ocorre naturalmente em concentrações muito baixas, ou seja, algumas partes por milhão na rocha, solo e água.
O urânio decai gradualmente (lentamente), emitindo sua partícula alfa.
O urânio tem baixa condutividade elétrica (mau condutor de eletricidade).
O urânio é maleável, dúctil e marginalmente paramagnético
Ocorrência de Urânio
O urânio é (naturalmente) encontrado como urânio-238, urânio-235 e urânio-234.
A meia-vida do urânio-238 é de cerca de 4,47 bilhões de anos, quase a idade da Terra, e a meia-vida do urânio-235 é de cerca de 704 milhões de anos.
Ligas de Urânio
A seguir estão as principais ligas de urânio -
Staballoy
Hidreto de urânio
Compostos de Urânio
A seguir estão os principais compostos de urânio -
Nitreto de urânio - U 2 N 3
Pentafluoreto de urânio - UF 5
Carboneto de urânio - UC
Fluoreto de uranila - UO 2 F 2
Dióxido de urânio - UO 2
Hexafluoreto de urânio - UF 6
Oxtoxido de triurânio - U 3 O 8
Tetrafluoreto de urânio - UF 4
Trióxido de urânio - UO 3
Tetracloreto de urânio - Ucl 4
Nitrato de uranil - UO 2 (NO 3 ) 2
Usos do Urânio
O urânio é usado como fonte de energia em submarinos nucleares (especialmente por militares).
O urânio é usado na fabricação de armas nucleares.
O urânio também é usado como reatores para navios.
Introdução
O chumbo é um elemento químico pesado (metal), ou seja, tem alta densidade.
O símbolo de chumbo é ‘Pb’ e o número atômico é ‘82.’

O chumbo tem tendência para se ligar; da mesma forma, pode formar cadeias, ligações, anéis e estruturas poliédricas.
Características importantes do chumbo
O chumbo é um metal macio e maleável; tem ponto de fusão relativamente baixo.
O chumbo é um elemento relativamente não reativo e tem tendência a formar vínculo de aliança.
Quando o chumbo é cortado, aparece uma tonalidade branco-azulada.
Enquanto queima, o chumbo produz uma chama branco-azulada (veja a imagem abaixo).

Os compostos de chumbo são normalmente encontrados no estado de oxidação +2.
Ocorrência de chumbo
O chumbo é conhecido pelos povos pré-históricos da Ásia Ocidental.
O chumbo é encontrado na crosta terrestre; raramente é encontrado nas profundezas da terra.
O chumbo é geralmente encontrado em combinação com o enxofre.
Galena é o principal mineral de chumbo, encontrado principalmente em minérios de zinco.
Ligas de Chumbo
A seguir estão as principais ligas de chumbo -
Molibdochalkos (cobre)
Solda (estanho)
Terne (estanho)
Compostos de Chumbo
A seguir estão os principais compostos de chumbo -
Monóxido de chumbo - PbO
Dióxido de chumbo - PbO 2
Usos de chumbo
O chumbo tem sido usado na fabricação de balas há centenas de anos.
O chumbo é comumente usado como uma bainha de proteção para cabos subaquáticos (apenas porque tem a propriedade de resistência à corrosão).
Folhas de chumbo também são usadas como metais arquitetônicos, especialmente em material de cobertura.
O chumbo também é usado em baterias de ácido.
Os compostos de chumbo são comumente usados como agentes corantes e semicondutores.
Os compostos de chumbo também são usados em plásticos, velas, vidro, etc.
O chumbo é comumente usado no cloreto de polivinila (ou seja, usado no revestimento de cabos elétricos).
Precaução
A presença de chumbo (em qualidade excessiva) no corpo pode causar danos graves ao cérebro e aos rins; pode até causar a morte por último.
Introdução
O tório é um dos metais actinídeos radioativos que ocorrem naturalmente em grandes quantidades.
O símbolo do tório é ‘Th’ e o número atômico é ’90.’

Em 1829, um mineralogista norueguês Morten Thrane Esmark, descobriu o tório pela primeira vez.
Jöns Jacob Berzelius, o químico sueco, identificou e chamou de 'tório' após o nome de 'Thor', o deus nórdico do trovão.
Características salientes do tório
O tório é um metal actinídeo radioativo paramagnético e macio.
A cor do metal de tório é prateada; quando exposto ao ar, escurece e forma dióxido.
Todos os isótopos de tório são instáveis e é um elemento radioativo fraco.
Entre todos os elementos radioativos significativos, a meia-vida do tório é a mais longa, ou seja, cerca de 14,05 bilhões de anos.
O ponto de fusão é de cerca de tório 1750 0 C.
Ocorrência de Tório
Thorium é o elemento primordial que existe em sua forma atual desde antes da formação da Terra.
O tório, encontrado na crosta terrestre, é refinado nas areias monazíticas.
A monazita que ocorre em grandes quantidades em todo o mundo é a fonte mais importante de tório.
Ligas de Tório
Mag-Thor e tório-alumínio são as ligas mais significativas de tório, magnésio e alumínio.
Compostos de Tório
A seguir estão os principais compostos de tório -
Dióxido de tório - ThO 2
Sulfeto de tório (IV) - ThS 2
Iodeto de tório (IV) - ThI 4
Tetrafluoreto de tório - ThF 4
Tório (cloreto IV - ThCl 4
Carboneto de tório (IV) - ThC
Alguns outros são -
Thorite
Nitrato de tório (IV)
Ortossilicato de tório (IV)
Usos de Thorium
O tório é normalmente usado na soldagem a arco com gás tungstênio (GTAW) porque (tório) aumenta a força de alta temperatura dos eletrodos de tungstênio e, consequentemente, melhora a estabilidade do arco.
Em equipamentos eletrônicos, a aplicação de revestimento de tório em fio de tungstênio aumenta a emissão de elétrons de cátodos aquecidos.
Na indústria química, o dióxido de tório é ‘thoria’ é comumente usado.
Introdução
Na tabela periódica, o hidrogênio é o elemento mais leve, seu peso atômico é de apenas 1,008.
O símbolo do hidrogênio é ‘H’ e o número atômico é ‘1.’

No início dos anos 16 th século, gás de hidrogénio foi primeiro produzido artificialmente pela reacção de ácidos e metais.
Henry Cavendish reconheceu o gás hidrogênio como uma substância discreta durante o período de 1766-81, pois ele produz água quando é queimado.
Características salientes do hidrogênio
Em seu estado de plasma, as estrelas não remanescentes são compostas principalmente de hidrogênio.
Em temperatura e pressão padrão, o hidrogênio parece incolor, insípido, inodoro, não metálico, não tóxico e gás diatômico altamente combustível.
A fórmula molecular do hidrogênio é H 2 .
Na terra, o hidrogênio existe em formas moleculares, por exemplo, água ou outros compostos orgânicos.
O hidrogênio também desempenha um papel importante nas reações ácido-base.
O gás hidrogênio é altamente inflamável no ar.
Chamas de hidrogênio-oxigênio puro irradiam luz ultravioleta; além disso, com alta mistura de oxigênio são quase invisíveis a olho nu.
O hidrogênio pode reagir com quase todos os elementos oxidantes.
À temperatura ambiente, o hidrogênio normalmente reage espontânea e violentamente com o cloro e o flúor e forma os haletos de hidrogênio correspondentes.
Ocorrência de Hidrogênio
Consistindo em cerca de 75% de toda a massa bariônica, o hidrogênio é a subsistência química mais abundantemente encontrada no universo.
Em todo o universo, o hidrogênio é normalmente encontrado nos estados atômico e plasmático; no entanto, as propriedades são bastante diferentes daquelas do hidrogênio molecular.
Na Terra, o hidrogênio existe como gás diatômico, ou seja, H 2 .
Por ser leve, o hidrogênio escapa facilmente da atmosfera terrestre.
O hidrogênio é o terceiro elemento mais abundante encontrado na superfície da Terra, mas amplamente encontrado na forma de hidrocarbonetos e água.
Compostos de Hidrogênio
A seguir estão os principais compostos de hidrogênio -
Água - H 2 O
Amônia - NH 3
Cloreto de hidrogênio - HCl
Fluoreto de hidrogênio - HF
Sulfeto de hidrogênio - H 2 S
Metano - CH 4
Hidróxido - OH -
Brometo de hidrogênio - HBr
Iodeto de hidrogênio - HI
Cianeto de hidrogênio - HCN
Fosfina - PH 3
Seleneto de hidrogênio - H 2 Se
Metanol - CH 3 OH
Hidreto de lítio - LiH
Bicarbonato - HCO 3
Telureto de hidrogênio - H 2 Te
Hidrogênio líquido - H 2
Cianeto - CN
Hidreto de cálcio - CaH 2
Água pesada - D 2 O
Diborano - B 2 H 6
Hidreto de sódio - NaH
Hidreto de potássio - KH
Usos do hidrogênio
A maior quantidade de H 2 é usada no processamento de combustíveis fósseis, bem como na produção de amônia.
O hidrogênio (H 2 ) é amplamente utilizado nas indústrias química e de petróleo.
H 2 é tipicamente usado como um agente hidrogenante, especialmente para aumentar o nível de saturação de óleos e gorduras insaturadas.
H 2 também é usado como um gás de proteção em procedimentos de soldagem, como soldagem de hidrogênio atômico, etc.
Introdução
O hélio é o segundo elemento mais leve (depois do hidrogênio) e o segundo mais abundante no universo.
O símbolo do Hélio é ‘He’ e o número atômico é ‘2.’

Na tabela periódica, o Hélio é o primeiro do grupo dos gases nobres.
Hélio é nomeado após o nome do deus grego do Sol, 'Helios. '
Características Salientes do Hélio
O hélio é um gás incolor, inodoro, insípido, inerte, não tóxico e monoatômico.
O ponto de ebulição (-268,9 0 C) do hélio é o mais baixo entre todos os elementos.
O hélio é tipicamente composto de dois elétrons em orbitais atômicos e rodeado por um núcleo, que consiste em dois prótons e dois nêutrons.
Ocorrência de Hélio
A maior parte do hélio encontrado no universo pertence a helium-4, e acredita-se que tenha sido formado durante o Big Bang.
A maior parte do novo hélio é normalmente criada pela fusão nuclear do hidrogênio em estrelas, incluindo o sol.
Embora haja criação contínua de novo hélio; no entanto, a disponibilidade de hélio na terra é substancialmente baixa porque, sendo o elemento de peso leve, ele escapa facilmente para o espaço.
Na heterosfera (atmosfera externa) da Terra, o hélio é um dos elementos mais abundantemente encontrados (gases).
Na crosta terrestre, o hélio é caracteristicamente encontrado em grandes quantidades nos minerais de urânio e tório.
Compostos de Hélio
A seguir estão os principais compostos de hélio -
Heleto dissódico - Na 2 He
Cristobalite He II (silicatos) - SiO 2 He
Arsenolito diélio - As 4 O 6 • 2He
Isótopos de Hélio
Existem cerca de nove isótopos de hélio conhecidos, mas a seguir dois estão os isótopos mais estáveis -
Hélio-3 e
Helium-4
Usos de hélio
Por ter baixa densidade, baixo ponto de ebulição, baixa solubilidade, alta condutividade térmica, o hélio é um elemento amplamente utilizado; o exemplo mais popular é - uso de hélio no balão.
Grande parte do hélio tem aplicações criogênicas, como resfriamento de ímãs supercondutores usados em scanners de ressonância magnética e espectrômetros de RMN médicos.
O hélio também é usado como gás protetor no cultivo de cristais de silício e germânio.
O hélio também é usado na cromatografia de gás e na produção de titânio e zircônio.
O hélio é usado em túneis de vento supersônicos.
O hélio também é aplicado como gás de proteção em processos de soldagem a arco.
Introdução
O oxigênio é membro do grupo 16 da tabela periódica; no entanto, na maioria das vezes, é tratado de forma diferente de seu grupo.
O símbolo do oxigênio é ‘O’ e o número atômico é ‘8.’

O oxigênio tem cerca de nove alótropos e o alótropo mais comum é o oxigênio diatômico (ou seja, O 2 ). Outro alótropo importante é o ozônio, ou seja, O 3 .
O oxigênio, pela primeira vez, foi notado pelo farmacêutico sueco Carl Wilhelm Scheele.
Características salientes do oxigênio
O oxigênio é caracteristicamente classificado como membro do grupo “calcogênio”.
A palavra "calcogênio" é derivada de uma palavra grega “khalkόs, ”Que significa“ cobre ”e a palavra latina-grega“Genēs, ”Que significa nascido ou produzido.
O oxigênio é um gás altamente reativo (ou elemento não metálico); portanto, é um agente oxidante que forma óxidos prontamente com a maioria dos elementos e compostos.
O oxigênio tem seis elétrons de valência.
O ponto de fusão do oxigênio é -218,8 0 C e o ponto de ebulição é -183 0 C.
Ocorrência de oxigênio
Com cerca de 20,8 por cento de participação (no total de constituintes atmosféricos da Terra), o oxigênio é o segundo elemento classificado da atmosfera da Terra.
O oxigênio ocorre quase na esfera da terra, ou seja, atmosfera, hidrosfera e litosfera.
Durante o processo de fotossíntese, o oxigênio livre é produzido por todas as plantas verdes.
O oxigênio ocorre como minérios de cobre constituintes.
O corpo humano contém cerca de 65% de oxigênio.
Em massa, quase metade da crosta terrestre é composta de oxigênio (ou seja, seus óxidos).
Em massa, o oxigênio é o terceiro elemento mais abundante que se encontra no universo; o primeiro e o segundo são hidrogênio e hélio em conformidade.
O oxigênio (ou seja, O 2 ) é um gás diatômico incolor e inodoro.
O oxigênio se dissolve na água com muita facilidade; entretanto, a solubilidade do oxigênio na água depende da temperatura.
Compostos de Oxigênio
A seguir estão os principais compostos de oxigênio -
Oxide
Peroxide
Dióxido de carbono - CO 2
Hidróxido - OH -
Ozônio - O 3
Óxido de mercúrio (II) - HgO
Clorato - ClO 3
Óxido de alumínio - Al 2 O 3
Monóxido de carbono - CO
Hipoclorito - ClO -
Dióxido de silício - SiO 2
Ácido hipofluoroso - HOF
Peróxido de sódio - Na 2 O 2
Clorato de potássio - KClO 3
Difluoreto de oxigênio - OF 2
Óxido de sódio - Na 2 O
Usos de oxigênio
O oxigênio (O 2 ) é o requisito mais essencial para a respiração, sem ele a vida não pode ser imaginada.
O oxigênio é usado na medicina.
A oxigenoterapia é normalmente usada para tratar algumas doenças, como enfisema, pneumonia, algumas doenças cardíacas, etc.
Algumas das atividades subaquáticas, como mergulho, submarinos, etc. também usam oxigênio artificial.

Aeronaves, montanhistas, etc. também usam oxigênio artificial.
O oxigênio também é usado em algumas indústrias, por exemplo, na fundição de minério de ferro em aço - neste processo, cerca de 55% do oxigênio é usado.
Introdução
O carbono é um elemento não metálico e tetravalente.
Meios tetravalentes - o carbono disponibiliza quatro elétrons para formar as ligações químicas covalentes.
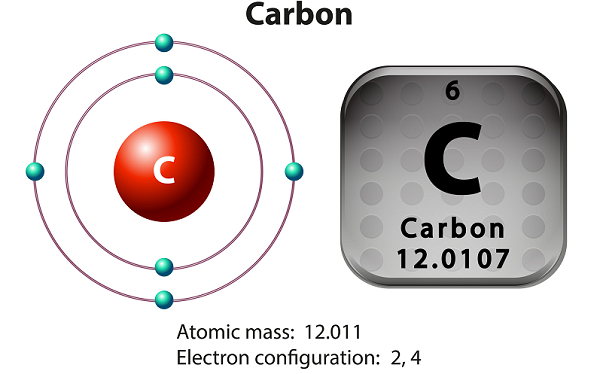
O carbono tem três isótopos que ocorrem naturalmente - a saber 12 C, 13 C e 14 C.
Entre eles, 12 C e 13 C são estáveis, mas 14 C é um isótopo radioativo. A meia-vida de 14 C é de cerca de 5.730 anos.
Características Salientes do Carbono
As propriedades físicas do carbono dependem muito de seus alótropos.
Os principais alótropos do carbono são grafite, diamante e carbono amorfo.
A grafite é opaca, preta e muito macia; portanto, costumava formar uma linha no papel.
Diamante muito duro (o material natural mais duro) e transparente.
O grafite é um bom condutor de eletricidade.
O diamante é um mau condutor de eletricidade.
O carbono provavelmente tem o ponto de sublimação mais alto entre todos os elementos.
Ocorrência de Carbono
Em termos de massa, o carbono é o quarto elemento químico mais abundante encontrado no universo (depois do hidrogênio, hélio e oxigênio).
O carbono está disponível em abundância no Sol, estrelas, cometas e na atmosfera da maioria dos planetas.
O carbono é encontrado na atmosfera terrestre e dissolvido na água.
Hidrocarbonetos, como carvão, petróleo e gás natural, todos eles contêm carbono.
O carbono também é encontrado nos hidratos de metano, que são encontrados nas regiões polares e no fundo do mar.
Algumas das rochas enriquecidas com carbono são carvão, calcário, dolomita, etc.
O carvão é muito rico em carbono; portanto, é a maior fonte comercial de carbono mineral.
O carvão compartilha cerca de 4.000 gigatoneladas ou 80% do combustível fóssil total.
Compostos de Carbono
A seguir estão os principais compostos de carbono -
Cianogênio - CN 2
Cianeto de hidrogênio - HCN
Cianamida - CN 2 H 2
Ácido isociânico - HNCO
Cloreto de cianogênio - CNCl
Isocianato de clorossulfonila - CNClO 3 S
Cloreto cianúrico - NCCl 3
Dissulfeto de carbono - CS 2
Sulfeto de carbonila - OCS
Monossulfeto de carbono - CS
Usos do Carbono
Dependendo dos alótropos, o carbono é usado em várias aplicações.
O carbono é um dos elementos mais essenciais da vida sem ele, não podemos imaginar a vida na terra.
Os combustíveis fósseis, nomeadamente o gás metano e o petróleo bruto (petróleo), o carvão, etc., são utilizados na vida quotidiana.
Grafite, combinada com argila, usada para fazer 'chumbo' usado em lápis.
O carvão vegetal também é usado como material de desenho em obras de arte, fundição de ferro, churrasqueiras, etc.
O diamante é geralmente usado em joias.
Os diamantes industriais são usados em ferramentas de corte, perfuração e polimento para usinagem de metais e pedra.
Hidrocarbonetos fósseis e fibra de carbono são usados na fabricação de plástico.
Introdução
O nitrogênio é um elemento químico do grupo de 15 da tabela periódica; entre todos os elementos do grupo 15, é o elemento mais leve.
O símbolo do nitrogênio é ‘N’ e o número atômico é 7.

Em 1772, o médico escocês Daniel Rutherford, primeiro descobriu e isolou o carbono.
No entanto, o nome 'nitrogênio' foi dado pela primeira vez por Jean-Antoine-Claude Chaptal em 1790.
Características salientes do nitrogênio
O nitrogênio tem dois isótopos estáveis, a saber 14 N e 15 N.
Os átomos de nitrogênio livres normalmente reagem facilmente com a maioria dos elementos e formam nitretos.
As moléculas de N 2 são incolores, inodoras, insípidas e gasosas diamagnéticas nas condições padrão.
O ponto de fusão do N 2 é −210 0 C e o ponto de ebulição é −196 0 C.
Os compostos de nitrogênio se intercambiam repetidamente entre a atmosfera e os organismos vivos, formando um ciclo de nitrogênio.
Ocorrência de nitrogênio
O nitrogênio é o elemento mais abundantemente encontrado na terra, pois constitui cerca de 78,1% de todo o volume da atmosfera terrestre.
Gás nitrogênio, que é um gás industrial, amplamente produzido pela destilação fracionada do ar líquido.
Compostos de Nitrogênio
A seguir estão os principais compostos de nitrogênio -
Amônio - NH 4+
Amônia - NH 3
Ácido nítrico - HNO 3
Nitrito - NÃO 2-
Dióxido de nitrogênio - NO 2
Pentroxido de dinitrogênio - N 2 O 5
Hidrazina - N 2 H 4
Dinitrogênio - N 2
Cianeto - CN
Nitrato de amônio - (NH 4 ) (NO 3 )
Tricloreto de nitrogênio - NCl 3
Trifluoreto de nitrogênio - NF 3
Triiodeto de nitrogênio - NI 3
Piridina - C 5 H 5 N
Íon nitrônio - NO 2+
Ácido hidrazóico - HN 3
Sulfato de amônio - (NH 4 ) 2 SO 4
Usos do nitrogênio
Os compostos de nitrogênio são amplamente usados em uma ampla variedade de campos e indústrias.
O nitrogênio puro é usado como aditivo alimentar.
Utilizado em sistemas de supressão de incêndio principalmente para equipamentos de tecnologia da informação.
Também utilizado na fabricação de aço inoxidável.
O nitrogênio também é usado para encher os pneus de algumas aeronaves e carros de corrida.
O nitrogênio líquido é usado como refrigerante.
As leis da natureza relacionadas à química são conhecidas como leis químicas.
As reações químicas, normalmente, são administradas por certas leis, que são observadas e formuladas em palavras tornam-se conceitos fundamentais na química.
A seguir estão as leis químicas significativas -
| Leis | Explicação |
|---|---|
| Lei de Avogadro | “Volumes iguais de todos os gases, na mesma temperatura e pressão, têm o mesmo número de moléculas” |
| Lei de Beer-Lambert (ou simplesmente lei de Beer ou lei de Lambert-Beer) | “Explica a atenuação da luz às propriedades do material por onde ela (a luz) passa” |
| Lei de Boyle | “A pressão absoluta exercida por uma dada massa de um gás ideal é inversamente proporcional ao volume que ocupa se a temperatura e a quantidade de gás permanecerem inalteradas dentro de um sistema fechado” |
| Lei de Charles (também conhecida como Lei do Volume) | “Quando a pressão em uma amostra de um gás seco é mantida constante, a temperatura Kelvin e o volume estarão diretamente relacionados” |
| Leis da Difusão de Fick | Descreve "difusão" (de fluxo) |
| Lei de Gay-Lussac | "Todos os gases têm a mesma expansividade térmica média em pressão constante na mesma faixa de temperatura" |
| Princípio de Le Chatelier ("A Lei do Equilíbrio") | “Quando qualquer sistema em equilíbrio está sujeito a mudança de concentração, temperatura, volume ou pressão, o sistema se reajusta para neutralizar (parcialmente) o efeito da mudança aplicada e um novo equilíbrio é estabelecido” |
| Lei de Henry | “A lei calcula a concentração de gás na solução sob pressão” |
| Lei de Hess | “A mudança de entalpia em uma reação química (ou seja, o calor da reação a pressão constante) é independente do caminho entre os estados inicial e final” |
| Lei da conservação de energia | “A energia não pode ser criada nem destruída” |
| Lei de Raoult | “A pressão de vapor parcial de cada componente de uma mistura ideal de líquidos é igual à pressão de vapor do componente puro multiplicada por sua fração molar na mistura” |
| Eletrólise da lei de Faraday | “A quantidade de substância produzida em um eletrodo é diretamente proporcional à quantidade de eletricidade passada” |
| Teoria atômica | “A matéria é composta de unidades distintas conhecidas como átomos” |
| Teoria Köhler | “Explica o processo em que o vapor de água se condensa e forma as gotas de nuvem líquida” |
| Equação de Van 't Hoff | “Descreve a mudança na constante de equilíbrio de uma reação química” |
| Teoria do Estado de Transição | “As taxas de reação das reações químicas elementares” |
| Lei de Grotthuss-Draper | “Ele descreve que a luz que é absorvida por um sistema / superfície pode trazer uma mudança fotoquímica” |
| Teoria Cinética de Gases | “Descreve o comportamento de um gás ideal hipotético” |
| Princípio Aufbau | “Explica que os elétrons orbitando os átomos primeiro preenchem os níveis de energia mais baixos e, em seguida, os níveis mais altos de segundo e assim por diante” |
| Regra de Hund | “Explica que cada orbital em um subnível é ocupado individualmente antes que qualquer orbital seja duplamente ocupado” |
| Teoria da Colisão | “Com base na teoria cinética dos gases, a teoria da colisão descreve que as reações químicas da fase gasosa ocorrem quando as moléculas colidem com energia cinética suficiente” |
Introdução
Provavelmente, o cobre foi o primeiro elemento, que foi extraído e usado por humanos.
A evidência do uso mais antigo do cobre foi encontrada na Anatólia, que pertence a 6.000 aC.
O chumbo foi provavelmente o segundo elemento que os humanos começaram a usar.
O mais antigo artefato de chumbo conhecido é a estatueta, que foi encontrada em um templo de Osiris, Abidos, Egito.
A estatueta do templo de Osíris pertence a (cerca de) 3.800 aC.
O mais antigo tesouro de ouro conhecido foi descoberto em Varna, Necrópolis (Bulgária).
Este tesouro de ouro pertence a (cerca de) 4.400 aC.
A descoberta da prata é quase igual à do ouro; sua evidência foi encontrada na Ásia Menor.
Algumas evidências dizem que o ferro era conhecido desde (cerca de) 5.000 aC.
Os objetos de ferro mais antigos conhecidos, usados pelos humanos, foram encontrados no Egito (pertence a 4000 aC).
A tabela a seguir ilustra os elementos significativos com sua data de descoberta e descobertas -
| Elemento | Descobridor | Data de Descoberta |
|---|---|---|
| Cobre | Oriente Médio (local) | Cerca de 9.000 AC |
| Conduzir | Egito (local) | Cerca de 7.000 AC |
| Ouro | Bulgária (local) | Cerca de 6.000 aC |
| Prata | Ásia Menor (local) | Cerca de 5.000 aC |
| Ferro | Egito (local) | Cerca de 5.000 aC |
| Lata | Cerca de 3.500 AC | |
| Enxofre | Chinês / Índia | Cerca de 2.000 AC |
| Mercúrio | Egito | 2.000 AC |
| Fósforo | H. Marca | 1669 |
| Cobalto | G. Brandt | 1735 |
| Platina | A. de Ulloa | 1748 |
| Níquel | F. Cronstedt | 1751 |
| Bismuto | CF Geoffroy | 1753 |
| Magnesium | J. Black | 1755 |
| Hydrogen | H. Cavendish | 1766 |
| Oxygen | W. Scheele | 1771 |
| Nitrogen | D. Rutherford | 1772 |
| Barium | W. Scheele | 1772 |
| Chlorine | W. Scheele | 1774 |
| Manganese | W. Scheele | 1774 |
| Molybdenum | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirconium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Beryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Boron | L. Gay-Lussac and L.J. Thénard | 1808 |
| Fluorine | A. M. Ampère | 1810 |
| Iodine | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S. L Hermann, F. Stromeyer, and J.C.H. Roloff | 1817 |
| Selenium | J. Berzelius and G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | H.C.Ørsted | 1825 |
| Bromine | J. Balard and C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen and G. R. Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich and T. Richter | 1863 |
| Helium | P. Janssen and N. Lockyer | 1868 |
| Neon | W. Ramsay and W. Travers | 1898 |
| Xenon | W. Ramsay and W. Travers | 1898 |
| Fermium | A. Ghiorso et al | 1952 |
| Nobelium | E. D. Donets, V. A. Shchegolev and V. A. Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris and P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
The following table illustrates significant elements and their valence −
| Element | Valence | Symbol | Atomic No. |
|---|---|---|---|
| Hydrogen | -1, +1 | H | 1 |
| Helium | 0 | He | 2 |
| Lithium | 1 | Li | 3 |
| Beryllium | 2 | Be | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Carbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oxygen | -1, -2, 0, 2, 1, | O | 8 |
| Fluorine | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminum | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphorus | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlorine | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Ca | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganese | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Iron | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Copper | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | As | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Bromine | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |