Химия - Углерод и его соединения
Введение
Углерод играет очень важную роль для всех живых существ.
Количество углерода в земной коре составляет всего 0,02%, он доступен в форме минералов, таких как карбонаты, гидрокарбонаты, уголь и нефть.
Присутствие углерода в атмосфере Земли составляет 0,03% в виде двуокиси углерода.
Соединения углерода
Почти все соединения углерода (за исключением некоторых) плохо проводят электричество.
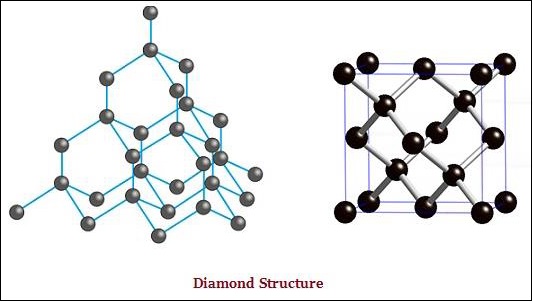
И алмаз, и графит образованы атомами углерода; однако различие между ними заключается в том, как атомы углерода связаны друг с другом.
В алмазе каждый атом углерода связан с четырьмя другими атомами углерода и образует жесткую трехмерную структуру (см. Изображение, приведенное ниже).
В графите каждый атом углерода связан с тремя другими атомами углерода в той же плоскости, что дает гексагональный массив (см. Изображение, приведенное ниже) -
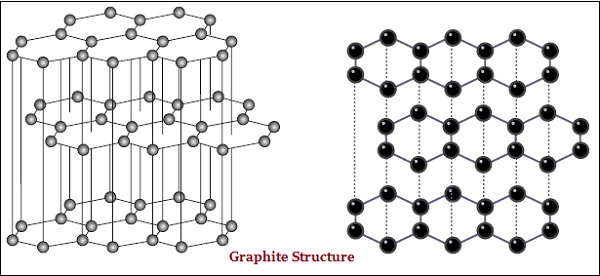
Существует также различие в некоторой физической структуре алмаза и графита.
Алмаз - самое твердое из известных веществ, а графит - гладкое и скользкое вещество.
Графит является хорошим проводником электричества, а алмаз - нет.
В следующей таблице показаны структуры соединений углерода и водорода.
| название | Формула | Состав |
|---|---|---|
| Метан | CH 4 |

|
| Этан | С 2 Н 6 |

|
| Пропан | С 3 Н 8 |

|
| Бутан | С 4 Н 10 |

|
| Пентан | С 5 Н 12 |

|
| Гексан | С 6 Н 14 |

|
Соединения, которые имеют идентичную молекулярную формулу, но разные структуры, известны как structural isomers (см. структуру бутана, приведенную ниже).

Насыщенные углеводороды известны как alkanes.
Ненасыщенные углеводороды, состоящие из одной или нескольких двойных связей, известны как alkenes.
Ненасыщенные углеводороды, состоящие из одной или нескольких тройных связей, известны как alkynes.
Использование алкоголя в качестве топлива
Заводы сахарного тростника очень эффективно преобразуют солнечный свет в химическую энергию, и его сок можно использовать для приготовления патоки.
При ферментации патоки образуется спирт (этанол).
Некоторые страны сейчас используют спирт в качестве добавки к бензину, поскольку это более чистое топливо.
Этот спирт при горении в достаточном количестве воздуха (кислорода) дает только углекислый газ и воду.
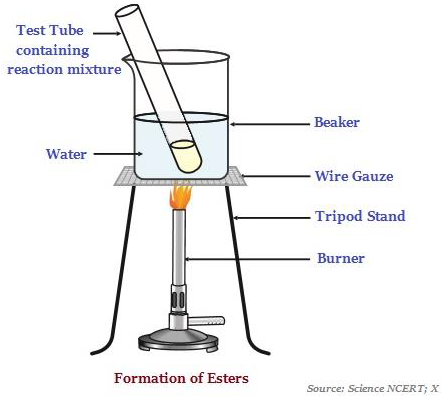
Сложные эфиры
Сложные эфиры - это вещества с приятным запахом, которые чаще всего образуются в результате реакции кислоты и спирта (см. Изображение ниже, иллюстрирующее образование сложных эфиров).
Когда сложные эфиры реагируют в присутствии кислоты или основания, они возвращают спирт и карбоновую кислоту.
Реакция сложных эфиров с кислотой или основанием известна как saponification потому что он используется при приготовлении мыла.
Молекулы мыла обычно представляют собой натриевые или калиевые соли длинноцепочечных карбоновых кислот.
Интересно, что ионный конец мыла растворяется в воде, тогда как углеродная цепь растворяется в масле. Эти типичные особенности молекул мыла образуют структуры, известные какmicelles (см. изображение ниже)

В мицеллах один конец молекул направлен к капле масла, тогда как ионный конец остается снаружи.
Мицелла мыла помогает растворять грязь в воде; Аналогичным образом очищается и одежда.
С другой стороны, моющие средства обычно представляют собой аммониевые или сульфонатные соли длинноцепочечных карбоновых кислот, которые остаются эффективными даже в жесткой воде.
Моющие средства обычно используются для приготовления шампуней и некоторых других средств для чистки одежды.