เคมีตอนที่ 1 - คู่มือฉบับย่อ
บทนำ
ทุกสิ่งที่พบในจักรวาลนี้ประกอบด้วยวัสดุบางอย่างนักวิทยาศาสตร์ตั้งชื่อให้ว่า “matter.” ตัวอย่างเช่นอาหารที่เรากินอากาศที่เราหายใจก้อนหินเมฆดวงดาวพืชสัตว์น้ำฝุ่นทุกอย่างถูกจัดประเภทเป็นสสาร
ลักษณะของอนุภาคของสสาร
อนุภาคของสสารมีขนาดเล็กมากโดยปกติไม่สามารถมองเห็นได้จากตาเปล่า

อนุภาคของสสารเคลื่อนที่อย่างต่อเนื่องซึ่งเรียกว่า “kinetic energy.”
พลังงานจลน์ของอนุภาคขึ้นอยู่กับอุณหภูมิโดยตรงเมื่ออุณหภูมิเพิ่มขึ้นความเร็วของการเคลื่อนที่ก็เพิ่มขึ้นด้วย
อนุภาคของสสารมีแรงดึงดูด ดังนั้นจึงดึงดูดซึ่งกันและกัน
แรงดึงดูดของอนุภาคทำให้อนุภาคอยู่ด้วยกัน อย่างไรก็ตามความแข็งแกร่งของแรงดึงดูดนั้นแตกต่างกันไปในแต่ละเรื่อง
สถานะของสสาร
สสารมีสามสถานะดังต่อไปนี้ -
Solid State
Liquid State
Gaseous State

มาคุยกันสั้น ๆ -
โซลิดสเตท
วัสดุที่เป็นของแข็งทั้งหมดมีรูปร่างที่แน่นอนขอบเขตที่แตกต่างกันและปริมาตรคงที่
วัสดุที่เป็นของแข็งส่วนใหญ่มีความสามารถในการบีบอัดเล็กน้อย
วัสดุที่เป็นของแข็งทั้งหมดมีแนวโน้มตามธรรมชาติในการรักษารูปร่างเมื่ออยู่ภายใต้แรงภายนอก
วัสดุที่เป็นของแข็งสามารถแตกหักได้ภายใต้แรงกระทำ แต่ยากที่จะเปลี่ยนรูปร่างเนื่องจากมีความแข็ง
สถานะของเหลว
ของเหลวไม่มีรูปร่างคงที่ต่างจากของแข็ง อย่างไรก็ตามมีปริมาตรคงที่
ของเหลวจะเป็นรูปร่างของภาชนะที่เก็บไว้
ของเหลวมีคุณสมบัติในการไหลและเปลี่ยนรูปร่าง
สถานะก๊าซ
สสารในรูปของอากาศซึ่งไม่เป็นของแข็งหรือของเหลวเรียกว่าแก๊ส ตัวอย่างเช่นออกซิเจนไนโตรเจนไฮโดรเจนเป็นต้น
ก๊าซไม่มีขนาดและรูปร่างที่แน่นอนแตกต่างจากของแข็ง
ก๊าซเช่นก๊าซปิโตรเลียมเหลว (LPG - ใช้ในการปรุงอาหาร) ก๊าซธรรมชาติอัด (CNG - ใช้เป็นเชื้อเพลิงในยานยนต์) ฯลฯ มีความสามารถในการบีบอัดสูง ดังนั้นก๊าซปริมาณมากสามารถบีบอัดลงในกระบอกสูบขนาดเล็กและสามารถเคลื่อนย้ายได้ง่าย
โดยปกติแล้วก๊าซแสดงคุณสมบัติของการแพร่กระจายอย่างรวดเร็วไปยังก๊าซอื่น ๆ นี่คือเหตุผลที่ทำให้เราได้กลิ่น (ทั้งดีหรือไม่ดี) จากระยะไกล
สสารสามารถเปลี่ยนสถานะได้
น้ำมีอยู่ในทั้งสามสถานะเช่นน้ำแข็งเป็นของแข็ง น้ำ (H2O) เป็นของเหลว และไอน้ำเป็นก๊าซ แผนภาพต่อไปนี้แสดงให้เห็นถึงการเปลี่ยนแปลงของน้ำในสถานะต่างๆ -

อุณหภูมิที่ของแข็งละลายและเปลี่ยนเป็นของเหลว (ที่ความดันบรรยากาศที่กำหนด) เรียกว่า “melting point.”
จุดหลอมเหลวของของแข็งเป็นตัวบ่งชี้ความแรงของแรงดึงดูดระหว่างอนุภาคของมัน
จุดหลอมเหลวของน้ำแข็งคือ 273.16 K คือ 0 0 C
กระบวนการหลอม (เช่นการเปลี่ยนสถานะของแข็งเป็นสถานะของเหลว) เรียกว่า fusion.
ปริมาณพลังงานความร้อนซึ่งต้องใช้ในการเปลี่ยนวัสดุแข็ง 1 กิโลกรัมเป็นวัสดุเหลวที่ความดันบรรยากาศที่กำหนดเรียกว่า latent heat ของฟิวชั่น
อุณหภูมิที่ของเหลวเริ่มเดือดที่ความดันบรรยากาศที่กำหนดเรียกว่า “boiling point.”
จุดเดือดของน้ำคือ 373 K คือ 100 0 C
การเปลี่ยนสถานะของสสารโดยตรงจากของแข็งเป็นก๊าซโดยไม่เปลี่ยนสถานะเป็นของเหลว (หรือในทางกลับกัน) เรียกว่า “sublimation.”
ปรากฏการณ์เช่นการเปลี่ยนของเหลวเป็นไอที่อุณหภูมิต่ำกว่าจุดเดือดเรียกว่า “evaporation.”
คาร์บอนไดออกไซด์แข็ง (CO 2 ) ถูกเก็บไว้ภายใต้ความดันสูง

Solid CO 2จะถูกเปลี่ยนเป็นสถานะก๊าซโดยตรงเมื่อความดันลดลงถึง 1 บรรยากาศ
Atmosphere(atm) เป็นหน่วยวัดความดันที่กระทำโดยก๊าซและหน่วยของความดันคือ Pascal (Pa) 1 บรรยากาศ = 1.01 × 105 Pa.
สภาวะที่สี่ของสสาร
Plasma คือสถานะที่ประกอบด้วยอนุภาคที่มีพลังและตื่นเต้นมาก

อนุภาคซุปเปอร์ตื่นเต้นพบได้ในรูปของก๊าซที่แตกตัวเป็นไอออน เช่นหลอดนีออน (ซึ่งมีก๊าซฮีเลียม) และหลอดไฟนีออน (ซึ่งมีก๊าซนีออน) ประกอบด้วยพลาสมา
บทนำ
สารบริสุทธิ์คือที่ประกอบด้วยอนุภาคหรืออนุภาคชนิดเดียว

ส่วนผสมของส่วนประกอบที่บริสุทธิ์ตั้งแต่สองชิ้นขึ้นไปโดยไม่มีสารที่ไม่ต้องการเรียกว่า Mixturesตัวอย่างเช่นน้ำแร่ธาตุดินเป็นต้น
ส่วนผสมที่เป็นเนื้อเดียวกันของสารตั้งแต่สองชนิดขึ้นไปเรียกว่า solution. ตัวอย่างเช่นน้ำมะนาวน้ำโซดาเป็นต้น
สารละลายอาจอยู่ในรูปแบบใดก็ได้เช่น - อาจเป็นของเหลวของแข็งหรือก๊าซ
Alloysเป็นอีกตัวอย่างหนึ่งของส่วนผสมที่มีส่วนผสมของโลหะที่เป็นเนื้อเดียวกัน ไม่สามารถแยกออกเป็นส่วนประกอบด้วยวิธีการทางกายภาพ ตัวอย่างเช่นทองเหลืองเป็นส่วนผสมของสังกะสี (ประมาณ 30%) และทองแดง (ประมาณ 70%)
คุณสมบัติที่สำคัญของโซลูชัน
โดยปกติสารละลายจะเป็นส่วนผสมที่เป็นเนื้อเดียวกัน
อนุภาคของสารละลายมีเส้นผ่านศูนย์กลางเล็กกว่า 1 นาโนเมตร (10-9 เมตร) ด้วยเหตุนี้จึงไม่สามารถมองเห็นได้ด้วยตาเปล่า
วิธีการแก้ปัญหาไม่สามารถมองเห็นเส้นทางของแสงได้
อนุภาคที่ละลายไม่สามารถแยกออกจากส่วนผสมได้ด้วยกระบวนการกรองแบบง่ายๆ
อนุภาคที่ละลายน้ำจะไม่ตกตะกอนเมื่อปล่อยทิ้งไว้โดยไม่ถูกรบกวน
ที่อุณหภูมิที่กำหนดเมื่อไม่สามารถละลายตัวถูกละลายในสารละลายได้อีกต่อไปเรียกว่า ‘saturated solution.’
ที่อุณหภูมิที่กำหนดปริมาณของอนุภาคที่ละลายอยู่ในสารละลายอิ่มตัวเรียกว่า solubility.’
การระงับ
สารแขวนลอยเป็นสารผสมที่ไม่เหมือนกันซึ่งอนุภาคของตัวถูกละลายไม่ละลาย แต่จะยังคงแขวนอยู่ตลอดทั้งมวลของตัวกลางเรียกว่า ‘suspension.’
คุณสมบัติที่สำคัญของการระงับ
อนุภาคของสารแขวนลอยสามารถมองเห็นได้ด้วยตาเปล่าอย่างชัดเจน

อนุภาคของสารแขวนลอยกระจายลำแสงที่ส่องผ่านและมองเห็นเส้นทางของมันในทำนองเดียวกัน
อนุภาคสลุตสามารถแยกออกจากส่วนผสมได้ด้วยกระบวนการกรองแบบง่ายๆ
คอลลอยด์
ส่วนผสมที่แตกต่างกันเรียกว่า ‘colloid.’ เช่นละอองหมอกควันครีมทาหน้าเป็นต้น

ขนาดของอนุภาคคอลลอยด์มีขนาดเล็กเกินไปที่จะมองเห็นได้จากตาเปล่า
อนุภาคคอลลอยด์มีขนาดใหญ่พอที่จะกระจายลำแสงที่ส่องผ่านและทำให้มองเห็นเส้นทางได้
อนุภาคคอลลอยด์ไม่สามารถแยกออกจากส่วนผสมได้ด้วยกระบวนการกรองแบบง่ายๆ
เทคนิคการกรองพิเศษ ได้แก่ centrifugation, สามารถใช้เพื่อแยกอนุภาคคอลลอยด์
โครมาโทกราฟี
กระบวนการแยกส่วนประกอบของสารผสมเรียกว่า chromatography; โดยปกติจะใช้สำหรับการแยกสี
เทคนิคโครมาโทกราฟีใช้สำหรับการแยกตัวถูกละลายที่ละลายในตัวทำละลายเดียวกัน
การกลั่น
กระบวนการทำให้ของเหลวบริสุทธิ์โดยใช้ความร้อนและความเย็นเรียกว่าการกลั่น
การตกผลึก
กระบวนการแยกของแข็งบริสุทธิ์ในรูปของผลึกออกจากสารละลายเรียกว่า ‘crystallization.’
องค์ประกอบ
ในปี ค.ศ. 1661 โรเบิร์ตบอยล์เป็นนักวิทยาศาสตร์คนแรกที่ใช้คำนี้ element; Antoine Laurent Lavoisier นักเคมีชาวฝรั่งเศสเป็นคนแรกที่ทำการทดลองกำหนดองค์ประกอบของคำศัพท์
องค์ประกอบเป็นรูปแบบพื้นฐานของสสารที่ไม่สามารถแยกย่อยออกเป็นสารที่ง่ายกว่าได้ด้วยปฏิกิริยาทางเคมี
โดยปกติองค์ประกอบสามารถแบ่งได้เป็น metals, non-metals, และ metalloids.
โลหะ
วัสดุที่เป็นของแข็งซึ่งโดยทั่วไปจะแข็งเหนียวอ่อนตัวได้เงางามและหลอมได้ด้วยการนำไฟฟ้าและความร้อนที่ดีเรียกว่า metal. เช่นทองเงินทองแดงอลูมิเนียมเป็นต้น

Mercury เป็นโลหะชนิดเดียวที่ยังคงเป็นของเหลวที่อุณหภูมิห้อง
อโลหะ
ธาตุหรือสสารทั้งหมดที่ไม่ใช่โลหะเรียกว่าอโลหะ เช่นไฮโดรเจนออกซิเจนไอโอดีนคาร์บอนเป็นต้น
อโลหะมีสีหลากหลายและเป็นตัวนำความร้อนและไฟฟ้าที่ไม่ดี
อโลหะไม่เป็นเงาวาวหรืออ่อน
สารประกอบ
สารที่ประกอบด้วยองค์ประกอบตั้งแต่สององค์ประกอบขึ้นไปเรียกว่า ‘compound.’
สารประกอบเป็นผลมาจากการรวมกันทางเคมีของสององค์ประกอบขึ้นไปในสัดส่วนคงที่

คุณสมบัติของสารประกอบแตกต่างจากองค์ประกอบที่เป็นส่วนประกอบในขณะที่คุณสมบัติของส่วนผสมจะเหมือนกับองค์ประกอบหรือสารประกอบที่เป็นส่วนประกอบ
บทนำ
ประมาณ 500 ปีก่อนคริสตกาลฤษีคานาดปราชญ์ชาวอินเดียได้ตั้งสมมติฐานเรื่องส่วนที่แบ่งแยกไม่ได้ของสสารเป็นครั้งแรกและตั้งชื่อว่า ‘pramanu.’
ในปี 1808 John Dalton ใช้คำนี้ ‘atom’ และตั้งสมมติฐาน atomic theory เพื่อการศึกษาเรื่อง

ทฤษฎีอะตอมของดาลตัน
ตามทฤษฎีอะตอมของดอลตันสสารทั้งหมดไม่ว่าจะเป็นองค์ประกอบสารประกอบหรือส่วนผสมประกอบด้วยอนุภาคขนาดเล็กที่เรียกว่าอะตอม
ตามทฤษฎีอะตอมของดอลตันสสารทั้งหมดไม่ว่าจะเป็นองค์ประกอบสารประกอบหรือของผสมประกอบด้วยอนุภาคขนาดเล็กที่เรียกว่าอะตอม
คุณสมบัติเด่นของทฤษฎีอะตอมของดาลตัน
สสารทั้งหมดสร้างขึ้นจากอนุภาคขนาดเล็กที่เรียกว่าอะตอม
อะตอมเป็นอนุภาคที่แบ่งแยกไม่ได้ซึ่งไม่สามารถสร้างหรือทำลายได้ด้วยปฏิกิริยาทางเคมี
อะตอมของธาตุทั้งหมดมีมวลและสมบัติทางเคมีเหมือนกันในขณะที่อะตอมของธาตุต่าง ๆ มีมวลและคุณสมบัติทางเคมีที่แตกต่างกัน
ในการสร้างสารประกอบอะตอมจะรวมกันในอัตราส่วนของจำนวนเต็มขนาดเล็ก
ในสารประกอบที่กำหนดจำนวนสัมพัทธ์และชนิดของอะตอมจะคงที่
มวลอะตอม
มวลของอะตอมขององค์ประกอบทางเคมี มันแสดงเป็นหน่วยมวลอะตอม (สัญลักษณ์คือu )
มวลอะตอมนั้นเทียบเท่ากับจำนวนโปรตอนและนิวตรอนที่มีอยู่ในอะตอม
หน่วยมวลอะตอมหนึ่งหน่วยเป็นหน่วยมวลที่มีค่าเท่ากับหนึ่งในสิบสอง (1/12) มวลของหนึ่งอะตอมของคาร์บอน -12 และมวลอะตอมสัมพัทธ์ของธาตุทั้งหมดได้รับการคำนวณเทียบกับอะตอมของคาร์บอน -12
โมเลกุล
อนุภาคที่เล็กที่สุดของธาตุหรือสารประกอบซึ่งสามารถดำรงอยู่ได้โดยอิสระและแสดงคุณสมบัติทั้งหมดของสารนั้น ๆ

โดยปกติโมเลกุลคือกลุ่มของอะตอมตั้งแต่สองอะตอมขึ้นไปซึ่งมีพันธะทางเคมีเข้าด้วยกัน
อะตอมของธาตุเดียวกันหรือของธาตุต่างกันสามารถรวม (ด้วยพันธะเคมี) เข้าด้วยกันเพื่อสร้างโมเลกุลได้
จำนวนอะตอมที่ประกอบกันเป็นโมเลกุลเรียกว่าของมัน atomicity.
ไอออน
อนุภาคที่มีประจุเรียกว่า ion; มันอาจเป็นอย่างใดอย่างหนึ่งnegative charge หรือ positive charge.
ไอออนที่มีประจุบวกเรียกว่า a ‘cation’.
ไอออนที่มีประจุลบเรียกว่า ‘anion.’
สูตรทางเคมี
สูตรทางเคมีของสารประกอบแสดงให้เห็นถึงองค์ประกอบที่เป็นส่วนประกอบและจำนวนอะตอมของแต่ละองค์ประกอบที่รวมกัน

สูตรทางเคมีของสารประกอบคือการแสดงสัญลักษณ์ขององค์ประกอบ
ความสามารถในการรวมกันขององค์ประกอบเรียกว่า ‘valency.’
มวลโมเลกุล
มวลโมเลกุลของสารคำนวณโดยการหาผลรวมของมวลอะตอมของอะตอมทั้งหมดในโมเลกุลของสารที่เกี่ยวข้อง ตัวอย่างเช่นมวลโมเลกุลของน้ำคำนวณเป็น -
มวลอะตอมของไฮโดรเจน = 1u
มวลอะตอมของออกซิเจน = 16 u
น้ำประกอบด้วยไฮโดรเจนสองอะตอมและออกซิเจนหนึ่งอะตอม
มวลโมเลกุลของน้ำคือ = 2 × 1+ 1 × 16 = 18 u ( uคือสัญลักษณ์ของมวลโมเลกุล)
มวลหน่วยสูตร
มวลหน่วยสูตรของสารคำนวณโดยการหาผลรวมของมวลอะตอมของอะตอมทั้งหมดในหน่วยสูตรของสารประกอบ
Avogadro Constant หรือ Avogadro Number
Avogadro เป็นนักวิทยาศาสตร์ชาวอิตาลีที่ให้แนวคิดเรื่อง Avogadro Number (หรือที่เรียกว่า Avogadro Constant)
จำนวนอนุภาค (อะตอมโมเลกุลหรือไอออน) ที่มีอยู่ใน 1 โมลของสารใด ๆ จะคงที่และค่าของมันจะคำนวณเป็น 6.022 × 1023.
ในปีพ. ศ. 2439 Wilhelm Ostwald ได้นำแนวคิดเรื่อง 'ไฝ; อย่างไรก็ตามหน่วยโมลได้รับการยอมรับให้เป็นวิธีง่ายๆในการรายงานจำนวนมากในปีพ. ศ. 2510
กฎหมายว่าด้วยการอนุรักษ์มวล
ในระหว่างปฏิกิริยาทางเคมีผลรวมของมวลของสารตั้งต้นและผลิตภัณฑ์จะไม่เปลี่ยนแปลงซึ่งเรียกว่า ‘Law of Conservation of Mass.’
กฎหมายว่าด้วยสัดส่วนที่แน่นอน
ในสารประกอบทางเคมีบริสุทธิ์องค์ประกอบของมันมักจะมีอยู่ในสัดส่วนที่แน่นอนตามมวลซึ่งเรียกว่า ‘Law of Definite Proportions.’
บทนำ
ภายในปี 1900 พบว่าอะตอมไม่ใช่อนุภาคธรรมดาที่แบ่งแยกไม่ได้ แต่ประกอบด้วยอนุภาคย่อยของอะตอม
J.J. Thomson ค้นพบอนุภาคย่อยอะตอมคือ ‘electron.’

JJ Thomson เป็นคนแรกที่เสนอ model สำหรับโครงสร้างของอะตอม
ในปีพ. ศ. 2429 E. Goldstein ได้ค้นพบการแผ่รังสีใหม่ในการปล่อยก๊าซและตั้งชื่อให้ canal rays.
อนุภาคย่อยอะตอมที่มีประจุบวกอีกชนิดหนึ่งถูกค้นพบจากการทดลองเกี่ยวกับคลองรังสีและตั้งชื่อมัน proton.
แบบจำลองอะตอมของทอมสัน
ทอมสันเสนอว่าอะตอมประกอบด้วยทรงกลมที่มีประจุบวกและอิเล็กตรอน (ประจุลบ) ฝังอยู่ในนั้น (ดังแสดงในภาพด้านล่าง)

นอกจากนี้ทอมสันยังกล่าวอีกว่าประจุลบและประจุบวกมีขนาดเท่ากัน ดังนั้นอะตอมโดยรวมจึงเป็นกลางทางไฟฟ้า
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
E. รัทเทอร์ฟอร์ดได้รับความนิยมในฐานะ 'บิดา' ของฟิสิกส์นิวเคลียร์

รัทเทอร์ฟอร์ดเป็นที่รู้จักอย่างกว้างขวางจากผลงานของเขาเกี่ยวกับกัมมันตภาพรังสีและการค้นพบ nucleus ของอะตอมด้วยการทดลองฟอยล์ทอง (ดังแสดงในภาพด้านล่าง

รัทเทอร์ฟอร์ดกล่าวว่าในอะตอมมีศูนย์กลางที่มีประจุบวกซึ่งเรียกว่า nucleus.
รัทเทอร์ฟอร์ดกล่าวว่ามวลเกือบทั้งหมดของอะตอมมีอยู่ในนิวเคลียส
ตามที่รัทเทอร์ฟอร์ดกล่าวว่าอิเล็กตรอนหมุนรอบนิวเคลียสในวงโคจรที่กำหนดไว้อย่างชัดเจน
แบบจำลองอะตอมของบอร์
นีลส์บอร์ขยายโมเดลของรัทเทอร์ฟอร์ดเพิ่มเติมและปรับปรุงข้อบกพร่องของเขา

ตามที่บอร์กล่าวเฉพาะวงโคจรพิเศษบางวงที่เรียกว่าวงโคจรไม่ต่อเนื่องของอิเล็กตรอนเท่านั้นที่ได้รับอนุญาตให้อยู่ภายในอะตอม
บอร์กล่าวว่าอิเล็กตรอนไม่แผ่พลังงานในขณะที่หมุนอยู่ในวงโคจรที่ไม่ต่อเนื่อง
Bohr ตั้งชื่อวงโคจรหรือเปลือกหอยเป็นระดับพลังงาน (ดังแสดงในภาพด้านล่าง)

บอร์แสดงถึงวงโคจรหรือเปลือกหอยเหล่านี้ด้วยตัวอักษร K, L, M, N, …หรือตัวเลข, n = 1,2,3,4, …
นิวตรอน
ในปีพ. ศ. 2475 J. Chadwick ได้ค้นพบอนุภาคย่อยอะตอมใหม่คือนิวตรอน
นิวตรอนไม่มีประจุและมีมวลใกล้เคียงกับโปรตอน
นิวตรอนมีอยู่ในนิวเคลียสของทุกอะตอมยกเว้นไฮโดรเจน
อิเล็กตรอนกระจายในวงโคจรต่าง ๆ (เปลือกหอย)
จำนวนอิเล็กตรอนสูงสุดที่สามารถมีอยู่ในเปลือกจะถูกกำหนดโดยสูตร 2n2.
‘n’ คือเลขวงโคจรหรือดัชนีระดับพลังงานคือ 1, 2, 3, ….
ตามสูตรที่กำหนด -
วงโคจรแรกคือ K-shellจะเป็น = 2 × 1 2 = 2
วงโคจรที่สองคือ L-shellจะเป็น = 2 × 2 2 = 8
วงโคจรที่สามคือ M-shellจะเป็น = 2 × 3 2 = 18
วงโคจรที่สี่ ได้แก่ N-shellจะเป็น = 2 × 4 2 = 32
ในทำนองเดียวกันจำนวนอิเล็กตรอนสูงสุดที่สามารถอยู่ในวงโคจรนอกสุดคือ 8
อิเล็กตรอนจะไม่ถูกเติมเต็มในเปลือกที่กำหนดเว้นแต่เปลือกด้านในจะเต็ม มันหมายความว่าเปลือกหอยถูกเติมในลักษณะที่ชาญฉลาด เริ่มจากเปลือกชั้นในสู่เปลือกนอก
วาเลนซ์
อิเล็กตรอนซึ่งมีอยู่ในเปลือกนอกสุดของอะตอมเรียกว่า valence อิเล็กตรอน
ตามแบบจำลองของบอร์ - บูรีเปลือกนอกสุดของอะตอมสามารถมีอิเล็กตรอนได้สูงสุด 8 ตัว
เลขอะตอม
จำนวนโปรตอนทั้งหมดที่มีอยู่ในนิวเคลียสของอะตอมเรียกว่า atomic number.
จำนวนโปรตอนของอะตอมเป็นตัวกำหนดเลขอะตอม
เลขอะตอมแสดงด้วย ‘Z’.
โปรตอนและนิวตรอนเรียกรวมกันว่า nucleons.
จำนวนมวล
ผลรวมของจำนวนโปรตอนและนิวตรอนทั้งหมดที่มีอยู่ในนิวเคลียสของอะตอมเรียกว่า mass number.
ไอโซโทป
อะตอมของธาตุเดียวกันซึ่งมีเลขอะตอมเหมือนกัน แต่มีมวลต่างกันเรียกว่าไอโซโทป เช่นไฮโดรเจนอะตอมมี 3 ไอโซโทป ได้แก่ โปรเทียมดิวเทอเรียมและไอโซโทป
คุณสมบัติทางเคมีของไอโซโทปของอะตอมมีความคล้ายคลึงกัน แต่คุณสมบัติทางกายภาพแตกต่างกัน
ไอโซบาร์
อะตอมของธาตุต่าง ๆ ที่มีเลขอะตอมต่างกันซึ่งมีเลขมวลเท่ากันเรียกว่าไอโซบาร์ เช่นเลขอะตอมของแคลเซียมคือ 20 และเลขอะตอมของอาร์กอนคือ 18 ยิ่งไปกว่านั้นจำนวนอิเล็กตรอนในอะตอมเหล่านี้แตกต่างกัน แต่จำนวนมวลของธาตุทั้งสองนี้คือ 40
บทนำ
กระบวนการที่สารเคมีหนึ่งหรือหลายชนิดทำปฏิกิริยากับสารเคมีอื่น ๆ และเปลี่ยนเป็นสารที่แตกต่างกันอย่างน้อยหนึ่งชนิดเรียกว่าปฏิกิริยาเคมี
สมการเคมี
สมการเคมีคือการแสดงสัญลักษณ์ของปฏิกิริยาเคมี มันแสดงผ่านสัญลักษณ์และสูตร เช่น
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
สารแมกนีเซียมและออกซิเจนเรียกว่าสารตั้งต้นและผลของปฏิกิริยากล่าวคือแมกนีเซียมออกไซด์เรียกว่าผลิตภัณฑ์
อย่าลืมว่ามวลรวมขององค์ประกอบที่มีอยู่ในผลิตภัณฑ์ของปฏิกิริยาเคมีจะต้องเท่ากับมวลรวมของธาตุที่มีอยู่ในสารตั้งต้น
จำนวนอะตอมของแต่ละองค์ประกอบจะยังคงเท่าเดิมก่อนและหลังปฏิกิริยาเคมี
ประเภทของปฏิกิริยาเคมี
ต่อไปนี้เป็นปฏิกิริยาเคมีประเภทสำคัญ -
Combination Reaction
Decomposition Reaction
Displacement Reaction
มาพูดคุยกันโดยสังเขปของแต่ละคน -
ปฏิกิริยาการรวมกัน
เมื่อสารสองชนิดขึ้นไป (เช่นองค์ประกอบหรือสารประกอบ) ทำปฏิกิริยากันจนเป็นผลิตภัณฑ์เดียวปฏิกิริยาดังกล่าวเรียกว่า combination reaction. เช่น
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
ดังที่แสดงไว้ในปฏิกิริยาข้างต้นแคลเซียมออกไซด์และน้ำทำปฏิกิริยา (หรือรวมกัน) เพื่อสร้างผลิตภัณฑ์เดียวเรียกว่าแคลเซียมไฮดรอกไซด์
ปฏิกิริยาทางเคมีที่ปล่อยความร้อนออกมาพร้อมกับการก่อตัวของผลิตภัณฑ์เรียกว่า exothermic chemical reactions.
ปฏิกิริยาการสลายตัว
ปฏิกิริยาที่สารตั้งต้นตัวเดียวแตกตัวเป็นผลิตภัณฑ์ที่ง่ายกว่าเรียกว่าปฏิกิริยาการสลายตัว เช่น

ในปฏิกิริยาที่ระบุข้างต้นผลึกเฟอร์รัสซัลเฟต (เช่น FeSO 4 , 7H 2 O) เมื่อถูกความร้อนจะสูญเสียน้ำและสีของผลึกจะเปลี่ยนไป ในที่สุดมันจะสลายตัวเป็นเฟอริกออกไซด์ (Fe 2 O 3 ), ซัลเฟอร์ไดออกไซด์ (SO 2 ) และซัลเฟอร์ไตรออกไซด์ (SO 3 )
ปฏิกิริยาการกำจัด
ปฏิกิริยาที่องค์ประกอบแทนที่หรือลบองค์ประกอบอื่นเรียกว่าปฏิกิริยาการกระจัด เช่น
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
ในปฏิกิริยาที่กำหนดข้างต้นเหล็กแทนที่ทองแดงจากสารละลายคอปเปอร์ซัลเฟตและสร้างเป็นเหล็กซัลเฟต
ออกซิเดชันและการลด
หากสารได้รับออกซิเจนในระหว่างการเกิดปฏิกิริยาเรียกว่า oxidation. ในทางกลับกันในปฏิกิริยาถ้าสารสูญเสียออกซิเจนเรียกว่าreduction. เช่น

ในปฏิกิริยาที่กำหนดข้างต้นออกไซด์ของทองแดงจะสูญเสียออกซิเจนและลดลง (เช่นการลดลง); ในทางกลับกันไฮโดรเจนจะได้รับออกซิเจนและด้วยเหตุนี้จึงถูกออกซิไดซ์ (เช่นออกซิเดชัน)
การกัดกร่อน
เมื่อโลหะถูกโจมตีโดยสารที่พบในสภาพแวดล้อมเช่นความชื้นกรด ฯลฯ เรียกว่า corrosion. เช่นการเคลือบสีดำบนเงินการเคลือบสีเขียวบนทองแดงเป็นต้น

ความห้าว
เมื่อไขมันและน้ำมันถูกออกซิไดซ์กระบวนการนี้เรียกว่าการเหม็นหืน กลิ่นรสสี ฯลฯ ก็เปลี่ยนไปเช่นกัน ในทำนองเดียวกันทำให้อาหารไม่ปลอดภัยต่อการบริโภค
บทนำ
เราได้ลิ้มรสอาหารที่มีรสเปรี้ยวและขมเป็นเพราะมีกรดและเบสตามลำดับเท่านั้น
น้ำยาลิตมัส
กระดาษลิตมัสซึ่งสกัดจากตะไคร่มีสีม่วง (ดูภาพด้านล่าง) แต่เงื่อนไขคือเมื่อไม่มีความเป็นกรดหรือเป็นพื้นฐานกล่าวคือเป็นกลาง

โดยทั่วไปแล้วกระดาษลิตมัสเป็นพืชที่อยู่ในกลุ่มธาลโลไฟตาและในการทดลองทางเคมีมักใช้เป็นตัวบ่งชี้
สารที่มีกลิ่นเปลี่ยนไปในสารที่เป็นกรดหรือสารพื้นฐานเรียกว่า olfactory ตัวชี้วัด
กรดหรือเบสในสารละลายน้ำ
ไฮโดรเจนไอออนใน HCl เกิดขึ้นเนื่องจากมีน้ำ ประการที่สองการแยก H + ion ออกจากโมเลกุล HCl ไม่สามารถทำได้ในกรณีที่ไม่มีน้ำ สูตรทางเคมีแสดงอยู่ด้านล่าง
HCl + H2O → H3O+ + Cl–
นอกจากนี้ไฮโดรเจนไอออนไม่สามารถดำรงอยู่ได้โดยลำพัง แต่สามารถมีอยู่ในโมเลกุลของน้ำได้ ดังนั้นไอออนของไฮโดรเจนจึงแสดงเป็น H + (aq) หรือไฮโดรเนียมไอออน (H 3 O + ) สูตรทางเคมีคือ -
H+ + H2O → H3O+
ฐานที่ละลายได้ในน้ำเรียกว่า alkalis. แต่ฐานทั้งหมดไม่ละลายในน้ำ
ถ้าเติมน้ำลงในกรดเข้มข้นความร้อนจะเกิดขึ้น
การผสมกรดหรือเบสกับน้ำจะทำให้ความเข้มข้นของไอออนลดลง (เช่น H 3 O + / OH–) ต่อหน่วยปริมาตรและกระบวนการนี้เรียกว่าdilution.
เครื่องชั่ง pH
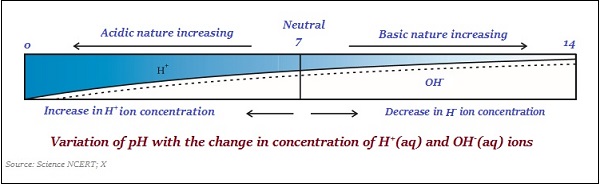
สเกลที่ใช้ในการวัดความเข้มข้นของไฮโดรเจนไอออนในสารละลายเรียกว่า pH scale.
‘p’ ใน pH หมายถึง ‘potenz’, เป็นศัพท์ภาษาเยอรมันซึ่งหมายถึง ‘power’.
ค่า pH ถือเป็นตัวเลขซึ่งบ่งบอกถึงลักษณะความเป็นกรดหรือพื้นฐานของสารละลาย ดังนั้นหากความเข้มข้นของไฮโดรเนียมไอออนสูงขึ้นค่า pH ก็จะต่ำลง
ค่าของมาตราส่วน pH อยู่ระหว่าง ‘0’ และ ’14;’ ดังนั้นถ้าวัดค่า pH เป็น '0' หมายความว่า - มันมาก acidic และถ้าเป็น 14 ก็หมายความว่า - มันมาก alkaline.
ค่าเป็นกลางของระดับ pH คือ ‘7’.
ในระดับ pH ค่าที่น้อยกว่า 7 แสดงถึงสารละลายที่เป็นกรดและค่าที่มากกว่า 7 แสดงถึงสารละลายพื้นฐาน
โดยปกติกระดาษที่ชุบด้วยตัวบ่งชี้ทั่วไปจะใช้ในการวัดค่า pH (ดูภาพด้านล่าง) -
ในทำนองเดียวกันความแข็งแรงของกรดและเบสของสารส่วนใหญ่ขึ้นอยู่กับจำนวนไอออนของ H +และ OH -ไอออนที่ผลิตตามลำดับ
ภาพต่อไปนี้แสดงให้เห็นอย่างคร่าวๆ (การเปลี่ยนแปลงของสี) ค่า pH ของสารทั่วไปบางชนิด -

ความสำคัญของ pH ในชีวิตประจำวัน
ค่า pH ของร่างกายมนุษย์อยู่ระหว่าง 7.0 ถึง 7.8
กระเพาะอาหารของร่างกายมนุษย์ผลิตกรดไฮโดรคลอริกที่ช่วยในการย่อยอาหาร น่าแปลกที่มันไม่เป็นอันตรายต่อกระเพาะอาหารอยู่แล้ว
อย่างไรก็ตามเมื่อกระเพาะอาหารผลิตกรดมากเกินไป (เรียกว่าอาหารไม่ย่อย) จะทำให้เกิดอาการปวดและระคายเคือง เพื่อบรรเทาอาการปวดนี้แพทย์แนะนำให้ใช้ยาที่เรียกว่ายาลดกรด
ยาลดกรดเหล่านี้ทำให้เป็นกลางและควบคุมปริมาณกรดที่เพิ่มขึ้น
ฟันซึ่งประกอบด้วยแคลเซียมฟอสเฟตเป็นสารที่แข็งที่สุดในร่างกาย อย่างไรก็ตามเมื่อ pH ในปากลดลง (ต่ำกว่า 5.5) จะทำให้ฟันสึกกร่อน
โดยปกติเกลือเกิดจากการรวมกันของกรดไฮโดรคลอริกและสารละลายโซเดียมไฮดรอกไซด์ และการรวมกันนี้เรียกว่าโซเดียมคลอไรด์
เมื่อวัดค่า pH ของน้ำฝนได้น้อยกว่า 5.6 จะเรียกว่า acid rain.
เมื่อฝนกรดไหลลงสู่แม่น้ำก็จะทำให้ pH ของน้ำในแม่น้ำลดลงด้วย
น้ำในแม่น้ำที่เป็นกรดเป็นภัยคุกคามต่อความอยู่รอดของสิ่งมีชีวิตในน้ำ
ผงฟอกสี
ผงฟอกสีที่ผลิตโดยการกระทำของคลอรีนแห้งปูนผิว [Ca (OH) 2 ] และมันจะแสดงเป็น CaOCl 2
โดยปกติแล้วผงฟอกสีจะใช้ในอุตสาหกรรมสิ่งทอโรงงานกระดาษอุตสาหกรรมเคมีและฆ่าเชื้อในน้ำดื่ม
ผงฟู
โดยทั่วไปมักใช้เบกกิ้งโซดาในห้องครัวเพื่อปรุงอาหารกรอบอร่อย นอกจากนี้ยังปรุงอาหารบางรายการได้เร็วขึ้น
ชื่อทางเคมีของโซดาโซเดียม hydrogencarbonate และสูตร NaHCO 3
ซักโซดา
การตกผลึกของโซเดียมคาร์บอเนตทำให้เกิดโซดาซักผ้า
สูตรทางเคมีของโซดาซักผ้าคือ Na 2 CO 3 .10H 2 O.
โซดาซักผ้ามักใช้ในอุตสาหกรรมแก้วสบู่และกระดาษ
ปูนปลาสเตอร์แห่งปารีส
ปูนปลาสเตอร์แห่งปารีสเป็นผงสีขาวที่แพทย์ใช้เป็นปูนปลาสเตอร์สำหรับรองรับกระดูกที่แตกหัก
ชื่อทางเคมีของปูนปลาสเตอร์ของปารีสคือแคลเซียมซัลเฟตเฮมิไฮเดรตและสูตรทางเคมีคือ 2CaSO 4 H 2 O.
บทนำ
โลหะสามารถแยกแยะได้จากอโลหะโดยอาศัยคุณสมบัติทางเคมีและทางกายภาพ
คุณสมบัติของโลหะที่สามารถตีเป็นแผ่นบาง ๆ เรียกว่า malleability.
คุณสมบัติของโลหะที่สามารถดึงเป็นสายไฟได้เรียกว่า ductility.
โดยปกติแล้วโลหะจะเป็นตัวนำความร้อนและไฟฟ้าที่มีความแข็งและอ่อนตัวได้ เช่นเหล็กทองแดงแคลเซียมอลูมิเนียมแมกนีเซียมเป็นต้น

วัสดุที่ไม่ดังและเป็นตัวนำความร้อนและไฟฟ้าที่ไม่ดีเรียกว่า non-metals. เช่นกำมะถันคาร์บอนออกซิเจนฟอสฟอรัสเป็นต้น
โลหะบางชนิดเช่น sodium และ potassium นุ่มและสามารถตัดด้วยมีด
Mercury เป็นโลหะชนิดเดียวที่ยังคงอยู่ในสถานะของเหลวที่อุณหภูมิห้อง
เมื่อซัลเฟอร์ไดออกไซด์ละลายในน้ำจะเกิดกรดซัลฟูรัส ภาพประกอบ - ซัลเฟอร์ไดออกไซด์ (SO 2 ) + น้ำ (H 2 O) →กรดซัลฟูรัส (H 2 SO 3 )
ออกไซด์ของอโลหะมีสภาพเป็นกรด
กรดซัลฟูรัสจะเปลี่ยนกระดาษลิตมัสสีน้ำเงินเป็นสีแดง
ฟอสฟอรัสเป็นอโลหะที่มีปฏิกิริยาสูงและติดไฟได้ทุกครั้งที่สัมผัสกับอากาศ
เพื่อป้องกันการสัมผัสฟอสฟอรัสกับออกซิเจนในชั้นบรรยากาศฟอสฟอรัสจะถูกเก็บไว้ในน้ำ
ในการเผาไหม้โลหะจะทำปฏิกิริยากับออกซิเจนและผลิตออกไซด์ของโลหะได้ง่ายซึ่งเป็นพื้นฐานในธรรมชาติ
อโลหะทำปฏิกิริยากับออกซิเจนและผลิตอโลหะออกไซด์ สิ่งเหล่านี้เป็นกรดในธรรมชาติ
โลหะบางชนิดทำปฏิกิริยากับน้ำและผลิตโลหะไฮดรอกไซด์และก๊าซไฮโดรเจน
โดยปกติอโลหะไม่ทำปฏิกิริยากับน้ำ
โลหะยังทำปฏิกิริยากับกรดและผลิตก๊าซไฮโดรเจนและเกลือของโลหะ
โดยปกติแล้วอโลหะจะไม่ทำปฏิกิริยากับกรด
การใช้โลหะและอโลหะ
โลหะใช้ในการผลิตเครื่องจักรเครื่องบินรถยนต์รถไฟดาวเทียมอุปกรณ์อุตสาหกรรมเครื่องทำอาหารหม้อต้มน้ำ ฯลฯ
อโลหะถูกใช้ในปุ๋ยเพื่อปรับปรุงการเจริญเติบโตของพืช
อโลหะใช้ในการทำน้ำให้บริสุทธิ์
อโลหะถูกใช้ในกะเทาะ
บทนำ
วัสดุที่เป็นของแข็งซึ่งโดยทั่วไปมีความแข็งอ่อนตัวเป็นมันเงาหลอมได้และเหนียวเรียกว่าโลหะ เช่นเหล็กทองแดงอลูมิเนียมแมกนีเซียมโซเดียมตะกั่วสังกะสีเป็นต้น
โดยปกติโลหะจะมีคุณสมบัติในการนำไฟฟ้าและความร้อนได้ดี

โลหะในสภาพบริสุทธิ์มีพื้นผิวที่ส่องแสงหรือที่เรียกว่า metallic luster.
โลหะสามารถตีเป็นแผ่นบาง ๆ คุณสมบัตินี้เรียกว่าmalleability.
คุณสมบัติของโลหะที่จะดึงเข้าไปในสายไฟบาง ๆ เรียกว่า ductility. เช่นทองเป็นโลหะที่เหนียวที่สุด
เงินและทองแดงเป็นตัวนำความร้อนที่ดีที่สุด
ไม่ใช่โลหะ
โดยปกติแล้วอโลหะจะพบได้ในของแข็งหรือสถานะของก๊าซ อย่างไรก็ตามโบรมีนเป็นข้อยกเว้นที่พบในสถานะของเหลว
ตัวอย่างที่สำคัญบางส่วนของอโลหะ ได้แก่ คาร์บอนกำมะถันไอโอดีนออกซิเจนไฮโดรเจน ฯลฯ

ข้อเท็จจริงของโลหะและอโลหะ
โลหะทั้งหมดมีอยู่ในรูปของแข็งที่อุณหภูมิห้องยกเว้นปรอท
แกลเลียมและซีเซียมมีจุดหลอมเหลวต่ำมาก โลหะทั้งสองนี้หลอมละลายแม้กระทั่งบนฝ่ามือ
ไอโอดีนเป็นอโลหะ แต่เป็นมันเงา (มันวาวเป็นสมบัติของโลหะ)
คาร์บอนเป็นอโลหะที่มีอยู่ในรูปแบบต่างๆกัน แต่ละรูปแบบเรียกว่า allotrope
เพชรเป็นส่วนผสมของคาร์บอนและเป็นสารธรรมชาติที่แข็งที่สุดเท่าที่รู้จัก
จุดหลอมเหลวและจุดเดือดของเพชรสูงมาก
กราไฟท์ยังเป็นส่วนประกอบของคาร์บอน มันเป็นตัวนำไฟฟ้า
โลหะอัลคาไลเช่นลิเธียมโพแทสเซียมโซเดียมเป็นตัวอย่างของโลหะอ่อนเนื่องจากสามารถตัดด้วยมีดได้
โลหะเกือบทุกชนิดเมื่อรวมตัวกับออกซิเจนจะก่อตัวเป็นโลหะออกไซด์
โลหะที่แตกต่างกันมีความถี่ในการเกิดปฏิกิริยาต่างกัน บางคนตอบสนองช้า แต่บางคนตอบสนองเร็วมาก เช่นโพแทสเซียมและโซเดียมมีปฏิกิริยามากและจะติดไฟได้ก็ต่อเมื่อเก็บไว้ในที่โล่ง
ดังนั้นโพแทสเซียมและโซเดียมจะถูกแช่ไว้ในน้ำมันก๊าดเพื่อไม่ให้ติดไฟ
อย่างไรก็ตามในบรรดาโลหะทั้งหมดโซเดียม (เป็นไปได้มากที่สุด) เป็นโลหะที่มีปฏิกิริยามากที่สุด
อโนไดซ์เป็นกระบวนการสร้างชั้นอลูมิเนียมออกไซด์ที่หนาป้องกันและป้องกันการกัดกร่อน
องค์ประกอบหรือสารประกอบที่เกิดขึ้นตามธรรมชาติในเปลือกโลก (ชั้นบน) ของโลกเรียกว่าแร่ธาตุ
แร่ธาตุในรูปดิบเรียกว่า ores. เช่นทองคำเงินเหล็กเป็นต้น (แร่เหล็กที่แสดงในภาพด้านล่าง) -

แร่ซึ่งสกัดจากแผ่นดินมักปนเปื้อนด้วยสิ่งสกปรกจำนวนมากเช่นผสมกับองค์ประกอบบางอย่างดินทราย ฯลฯ หรือที่เรียกว่า ‘gangue’.
ขึ้นอยู่กับลักษณะการเกิดปฏิกิริยาและการสกัดจากแร่โลหะสามารถแบ่งประเภทได้เป็น -

บทนำ
คาร์บอนมีบทบาทสำคัญมากสำหรับสิ่งมีชีวิตทุกชนิด
ปริมาณคาร์บอนในเปลือกโลกมีเพียง 0.02% ซึ่งมีอยู่ในรูปของแร่ธาตุเช่นคาร์บอเนตไฮโดรเจนคาร์บอเนตถ่านหินและปิโตรเลียม
การปรากฏตัวของคาร์บอนในบรรยากาศของโลกคือ 0.03% ในรูปของก๊าซคาร์บอนไดออกไซด์
สารประกอบของคาร์บอน
สารประกอบคาร์บอนเกือบทั้งหมด (ยกเว้นบางส่วน) เป็นตัวนำไฟฟ้าที่ไม่ดี
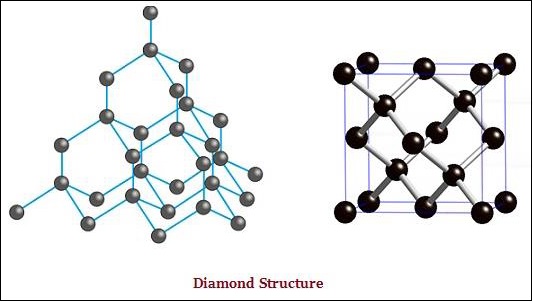
เพชรและกราไฟต์ทั้งคู่เกิดจากอะตอมของคาร์บอน อย่างไรก็ตามความแตกต่างอยู่ระหว่างพวกมันในลักษณะที่อะตอมของคาร์บอนยึดติดกัน
ในเพชรแต่ละอะตอมของคาร์บอนจะถูกผูกมัดกับคาร์บอนอีกสี่อะตอมและสร้างโครงสร้างสามมิติที่แข็ง (ดูภาพด้านล่าง)
ในกราไฟท์แต่ละอะตอมของคาร์บอนถูกผูกมัดกับคาร์บอนอีกสามอะตอมในระนาบเดียวกันซึ่งให้อาร์เรย์หกเหลี่ยม (ดูภาพด้านล่าง) -
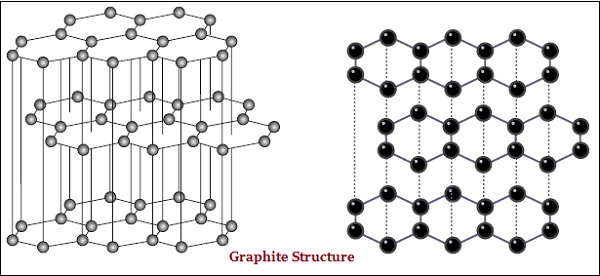
นอกจากนี้ยังมีความแตกต่างในโครงสร้างทางกายภาพของเพชรและกราไฟต์
เพชรเป็นสารที่แข็งที่สุดที่รู้จักในขณะที่กราไฟต์เป็นสารที่เรียบและลื่น
กราไฟท์เป็นตัวนำไฟฟ้าที่ดีในขณะที่เพชรไม่ใช่
ตารางต่อไปนี้แสดงโครงสร้างของสารประกอบคาร์บอนและไฮโดรเจน -
| ชื่อ | สูตร | โครงสร้าง |
|---|---|---|
| มีเทน | CH 4 |

|
| อีเทน | C 2 H 6 |

|
| โพรเพน | C 3 H 8 |

|
| บิวเทน | C 4 H 10 |

|
| เพนเทน | C 5 H 12 |

|
| เฮกเซน | C 6 H 14 |

|
สารประกอบที่มีสูตรโมเลกุลเหมือนกัน แต่มีโครงสร้างต่างกันเรียกว่า structural isomers (ดูโครงสร้างบิวเทนที่ระบุด้านล่าง)

ไฮโดรคาร์บอนอิ่มตัวเรียกว่า alkanes.
ไฮโดรคาร์บอนไม่อิ่มตัวซึ่งประกอบด้วยพันธะคู่หนึ่งพันธะหรือมากกว่านั้นเรียกว่า alkenes.
ไฮโดรคาร์บอนไม่อิ่มตัวซึ่งประกอบด้วยพันธะสามอย่างหนึ่งหรือมากกว่านั้นเรียกว่า alkynes.
การใช้แอลกอฮอล์เป็นเชื้อเพลิง
ต้นอ้อยเปลี่ยนแสงแดดเป็นพลังงานเคมีได้อย่างมีประสิทธิภาพและน้ำผลไม้สามารถใช้ในการเตรียมกากน้ำตาล
เมื่อหมักกากน้ำตาลจะทำให้เกิดแอลกอฮอล์ (เอทานอล)
ปัจจุบันบางประเทศใช้แอลกอฮอล์เป็นสารเติมแต่งในน้ำมันเนื่องจากเป็นเชื้อเพลิงที่สะอาดกว่า
แอลกอฮอล์เหล่านี้เมื่อเผาไหม้ในอากาศที่เพียงพอ (ออกซิเจน) จะทำให้เกิดก๊าซคาร์บอนไดออกไซด์และน้ำเท่านั้น
เอสเทอร์
เอสเทอร์เป็นสารที่มีกลิ่นหวานซึ่งส่วนใหญ่เกิดจากปฏิกิริยาของกรดและแอลกอฮอล์ (ดูภาพด้านล่าง - แสดงการก่อตัวของเอสเทอร์)
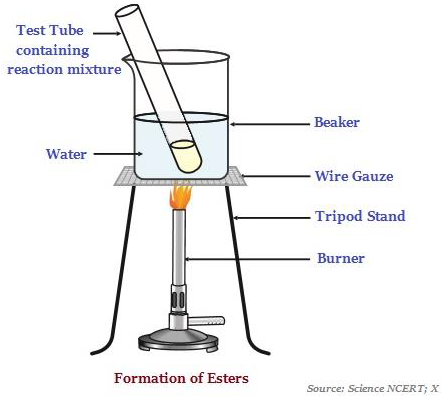
เมื่อเอสเทอร์ทำปฏิกิริยาต่อหน้ากรดหรือเบสจะให้แอลกอฮอล์และกรดคาร์บอกซิลิกกลับคืนมา
ปฏิกิริยาของเอสเทอร์กับกรดหรือเบสเรียกว่า saponification เพราะใช้ในการเตรียมสบู่
โดยปกติโมเลกุลของสบู่คือเกลือโซเดียมหรือโพแทสเซียมของกรดคาร์บอกซิลิกสายยาว
ที่น่าสนใจคือปลายไอออนิกของสบู่ละลายในน้ำในขณะที่โซ่คาร์บอนละลายในน้ำมัน คุณสมบัติทั่วไปของโมเลกุลสบู่นี้ก่อให้เกิดโครงสร้างที่เรียกว่าmicelles (ดูภาพด้านล่าง)

ในไมเซลส์ปลายด้านหนึ่งของโมเลกุลจะหันไปทางหยดน้ำมันในขณะที่ปลายไอออนิกยังคงอยู่ด้านนอก
ไมเซลล่าของสบู่ช่วยในการละลายสิ่งสกปรกในน้ำ ในทำนองเดียวกันเสื้อผ้าจะได้รับการทำความสะอาด
ในทางกลับกันผงซักฟอกมักเป็นแอมโมเนียมหรือเกลือซัลโฟเนตของกรดคาร์บอกซิลิกสายยาวซึ่งยังคงมีประสิทธิภาพแม้ในน้ำกระด้าง
โดยทั่วไปแล้วผงซักฟอกมักใช้ในการทำแชมพูและผลิตภัณฑ์อื่น ๆ สำหรับทำความสะอาดเสื้อผ้า
บทนำ
มีองค์ประกอบประมาณ 115 รายการที่เรารู้จักจนถึงทุกวันนี้
องค์ประกอบทั้งหมดจะถูกจัดเรียงตามลำดับตามคุณสมบัติซึ่งเรียกว่าตารางธาตุ
Johann Wolfgang Döbereinerนักวิทยาศาสตร์ชาวเยอรมันพยายามจัดเรียงองค์ประกอบเป็นครั้งแรกในปี พ.ศ. 2360
John Newlands นักวิทยาศาสตร์ชาวอังกฤษได้พยายามจัดองค์ประกอบที่รู้จักกันในตอนนั้นด้วย (ในปี 1866)
John Newlands ทำตามคำสั่งของการเพิ่มมวลอะตอมเพื่อจัดเรียงองค์ประกอบ
Newlands เริ่มต้นด้วยธาตุที่มีมวลอะตอมต่ำที่สุด (เช่นไฮโดรเจน) และสิ้นสุดที่ทอเรียมซึ่งเป็นธาตุที่ 56 (ในเวลานั้น)

การจัดเรียงองค์ประกอบของ Newlands เรียกว่า "Law of Octaves" ในขณะที่การจัดเรียงของเขาทุกๆแปดองค์ประกอบมีคุณสมบัติคล้ายกับองค์ประกอบแรก เช่นคุณสมบัติของลิเทียมและโซเดียมพบว่าเหมือนกัน
| สา (ทำ) | อีกครั้ง | Ga (ไมล์) | มะ (ฟะ) | Pa (งั้น) | ดา (ลา) | พรรณี (ti) |
|---|---|---|---|---|---|---|
| ซ | หลี่ | เป็น | ข | ค | น | โอ |
| ฉ | นา | มก | อัล | ศรี | ป | ส |
| Cl | เค | Ca | Cr | Ti | Mn | เฟ |
| Co & Ni | Cu | Zn | ย | ใน | เช่น | เซ |
| บ | Rb | Sr | Ce & La | Zr |
Newlands ยังเปรียบเทียบกับอ็อกเทฟที่พบในเพลง (ดูตารางที่ให้ไว้ด้านบน)
ในดนตรีอินเดียโน้ตดนตรีทั้งเจ็ด ได้แก่sa, re, ga, ma, pa, da, ni; อย่างไรก็ตามทางตะวันตกโน้ตดนตรีคือdo, re, mi, fa, so, la, ti
นอกจากนี้เพื่อให้พอดีกับองค์ประกอบบางอย่างในตารางของเขา Newlands ใส่สององค์ประกอบในเซลล์เดียวกัน (ดูตารางที่ให้ไว้ด้านบน - โคบอลต์และนิกเกิลเก็บไว้ในเซลล์เดียวกัน) แต่เทคนิคนี้ไม่ได้ผลเนื่องจากมีคุณสมบัติที่แตกต่างกัน
อย่างไรก็ตามกฎของอ็อกเทฟมีข้อ จำกัด เช่นเดียวกับแคลเซียมเท่านั้น และหลังจากแคลเซียมทุกองค์ประกอบที่แปดไม่มีคุณสมบัติคล้ายกับองค์ประกอบแรก
ตารางธาตุของMendeléev
Dmitri Ivanovich Mendeléevนักเคมีชาวรัสเซียผู้ซึ่งพยายามจัดเรียงองค์ประกอบได้สำเร็จ
Mendeléevจัดเรียงองค์ประกอบตามคุณสมบัติพื้นฐาน (องค์ประกอบ) มวลอะตอมรวมถึงความคล้ายคลึงกันของคุณสมบัติทางเคมี
ในช่วงเวลาของเมนเดเลเยฟมีเพียง 63 องค์ประกอบเท่านั้นที่รู้จัก
ตารางธาตุของMendeléevประกอบด้วยคอลัมน์แนวตั้งที่เรียกว่า ‘groups’ และแถวแนวนอนที่เรียกว่า ‘periods.’

กฎหมายประจำงวดของMendeléevระบุว่า
'คุณสมบัติของธาตุคือฟังก์ชันคาบของมวลอะตอม'
Mendeléevจัดเรียงลำดับแบบกลับด้านเพื่อให้องค์ประกอบที่มีคุณสมบัติคล้ายกันสามารถจัดกลุ่มเข้าด้วยกันได้
Mendeléevเหลือพื้นที่สำหรับองค์ประกอบบางอย่างซึ่งยังไม่ถูกค้นพบในเวลานั้น เขาทำนายอย่างกล้าหาญเกี่ยวกับการมีอยู่ขององค์ประกอบในอนาคต
ข้อ จำกัด ที่ใหญ่ที่สุดอย่างหนึ่งของสูตรธาตุของMendeléevคือ - ไม่มีการกำหนดตำแหน่งตายตัวให้กับไฮโดรเจนในตารางธาตุ
ตารางธาตุสมัยใหม่
ในปีพ. ศ. 2456 Henry Moseley นักฟิสิกส์ชาวอังกฤษได้ค้นพบว่าเลขอะตอมของธาตุเป็นคุณสมบัติพื้นฐานที่มากกว่าเมื่อเปรียบเทียบกับมวลอะตอมของมัน
จากการค้นพบของ Moseley กฎธาตุของMendeléevได้รับการแก้ไขและใช้เลขอะตอมเป็นพื้นฐานของตารางธาตุสมัยใหม่
กฎหมายเป็นระยะ ๆ สมัยใหม่ -
'คุณสมบัติของธาตุเป็นฟังก์ชันคาบเลขอะตอม'
18 คอลัมน์แนวตั้งที่เรียกว่า "groups'และ 7 แถวแนวนอนที่เรียกว่า 'จุด' ถูกกำหนดไว้ในตารางธาตุสมัยใหม่
ในตารางธาตุสมัยใหม่องค์ประกอบต่างๆจะถูกจัดเรียงในลักษณะที่แสดงคุณสมบัติเป็นระยะ ๆ เช่นขนาดอะตอมความจุหรือความสามารถในการรวมและลักษณะของโลหะและอโลหะ (ของธาตุ)
ในตารางธาตุสมัยใหม่อักขระโลหะจะลดลงในช่วงเวลาหนึ่งและเพิ่มขึ้นตามกลุ่ม
ในทางกลับกันอโลหะเป็นอิเล็กโทรเนกาติวิตีเนื่องจากมีแนวโน้มที่จะสร้างพันธะโดยรับอิเล็กตรอน
ในตารางธาตุสมัยใหม่อโลหะจะถูกวางไว้ทางด้านขวามือ (จากด้านบน)
บทนำ
เสื้อผ้าที่เราสวมใส่ประกอบด้วยผ้าและผ้าทำจากเส้นใยซึ่งได้มาจากแหล่งธรรมชาติหรือเทียม
แหล่งที่มาตามธรรมชาติของเส้นใยคือฝ้ายขนสัตว์ไหม ฯลฯ ซึ่งได้มาจากพืชหรือสัตว์
เส้นใยสังเคราะห์ถูกสร้างขึ้นโดยมนุษย์ ดังนั้นจึงเรียกว่าเส้นใยสังเคราะห์หรือเส้นใยที่มนุษย์สร้างขึ้น
เส้นใยสังเคราะห์มักเป็นโซ่ของหน่วยเล็ก ๆ ที่เชื่อมต่อกัน หน่วยเล็ก ๆ แต่ละหน่วยเป็นสารเคมี
ประเภทของเส้นใยสังเคราะห์
โดยปกติผ้าไหมเทียมจะเรียกว่า Rayon.
เรยอน (เส้นใย) ได้มาจากการบำบัดทางเคมีของเยื่อไม้
เส้นใยที่เตรียมจากถ่านหินน้ำและอากาศเรียกว่า Nylon.

ไนลอนเป็นเส้นใยสังเคราะห์ชนิดแรก
Polyesterยังเป็นใยสังเคราะห์ เป็นไฟเบอร์ที่ปราศจากริ้วรอย เช่น Terylene.
PET เป็นโพลีเอสเทอร์รูปแบบหนึ่งที่คุ้นเคยและใช้สำหรับทำเครื่องใช้ขวดฟิล์มสายไฟและผลิตภัณฑ์ที่มีประโยชน์อื่น ๆ อีกมากมาย
โพลีเอสเตอร์ (Poly + ester) ประกอบด้วยหน่วยการทำซ้ำของสารเคมีที่เรียกว่าเอสเทอร์
พลาสติกยังเป็นประเภทของโพลีเมอร์เช่นเดียวกับใยสังเคราะห์
Polythene (Poly + ethene) เป็นตัวอย่างทั่วไปของพลาสติก
มีพลาสติกบางชนิดซึ่งเมื่อขึ้นรูปครั้งเดียวไม่สามารถทำให้นิ่มได้ด้วยความร้อน ดังนั้นจึงเรียกว่าพลาสติกเทอร์โมเซตติง เช่น Bakelite และเมลามีน
Bakelite เป็นตัวนำความร้อนและไฟฟ้าที่ไม่ดี ดังนั้นจึงใช้ในการทำสวิตช์ไฟฟ้าที่จับของเครื่องใช้ต่างๆ ฯลฯ
เมลามีนทนไฟและทนความร้อนได้ดีกว่าพลาสติกชนิดอื่น จึงใช้สำหรับทำกระเบื้องปูพื้นเครื่องครัวและผ้า
วัสดุที่ถูกย่อยสลายโดยกระบวนการทางธรรมชาติเช่นการกระทำของแบคทีเรียเรียกว่าย่อยสลายได้ทางชีวภาพ
วัสดุที่ไม่สามารถย่อยสลายได้ง่ายด้วยกระบวนการทางธรรมชาติเรียกว่าไม่ย่อยสลายทางชีวภาพ
พลาสติกไม่เป็นมิตรต่อสิ่งแวดล้อม
บทนำ
ทรัพยากรซึ่งมีอยู่ในปริมาณที่ไม่ จำกัด ในธรรมชาติและไม่น่าจะหมดไปจากกิจกรรมของมนุษย์เรียกว่า Inexhaustible Natural Resources. เช่นแสงแดดอากาศ
ทรัพยากรซึ่งมีอยู่ในปริมาณที่ จำกัด ในธรรมชาติและมีแนวโน้มที่จะหมดไปจากกิจกรรมของมนุษย์เรียกว่า Exhaustible Natural Resources. เช่นป่าไม้สัตว์ป่าแร่ธาตุถ่านหินปิโตรเลียมก๊าซธรรมชาติเป็นต้น
ทรัพยากรธรรมชาติที่หมดไปเกิดขึ้นจากซากสิ่งมีชีวิตที่ตายแล้ว (ฟอสซิล) ดังนั้นทรัพยากรธรรมชาติเหล่านี้จึงเรียกอีกอย่างหนึ่งว่าfossil fuels. เช่นถ่านหินปิโตรเลียมและก๊าซธรรมชาติ
ถ่านหิน
ถ่านหินแข็งเหมือนหินและมีสีดำ
ถ่านหินเป็นเชื้อเพลิงชนิดหนึ่งที่ใช้ปรุงอาหาร

ถ่านหินถูกใช้ในโรงไฟฟ้าพลังความร้อนเพื่อผลิตไฟฟ้า
ภายใต้ความกดดันและอุณหภูมิสูงพืชที่ตายแล้วที่ฝังอยู่ในโลกจะถูกเปลี่ยนเป็นถ่านหินอย่างช้าๆ
ถ่านหินมีคาร์บอนเป็นหลัก
กระบวนการที่ช้าในการเปลี่ยนพืชที่ตายแล้วเป็นถ่านหินเรียกว่าคาร์บอไนเซชัน
ถ่านหินเกิดจากซากพืชพันธุ์ ดังนั้นจึงเรียกอีกอย่างหนึ่งว่าเชื้อเพลิงฟอสซิล
เมื่อถ่านหินเผาไหม้จะก่อให้เกิดก๊าซคาร์บอนไดออกไซด์เป็นหลัก
เมื่อถ่านหินถูกแปรรูปในอุตสาหกรรมจะทำให้เกิดผลิตภัณฑ์ที่มีประโยชน์เช่นโค้กน้ำมันดินและก๊าซถ่านหิน
Coke เป็นสารที่แข็งมีรูพรุนและมีสีดำ
โค้กเป็นคาร์บอนบริสุทธิ์
โค้กส่วนใหญ่ใช้ในการผลิตเหล็กและในการสกัดโลหะหลายชนิด
น้ำมันถ่านหินเป็นของเหลวสีดำข้นมีกลิ่นไม่พึงประสงค์
น้ำมันถ่านหินมีส่วนผสมของสารประมาณ 200 ชนิด
ผลิตภัณฑ์เหล่านี้ได้มาจากน้ำมันดินถ่านหินใช้เป็นวัสดุเริ่มต้นในการผลิตสารต่างๆที่ใช้ในชีวิตประจำวันและในอุตสาหกรรม เช่นวัตถุระเบิดสีวัสดุมุงหลังคาสีสังเคราะห์ยาน้ำหอมพลาสติกวัสดุถ่ายภาพเป็นต้น
Naphthalene ballsที่ได้จากน้ำมันดินถ่านหินใช้ขับไล่แมลงเม่าและแมลงอื่น ๆ
Bitumenที่ได้จากผลิตภัณฑ์ปิโตรเลียมใช้แทนน้ำมันดินถ่านหินสำหรับทำโลหะบนถนน
ในระหว่างการแปรรูปถ่านหินเพื่อให้ได้โค้ก coal gas จะได้รับ
ในปีพ. ศ. 2353 เป็นครั้งแรกในลอนดอนสหราชอาณาจักรมีการใช้ก๊าซถ่านหินสำหรับไฟถนนและในปีพ. ศ. 2363 ในนิวยอร์กสหรัฐอเมริกา
ในปัจจุบันก๊าซถ่านหินถูกใช้เป็นแหล่งความร้อน
ปิโตรเลียม
น้ำมันเบนซินและดีเซลได้มาจากทรัพยากรธรรมชาติที่เรียกว่าปิโตรเลียม
ปิโตรเลียมถูกสร้างขึ้นจากสิ่งมีชีวิตที่อาศัยอยู่ในทะเล
กว่าหลายล้านปี (สิ่งมีชีวิตที่ตายแล้วฝังอยู่ในโลก) ในที่ที่มีอุณหภูมิสูงความดันสูงและในที่ไม่มีอากาศสิ่งมีชีวิตที่ตายแล้วจะเปลี่ยนเป็นปิโตรเลียมและก๊าซธรรมชาติ
ในปีพ. ศ. 2402 บ่อน้ำมันแห่งแรกของโลกถูกขุดขึ้นในรัฐเพนซิลเวเนียสหรัฐอเมริกา
ในปีพ. ศ. 2410 น้ำมันติดอยู่ที่ Makum ในรัฐอัสสัมประเทศอินเดีย
ในอินเดียปิโตรเลียมส่วนใหญ่พบในอัสสัมคุชราตมุมไบไฮรัฐมหาราษฏระและในแอ่งแม่น้ำของ Godavari และ Krishna
ภาพต่อไปนี้แสดงชั้นของก๊าซและน้ำมัน -

ปิโตรเลียมเป็นส่วนผสมขององค์ประกอบต่างๆเช่นน้ำมันเบนซินก๊าซปิโตรเลียมดีเซลน้ำมันหล่อลื่นขี้ผึ้งพาราฟินเป็นต้น
กระบวนการแยกองค์ประกอบต่างๆของปิโตรเลียมเรียกว่า refining.
สารที่มีประโยชน์ต่าง ๆ ซึ่งได้รับจากปิโตรเลียมและก๊าซธรรมชาติเรียกว่า 'ปิโตรเคมี'
ปิโตรเคมีถูกใช้ในการผลิตผงซักฟอกเส้นใย (โพลีเอสเตอร์ไนลอนอะคริลิก ฯลฯ ) โพลีธีนและพลาสติกอื่น ๆ ที่มนุษย์สร้างขึ้น
ก๊าซไฮโดรเจนซึ่งได้มาจากก๊าซธรรมชาติใช้ในการผลิตปุ๋ย (ยูเรีย)
เนื่องจากมีความสำคัญทางการค้าอย่างมากปิโตรเลียมจึงเรียกอีกอย่างหนึ่งว่า ‘black gold.’
โดยปกติก๊าซธรรมชาติจะถูกเก็บไว้ภายใต้ความดันสูงและด้วยเหตุนี้จึงเรียกว่า Compressed Natural Gas (CNG).
CNG ใช้สำหรับการผลิตไฟฟ้าและเชื้อเพลิงสำหรับยานยนต์
The following table illustrates various constituents of petroleum and their uses −
| องค์ประกอบของปิโตรเลียม | ใช้ |
|---|---|
| ก๊าซปิโตรเลียมในรูปของเหลว (LPG) | เชื้อเพลิงสำหรับบ้านและอุตสาหกรรม |
| น้ำมัน | น้ำมันเชื้อเพลิงเชื้อเพลิงการบินตัวทำละลายสำหรับซักแห้ง |
| ดีเซล | เชื้อเพลิงสำหรับยานยนต์หนักเครื่องกำเนิดไฟฟ้า |
| น้ำมันก๊าด | เชื้อเพลิงสำหรับเตาโคมไฟและสำหรับเครื่องบินเจ็ท |
| น้ำมันหล่อลื่น | การหล่อลื่น |
| ขี้ผึ้งพาราฟิน | ขี้ผึ้งเทียนวาสลีน ฯลฯ |
| น้ำมันดิน | สีทาพื้นถนน |
บทนำ
กระบวนการทางเคมีที่สารทำปฏิกิริยากับออกซิเจนและให้ความร้อนเรียกว่า combustion.
สารที่ผ่านการเผาไหม้เรียกว่า as combustible หรือ fuel.
เชื้อเพลิงอาจอยู่ในรูปของแข็งของเหลวหรือก๊าซ
ในระหว่างการเผาไหม้แสงจะถูกปล่อยออกมาในรูปแบบของ flame หรือเป็น glow.

สารที่กลายเป็นไอในช่วงเวลาการเผาไหม้ให้เปลวไฟ
มีสามโซนที่แตกต่างกันของโซนมืดเปลวไฟโซนส่องสว่างและโซนไม่ส่องสว่าง

สารต่างๆจะลุกเป็นไฟที่อุณหภูมิต่างกัน
อุณหภูมิต่ำสุดที่สารก่อไฟเรียกว่าของมัน ignition temperature.
การจับคู่ประกอบด้วยพลวงไตรซัลไฟด์และโพแทสเซียมคลอเรต
พื้นผิวไม้ขีดมีผงแก้วและฟอสฟอรัสแดงเล็กน้อย
ฟอสฟอรัสแดงมีอันตรายน้อยกว่ามาก
เมื่อไม้ขีดไฟกระแทกกับพื้นผิวที่ถูฟอสฟอรัสแดงบางส่วนจะถูกเปลี่ยนเป็นฟอสฟอรัสสีขาว กระบวนการนี้จะทำปฏิกิริยาทันทีกับโพแทสเซียมคลอเรตที่มีอยู่ในหัวไม้ขีดไฟและผลิตความร้อนเพียงพอที่จะจุดไฟให้พลวงไตรซัลไฟด์ ในทำนองเดียวกันการเผาไหม้จะเริ่มขึ้น
สารที่มีอุณหภูมิจุดติดไฟต่ำมากและสามารถลุกไหม้ได้ง่ายด้วยเปลวไฟเรียกว่า inflammable substances. เช่น. น้ำมันเบนซินแอลกอฮอล์ก๊าซปิโตรเลียมเหลว (LPG) ฯลฯ
เครื่องดับเพลิง
Water เป็นเครื่องดับเพลิงที่พบมากที่สุด
น้ำเป็นเครื่องดับเพลิงจะทำงานได้ก็ต่อเมื่อสิ่งต่างๆเช่นไม้และกระดาษถูกไฟไหม้

หากอุปกรณ์ไฟฟ้าเกิดไฟไหม้น้ำอาจนำไฟฟ้าและสร้างความเสียหายให้กับผู้ที่พยายามดับไฟ
นอกจากนี้น้ำยังไม่ใช่เครื่องดับเพลิงที่ดีสำหรับการเกิดเพลิงไหม้ที่เกี่ยวข้องกับน้ำมันและน้ำมัน
สำหรับเพลิงไหม้ที่เกี่ยวข้องกับอุปกรณ์ไฟฟ้าและวัสดุที่ติดไฟได้เช่นน้ำมันเบนซินคาร์บอนไดออกไซด์ (CO2) เป็นเครื่องดับเพลิงที่ดีที่สุด

วิธีหนึ่งในการรับ CO2 คือการปล่อยผงเคมีแห้งจำนวนมากเช่นโซเดียมไบคาร์บอเนต (เบกกิ้งโซดา) หรือโพแทสเซียมไบคาร์บอเนต
ฟอสฟอรัสไหม้ในอากาศที่อุณหภูมิห้อง
ปริมาณพลังงานความร้อนที่เกิดจากการเผาไหม้ที่สมบูรณ์ของเชื้อเพลิง 1 กิโลกรัมเรียกว่าเป็นพลังงาน calorific value.
ค่าความร้อนของเชื้อเพลิงวัดเป็นหน่วยที่เรียกว่ากิโลจูลต่อกิโลกรัม (kJ / kg)
The following table illustrates the Calorific Values of Different Fuels −
| เชื้อเพลิง | ค่าความร้อน (kJ / kg) |
|---|---|
| เค้กขี้วัว | 6000-8000 |
| ไม้ | 17000-22000 |
| ถ่านหิน | 25000-33000 |
| น้ำมัน | 45000 |
| น้ำมันก๊าด | 45000 |
| ดีเซล | 45000 |
| มีเทน | 50000 |
| CNG | 50000 |
| ก๊าซหุงต้ม | 55000 |
| ก๊าซชีวภาพ | 35000-40000 |
| ไฮโดรเจน | 150000 |
การเผาไหม้ของเชื้อเพลิงส่วนใหญ่ปล่อยออกมา carbon dioxide ในสิ่งแวดล้อม
ความเข้มข้นของก๊าซคาร์บอนไดออกไซด์ที่เพิ่มขึ้นในอากาศเป็นสาเหตุส่วนใหญ่ global warming.
การเพิ่มขึ้นของอุณหภูมิบรรยากาศของโลกเรียกว่า Global Warming.
ภาวะโลกร้อนทำให้ธารน้ำแข็งขั้วโลกละลายซึ่งนำไปสู่การเพิ่มขึ้นของระดับน้ำทะเลและทำให้เกิดน้ำท่วมในบริเวณชายฝั่งในที่สุด
ออกไซด์ของกำมะถันและไนโตรเจนละลายในน้ำฝนและสร้างกรด ฝนชนิดนี้เรียกว่าacid rain.