Kimya Bölüm 2 - Hızlı Kılavuz
Giriş
Kimya, maddelerin yapısı, bileşimi ve değişen özellikleri hakkında çalışan bir Doğa Bilimi dalıdır.
Kimya, bir maddenin en küçük bölümünü, yani atomu (tüm özellikleriyle birlikte) büyük maddelere (örneğin altın, gümüş, demir vb.) Ve bunların özelliklerini inceler.
Kimya ayrıca moleküller arası kuvvetleri (maddeye genel özellikleri sağlayan) ve kimyasal reaksiyonlar yoluyla maddeler arasındaki etkileşimleri de inceler.

1998'de Profesör Raymond Chang Kimyayı şu şekilde tanımladı:
"Kimya", maddenin incelenmesi ve geçirdiği değişiklikler anlamına gelir.
Kimya çalışmasının Aristoteles'in öne sürdüğü dört element teorisi ile başladığına inanılıyor.
Dört element teorisi, "ateş, hava, toprak ve su, her şeyin bir arada oluştuğu temel unsurlar olduğunu " belirtir .
Yani klasik eseri nedeniyle “The Sceptical Chymist,” Robert Boyle, kimyanın kurucu babası olarak biliniyor.
Boyle bir yasa oluşturdu ve 'Boyle Yasası' olarak popüler oldu.
Boyle yasası, bir gazın basıncı ile ilgili kabın hacmi arasındaki ilişkiyi analiz eden deneysel bir gaz yasasıdır.
Boyle, yasasını savunarak klasik 'dört element' teorisini reddetti.
Amerikalı bilim adamları Linus Pauling ve Gilbert N. Lewis topluca kimyasal bağların ve moleküler orbitallerin elektronik teorisini ortaya attılar.
Birleşmiş Milletler 2011'i 'Uluslararası Kimya Yılı' ilan etti.
Madde, kimyada dinlenme kütlesi ve hacmi olan ve ayrıca yer kaplayan herhangi bir şey olarak tanımlanır.
matter parçacıklardan oluşur.
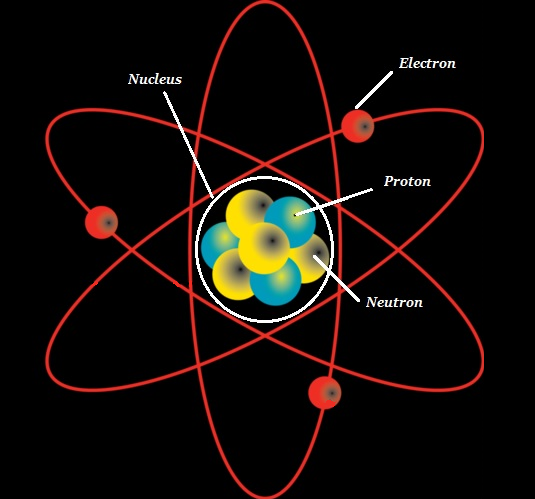
atom kimyanın temel birimidir.
Atom olarak bilinen yoğun bir çekirdekten oluşur atomic nucleus olarak bilinen bir alanla çevrilidir. electron cloud.
Çekirdek (bir atomun) şunlardan oluşur: protons (+ve charged particles) ve neutrons (neutral or uncharged particles); toplu olarak, bu ikisi olarak bilinirnucleons (aşağıda verilen resimde gösterildiği gibi).
Kimyasal element, bir maddenin saf bir şeklidir; tek tip atomdan oluşur.
Periyodik tablo, mevcut tüm kimyasal elementlerin standartlaştırılmış temsilidir.
Bir bileşik, bir maddenin saf bir şeklidir; birden fazla unsurdan oluşur.
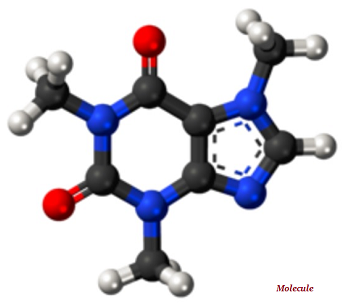
Molekül, saf bir kimyasal maddenin bölünemez en küçük parçasıdır; molekül kendine özgü kimyasal özelliklere sahiptir (aşağıda verilen resme bakınız).
Aşağıdaki tablo kimya dallarını göstermektedir -
| Şube | Alt şube | Tanım |
|---|---|---|
| Physical Chemistry | Fiziksel kimya | Moleküllerin fiziksel özelliklerinin incelenmesi |
| Kimyasal kinetik | Kimyasal reaksiyon oranlarının incelenmesi | |
| Elektrokimya | Atomların, moleküllerin, iyonların ve elektrik akımının etkileşiminin incelenmesi (yani elektrot ile elektrolit veya türler arasındaki elektron transferi) | |
| Yüzey kimyası | yüzeylerdeki kimyasal reaksiyonların incelenmesi (maddelerin) | |
| Termokimya | Kimyasal etki ile emilen ısı miktarı arasındaki ilişkiyi inceleyin | |
| Kuantum Kimyası | Kuantum mekaniğinin fiziksel modellerde uygulanmasının incelenmesi | |
| Spektroskopi | Işık veya radyasyon spektrumlarının incelenmesi | |
| Fotokimya | ışığın neden olduğu kimyasal etkilerin incelenmesi | |
| Organic Chemistry | Organik Kimya | Kimyasal (karbon) bileşiklerin yapısı, özellikleri ve hazırlanmasının incelenmesi (örneğin yakıtlar, plastikler, gıda katkı maddeleri ve ilaçlar) |
| Stereokimya | Atomların göreceli uzaysal düzeninin incelenmesi (moleküllerde) | |
| Fiziksel organik kimya | organik moleküllerde yapı ve reaktivite (karşılıklı ilişki) çalışması | |
| Polimer Kimyası | Polimer moleküllerinin incelenmesi (bileşim ve oluşturma) | |
| Organometalik Kimya | Bağ içeren kimyasalların incelenmesi (özellikle bir karbon ve bir metal arasında) | |
| Tıbbi kimya | İlaçları ve ilaçları tasarlama, geliştirme ve sentezleme çalışması | |
| Inorganic chemistry | İnorganik kimya | Organik olmayan tüm malzemelerin (mineraller, metaller, katalizörler, kristal yapılar vb.) İncelenmesi |
| Organometalik Kimya | Bağ içeren kimyasal bileşiklerin incelenmesi (özellikle karbon ve metal arasında) | |
| Katı hal Kimyası | Karbon ve metal arasındaki bağları içeren kimyasal bileşiklerin incelenmesi | |
| Nükleer Kimya | Radyoaktif maddelerin incelenmesi | |
| Jeokimya | Dünyanın kimyasal bileşiminin incelenmesi (örneğin kayalar, mineraller ve atmosfer) | |
| Biyoinorganik Kimya | Metal iyonları ve canlı doku arasındaki etkileşimlerin incelenmesi | |
| Koordinasyon Kimyası | ||
| Biochemistry | Biyokimya | Canlılarda kimyasal reaksiyonun (ve değişimlerin) incelenmesi |
| Moleküler Biyokimya | Biyomoleküllerin işlevleriyle birlikte incelenmesi | |
| Klinik Biyokimya | Canlılarda farklı hastalıkların neden olduğu kimyasal değişimlerin incelenmesi | |
| Moleküler Biyoloji | Farklı DNA, RNA ve protein biyosentezi türlerinin (ve bunların ilişkilerinin) incelenmesi | |
| Tarımsal biyokimya | Fauna (yani bitkiler) kimyasının incelenmesi | |
| Analytical Chemistry | Kimyada standartlaştırılmış deneysel yöntemlerin incelenmesi (yani bir maddenin kimyasal özelliklerinin kantitatif belirlenmesi) | |
| Astrochemistry | Evrende bulunan kimyasal elementlerin ve moleküllerin reaksiyonlarının incelenmesi | |
| Cosmochemistry | Evrende bulunan maddelerin kimyasal bileşiminin incelenmesi | |
| Environmental chemistry | Çevrede meydana gelen kimyasal ve biyokimyasal olayların incelenmesi |
Giriş
Nükleer istikrarsızlık nedeniyle parçacıkların çekirdeklerden yayılma süreci; radyoaktivite olarak bilinir.
Bu tür enerjiyi / ışınları açığa çıkaran madde radyoaktif madde olarak bilinir.
Bu tür radyoaktif maddelerden salınan görünmez ışınlar radyoaktif ışınlar olarak bilinir.
Benzer şekilde, radyoaktivite, atomların nükleer kararsızlığı nedeniyle (doğal olarak) meydana gelen nükleer bir fenomendir.
1896'da Henri Becquerel ilk olarak radyoaktivite fenomenini gözlemledi, ancak 'radyoaktivite' terimi Marie Curie tarafından icat edildi.
Marie Curie, 1898'de Polonyum ve Radyum adlı radyoaktif elementleri keşfetti.
Marie Curie, keşfi için Nobel Ödülü'nü kazandı.
Radyoaktif Işınlar
Uzun yıllar süren deneylerden sonra Ernest Rutherford, meslektaşı (Hans Geiger ve öğrencisi Ernest Marsden) ile birlikte alfa ışınlarını, beta ışınlarını ve gama ışınlarını keşfetti.
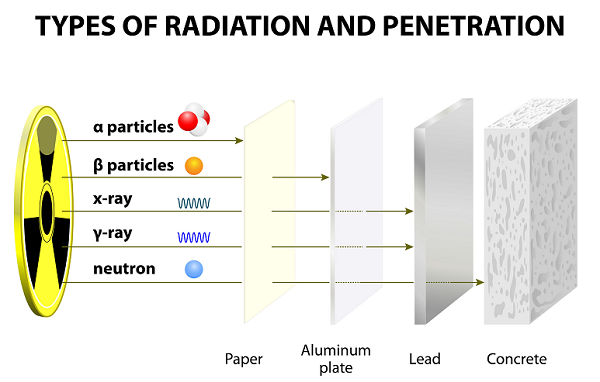
Bu ışınlar atomların parçalanması sonucu ortaya çıktı.
Alfa (α) Parçacıklar
Alfa parçacıkları genellikle birbirine sıkıca bağlanan iki proton ve iki nötrondan oluşur.
Alfa parçacıkları, radyoaktif bozunma (veya alfa bozunması) sırasında çekirdek radyo çekirdeklerinden salınır.
Alfa parçacıkları, normal helyum atomunun veya çift iyonize helyum atomunun çekirdeğiyle aynıdır.
Diğer parçacıklara (yani Gama ve Beta) kıyasla, alfa parçacıkları ağır ve yavaştır. Bu nedenle alfa parçacıkları havada çok küçük bir menzile sahiptir.
Yavaş hız nedeniyle, Alfa parçacıkları çok zayıf nüfuz etme gücüne sahiptir; bu parçacıklar ince bir kağıt tabakayla bile durdurulur (yukarıda verilen resme bakın).
Çift pozitif yüke sahip oldukları için, alfa parçacıkları oldukça iyonlaştırıcıdır.
Beta (β) Parçacıklar
Beta parçacıkları, radyoaktif bozunma (beta bozunması olarak da bilinir) sırasında bazı radyo çekirdeklerin yaydığı hızlı hareket eden elektronlardır.
Beta parçacıkları çok daha hafiftir ve tek bir negatif yük taşır.
Beta parçacıkları, alfa parçacıklarından nadiren iyonlaştırıcıdır.
Beta parçacıkları daha hafif olduğu için alfa parçacıklarından çok daha uzağa gidebilir; bununla birlikte beta parçacıkları, birkaç yaprak kağıt veya bir alüminyum levha ile durdurulabilir.
Beta parçacıkları negatif yüklüdür ve pozitif yüklü parçacıklara doğru çekilir.
Gama (ү) Parçacıklar
Gama parçacıkları, radyoaktif bozunma sırasında radyoaktif elementlerin yaydığı yüksek enerji, yani elektromanyetik enerji (foton) demetidir.
Üç parçacığın tümü (alfa, beta ve gama) arasında, gama parçacıkları en enerjik fotonlardır.
Elektromanyetik radyasyon (EMR) formu olan gama parçacıkları çekirdekten kaynaklanır.
Gama dalga boyları, üçü arasında en kısadır.
Gama parçacıklarının yükü yoktur ve nötrdürler; bu nedenle manyetik ve elektrik alanlardan etkilenmezler.
Radyoaktif Elementlerin Kullanım Alanları
Radyoaktif elementler -
Tıp alanı (birçok hastalığın tedavisi)
Endüstriyel süreç
Enerji üretimi - Nükleer reaktörler
Giriş
Nükleer reaksiyonlar, bir nükleer santralde elektrik üretmek için kullanılan muazzam miktarda enerji (nükleer enerji olarak bilinir) açığa çıkarır.

Normalde tarafından üretilen nükleer enerji nuclear fission, nuclear fusion, ve nuclear decay.
1938'de Alman kimyagerler Otto Hahn, Fritz Strassmann ve Avusturyalı fizikçi Lise Meitner, nötron bombardımanına tabi tutulan uranyum ürünlerinin kullanıldığı deneyler yaptı. Bu deneyin sonucunda, nispeten küçük nötron, büyük uranyum atomlarının çekirdeğini kabaca eşit iki parçaya böldü ve muazzam enerji saldı.
Otto Hahn ve meslektaşlarının nükleer deneyleri nükleer fisyon kadar popüler.
Nükleer Fisyon
Nükleer fisyon süreci serbest nötronlar ve gama fotonları üretirken, bunu yaparken de çok büyük miktarda enerji açığa çıkarır.
Nükleer fisyon, elektromanyetik radyasyon ve kinetik enerji formlarında büyük miktarlarda enerji açığa çıkarabilen ekzotermik bir reaksiyondur.
Nükleer fisyon, bazen bir tür radyoaktif bozulma olarak doğal olarak (yani nötron bombardımanı olmadan) meydana gelebilir.
Nükleer Fisyon Türleri
Ana Nükleer Fisyon türleri aşağıdadır -
Chain Reaction and
Fission Reaction
Bunları kısaca tartışalım -
Zincirleme tepki
Tek bir nükleer reaksiyon, bir veya daha fazla müteakip nükleer reaksiyona neden olduğunda, zincir reaksiyonu olarak bilinir.
Böyle bir zincirleme reaksiyon, kendi kendine çoğalan bir dizi nükleer reaksiyon olasılığını artırır.
Nükleer zincir reaksiyonları, reaksiyon başına diğer kimyasal reaksiyonlardan milyon kat daha fazla enerji açığa çıkarır; bu nedenle, patlayıcı veya kontrolsüz zincirleme reaksiyon olarak da bilinir.
Ağır bir atom nükleer fisyon yaşadığında, normalde iki veya daha fazla fisyon parçasına ayrılır. İşlem sırasında birkaç serbest nötron, gama ışını ve nötrino yayılır ve sonuçta büyük miktarda enerji açığa çıkar.
Aşağıda iki zincirleme reaksiyon örneği verilmiştir -
235 U + → nötron Fisyon fragmanları + 2.4 nötron + 192.9 MeV
235 Pu + → nötron Fisyon fragmanları + 2.9 nötron + 198.9 MeV
Atom bombasında, tutarlı bir enerji kaynağı gerektirdiği için zincirleme reaksiyon teknolojisi kullanılır.
Fisyon Reaksiyonları
Sürdürülebilir enerjinin serbest bırakılması için daha fazla fisyon başlatmak için nötronların (yakıt atomlarının bölünmesiyle üretilen) kullanıldığı fisyon reaksiyonu, fisyon reaksiyonları olarak bilinir.
Bu tür reaksiyonlar yavaş ve kontrol edilebilir; bu nedenle, kontrollü zincir reaksiyonu olarak da bilinir.
Güç (elektrik) üreten nükleer reaktör, kontrollü zincirleme reaksiyonun ideal bir örneğidir.
Özelliklerine ve kullanım türlerine göre fisyon / kontrollü zincir reaksiyonu şu şekilde sınıflandırılır:
Power reactors
Research reactors
Breeder reactors
Bu güç reaktörleri genellikle fisyon ürünlerinin kinetik enerjisini ısıya dönüştürür; ayrıca ısı, bir ısı motorunu çalıştıran ve sonuçta mekanik veya elektrik gücü üreten bir çalışma akışkanını ısıtmak için kullanılır.
Nükleer Reaktörün temel bileşenleri
Bir nükleer reaktörün temel bileşenleri aşağıdadır -
Nuclear fuels- Uranyum ( 233 U, 235 U), toryum (Th 232 ), plütonyum (Pu 239 ) gibi.
Moderators- Yayılan nötronları kontrol etmek için kullanılır. Örneğin yoğun su, berilyum, grafit vb.
Coolant- Reaktörü soğutmak için kullanılır. Örneğin su, buhar, helyum, CO 2 , hava, erimiş metaller vb.
Control rods- Fisyon reaksiyonunu çalıştırmak ve durdurmak için kullanılır. Örneğin kadmiyum veya bor çubuklar bu amaçla kullanılır.
Nükleer füzyon
İki hafif çekirdeğin ağır bir çekirdek oluşturmak için kaynaştığı süreç, nükleer füzyon olarak bilinir; Bu süreçte, nükleer enerji olarak bilinen muazzam miktarda enerji açığa çıkıyor.
En iyi nükleer füzyon örneği - hidrojen bombasıdır.
Bir hidrojen bombası, bir atom bombasından yaklaşık 1000 kat daha güçlüdür.
Giriş
Karakteristik olarak sert, parlak, opak olan ve ısı ve elektrik iletme özelliğine sahip olan malzeme (bir element, bileşik veya alaşım olabilir), metal olarak bilinir.
Metaller doğal olarak yer kabuğunda saf olmayan biçimde yani cevherlerde bulunur. Ve madencilik süreci ile çıkarılır.
Bilinen 118 element arasında (periyodik tablodaki) yaklaşık 91 element metaldir.

Metallerin Özellikleri
Metallerin önemli özellikleri aşağıdadır -
Metaller genellikle dövülebilirdir - bu, şeklinin kırılmadan ve çatlamadan kalıcı olarak değiştirilebileceği anlamına gelir.
Metaller eriyebilir - bunun anlamı; kolayca eritilebilir veya eritilebilir.
Metaller sünektir - bunun anlamı; ince bir sac veya tel bile herhangi bir şekilde verilebilir.
Metaller iyi ısı ve elektrik iletkenleridir; Heaver, kurşun elektrik taşımadığı için bir istisnadır.
Metaller, çeşitli metal olmayanlarla doğal olarak reaksiyona girer ve bileşikler oluşturur. Metaller, bazlar ve asitlerle reaksiyona girebilir. Örneğin 4 Na + O 2 → 2 Na 2 O (sodyum oksit), vb.
Alaşımlar
Alaşım, metalin hakim olduğu iki veya daha fazla elementin karışımının bir ürünüdür.
Arzu edilen bir ürünü üretmek veya üretmek için farklı metaller (farklı oranlarda) karıştırılır (yani alaşımlar). Örneğin paslanmaz çelik, dökme demir, alaşımlı levha vb. Gibi demir alaşımları, hem miktar hem de ticari değer açısından büyük bir orana katkıda bulunur.
Metaller genellikle korozyona karşı daha dirençli, daha az kırılgan, çekici renkler vb. Yapmak amacıyla alaşımlar yapılır.
Metal Terminolojileri
Base Metal- Kimyada baz metalin anlamı - kolayca oksitlenebilen veya aşınabilen ve ayrıca HCl (seyreltik hidroklorik asit) ile kolayca reaksiyona giren ve hidrojeni oluşturan metaldir. Örneğin demir, nikel, çinko, kurşun vb.
Ferrous Metal- "Demir içeren" Latince bir kelimedir ve "demir içeren" madde anlamına gelir. Örneğin çelik vb.
Heavy Metal- Normal metale göre çok daha yoğun olan metal, ağır metal olarak sınıflandırılır. Ağır metaller düşük konsantrasyonlarda toksik veya zehirlidir. Örneğin cıva (Hg), arsenik (As), krom (Cr), kadmiyum (Cd), talyum (Tl) ve kurşun (Pb).
Precious Metal- Ekonomik değeri yüksek nadir metalik kimyasal elemente sahip olan metalik elementler, değerli metal olarak sınıflandırılır. Örneğin platin, altın, gümüş, paladyum vb.
Noble Metal- Korozyona veya oksidasyona dayanıklı metaller. Örneğin rutenyum (Ru), rodyum (Rh), paladyum (Pd) vb.
Metallerin Uygulanması
Metallerin önemli uygulamaları aşağıdadır -
Metaller iyi ısı ve elektrik iletkenleri olduğundan; bu nedenle, elektrik teli olarak ve elektrik motorları dahil diğer birçok elektrikli cihazda kullanılır. Örneğin bakır, gümüş, alüminyum vb.
Ağır metaller, köprü, havuz inşaatlarında ve bunun gibi pek çok amaçla kullanılmaktadır.
Mutfak eşyaları, tencere, soba vb. Gibi çeşitli ev eşyalarını üretmek için birçok metal kullanılır.
Metaller, basit bir tornavidadan ağır bir çubuk silindirine kadar pek çok alet türünü üretmek için sıklıkla kullanılır.
Değerli metaller güzel bir görünüme sahiptir ve çekicidirler (örneğin altın, gümüş vb.); bu nedenle süs eşyası olarak kullanılırlar.
Hassas ekipmanı aşırı ısınmadan koruyan ısı alıcıları için bazı özel metaller kullanılır.
Nükleer enerjinin üretiminde radyoaktif metaller (örneğin uranyum ve plütonyum) kullanılır.
Cıva, oda sıcaklığında sıvı halde kalan bir metaldir; termometrede kullanılır.
Metallerin özelliklerini, üretimi ve saflaştırılmasını inceleyen bilim ve teknoloji dalı olarak bilinir. metallurgy.
Doğal olarak oluşan katı inorganik madde, mineral.
Değerli mineral veya metalin çıkarılabileceği doğal olarak oluşan katı malzeme olarak bilinir. ore.
Aşağıdaki tablo ana elementleri ve cevherlerini göstermektedir -
| Eleman | Cevher | Kimyasal bileşim |
|---|---|---|
| Alüminyum | Boksit | Al 2 O 3 2H 2 O |
| Korindon | Al 2 O 3 | |
| Kryolit | Na 3 AlF 6 | |
| Dispor | Al 2 O 3 .H 2 O | |
| Bakır | Bakır Pirit | ÖZELLİKLER 2 |
| Malakit | 2CuCO 3 Cu (OH) 2 | |
| Demir | Hematit | Fe 2 O 3 |
| Manyetit | Fe 3 O 4 | |
| Siderit | FeCO 3 | |
| Sodyum | Sodyum karbonat | Na 2 CO 3 |
| Sodyum klorit | NaCl | |
| Sodyum nitrat | NaNO 3 | |
| Sodyum sülfat | Na 2 SO 4 | |
| Potasyum | Potasyum klorür | KCl |
| Potasyum karbonat | K 2 CO 3 | |
| Potasyum nitrat | KNO 3 | |
| Magnezyum | Manyezit | MgCO 3 |
| Dolomit | CaMg (CO 3 ) 2 | |
| Epsom tuzu | MgSO 4 | |
| Kalsiyum | Kalsiyum karbonat | CaCO 3 |
| Teneke | Kasiterit | SnO 2 |
| Öncülük etmek | Galen | PbS |
| Serüsit | PbCO 3 | |
| Anglezit | PbSO 4 | |
| Gümüş | Arjantin | Ag 2 S |
| Tetrahedrit | Şb 4 S 3 | |
| Çinko | Çinko Karbonat (kalamin olarak bilinir) | ZnCO 3 |
| Çinko Sülfür | ZnS | |
| Merkür | Cinnabar | HgS |
| Manganez | Pirolüzit | MnO 2 |
| Fosforlu | Fosforit | Ca 3 (PO 4 ) 2 |
| Florapatit | Ca 5 (PO 4 ) 3 F | |
| Klorapatit | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Altın | Kalaverit | AuTe 2 |
| Sylvanit | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzit | Ag 3 AuTe 2 | |
| Antimon | Stibnit | Şb 2 S 3 |
| Stibikonit | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Kobalt | Kobaltit | CoAsS |
| Nikel | Pentlandit | ((Ni, Fe) S) |
| Krom | Kromit | (FeCr 2 O 4 ) |
Giriş
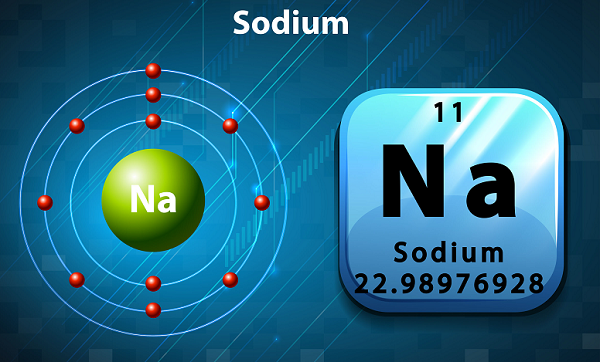
Sodyum, yumuşak, gümüşi bir renk ve oldukça reaktif bir alkali metaldir.
Periyodik tabloda Sodyum dış kabuğunda tek elektron olduğu için grup 1'de tutulur.
Sodyumun sembolü 'Na,'aslında Latince kelimeden alınmıştır ‘natrium.’
Bolluk açısından sodyum, Dünya'nın kabuğunda bulunan altıncı elementtir.
Sodyum, feldispatlar, sodalit ve kaya tuzu (NaCl) dahil olmak üzere çeşitli minerallerde bulunur.
1807'de Humphry Davy, ilk olarak sodyum hidroksitin elektroliziyle sodyumu izole etti.
Zamanla, 20 sodyum izotopu biliniyor, ancak bunların arasında sadece 23 Na kararlı.
Sodyumun Göze Çarpan Özellikleri
Sodyum elementinin başlıca özellikleri aşağıdadır -
Sodyum metali bıçakla kolayca kesilebilen yumuşak bir elementtir.
Sodyum, iyi bir ısı ve elektrik iletkenidir.
Düşük atomik kütleye ve geniş atom yarıçapına sahip olduğu için sodyum en az yoğun elementlerden biridir (üçüncü en az yoğun element - ilk ikisi lityum ve potasyumdur).
Sodyum su üzerinde yüzebilir.
Bileşikleri boyunca sodyum sarı renkte parlar (aşağıdaki resme bakın).

Sodyum bileşiklerinin ticari önemi çok yüksektir ve cam, kağıt, sabun ve tekstil endüstrilerinde yüksek talep vardır.
Sodyum Bileşikleri
Aşağıda, sodyum bileşiklerinin bazı önemli örnekleri verilmiştir -
Sofra tuzu - (NaCl)
Soda külü - (Na 2 CO 3 )
Kabartma tozu - (NaHCO 3 )
Kostik soda - (NaOH)
Sodyum nitrat - (NaNO 3 )
Sodyum tiyosülfat - (Na 2 S 2 O 3 · 5 H 2 O)
Boraks - (Na 2 B 4 O 7 · 10H 2 O)
Sodyum Oluşumu
Dünya'nın kabuğu yaklaşık% 2.27 sodyum içerir.
Sodyum en çok bulunan 5. metaldir; diğer dördü alüminyum, demir, kalsiyum ve magnezyumdur.
Okyanus suyunda, litre başına yaklaşık 1.08 × 104 miligram sodyum bulundu.
Sodyum, oldukça reaktif olduğu için saf bir element olarak bulunmaz.
Sodyumun Kullanım Alanları
Sodyumun başlıca kullanımları aşağıdadır -
Sodyum klorür, bir koruyucunun yanı sıra buzlanmayı önleme ve buz çözme için oldukça kullanışlıdır.
Pişirmede sodyum bikarbonat kullanılır.
Sodyum ve bazı bileşikleri ilaçlarda kullanılmaktadır.
Daha iyi bir iyon olan potasyuma kıyasla sodyum, fiyatı ve atom ağırlığı düşük olduğu için daha sık kullanılır.
Organik kimyada sodyum hidrit, çeşitli reaksiyonlar olarak kullanılır.
Metalik sodyum esas olarak sodyum borohidrür, sodyum trifenilfosfin, azid, indigo vb. Üretiminde kullanılır.
Bazı hızlı reaktörlerde, sıvı sodyum, iyi ısı iletkenliği özelliğine sahip olduğu için bir ısı transfer sıvısı olarak kullanılır.
Kan basıncını, kan hacmini, ozmotik dengeyi ve pH değerini düzenlediği için sodyum aynı zamanda insan sağlığı için de gerekli bir mineraldir.
Sağlıklı bir insan vücudu için her gün minimum miktarda 500 miligram sodyum gereklidir.
Giriş
Kalsiyum, büyük ölçüde Dünya'nın kabuğunda bulunan yumuşak, grimsi-sarı bir alkali elementtir.
Kalsiyumun sembolü “Ca” ve atom numarası “20.”
Oldukça reaktif olduğu için serbest kalsiyum doğada neredeyse hiç bulunmaz.
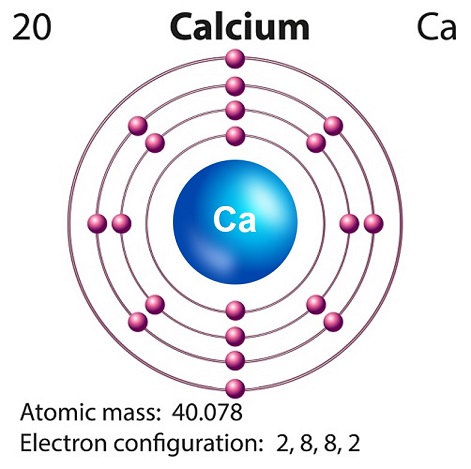
Kalsiyum genellikle süpernova nükleosentezinde üretilir.
Kalsiyumun Göze Çarpan Özellikleri
Kalsiyum, birçok hayvanda bulunan kütlece en bol bulunan metallerden biridir.
Kalsiyum diş, kemik ve kabukların çok önemli bir bileşenidir.
Kalsiyum karbonat ve kalsiyum sitrat, iyi bir sağlık için gerekli olan başlıca besin takviyeleridir.
Dünya Sağlık Örgütü (WHO) kalsiyumu Temel İlaçlar olarak listeledi.
Diğer metallerle karşılaştırıldığında, kalsiyum iyonu ve diğer kalsiyum bileşiklerinin çoğu düşük toksisiteye sahiptir.
Kalsiyum su veya asitle temas ederse onlarla reaksiyona girer ve tehlikeli hale gelir.
Kalsiyum hava ile temas ederse, hızla reaksiyona girer ve gri-beyaz bir kalsiyum nitrür ve kalsiyum oksit tabakası oluşturur.
Kalsiyum tuzlarının çoğu normalde renksizdir.
Kalsiyum yandığında, alevin rengi tuğla kırmızısı görünür (aşağıdaki resme bakın).

Kalsiyum metali, alüminyum veya bakırdan nispeten daha yüksek bir elektrik direncine sahiptir.
Oluşum
Kalsiyum genellikle tortul kayaçlarda bulunur.
Kalsiyumun bulunduğu mineraller (tortul) kalsit, dolomit ve alçıdır.
Kalsiyum ayrıca magmatik ve metamorfik kayaçlarda, çoğunlukla amfiboller, plajiyoklazlar, piroksenler ve granatlar gibi silikat minerallerinde bulunur.
Kalsiyum ayrıca süt ürünleri, badem, fındık, soya fasulyesi, brokoli, karahindiba yaprağı, incir ve daha birçok gıda ürününde bulunur.
Kalsiyum Bileşikleri
Kalsiyum oksit - CaO
Kalsiyum hidroksit - Ca (OH) 2
Kalsiyum klorür - CaCl 2
Kalsiyum hipoklorit (Ağartma tozu) - Ca (ClO) 2
Kalsiyum fosfat - Ca 3 (PO 4 ) 2
Kalsiyumun Kullanım Alanları
Kalsiyumun geniş bir kullanım alanı vardır, bunların en önemlileri -
Çimento üretiminde kalsiyum karbonat (CaCO 3 ) kullanılmaktadır.
Diş macunu yapımında da kalsiyum karbonat (CaCO 3 ) kullanılır.
İnsektisitlerde kalsiyum arsenat (Ca 3 (AsO 4 ) 2 ) kullanılır.
Kalsiyum klorür (CaCl 2 ), buzun giderilmesinde ve toz kontrolünde kullanılır.
Kalsiyum sitrat (Ca 3 (C 6 H 5 O 7 ) 2 ) yaygın olarak gıda koruyucu olarak kullanılır.
Kalsiyum glukonat (Ca (C 6 H 11 O 7 ) 2 ) vitamin haplarında olduğu kadar gıda katkı maddesi olarak da sıklıkla kullanılmaktadır.
Kalsiyum hipoklorit (Ca (OCl) 2 ) genellikle yüzme havuzu dezenfektanı, ağartma maddesi olarak kullanılır.
Giriş
Simli-beyaz renkli, yumuşak, manyetik olmayan ve sünek metal özelliğine sahip metal, alüminyum olarak bilinir.
Alüminyumun sembolü ‘Al’ ve atom numarası ‘13.’
Kimyasal element alüminyum, bor grubuna aittir.

- Boksit, alüminyumun ana cevheridir.
Alüminyumun Göze Çarpan Özellikleri
Alüminyum metal kimyasal olarak reaktif bir elementtir.
Alüminyum, korozyona direnme potansiyeline sahiptir ve bu dirençlilik süreci pasifleştirme olarak bilinir.
Alüminyum nispeten dayanıklı, hafif, yumuşak, dövülebilir ve sünek bir metaldir.
Alüminyum manyetik değildir ve kolay tutuşmaz.
Bir alüminyum film, gelen ışınların yüzde 90'ından fazlasını yansıttığı için görünür ışığın çok iyi bir yansıtıcısıdır.
Alüminyum genellikle su ile reaksiyona girer ve hidrojeni oluşturur.
Alüminyum düşük yoğunluklu bir metaldir ve korozyona karşı dayanıklılık özelliğine sahiptir.
Alüminyum, ısı ve elektrik iletkenliği özelliğine sahiptir ve bu nedenle iyi bir iletkendir.
Alüminyum Oluşumu
Alüminyum, yer kabuğunun (yaklaşık) yüzde 8'ini oluşturur.
Oksijen ve silikondan sonra alüminyum en çok bulunan üçüncü elementtir; ancak kabukta en bol bulunan metaldir.
Hidrojen, magnezyum ile birleştiğinde kararlı alüminyum oluşturur.
Alüminyum, oksitler veya silikat hallerinde doğal olarak bulunur.
Alüminyum Bileşikleri
Aşağıdakiler alüminyumun başlıca bileşikleridir -
Alümina - Al 2 O 3
Alüminyum klorür - AlCl 3
Alüminyum sülfat - Al 2 (SO 4 ) 3
Alüminyum hidroksit - Al (OH) 3
Alüminyum karbür - Al 4 C 3
Alüminyum Kullanımı
Alüminyum, endüstrilerde olduğu kadar günlük yaşamda da geniş bir kullanım alanına sahiptir; önemli olan -
Alüminyum, demiryolu, otomobil, uçak, uzay aracı, kamyon, deniz aracı, bisiklet vb. Ulaşım endüstrilerinde kullanılmaktadır.
Alüminyum, bazı özel malzemelerin paketlenmesinde kullanılır.
Alüminyum, kapı, pencere, inşaat teli, mantolama, çatı kaplama vb. Yapımlarında kullanılır.
Elektrik teli yapımında büyük ölçüde alüminyum kullanılır.
Alüminyum, ev aletleri ve mutfak aletleri gibi diğer birçok ev eşyasının yapımında kullanılır.
Alüminyum beyzbol sopalarında, saatlerde ve daha pek çok türde malzemede kullanılır.
Fotoğraf ekipmanlarında alüminyum kullanılmaktadır.
Alüminyum elektronik cihazlarda kullanılmaktadır.
Alüminyum, iyi bir ışık reflektörü olduğu için ışık reflektörü olarak kullanılır; temelde bazı malzemeler ışığı yansıtmak için özel olarak alüminyum kaplıdır.
Alüminyum, hidroklorik asit ile reaksiyona girerek hidrojen gazı üretiminde kullanılır.
Alüminyum, müzik aletlerinin üretiminde kullanılmaktadır.
Giriş
Magnezyum parlak gri katı bir elementtir.
Magnezyumun sembolü ‘Mg’ ve atom numarası ‘12.’

Dünya pazar payının yaklaşık% 80'i ile Çin, en büyük magnezyum tedarikçisidir.
Magnezyumun Göze Çarpan Özellikleri
Magnezyum yoğunluğu, alüminyumun üçte ikisidir.
Dünyanın tüm alkali metalleri arasında magnezyum en düşük erime noktasına (yani yaklaşık 1,202 0 F) ve en düşük kaynama noktasına (yaklaşık 1,994 0 F) sahiptir.
Magnezyum genellikle oda sıcaklığında suyla reaksiyona girer.
Bazen magnezyum, termit için ateşleyici olarak da kullanılır.
Magnezyum havada yandığında, güçlü ultraviyole dalga boylarını da içeren parlak beyaz bir ışık üretir.

Magnezyum yandığında yoğun, parlak ve beyaz ışık üretir (yukarıdaki resme bakın).
Magnezyum Oluşumu
Kütle olarak magnezyum, Dünya'nın kabuğunda bulunan en bol sekizinci elementtir.
Magnezyum genellikle büyük magnezit, dolomit ve benzeri mineral birikintilerinde bulunur.
Çözünür magnezyum iyonu maden suyunda bulunur.
Sodyum ve klordan sonra magnezyum, deniz suyunda çözünen en çok bulunan üçüncü elementtir.
Magnezyum doğal olarak yalnızca diğer bazı elementlerle birlikte oluşur.
Kütle ile, magnezyum 11'dir inci insan vücudundaki en bol elemanı ve tüm hücre ve enzimler için gereklidir.
Magnezyum iyonları sıklıkla ATP, DNA ve RNA dahil polifosfat bileşikleriyle etkileşime girer.
Magnezyum Bileşikleri
Aşağıdakiler magnezyumun ana bileşikleridir -
Magnezyum karbonat - MgCO 3
Magnezyum klorür - MgCl 2
Magnezyum sitrat - C 6 H 6 MgO 7
Magnezyum hidroksit - Mg (OH) 2
Magnezyum oksit - MgO
Magnezyum sülfat - MgSO 4
Magnezyum sülfat heptahidrat - (MgSO 4 · 7H 2 O)
Magnezyum sülfat heptahidrat genellikle şu şekilde bilinir: Epsom salt.
Magnezyum Kullanım Alanları
Magnezyumun hayatımızda geniş bir kullanım alanı vardır; ancak, magnezyumun bazı önemli kullanımları -
Demir ve alüminyumdan sonra en çok kullanılan üçüncü element magnezyumdur.
Magnezyum, özellikle süper güçlü, hafif malzemeler ve alaşımlarda kullanılır.
Magnezyum, uçak endüstrisinde motor malzemesi olarak da kullanılmaktadır.
Magnezyum ayrıca çözücüleri saflaştırmak için kullanılır; süper kuru etanolün hazırlanmasında olduğu gibi.
Mercedes, Porsche, BMW, Volkswagen, Chevrolet gibi otomotiv büyük markalarının çoğu, yüksek kaliteli otomobillerinin yapımında magnezyum kullanıyor.
Düşük ağırlığı ve iyi elektriksel ve mekanik özelliklere sahip olması nedeniyle, magnezyum genellikle dizüstü bilgisayarlar ve tablet bilgisayarlar, cep telefonları, kameralar ve diğer birçok elektronik bileşenin üretiminde kullanılır.
Magnezyum sülfit genellikle kağıt imalatında kullanılır.
Giriş
Manganez, genellikle demir ile birlikte bulunan kimyasal bir elementtir.
Manganezin sembolü ‘Mn’ ve atom numarası ’25.’
Manganez, endüstriyel kullanım için çok önemli bir metaldir.

1774'te, Johan Gottlieb Gahn, ilk kez 1774'te saf olmayan bir manganez metal numunesini izole etti.
Manganezin Özellikleri
Manganezin başlıca özellikleri ve özellikleri aşağıdadır -
Demire benzer şekilde manganez gümüşi gri bir metaldir.
Manganez kolayca oksitlenebilir, ancak çok sert ve kırılgan olduğu için onu kaynaştırması çok zordur.
Havada manganez yavaşça kararır (oksitlenme).
Manganez, demir grubunun bir parçası olan bir elementtir.
Manganez Oluşumu
Manganez 12'dir inci yerkabuğunun en bol unsuru.
Toprak genellikle ortalama 440 ppm ile yaklaşık 7–9000 ppm manganez içerir.
Deniz suyunda yalnızca yaklaşık 10 ppm manganez vardır; oysa atmosfer yaklaşık 0.01 µg / m3 içerir.
Pirolüzit (MnO 2 ) manganezin en önemli cevheridir.
Manganez Bileşikleri
Manganezin başlıca bileşikleri aşağıdadır -
Manganez (II) oksit - MnO
Manganez (I) oksit - Mn 2 O 3
Manganez dioksit - MnO 2
Manganez klorür - MnCl 2
Potasyum permanganat - KMnO 4
Manganez (II) sülfat - MnSO 4
Manganez (II) karbonat - MnCO 3
Manganez (II) sülfür - MnS
Manganez (II) nitrat - Mn (NO 3 ) 2
Manganez (II) bromür - MnBr 2
Manganez heptoksit - Mn 2 O 7
Dimangan dekakarbonil - C 10 O 10 Mn 2
Manganez (II) iyodür - MnI 2
Manganez (II) florür - MnF 2
Manganez Kullanım Alanları
Manganezin başlıca kullanımları aşağıdadır -
Manganez, çelik üretiminin en temel bileşenlerinden biridir.
Mangan fosfatlama, çelikte paslanma ve korozyonun önlenmesi için yaygın olarak kullanılmaktadır.
Biyolojide, manganez (II) iyonları, çok çeşitli enzimler için kofaktör görevi görür.
Manganez, fotosentetik bitkilerin oksijenle gelişen fenomeninde de önemlidir.
Manganez dioksit ayrıca oksijen ve klor üretiminde ve siyah boyaların kurutulmasında kullanılır.
Giriş
Demir, büyük ölçüde dünyanın iç ve dış çekirdeğinde bulunan en yaygın elementtir.
Demirin sembolü ‘Fe’ ve atom numarası ‘26.’

Demir, insanoğlunun kullandığı bilinen en eski elementlerden biridir.
Demirin Göze Çarpan Özellikleri
Demirin başlıca özellikleri aşağıdadır -
Saf demir element yumuşak, sünek ve dövülebilirdir.
Demirin kaynama noktası 1533 0 C ile 2450 0 C arasında değişmektedir .
Demir, mıknatısa kolayca çekilir.
Kuru havada demir inaktif kalır ve (hava ile) reaksiyona girmez; ancak nemli havada reaksiyona girer ve pas oluşturur.
Saf demir normalde saf su ile reaksiyona girmez; ancak sıradan kirli su ve pas formlarına kolayca tepki verir.
Demir, buna göre halojen ve sülfür oluşturmak için halojen ve Sülfür ile reaksiyona girer.
Demir Oluşumu
Yeryüzünün iç ve dış çekirdekleri büyük ölçüde demir ve nikelden yapılmıştır.
Büyük olasılıkla, demir, dünyanın en bol bulunan elementidir; ancak, kabuğun en bol bulunan dördüncü elementidir.
Demir Çeşitleri
Başlıca demir türleri aşağıdadır -
Hematit - Fe 2 O 3
Manyetit - Fe 3 O 4
Siderit - FeCO 3
Demir Bileşikleri
Aşağıdakiler demirin başlıca bileşikleridir -
Demir (II) oksit - FeO
Demir (III) klorür - FeCl 3
Demir (III) oksit-hidroksit - Fe (OH) 3
Demir (II) sülfit - FeS
Demir (II) klorür - FeCl 2
Demir fosfat - FePO 4
Ferrate (VI) - (FeO 4 ) 2-
Demir (II) asetat - Fe (C 2 H 3 O 2 ) 2
Demir (III) sülfit - Fe 2 S 3
Demir (III) kromat - Fe 2 (CrO 4 ) 3
Demir (II) hidroksit - Fe (OH) 2
Demir (III) asetat - C 14 H 27 Fe 3 O
Demir (II) oksalat - FeC 2 O 4
Demir (II) flurür - FeF 2
Demir Kullanım Alanları
Tüm metaller arasında en yaygın olarak demir kullanılır (dünyadaki toplam metal üretiminin yaklaşık yüzde 90'ı).
Ağır sanayilerin çoğunda demir en temel unsurdur.
Demiryolu, gemi yapımı, otomobil, mühendislik inşaatı vb. Endüstriler her yerde demir esasen gereklidir.
Giriş
Bakır yumuşak, sünek ve dövülebilir bir metaldir.
Bakırın ısı ve elektrik iletkenliği çok yüksektir.
Bakırın sembolü ‘Cu’ ve atom numarası ’29.’

Bakır (yaklaşık) c. MÖ 8000.
Bakır, c civarında cevherinden eritilen ilk metaldir. MÖ 5000.
Bakırın Göze Çarpan Özellikleri
Bakır, bir şekle (bir kalıpta) giren ilk metaldi.
Bakır, başka bir metalle başarılı bir şekilde alaşımlanan ilk metaldi, örneğin kalayla alaşımlı bakır ve bunun sonucunda bronz hazırlandı. C hakkında yapılır. MÖ 3500.
Bronz oluşturmak için bilerek başka bir metal olan kalayla alaşımlanacak ilk metal, c. MÖ 3500.
Bakırın doğal bir kırmızımsı-turuncu rengi vardır; yüzeyi açığa çıktığında görülebilir.
Bakır çok iyi bir elektrik ve ısı iletkenidir.
Bakır, periyodik tablonun 11. grubunun bir elementidir.
Bakır normalde su ile reaksiyona girmez; ancak atmosferik oksijen ile yavaş reaksiyona girerek kahverengi-siyah bakır oksit tabakası oluşturur.
Kahverengi-siyah bakır oksit genellikle altta yatan metali pasifleştirme gibi daha fazla korozyondan korur.
Pasivasyon, korozyona karşı koruyucu bir kabuk oluşturmak için kullanılan metal oksit gibi koruyucu bir malzemenin hafif bir katının kullanılması işlemidir.
Bakır Oluşumu
Bakır, yer kabuğunda yaygın olarak bulunur.
1857'de, en büyük elementel bakır kütlesi (yaklaşık 420 ton ağırlığında) keşfedildi. ABD, Michigan'da bulunan Keweenaw Yarımadası'nda bulundu.
Bakır Alaşımları
Bakırın ana bileşenini içeren metal alaşımları, bakır alaşımları olarak bilinir.
Bakır alaşımları korozyona karşı oldukça dayanıklıdır.
Bakır alaşımının en iyi (geleneksel) örneği bronzdur (kalay ve pirinç karıştırılarak yapılır).
Bakırın başlıca alaşımları aşağıdadır -
Brass
Bronze
Auricupride
Çin gümüşü
Korint bronz
Electrum, Yeşil altın
Gri altın
Niello
Panchaloha
Gül, kırmızı ve pembe altın
Spangold
Shibuichi
Tibet gümüşü
Beyaz altın
Bakır Bileşikleri
Bakırın ana bileşikleri aşağıdadır -
Bakır asetat - Cu (CH 3 COO) 2
Bakır (I) oksit - Cu 2 O
Bakır (II) oksit - CuO
Bakır (II) klorür - CuCl 2
Dicopper klorür trihidroksit - Cu 2 (OH) 3 Cl
Bakır (I) klorür - CuCl
Bakır (II) nitrat - Cu (NO 3 ) 2
Bakır Siyanür - CuCN
Bakır Kullanım Alanları
Bakır, elektrik tellerinin yapımında büyük ölçüde kullanılır.
Elektrik motorlarında bakır kullanılır.
Bakır çatılarda, sıhhi tesisatta ve diğer birçok endüstride kullanılmaktadır.
Bakır boya teknelerin ve daha birçok malzemenin boyanmasında kullanılmaktadır.
Ev aletlerinin çoğu ya saf bakırdan ya da alaşımlarından yapılmıştır.
Giriş
Gümüş, yumuşak, parlak bir geçiş ve beyaz metaldir.
Gümüş en yüksek elektriksel ve termal iletkenliğe sahiptir; ve ayrıca herhangi bir metalin en yüksek yansıtıcılığına sahiptir.

Gümüşün sembolü ‘Ag’ ve atom numarası ’47.’
Gümüşün Göze Çarpan Özellikleri
Gümüş, insanoğlunun uzun zamandan beri kullandığı değerli bir metaldir.
Gümüş, periyodik tablonun 11. grubundaki bir elementtir.
Gümüş, genellikle yüksek cilada kullanılan mükemmel bir beyaz metalik parlaklığa sahiptir.
Gümüşün rengi olmadığı için; bu nedenle yüksek yansıtma özelliğine (ışık) sahiptir.
Gümüş, çok yüksek elektriksel ve termal iletkenliğe sahiptir. Elektrik iletkenliği en yüksektir - bakırdan daha yüksektir.
Tüm metaller arasında gümüş aynı zamanda en düşük temas direncine sahiptir.
Gümüş Oluşumu
Metal gümüş genellikle Dünya'nın kabuğunda saf halde bulunur.
Gümüş ayrıca altın ve diğer bazı metallerle alaşım olarak bulundu.
Gümüş ayrıca argentit ve klorarjirit gibi bazı minerallerde de bulunur.
Gümüş büyük ölçüde altın, bakır, çinko, kurşun vb. Yan ürünleri olarak üretilir.
Gümüş Alaşımları
Gümüşün başlıca alaşımları aşağıdadır -
Argentium som gümüş
Britanya gümüşü
Doré külçe
Electrum
Goloid
Platin sterlin
som gümüş
Tibet gümüşü
Gümüş Bileşikleri
Aşağıdakiler gümüşün ana bileşiğidir -
Gümüş klorür - AgCl
Gümüş iyodür - Agl
Gümüş bromür - AgBr
Gümüş oksit - Ag 2 O
Gümüş sülfit - Ag 2 S
Gümüş florür - AgF
Gümüş siyanür - AgCN
Gümüş karbonat - Ag 2 CO 3
Gümüş asetat - AgC 2 H 3 O 2
Gümüş sülfat - Ag 2 SO 4
Gümüş kromat - Ag 2 CrO 4
Gümüş oksalat - Ag 2 C 2 O 4
Gümüş klorat - AgClO 3
Gümüşün Kullanım Alanları
Aşağıdakiler gümüşün başlıca kullanımlarıdır -
Antik dönemden beri gümüş sikke yapımında kullanılmaktadır.
Gümüş ayrıca süs yapımında da kullanılır.
Ev kaplarının ve diğer mutfak eşyalarının çoğu da gümüşten yapılırdı.
Gümüş, tıbbi cihazlarda antibiyotik kaplama olarak kullanıldığı için tıbbi olarak da kullanılmaktadır.
Elektrik iletkenliği çok yüksek olduğu için gümüş bazı elektronik cihazlarda yaygın olarak kullanılmaktadır.
Ayrıca gümüş, fotoğrafçılıkta, kimyasal ekipmanlarda, nanopartiküllerde vb.
Giriş
Altın, yerkabuğunda doğal olarak bulunan parlak, kırmızımsı sarı, yumuşak, yoğun, dövülebilir ve sünek bir metaldir.
Altının sembolü ‘Au’ ve atom numarası ‘79.’

Altın (kimyasal olarak) bir geçiş metalidir ve periyodik tablonun 11. grubuna aittir.
Altının Göze Çarpan Özellikleri
Standart koşullar altında katı halde kalan altın en az reaktif elementtir.
Altın, asitlerin çoğuna dayanıklıdır.
Altın aqua regia'da çözünür; aqua regia, nitrik asit ve hidroklorik asit karışımıdır.
Bununla birlikte, altın nitrik asitte çözünmez.
Altın genellikle siyanürün alkali çözeltilerinde çözünür.
Siyanür çözeltileri, madencilik ve elektrokaplamada yaygın olarak kullanılmaktadır.
Altın ayrıca cıva içinde çözünür ve oluşur ‘amalgam alloys.’
Altın hiçbir sıcaklıkta oksijenle reaksiyona girmez.
Altın Oluşumu
Altın genellikle serbest bir element olarak yani doğal formda bulunur.
Altın külçeler halinde veya kayalarda, tahıllarda, damarlarda ve diğer bazı alüvyal birikintilerde bulunur.
Altın ayrıca gümüş gibi doğal elementlerle (elektrum olarak) katı bir çözelti formunda oluşur.
Altın bazı yerlerde doğal olarak bakır ve paladyum ile alaşımlaşmıştır.
Altın Alaşımları
Altının başlıca alaşımları aşağıdadır -
Renkli altın
Taç altın
Electrum
Altın gül
Tumbaga
Beyaz altın
Altın Bileşikleri
Altının başlıca bileşikleri aşağıdadır -
Altın (III) klorür - AuCl 3
Altın (I) klorür - AuCl
Siyanür - CN
Kloroaurik asit - HAuCl 4
Altın (III) oksit - Au 2 O 3
Altın bromür - AuBr
Aqua regia - HNO 3 + 3HCl
Altın bromür - AuBr 3
Altın (III) hidroksit - AuH 3 O 3
Altın florür - AuF 3
Altın (V) florür - AuF 5
Altın sülfit - Au 2 S
Fulminan altın
Altın tuzları
Altın heptaflorür
Altın Kullanımı
Altın, insanoğlunun binlerce yıldır kullandığı en eski elementlerden biridir.
Oldukça kıymetli olduğu ve güzel bir görünüm sağladığı için karakteristik olarak süs yapımında kullanılır.
Son trendlere göre (dünyada) mücevher yapımında yaklaşık% 50 altın,% 40'ı yatırımlarda, kalan% 10'u sanayide kullanılıyor.
Giriş
Platin, dövülebilir, sünek, yoğun ve oldukça tepkisiz bir kimyasal elementtir.
Platinin sembolü ‘Pt’ ve atom numarası ‘78.’

Platin adı, İspanyolca bir terim olan "platina" dan türetilmiştir ve "little silver. "
Platin, dünyadaki en değerli ve en nadir metaldir (element).
Platinin Göze Çarpan Özellikleri
Platinin önemli özellikleri şunlardır -
Platin, gümüş beyaz bir metaldir.
Platin, periyodik tablonun 10. grubunun bir unsurudur.
Platin, yer kabuğundaki en nadir elementlerden biridir.
Platin, en az reaktif elementlerden biridir.
Platin altı doğal izotopa sahiptir.
Platin, en değerli ve kıymetli metallerden biridir.
Platin karakteristik olarak her koşulda korozyona dayanıklıdır. Bu nedenle asil metal olarak kabul edilir.
Platin normalde nitrik ve hidroklorik asitte çözünmez, ancak sıcak su rejiminde çözünür .
Platin , sıcak su ortamında çözüldükten sonra sulu kloroplatinik asit verir (aşağıda verilen resme bakın).

Platinum Oluşumu
Platin, genellikle doğal (doğal) platin ve diğer platin grubu ile alaşım olarak bulunur.
Platin genellikle nikel ve bakır cevherlerinde bulunur.
Platin ayrıca alüvyal kumlarda (genellikle nehirlerde bulunur) doğal olarak bulunur.
Platin, Dünya'nın kabuğunda yalnızca (yaklaşık) 0,005 ppm konsantrasyonda oluşur.
Platin Alaşımları
Platin-iridyum, platinin en önemli alaşımlarından biridir.
Platin Bileşikleri
Aşağıdakiler platinin başlıca bileşikleridir -
Platin (II) klorür - Pt Cl 2
Platin (IV) klorür - PtCl 4
Adam'ın katalizörü - PtO 2
Platin hekzaflorür - PtF 6
Potasyum tetrakloropla - K 2 PtCl 4
Krogmann tuzu - K 2 Pt (CN) 4 Br
Kloroplatinik asit - H 2 PtCl 6
Sodyum heksakloropl - Na 2 PtCl 6
Aqua regia - HNO 3 + 3HCl
Platin Kullanım Alanları
Platin, büyük ölçüde araç emisyon kontrol cihazları için kullanılır.
Platin, petrol arıtma ve diğer birçok kimyasal üretimde kullanılmaktadır.
Platin, sabit diskler (sürücüler) gibi elektronik cihazlarda kullanılır.
Platin, takılarda da kullanılmaktadır.
Platin tüm bu kullanımların dışında tıpta (kanser ilaçları), cam yapım ekipmanlarında, elektrotlarda, türbin motorlarında, yatırımlarda vb. Kullanılmaktadır.
Giriş
Periyodik tabloda çinko, 12. grubun ilk elementidir.
Çinkonun sembolü ‘Zn’ ve atom numarası ‘30.’
Kullanılabilirlik açısından, çinko 24 olduğunu inci en bol element yerkabuğunda bulunan ve beş kararlı izotopu vardır.

En yaygın çinko cevheri, bir çinko sülfit minerali olan sfalerittir (çinko blende).
Alman kimyager Andreas Sigismund Marggraf, ilk olarak 1746'da saf metalik çinkoyu keşfetti.
İlginç bir şekilde simyacılar havada çinko yaktılar ve farklı bir şey oluşturdular ve buna "philosopher's wool" veya "white snow. "
Çinkonun Göze Çarpan Özellikleri
Çinkonun rengi mavimsi beyazdır ve parlak ve diyamanyetik metaldir.
Çinko metali normalde sert ve kırılgandır; ancak sıcaklık 100 0 C'den yükseldiğinde yumuşak hale gelir.
Sıcaklık 210 0 C arttığında , çinko metal tekrar kırılgan hale gelir ve çırpılarak kolayca toz haline getirilebilir.
Çinko, bir elektrik iletkenidir.
Çinko Oluşumu
Çinko, genellikle bakır ve kurşun gibi bazı diğer baz metallerle birlikte bulunur.
Sfalerit, bir çinko sülfit şeklidir ve en yoğun şekilde çıkarılmış cevherdir.
Sfalerit, yaklaşık% 60 ila 62 çinko içerir.
Çinko Alaşımları
Başlıca çinko alaşımları aşağıdadır -
Brass
Nikel gümüş
Alman gümüşü
Çinko Bileşikleri
Çinkonun başlıca bileşikleri aşağıdadır -
Çinko oksit - ZnO
Çinko sülfür - ZnS
Çinko halojenürler - ZnF 2
Çinko nitrat - Zn (NO 3 ) 2
Çinko klorat - Zn (ClO 3 ) 2
Çinko sülfat - ZnSO 4
Çinko fosfat - Zn 3 (PO 4 ) 2
Çinko molibdat - ZnMoO 4
Çinko kromat - ZnCrO 4
Çinko arsenit - Zn (AsO 2 ) 2
Çinko asetat - Zn (O 2 CCH 3 ) 2
Çinko Kullanımı
Halk sağlığı için en önemli unsurlardan biri çinko.
Çinko, büyük ölçüde bir korozyon önleyici madde ve demir ve çelik malzemelerin kaplanması olarak kullanılır.
Çinko, genellikle çinko-hava pilinin anodu veya yakıtı olarak kullanılır.
Çinko oksit, boyalarda beyaz bir pigment (aşağıda verilen resme bakınız) olarak yaygın şekilde kullanılmaktadır.

Çinko oksit ayrıca kauçuk üretiminde katalizör olarak kullanılır.
Çinko, sağlığımız için temelde gerekli bir elementtir; normalde çinko oksit, çinko asetat veya çinko glukonat formlarında tamamlayıcı malzemeler olarak kullanılır.
Çinko normalde antioksidan malzemedir.
İnsan vücudundaki çinko eksikliği majör depresif bozukluğa neden olabilir.
Bedensel yaralanmadan sonra iyileşme sürecini hızlandırmak için çinko kullanılır.
Çinko pirition, şampuanlarda kepeği önlemek için yaygın olarak kullanılır.
Şelatlı çinko ağız kokusunu önlediği için genellikle diş macunlarında ve gargaralarda (sıvı) kullanılır.
Çinko ayrıca cildi güneş yanığından korur, bu nedenle vücut losyonlarında kullanılır.
Giriş
Cıva, genellikle 'quicksilver. '
Eskiden cıva 'hydrargyrum. '
Cıvanın sembolü ‘Hg’ ve atom numarası ‘80.’

Kırmızı pigment vermilyon, doğal zinober veya sentetik civa sülfit öğütülerek çıkarılır.
Cıva'nın Göze Çarpan Özellikleri
Cıva, ağır ve gümüşi beyaz bir metaldir.
Cıva genellikle sıvı halde bulunur; normal durumda, oda sıcaklığında sıvı halde kalan yalnızca birkaç metalik elementtir.
Cıva, zayıf ısı iletkenidir, ancak elektriğin iyi bir iletkenidir.
Cıvanın donma noktası -38.83 0 C ve kaynama noktası 356.73 0 C'dir.
Cıva zehirlenmesi, herhangi bir şekilde cıva yutulması nedeniyle ortaya çıktı. Ayrıca cıva buharının solunmasından da kaynaklanır.
Cıva, amalgam oluşturmak için altın ve gümüş dahil birçok metali çözer.
Merkür Oluşumu
Cıva, yer kabuğundaki en nadir elementlerden biridir.
En zengin cıva cevherleri yaklaşık yüzde 2,5 civa (kütle olarak) taşır.
Cıva, doğal (doğal) bir element olarak veya korderoit, zinober, livingstonit vb. Minerallerde bulunur.
Merkür genç dağ kuşağı bölgesinde bulunur; daha yoğun kayaları yer kabuğuna zorlayan kemer. Örneğin volkanik bölge ve hatta kaplıca bölgeleri.
Cıva Alaşımları
Amalgam, civanın ana alaşımıdır.
Cıva Bileşikleri
Aşağıdakiler, Merkür'ün başlıca bileşikleridir -
Cıva (II) klorür - HgCl 2
Cıva (II) oksit - HgO
Cıva sülfit - HgS
Cıva (I) - klorür - Hg 2 Cl 2
Dimethylmer - Cı 2 H 6 Hg
Cıva (II) nitrat - Hg (NO 3 ) 2
Cıva (II) asetat - C 4 H 6 O 4 Hg
Cıva (II) sülfat - HgSO 4
Cıva (I) iyodür - Hg 2 I 2
Cıva selenit - HgSe
Cıva (II) fulminat - Hg (CNO) 2
Cıva (II) bromür - HgBr 2
Cıva (II) iyodür - HgI 2
Cıva (I) oksit - Hg 2 O
Cıva (I) florür - Hg 2 F 2
Cıva amidoklorür - ClH 2 HgN
Dietil cıva - C 4 H 10 Hg
Merkür Kullanım Alanları
Cıva, büyük ölçüde kimya endüstrilerinde kullanılmaktadır.
Cıva, elektrik ve elektronik uygulamalarda kullanılır.
Sıcaklığı ölçmek için kullandığımız termometrelerde cıva kullanılmaktadır.
Civa, bileşikleriyle birlikte çeşitli ilaçlarda yaygın olarak kullanılmaktadır.
Giriş
Plütonyum temelde bir aktinit metalidir ve gümüşi gri gibi görünür.
Atom numarası 89 ile 103 arasında değişen element aktinid element olarak bilinir.
Plütonyumun sembolü ‘Pu’ ve atom numarası ‘94.’

Plütonyum normalde altı allotropa sahiptir.
Plütonyum, 'Pluto. '
Plütonyum ilk olarak 1940 yılında Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan ve Arthur C. Wahl adlı bir grup bilim adamı tarafından keşfedildi.
Plütonyumun Göze Çarpan Özellikleri
Plütonyum, radyoaktif bir kimyasal elementtir.
Plütonyum havaya maruz kaldığında kararır ve oksitlendiğinde donuk bir kaplama oluşturur.
Plütonyum, halojenler, nitrojen, karbon, silikon ve hidrojen gibi birçok elementle reaksiyona girer.
Fisyon süreci nedeniyle nötronlar salınır ve uranyum-238 çekirdeklerini plütonyum-239'a dönüştürür.
Plütonyum-239 ve plütonyum-241'in her ikisi de bölünebilirdir ve dolayısıyla bir nükleer zincir reaksiyonunu sürdürebilirler. Nükleer silahlarda ve nükleer reaktörlerde çok iyi uygulanabilir.
Plütonyumun erime noktası 640 0 C ve kaynama noktası 3,228 0 C'dir.
Helyum çekirdeğinin salınımı (yüksek enerjili), plütonyum için en yaygın radyoaktif bozunma şeklidir.
Plütonyumun Oluşumu
Plütonyum doğal olarak uranyum yataklarında yalnızca eser miktarlarda bulunur.
Plütonyum ayrıca uranyum yakılarak da çıkarılır (nükleer enerji geliştirirken).
Plütonyum Alaşımları
Plütonyumun başlıca alaşımları aşağıdadır -
Plütonyum-galyum, galyumun yanı sıra plütonyumun da önemli alaşımlarından biridir.
Plütonyum-galyum nükleer silah çukurlarında kullanılıyor.
Plütonyum-galyum, çok düşük termal genleşme özelliğine sahiptir.
Diğer bazı plütonyum alaşımları -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Plütonyum Bileşikleri
Plütonyum (IV) oksit - PuO 2
Plütonyum (III) klorür - PuCl 3
Plütonyum tetraflorür - PuF 4
Plütonyumun Kullanım Alanları
İzotop plütonyum-239, nükleer silahların geliştirilmesinde önemli unsurlardan biridir.
Plütonyum, nükleer santrallerde yakıt olarak kullanılmaktadır.
Giriş
Uranyum, periyodik tablonun aktinid serisinin metalidir.
Uranyumun sembolü ‘U’ ve atom numarası ’92.’
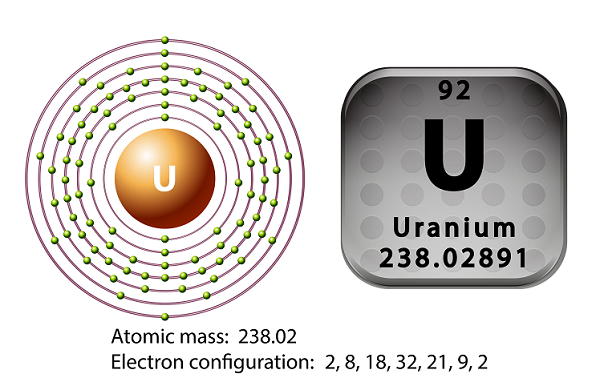
1789'da Martin Heinrich Klaproth uranyum elementini keşfetti ve ona Uranüs adını verdi.
Uranyumun Göze Çarpan Özellikleri
Uranyum, gümüşi beyaz bir metaldir.
Bir uranyum atomunda 92 elektronun yanı sıra 6'sı değerlik elektronu olan 92 proton vardır.
Kararsız izotoplara sahip olduğu için uranyum zayıf bir radyoaktif elementtir.
Uranyum-238, uranyumun en yaygın izotopudur.
Uranyum doğal olarak çok düşük konsantrasyonlarda, yani kayada, toprakta ve suda milyonda birkaç parça halinde bulunur.
Uranyum, alfa parçacığını yayarak yavaş yavaş (yavaşça) bozunur.
Uranyum zayıf elektrik iletkenliğine sahiptir (dolayısıyla zayıf elektrik iletkeni).
Uranyum dövülebilir, sünek ve marjinal olarak paramanyetiktir
Uranyumun Oluşumu
Uranyum (doğal olarak) uranyum-238, uranyum-235 ve uranyum-234 olarak bulunur.
Uranyum-238'in yarı ömrü yaklaşık 4.47 milyar yıl, neredeyse Dünya'nın yaşı ve uranyum-235'in yarı ömrü yaklaşık 704 milyon yıldır.
Uranyum alaşımları
Uranyumun başlıca alaşımları aşağıdadır -
Staballoy
Uranyum hidrit
Uranyum Bileşikleri
Aşağıdakiler, Uranyumun başlıca bileşikleridir -
Uranyum nitrür - U 2 N 3
Uranyum pentaflorür - UF 5
Uranyum karbür - UC
Uranil florür - UO 2 F 2
Uranyum dioksit - UO 2
Uranyum hekzaflorür - UF 6
Triuranium oxtoxide - U 3 O 8
Uranyum tetraflorür - UF 4
Uranyum trioksit - UO 3
Uranyum tetraklorür - Ucl 4
Uranil nitrat - UO 2 (NO 3 ) 2
Uranyum Kullanımı
Uranyum, nükleer denizaltılarda (özellikle askeri tarafından) güç kaynağı olarak kullanılır.
Uranyum, nükleer silah yapımında kullanılır.
Uranyum, gemiler için balast olarak da kullanılır.
Giriş
Kurşun ağır kimyasal bir elementtir (metal) yani yoğunluğu yüksektir.
Kurşun sembolü ‘Pb’ ve atom numarası ‘82.’

Kurşun kendini bağlama eğilimindedir; aynı şekilde zincirler, bağlar, halkalar ve çok yüzlü yapılar oluşturabilir.
Kurşunun Göze Çarpan Özellikleri
Kurşun yumuşak ve dövülebilir bir metaldir; nispeten düşük erime noktasına sahiptir.
Kurşun, nispeten tepkisiz bir unsurdur ve taahhüt bağı oluşturma eğilimindedir.
Kurşun kesildiğinde mavimsi beyaz bir ton görünür.
Kurşun yanarken mavimsi beyaz bir alev verir (aşağıdaki resme bakınız).

Kurşun bileşikleri tipik olarak +2 oksidasyon durumunda bulunur.
Kurşun Oluşumu
Kurşun, Batı Asya'nın tarih öncesi insanları tarafından bilinir.
Kurşun yer kabuğunda bulunur; nadiren yeryüzünün derinlerinde bulunur.
Kurşun genellikle kükürt ile birlikte bulunur.
Galen, çoğunlukla çinko cevherlerinde bulunan kurşun içeren ana mineraldir.
Kurşun Alaşımları
Başlıca kurşun alaşımları aşağıdadır -
Molibdochalkos (bakır)
Lehim (kalay)
Terne (kalay)
Kurşun Bileşikleri
Aşağıdakiler, kurşunun başlıca bileşikleridir -
Kurşun monoksit - PbO
Kurşun dioksit - PbO 2
Kurşun Kullanımı
Kurşun, mermi yapımında yüzlerce yıldır kullanılmaktadır.
Kurşun, genellikle su altı kabloları için koruyucu kılıf olarak kullanılır (sadece korozyon direnci özelliğine sahip olduğu için).
Kurşun levhalar, özellikle çatı malzemelerinde mimari metal olarak da kullanılmaktadır.
Asitli bataryalarda da kurşun kullanılır.
Kurşun bileşikleri genellikle renklendirici maddeler ve yarı iletkenlerdir.
Kurşun bileşikleri ayrıca plastik, mum, cam vb.
Kurşun polivinil klorürde yaygın olarak kullanılır (yani elektrik kablolarının kaplanmasında kullanılır).
Önlem
Vücutta kurşun bulunması (aşırı kalitede) beyinde ve böbreklerde ciddi hasara neden olabilir; hatta son olarak ölüme bile neden olabilir.
Giriş
Toryum, büyük miktarlarda doğal olarak oluşan radyoaktif aktinit metallerinden biridir.
Toryumun sembolü ‘Th’ ve atom numarası ’90.’

1829'da, Norveçli bir mineralog Morten Thrane Esmark, ilk kez toryumu keşfetti.
İsveçli kimyager Jöns Jacob Berzelius, onu İskandinav gök gürültüsü tanrısı 'Thor' adından sonra 'toryum' olarak tanımladı ve adlandırdı.
Toryumun Göze Çarpan Özellikleri
Toryum, paramanyetik ve yumuşak radyoaktif aktinit metaldir.
Toryum metalinin rengi simli; havaya maruz kaldığında siyaha karararak dioksit oluşturur.
Toryumun tüm izotopları kararsızdır ve zayıf bir radyoaktif elementtir.
Tüm önemli radyoaktif elementler arasında toryumun yarı ömrü en uzun olanıdır, yani yaklaşık 14.05 milyar yıldır.
Toryumun erime noktası yaklaşık 1750 0 C'dir.
Toryum Oluşumu
Toryum, Dünya oluşmadan önce mevcut haliyle var olan ilkel elementtir.
Yerkabuğunda bulunan toryum, monazit kumlarından rafine edilmiştir.
Dünya genelinde büyük miktarlarda bulunan monazit, en önemli toryum kaynağıdır.
Toryum Alaşımları
Mag-Thor ve toryum-alüminyum, toryum, Magnezyum ve alüminyumun en önemli alaşımlarıdır.
Toryum Bileşikleri
Aşağıdakiler, Toryum'un başlıca bileşikleridir -
Toryum dioksit - ThO 2
Toryum (IV) sülfür - ThS 2
Toryum (IV) iyodür - ThI 4
Toryum tetraflorür - ThF 4
Toryum (IV klorür - ThCl 4
Toryum (IV) karbür - ThC
Bazıları -
Thorite
Toryum (IV) nitrat
Toryum (IV) ortosilikat
Toryumun Kullanım Alanları
Toryum normalde gaz tungsten ark kaynağında (GTAW) kullanılır çünkü (toryum) tungsten elektrotların yüksek sıcaklık dayanımını arttırır ve buna bağlı olarak ark stabilitesini iyileştirir.
Elektronik cihazlarda, tungsten tel üzerine toryum kaplama uygulanması, ısıtılmış katotların elektron emisyonunu arttırır.
Kimya endüstrisinde toryum dioksit yani ‘thoria’ yaygın olarak kullanılmaktadır.
Giriş
Periyodik tabloda hidrojen en hafif elementtir, atom ağırlığı sadece 1.008'dir.
Hidrojenin sembolü ‘H’ ve atom numarası ‘1.’

Erken 16 inci yüzyılda, hidrojen gazı ilk yapay asitlerin ve metallerin reaksiyonu ile üretildi.
Henry Cavendish, hidrojen gazını ilk olarak 1766-81 döneminde, yandığında su ürettiği için ayrı bir madde olarak tanımıştır.
Hidrojenin Göze Çarpan Özellikleri
Plazma hallerinde, kalıntı olmayan yıldızlar esas olarak hidrojenden oluşur.
Standart sıcaklık ve basınçta, hidrojen renksiz, tatsız, kokusuz, metalik olmayan, toksik olmayan ve oldukça yanıcı iki atomlu gaz olarak görünür.
Hidrojen moleküler formülü H 2 .
Yeryüzünde hidrojen, su veya diğer organik bileşikler gibi moleküler formlarda bulunur.
Hidrojen ayrıca asit-baz reaksiyonlarında önemli bir rol oynar.
Hidrojen gazı havada oldukça yanıcıdır.
Saf hidrojen-oksijen alevleri ultraviyole ışık yayar; ayrıca, yüksek oksijen karışımı ile çıplak gözle neredeyse görünmez.
Hidrojen hemen hemen her oksitleyici elementle reaksiyona girebilir.
Oda sıcaklığında Hidrojen normalde klor ve flor ile kendiliğinden ve kısır şekilde reaksiyona girer ve karşılık gelen hidrojen halojenürlerini oluşturur.
Hidrojen Oluşumu
Tüm baryonik kütlenin yaklaşık yüzde 75'ini oluşturan hidrojen, evrende en bol bulunan kimyasal varlıktır.
Evren boyunca, hidrojen tipik olarak atomik ve plazma hallerinde bulunur; bununla birlikte, özellikler moleküler hidrojenden oldukça farklıdır.
Yeryüzünde, hidrojen atomlu gaz, örneğin, H olarak bulunur 2 .
Hidrojen, hafif olduğu için dünya atmosferinden kolaylıkla kaçar.
Hidrojen, Dünya yüzeyinde en bol bulunan üçüncü elementtir, ancak büyük ölçüde hidrokarbonlar ve su şeklinde bulunur.
Hidrojen Bileşikleri
Aşağıdakiler, hidrojenin başlıca bileşikleridir -
Su - H 2 O
Amonyak - NH 3
Hidrojen klorür - HCl
Hidrojen florür - HF
Hidrojen sülfit - H 2 S
Metan - CH 4
Hidroksit - OH -
Hidrojen bromür - HBr
Hidrojen iyodür - HI
Hidrojen siyanür - HCN
Fosfin - PH 3
Hidrojen selenid - H 2 Se
Metanol - CH 3 OH
Lityum hidrit - LiH
Bikarbonat - HCO 3
Hidrojen tellürür - H 2 Te
Sıvı hidrojen - H 2
Siyanür - CN
Kalsiyum hidrit - CaH 2
Ağır su - D 2 O
Diboran - B 2 H 6
Sodyum hidrit - NaH
Potasyum hidrit - KH
Hidrojen Kullanım Alanları
En büyük miktarda H 2 fosil yakıtların işlenmesinde ve amonyak üretiminde kullanılır.
Hidrojen (H 2 ), petrol ve kimya endüstrilerinde yaygın olarak kullanılmaktadır.
H 2 , tipik olarak, özellikle doymamış katı yağların ve sıvı yağların doygunluk düzeyini arttırmada, bir hidrojen ekleme maddesi olarak kullanılır.
H 2 de bu gibi atomik hidrojen kaynağı olarak kaynak prosedürleri, bir koruyucu gaz olarak kullanılır
Giriş
Helyum, evrendeki en hafif ikinci (hidrojenden sonra) ve en çok bulunan ikinci elementtir.
Helyumun sembolü ‘He’ ve atom numarası ‘2.’

Periyodik tabloda Helyum, asal gaz grubunda birinci sırada yer almaktadır.
Helyum, adını Yunan Güneş tanrısının adından alır.Helios. '
Helyumun Göze Çarpan Özellikleri
Helyum renksiz, kokusuz, tatsız, inert, toksik olmayan ve tek atomlu bir gazdır.
Helyumun kaynama noktası (-268.9 0 C) tüm elementler arasında en düşük olanıdır.
Helyum tipik olarak atomik yörüngelerde iki elektrondan oluşur ve iki proton ve iki nötrondan oluşan bir çekirdekle çevrelenmiştir.
Helyum Oluşumu
Evrende bulunan helyumların çoğu, helium-4Big Bang sırasında oluştuğuna inanılıyor.
Yeni helyumun büyük bir kısmı, tipik olarak Güneş dahil yıldızlarda hidrojenin nükleer füzyonuyla yaratılır.
Sürekli yeni helyum oluşumu olmasına rağmen; yine de, helyumun yeryüzündeki mevcudiyeti önemli ölçüde düşüktür, çünkü hafif bir element olduğu için uzaya kolayca kaçar.
Dünyanın heterosferinde (dış atmosfer) helyum, en bol bulunan elementlerden (gazlar) biridir.
Yerkabuğunda helyum karakteristik olarak uranyum ve toryum minerallerinde büyük miktarlarda bulunur.
Helyum Bileşikleri
Aşağıdakiler helyumun başlıca bileşikleridir -
Disodyum helid - Na 2 He
Cristobalite He II (Silikatlar) - SiO 2 He
Dihelium arsenolite - As 4 O 6 • 2HE
Helyum İzotopları
Bilinen dokuz helyum izotopu vardır, ancak aşağıdaki iki izotop en kararlı izotoplardır -
Helyum-3 ve
Helium-4
Helyumun Kullanım Alanları
Düşük yoğunluk, düşük kaynama noktası, düşük çözünürlük, yüksek ısı iletkenliği nedeniyle helyum yaygın olarak kullanılan elementtir; en popüler örnek - balonda helyum kullanılmasıdır.
Helyumun büyük bir kısmı, tıbbi MRI tarayıcılarında ve NMR spektrometrelerinde kullanılan süper iletken mıknatısların soğutulması gibi kriyojenik uygulamalara sahiptir.
Helyum ayrıca büyüyen silikon ve germanyum kristallerinde koruyucu bir gaz olarak kullanılır.
Helyum ayrıca gaz kromatografisinde ve titanyum ve zirkonyum üretiminde kullanılmaktadır.
Helyum, süpersonik rüzgar tünellerinde kullanılır.
Helyum ayrıca ark kaynağı işlemlerinde koruyucu gaz olarak uygulanır.
Giriş
Oksijen periyodik tablodaki 16. grubun üyesidir; ancak çoğu zaman grubundan farklı muamele görür.
Oksijenin sembolü ‘O’ ve atom numarası ‘8.’

Oksijen yaklaşık dokuz allotropa sahiptir ve en yaygın allotrop diatomik oksijendir (yani O 2 ). Diğer önemli allotrop Ozon yani O 3'tür .
Oksijen ilk kez İsveçli eczacı Carl Wilhelm Scheele tarafından fark edildi.
Oksijenin Göze Çarpan Özellikleri
Oksijen karakteristik olarak “kalkojen” grubunun üyesi olarak kategorize edilir.
"Kalkojen" kelimesi Yunanca bir kelime olan "khalkόs, "Bakır" anlamına gelir ve Latince-Yunanca kelime "Genēs, "Doğmuş veya üretilmiş anlamına gelir.
Oksijen, oldukça reaktif bir gazdır (veya metal olmayan bir elementtir); bu nedenle, elementlerin ve bileşiklerin çoğu ile kolayca oksit oluşturan bir oksitleyici ajandır.
Oksijen altı değerlik elektronuna sahiptir.
Oksijenin erime noktası -218,8 0 C ve kaynama noktası -183 0 C'dir.
Oksijen Oluşumu
Yaklaşık yüzde 20,8'lik payla (dünyanın toplam atmosferik bileşenlerinde) oksijen, dünya atmosferinin ikinci sırada yer alan elementidir.
Oksijen neredeyse dünyanın küresinde yani atmosfer, hidrosfer ve litosferde oluşur.
Fotosentez işlemi sırasında, tüm yeşil bitkiler tarafından serbest oksijen üretilir.
Oksijen, kurucu bakır cevherleri olarak oluşur.
Bir insan vücudu yaklaşık yüzde 65 oksijen içerir.
Kütle olarak, yer kabuğunun neredeyse yarısı oksijenden (yani oksitlerinden) oluşur.
Kütle olarak oksijen, evrende bulunan üçüncü en bol elementtir; buna göre birinci ve ikinci hidrojen ve helyumdur.
Oksijen (yani O 2 ) renksiz ve kokusuz bir iki atomlu gazdır.
Oksijen suda çok kolay çözünür; bununla birlikte, oksijenin sudaki çözünürlüğü sıcaklığa bağlıdır.
Oksijen Bileşikleri
Aşağıdakiler oksijenin ana bileşikleridir -
Oxide
Peroxide
Karbondioksit - CO 2
Hidroksit - OH -
Ozon - O 3
Cıva (II) oksit - HgO
Klorat - ClO 3
Alüminyum oksit - Al 2 O 3
Karbon monoksit - CO
Hipoklorit - ClO -
Silikon dioksit - SiO 2
Hipofloröz asit - HOF
Sodyum peroksit - Na 2 O 2
Potasyum klorat - KClO 3
Oksijen diflorür - OF 2
Sodyum oksit - Na 2 O
Oksijen Kullanımı
Oksijen (O 2 ) solunum için en temel gerekliliktir, onsuz yaşam hayal edilemez.
Oksijen tıpta kullanılır.
Oksijen tedavisi tipik olarak amfizem, zatürree, bazı kalp rahatsızlıkları gibi bazı hastalıkları tedavi etmek için kullanılır.
Tüplü dalış, denizaltı vb. Su altı aktivitelerinden bazıları da yapay oksijen kullanır.

Uçaklar, dağcılar vb. De yapay oksijen kullanır.
Oksijen ayrıca demir cevherinin çeliğe eritilmesi gibi bazı endüstrilerde de kullanılır - bu süreçte oksijen yaklaşık% 55'i kullanılır.
Giriş
Karbon, metalik olmayan ve dört değerlikli bir elementtir.
Tetravalan anlamına gelir - karbon, kovalent kimyasal bağları oluşturmak için dört elektronu kullanılabilir hale getirir.
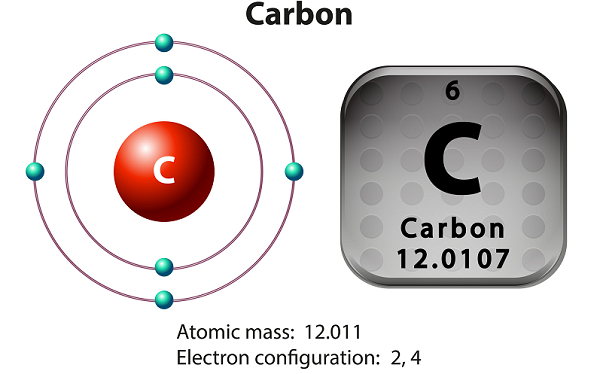
Karbonun doğal olarak oluşan üç izotopu vardır - 12 C, 13 C ve 14 C.
Bunların arasında 12 C ve 13 C kararlıdır, ancak 14 C radyoaktif bir izotoptur. 14 C'nin yarı ömrü yaklaşık 5,730 yıldır.
Karbonun Göze Çarpan Özellikleri
Karbonun fiziksel özellikleri büyük ölçüde allotroplarına bağlıdır.
Karbonun başlıca allotropları grafit, elmas ve amorf karbondur.
Grafit opak, siyah ve çok yumuşaktır; dolayısıyla kağıt üzerinde bir çizgi oluşturuyordu.
Elmas çok sert (doğal olarak oluşan en sert malzeme) ve şeffaftır.
Grafit, iyi bir elektrik iletkenidir.
Elmas kötü elektrik iletkenidir.
Karbon, büyük olasılıkla tüm elementler arasında en yüksek süblimleşme noktasına sahiptir.
Karbon Oluşumu
Kütle olarak karbon, evrende bulunan en bol dördüncü kimyasal elementtir (hidrojen, helyum ve oksijenden sonra).
Karbon, Güneş'te, yıldızlarda, kuyrukluyıldızlarda ve çoğu gezegenin atmosferinde bol miktarda bulunur.
Karbon, dünya atmosferinde bulunur ve suda çözünür.
Kömür, petrol ve doğal gaz gibi hidrokarbonların tümü karbon içerir.
Karbon ayrıca kutup bölgelerinde ve denizlerin altında bulunan metan hidratlarda da bulunur.
Karbon yönünden zenginleştirilmiş kayalardan bazıları kömür, kalker, dolomit vb.
Kömür karbon açısından çok zengindir; dolayısıyla, en büyük ticari mineral karbon kaynağıdır.
Kömür, yaklaşık 4.000 gigaton veya toplam fosil yakıtın% 80'ini paylaşır.
Karbon Bileşikleri
Aşağıdakiler, Karbonun başlıca bileşikleridir -
Siyanojen - CN 2
Hidrojen siyanür - HCN
Siyanamid - CN 2 H 2
İzosiyanik asit - HNCO
Siyanojen klorür - CNCl
Klorosülfonil izosiyanat - CNC10 3 S
Siyanürik klorür - NCCl 3
Karbon disülfür - CS 2
Karbonil sülfit - OCS
Karbon monosülfür - CS
Karbon Kullanımları
Allotroplara bağlı olarak, karbon çeşitli uygulamalarda kullanılır.
Karbon, onsuz yaşamın en temel unsurlarından biridir, dünyadaki yaşamı hayal edemiyoruz.
Fosil yakıtlar yani metan gazı ve ham petrol (petrol), kömür vb. Günlük yaşamda kullanılmaktadır.
Kalemlerde kullanılan 'kurşun' yapımında kullanılan kil ile birleşen grafit.
Kömür ayrıca sanat eserlerinde, demir eritme, barbekü ızgaralarında vb. Çizim malzemesi olarak kullanılır.
Elmas genellikle takılarda kullanılır.
Endüstriyel elmaslar, metalleri ve taşı işlemek için kesme, delme ve parlatma aletlerinde kullanılır.
Plastik yapımında fosil hidrokarbonlar ve karbon fiber kullanılır.
Giriş
Azot, periyodik tablodaki 15'inci grubun kimyasal bir elementidir; 15. grubun tüm unsurları arasında en hafif elementtir.
Azotun sembolü ‘N’ ve atom numarası 7.

1772'de İskoç doktor Daniel Rutherford karbonu ilk keşfetti ve izole etti.
Ancak, 'nitrojen' adı ilk olarak 1790'da Jean-Antoine-Claude Chaptal tarafından verildi.
Azotun Göze Çarpan Özellikleri
Azot, 14 N ve 15 N olmak üzere iki kararlı izotopa sahiptir .
Serbest nitrojen atomları normalde çoğu elementle kolayca reaksiyona girer ve nitrürler oluşturur.
N 2 molekülleri standart koşullarda renksiz, kokusuz, tatsız ve diyamanyetik gazdır.
N erime noktası 2 -210 olan 0 ° C ve kaynama noktası -196 olan 0 ° C
Azot bileşikleri, atmosfer ile canlı organizmalar arasında tekrar tekrar yer değiştirerek bir nitrojen döngüsü oluşturur.
Azot Oluşumu
Azot, dünya atmosferinin tüm hacminin yaklaşık% 78,1'ini oluşturduğundan, dünyada en bol bulunan elementtir.
Azot gazı, büyük ölçüde sıvı havanın fraksiyonel damıtılmasıyla üretilen endüstriyel bir gazdır.
Azot Bileşikleri
Aşağıdakiler, Azotun başlıca bileşikleridir -
Amonyum - NH 4+
Amonyak - NH 3
Nitrik asit - HNO 3
Nitrit - NO 2-
Azot dioksit - NO 2
Dinitrojen pentroksit - N 2 O 5
Hidrazin - N 2 H 4
Dinitrojen - N 2
Siyanür - CN
Amonyum nitrat - (NH 4 ) (NO 3 )
Azot triklorür - NCl 3
Azot triflorür - NF 3
Azot triiyodür - NI 3
Piridin - C 5 H 5 N
Nitronyum iyonu - NO 2+
Hidrazoik asit - HN 3
Amonyum sülfat - (NH 4 ) 2 SO 4
Azot Kullanımı
Azot bileşikleri, çok çeşitli alanlarda ve endüstrilerde yaygın olarak kullanılmaktadır.
Gıda katkı maddesi olarak saf azot kullanılır.
Özellikle bilgi teknolojisi ekipmanları için yangın söndürme sistemlerinde kullanılır.
Paslanmaz çelik üretiminde de kullanılır.
Nitrojen ayrıca bazı uçakların ve yarış arabalarının lastiklerini şişirmek için kullanılır.
Soğutucu akışkan olarak sıvı nitrojen kullanılır.
Kimya ile ilgili doğa kanunları, kimyasal kanunlar olarak bilinir.
Kimyasal reaksiyonlar, normalde, gözlenen ve kelimelerle formüle edilen, kimyada temel kavramlar haline gelen belirli yasalarla yönetilir.
Aşağıdakiler önemli kimyasal kanunlardır -
| Kanunlar | Açıklama |
|---|---|
| Avogadro Yasası | "Aynı sıcaklık ve basınçtaki tüm gazların eşit hacimleri aynı sayıda moleküle sahiptir" |
| Beer-Lambert yasası (veya sadece Beer's yasası veya Lambert-Beer yasası) | "Işığın zayıflamasını, içinden (ışığın) geçtiği malzemenin özelliklerine açıklar" |
| Boyle Kanunu | "Belirli bir ideal gaz kütlesinin uyguladığı mutlak basınç, kapalı bir sistem içinde gazın sıcaklığı ve miktarı değişmeden kalırsa kapladığı hacimle ters orantılıdır" |
| Charles Yasası (Hacim Yasası olarak da bilinir) | "Bir kuru gaz numunesi üzerindeki basınç sabit tutulduğunda, Kelvin sıcaklığı ve hacim doğrudan ilişkili olacaktır" |
| Fick'in Difüzyon Kanunları | "Difüzyonu" (akı) tanımlar |
| Gay-Lussac Yasası | "Tüm gazlar, aynı sıcaklık aralığında sabit basınçta aynı ortalama termal genleşmeye sahiptir" |
| Le Chatelier'in İlkesi ("Denge Yasası") | "Dengedeki herhangi bir sistem konsantrasyon, sıcaklık, hacim veya basınçta değişikliğe maruz kaldığında, sistem uygulanan değişikliğin etkisine (kısmen) karşı koymak için kendini yeniden ayarlar ve yeni bir denge kurulur" |
| Henry Yasası | "Kanun, basınç altındaki çözelti içindeki gaz konsantrasyonunu hesaplar" |
| Hess Yasası | "Bir kimyasal reaksiyondaki entalpi değişimi (sabit basınçta reaksiyon ısısı anlamına gelir), başlangıç ve son durumlar arasındaki yoldan bağımsızdır" |
| Enerji korunumu yasası | "Enerji ne yaratılabilir ne de yok edilemez" |
| Raoult Yasası | "İdeal bir sıvı karışımının her bir bileşeninin kısmi buhar basıncı, saf bileşenin karışımdaki mol fraksiyonu ile çarpılan buhar basıncına eşittir" |
| Faraday Yasası Elektrolizi | "Bir elektrotta üretilen madde miktarı, geçen elektrik miktarıyla doğru orantılıdır" |
| Atomik teori | "Madde, atom olarak bilinen farklı birimlerden oluşur" |
| Köhler Teorisi | "Su buharının yoğunlaştığı ve sıvı bulutu damlalarını oluşturduğu süreci açıklar" |
| Van 't Hoff Denklemi | "Bir kimyasal reaksiyonun denge sabitindeki değişikliği açıklar" |
| Geçiş Durumu Teorisi | "Temel kimyasal reaksiyonların reaksiyon hızları" |
| Grotthuss-Draper Yasası | "Bir sistem / yüzey tarafından emilen ışığın bir fotokimyasal değişim getirebileceğini anlatıyor" |
| Gazların Kinetik Teorisi | "Varsayımsal bir ideal gazın davranışını açıklar" |
| Aufbau İlkesi | "Atomların yörüngesinde dönen elektronların önce en düşük enerji seviyelerini, sonra ikinci daha yüksek seviyeleri vb. Doldurduğunu açıklıyor." |
| Hund Kuralı | "Bir alt seviyedeki her yörüngenin, herhangi bir yörünge iki katına çıkmadan önce tek başına işgal edildiğini açıklar" |
| Çarpışma Teorisi | "Gazların kinetik teorisine dayanan çarpışma teorisi, gaz fazındaki kimyasal reaksiyonların moleküller yeterli kinetik enerji ile çarpıştığında meydana geldiğini tanımlar" |
Giriş
Büyük olasılıkla bakır, insanlar tarafından çıkarılıp kullanılan ilk elementti.
Bakırın en erken kullanımının kanıtı, M.Ö.6.000'e ait olan Anadolu'da bulundu.
Kurşun, büyük olasılıkla insanların kullanmaya başladığı ikinci unsurdu.
Bilinen en eski kurşun eseri, Mısır'ın Abydos kentindeki Osiris tapınağında bulunan heykelciktir.
Osiris tapınağının heykelciği (yaklaşık) M.Ö.3800'e aittir.
Bilinen en eski altın hazinesi Varna, Nekropol'de (Bulgaristan) keşfedildi.
Bu altın hazine (yaklaşık) MÖ 4.400'e aittir.
Gümüşün keşfi neredeyse altınla aynıdır; kanıtı Küçük Asya'da bulundu.
Bazı kanıtlar, demirin (yaklaşık) MÖ 5.000'den beri bilindiğini söylüyor.
İnsanlar tarafından kullanılan bilinen en eski demir nesneler Mısır'da bulundu (MÖ 4000'e aittir).
Aşağıdaki tablo, keşif tarihleri ve keşifleriyle ilgili önemli unsurları göstermektedir -
| Eleman | Discoverer | Keşif Tarihi |
|---|---|---|
| Bakır | Orta Doğu (Yer) | Yaklaşık MÖ 9.000 |
| Öncülük etmek | Mısır (Yer) | Yaklaşık MÖ 7.000 |
| Altın | Bulgaristan (Yer) | Yaklaşık MÖ 6.000 |
| Gümüş | Küçük Asya (Yer) | Yaklaşık MÖ 5.000 |
| Demir | Mısır (Yer) | Yaklaşık MÖ 5.000 |
| Teneke | Yaklaşık MÖ 3500 | |
| Kükürt | Çince / Hindistan | Yaklaşık 2.000 BCE |
| Merkür | Mısır | MÖ 2.000 |
| Fosfor | H. Brand | 1669 |
| Kobalt | G. Brandt | 1735 |
| Platin | A. de Ulloa | 1748 |
| Nikel | F. Cronstedt | 1751 |
| Bizmut | CF Geoffroy | 1753 |
| Magnezyum | J. Siyah | 1755 |
| Hidrojen | H. Cavendish | 1766 |
| Oksijen | W. Scheele | 1771 |
| Azot | D. Rutherford | 1772 |
| Baryum | W. Scheele | 1772 |
| Klor | W. Scheele | 1774 |
| Manganez | W. Scheele | 1774 |
| Molibden | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirkonyum | H. Klaproth | 1789 |
| Uranyum | H. Klaproth | 1789 |
| Titanyum | W. Gregor | 1791 |
| Krom | N. Vauquelin | 1797 |
| Berilyum | N. Vauquelin | 1798 |
| Vanadyum | M. del Río | 1801 |
| Potasyum | H. Davy | 1807 |
| Sodyum | H. Davy | 1807 |
| Kalsiyum | H. Davy | 1808 |
| Bor | L. Gay-Lussac ve LJ Thénard | 1808 |
| Flor | AM Ampère | 1810 |
| İyot | B. Courtois | 1811 |
| Lityum | A. Arfwedson | 1817 |
| Kadmiyum | S. L Hermann, F. Stromeyer ve JCH Roloff | 1817 |
| Selenyum | J. Berzelius ve G. Gahn | 1817 |
| Silikon | J. Berzelius | 1823 |
| Alüminyum | HCØrsted | 1825 |
| Brom | J. Balard ve C. Löwig | 1825 |
| Toryum | J. Berzelius | 1829 |
| Lantan | G. Mosander | 1838 |
| Rubidyum | R. Bunsen ve GR Kirchhoff | 1861 |
| Talyum | W. Crookes | 1861 |
| İndiyum | F. Reich ve T. Richter | 1863 |
| Helyum | P. Janssen ve N. Lockyer | 1868 |
| Neon | W. Ramsay ve W. Travers | 1898 |
| Xenon | W. Ramsay ve W. Travers | 1898 |
| Fermiyum | A. Ghiorso ve diğerleri | 1952 |
| Nobelium | ED Donets, VA Shchegolev ve VA Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris ve P. Eskola | 1970 |
| Tennessine | Y. Oganessian ve diğerleri | 2010 |
Aşağıdaki tablo, önemli unsurları ve bunların değerini göstermektedir -
| Eleman | Değerlik | Sembol | Atom No. |
|---|---|---|---|
| Hidrojen | -1, +1 | H | 1 |
| Helyum | 0 | O | 2 |
| Lityum | 1 | Li | 3 |
| Berilyum | 2 | Ol | 4 |
| Bor | 3, 2, 1 | B | 5 |
| Karbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Azot | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oksijen | -1, -2, 0, 2, 1, | Ö | 8 |
| Flor | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodyum | -1, 1 | Na | 11 |
| Magnezyum | 2 | Mg | 12 |
| Alüminyum | 3, 1 | Al | 13 |
| Silikon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Fosfor | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Kükürt | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Klor | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potasyum | -1, 1 | K | 19 |
| Kalsiyum | 2 | CA | 20 |
| Skandiyum | 3, 2, 1 | Sc | 21 |
| Titanyum | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadyum | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Krom | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganez | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Demir | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Kobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nikel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Bakır | 4, 3, 2, 1, 0 | Cu | 29 |
| Çinko | 2, 1, 0 | Zn | 30 |
| Galyum | 3, 2, 1 | Ga | 31 |
| Germanyum | 4, 3, 2, 1 | Ge | 32 |
| Arsenik | -3, 5, 3, 2, | Gibi | 33 |
| Selenyum | -2, 6, 4, 2, 1 | Se | 34 |
| Brom | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Kripton | 2, 0 | Kr | 36 |
| Rubidyum | -1, 1 | Rb | 37 |
| Stronsiyum | 2 | Sr | 38 |
| İtriyum | 3, 2 | Y | 39 |
| Zirkonyum | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niyobyum | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molibden | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Pzt | 42 |
| Teknesyum | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Rutenyum | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rodyum | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Paladyum | 4, 2, 0 | Pd | 46 |
| Gümüş | 3, 2, 1, 0 | Ag | 47 |
| Kadmiyum | 2, 1 | CD | 48 |
| İndiyum | 3, 2, 1 | İçinde | 49 |
| Teneke | -4, 4, 2 | Sn | 50 |
| Antimon | -3, 5, 3 | Sb | 51 |
| Tellür | -2, 6, 5, 4, 2, 1 | Te | 52 |
| İyot | -1, 0, 7, 5, 3, 1 | ben | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Sezyum | -1, 1 | Cs | 55 |
| Baryum | 2 | Ba | 56 |
| Lantan | 3, 2 | La | 57 |
| Seryum | 4, 3, 2 | Ce | 58 |
| Praseodim | 4, 3, 2 | Pr | 59 |
| Neodimyum | 4, 3, 2 | Nd | 60 |
| Prometyum | 3 | Pm | 61 |
| Samaryum | 3, 2 | Sm | 62 |
| Evropiyum | 3, 2 | AB | 63 |
| Gadolinyum | 3, 2, 1 | Gd | 64 |
| Terbiyum | 4, 3, 1 | Tb | 65 |
| Disporsiyum | 4, 3, 2 | Dy | 66 |
| Holmiyum | 3, 2 | Ho | 67 |
| Erbiyum | 3 | Er | 68 |
| Tülyum | 3, 2 | Tm | 69 |
| İterbiyum | 3, 2 | Yb | 70 |
| Lutesyum | 3 | lu | 71 |
| Hafniyum | 4, 3, 2, 1 | Hf | 72 |
| Tantal | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Renyum | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Yeniden | 75 |
| Osmiyum | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | İşletim sistemi | 76 |
| İridyum | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platin | 6, 5, 4, 2, 0 | Pt | 78 |
| Altın | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Merkür | 2, 1 | Hg | 80 |
| Talyum | 3, 1 | Tl | 81 |
| Öncülük etmek | 4, 2 | Pb | 82 |
| Bizmut | -3, 5, 3, 1 | Bi | 83 |
| Polonyum | -2, 6, 4, 2 | Po | 84 |
| Astatin | -1, 7, 5, 3, 1 | Şurada: | 85 |
| Radon | 2, 0 | Rn | 86 |
| Fransiyum | 1 | Fr | 87 |
| Radyum | 2 | Ra | 88 |
| Aktinyum | 3 | AC | 89 |
| Toryum | 4, 3, 2 | Th | 90 |
| Protaktinyum | 5, 4, 3 | Baba | 91 |
| Uranyum | 6, 5, 4, 3, 2 | U | 92 |
| Neptunyum | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plütonyum | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Amerikum | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atom numarası, bir elementin çekirdeğinde bulunan proton sayısını tanımlar.
Çekirdekte bulunan toplam proton ve nötron sayısı atomik kütle numarası olarak hesaplanır.
Aşağıdaki tablo, atom numaraları, atom kütleleri ve sembolleriyle bazı önemli elementleri göstermektedir -
| Eleman | Atomik numara | Atom Kütlesi (g mol-1) | Sembol |
|---|---|---|---|
| Hidrojen | 1 | 1.0079 | H |
| Helyum | 2 | 4.00 | O |
| Lityum | 3 | 6,94 | Li |
| Berilyum | 4 | 9.01 | Ol |
| Bor | 5 | 10.81 | B |
| Karbon | 6 | 12.01 | C |
| Azot | 7 | 14.0067 | N |
| Oksijen | 8 | 16.00 | Ö |
| Flor | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodyum | 11 | 22.989768 | Na |
| Magnezyum | 12 | 24.3050 | Mg |
| Alüminyum | 13 | 26.981539 | Al |
| Silikon | 14 | 28.0855 | Si |
| Fosfor | 15 | 30.973762 | P |
| Kükürt | 16 | 32.066 | S |
| Klor | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potasyum | 19 | 39.0983 | K |
| Kalsiyum | 20 | 40.078 | CA |
| Scandlum | 21 | 44.955910 | Sc |
| Titanyum | 22 | 47.867 | Ti |
| Vanadyum | 23 | 50.9415 | V |
| Krom | 24 | 51.9961 | Cr |
| Manganez | 25 | 54.93805 | Mn |
| Demir | 26 | 55.845 | Fe |
| Kobalt | 27 | 58.93320 | Co |
| Nikel | 28 | 58.6934 | Ni |
| Bakır | 29 | 63.546 | Cu |
| Çinko | 30 | 65,39 | Zn |
| Galyum | 31 | 69.723 | Ga |
| Germanyum | 32 | 72.61 | Ge |
| Arsenik | 33 | 74.92159 | Gibi |
| Selenyum | 34 | 78,96 | Se |
| Brom | 35 | 79.904 | Br |
| Kripton | 36 | 83,80 | Kr |
| Rubidyum | 37 | 85.4678 | Rb |
| Stronsiyum | 38 | 87.62 | Sr |
| İtriyum | 39 | 88.90585 | Y |
| Zirkonyum | 40 | 91.224 | Zr |
| Niyobyum | 41 | 92.90638 | Nb |
| Molibden | 42 | 95.94 | Pzt |
| Teknesyum | 43 | 97.9072 | Te |
| Rutenyum | 44 | 101.07 | Ru |
| Rodyum | 45 | 102.90550 | Rh |
| Paladyum | 46 | 106.42 | Pd |
| Gümüş | 47 | 107.8682 | Ag |
| Kadmiyum | 48 | 112.411 | CD |
| İndiyum | 49 | 114.818 | İçinde |
| Teneke | 50 | 118.710 | Sn |
| Antimon | 51 | 121.760 | Sb |
| Tellür | 52 | 127,60 | Te |
| İyot | 53 | 126.90447 | ben |
| Xenon | 54 | 131.29 | Xe |
| Sezyum | 55 | 132.90543 | Cs |
| Baryum | 56 | 137.327 | Ba |
| Lantan | 57 | 138.9055 | La |
| Seryum | 58 | 140.115 | Ce |
| Praseodim | 59 | 140.90765 | Pr |
| Neodimyum | 60 | 144,24 | Nd |
| Prometyum | 61 | 144.9127 | Pm |
| Samaryum | 62 | 150.36 | Sm |
| Evropiyum | 63 | 151.965 | AB |
| Gadolinyum | 64 | 157.25 | Gd |
| Terbiyum | 65 | 158.92534 | Tb |
| Disporsiyum | 66 | 162.50 | Dy |
| Holmiyum | 67 | 164.93032 | Ho |
| Erbiyum | 68 | 167.26 | Er |
| Tülyum | 69 | 168.93421 | Tm |
| İterbiyum | 70 | 173.04 | Yb |
| Lutesyum | 71 | 174.967 | lu |
| Hafniyum | 72 | 178.49 | Hf |
| Tantal | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183,84 | W |
| Renyum | 75 | 186.207 | Yeniden |
| Osmiyum | 76 | 190,23 | İşletim sistemi |
| İridyum | 77 | 192.217 | Ir |
| Platin | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |