Chemie Teil 2 - Kurzanleitung
Einführung
Die Chemie ist ein Zweig der Naturwissenschaften, der sich mit Struktur, Zusammensetzung und sich ändernden Eigenschaften von Materie befasst.
Die Chemie untersucht den kleinsten Teil einer Materie, dh ein Atom (zusammen mit all seinen Eigenschaften), anhand der großen Materialien (z. B. Gold, Silber, Eisen usw.) und ihrer Eigenschaften.
Die Chemie untersucht auch die intermolekularen Kräfte (die der Materie die allgemeinen Eigenschaften verleihen) und die Wechselwirkungen zwischen Substanzen durch die chemischen Reaktionen.

Im Jahr 1998 definierte Professor Raymond Chang Chemie als -
"Chemie" bedeutet das Studium der Materie und der Veränderungen, die sie durchläuft.
Es wird angenommen, dass das Studium der Chemie mit der von Aristoteles vorgebrachten Theorie der vier Elemente begann.
Die vier Elementtheorie besagt, dass „Feuer, Luft, Erde und Wasser die grundlegenden Elemente waren, aus denen alles als Kombination gebildet wird“.
Wegen seiner klassischen Arbeit nämlich “The Sceptical Chymist,” Robert Boyle ist als Gründungsvater der Chemie bekannt.
Boyle formulierte ein Gesetz und wurde als "Boyles Gesetz" populär.
Das Boyle'sche Gesetz ist ein experimentelles Gasgesetz, das die Beziehung zwischen dem Druck eines Gases und dem Volumen des jeweiligen Behälters analysiert.
Boyle befürwortete sein Gesetz und lehnte die klassische Theorie der vier Elemente ab.
Die amerikanischen Wissenschaftler Linus Pauling und Gilbert N. Lewis haben gemeinsam die elektronische Theorie der chemischen Bindungen und Molekülorbitale aufgestellt.
Die Vereinten Nationen haben 2011 zum "Internationalen Jahr der Chemie" erklärt.
Die Materie wird in der Chemie als alles definiert, was Ruhemasse und -volumen hat und auch Raum beansprucht.
Das matter besteht aus Partikeln.
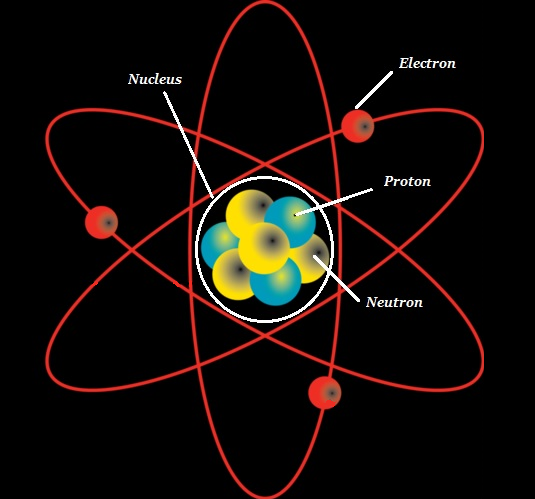
Das atom ist die grundlegende Einheit der Chemie.
Das Atom besteht aus einem dichten Kern, der als atomic nucleus und es ist von einem Raum umgeben, der als der bekannt ist electron cloud.
Der Kern (eines Atoms) besteht aus protons (+ve charged particles) und neutrons (neutral or uncharged particles); zusammen sind diese beiden bekannt alsnucleons (wie im Bild unten gezeigt).
Ein chemisches Element ist eine reine Form einer Substanz; es besteht aus einem einzigen Atomtyp.
Das Periodensystem ist die standardisierte Darstellung aller verfügbaren chemischen Elemente.
Eine Verbindung ist eine reine Form einer Substanz; es besteht aus mehr als einem Element.
Ein Molekül ist der kleinste unteilbare Teil einer reinen chemischen Substanz; Das Molekül hat unterschiedliche chemische Eigenschaften (siehe Abbildung unten).
Die folgende Tabelle zeigt die Zweige der Chemie -
| Ast | Unterzweig | Definition |
|---|---|---|
| Physical Chemistry | Physikalische Chemie | Untersuchung der physikalischen Eigenschaften von Molekülen |
| Chemische Kinetik | Untersuchung der Geschwindigkeit chemischer Reaktionen | |
| Elektrochemie | Untersuchung der Wechselwirkung von Atomen, Molekülen, Ionen und elektrischem Strom (dh Elektronentransfer zwischen der Elektrode und dem Elektrolyten oder der Spezies) | |
| Oberflächenchemie | Untersuchung chemischer Reaktionen an Oberflächen (von Substanzen) | |
| Thermochemie | Untersuchen Sie die Beziehung zwischen der chemischen Wirkung und der absorbierten Wärmemenge | |
| Quantenchemie | Untersuchung der Anwendung der Quantenmechanik in physikalischen Modellen | |
| Spektroskopie | Untersuchung von Licht- oder Strahlungsspektren | |
| Photochemie | Untersuchung der durch Licht verursachten chemischen Wirkungen | |
| Organic Chemistry | Organische Chemie | Untersuchung der Struktur, Eigenschaften und Herstellung der chemischen (Kohlenstoff-) Verbindungen (z. B. Kraftstoffe, Kunststoffe, Lebensmittelzusatzstoffe und Arzneimittel) |
| Stereochemie | Untersuchung der relativen räumlichen Anordnung von Atomen (in Molekülen) | |
| Physikalische organische Chemie | Untersuchung von Struktur und Reaktivität (Wechselbeziehung) in organischen Molekülen | |
| Polymerchemie | Untersuchung von Polymermolekülen (Zusammensetzung und Entstehung) | |
| Metallorganische Chemie | Untersuchung von Chemikalien, die Bindungen enthalten (insbesondere zwischen einem Kohlenstoff und einem Metall) | |
| Medizinische Chemie | Studie zum Entwerfen, Entwickeln und Synthetisieren der Medikamente | |
| Inorganic chemistry | Anorganische Chemie | Untersuchung aller nicht organischen Materialien (wie Mineralien, Metalle, Katalysatoren, Kristallstrukturen usw.) |
| Metallorganische Chemie | Untersuchung chemischer Verbindungen, die Bindungen enthalten (insbesondere zwischen Kohlenstoff und Metall) | |
| Festkörperchemie | Untersuchung chemischer Verbindungen, die Bindungen zwischen Kohlenstoff und Metall enthalten | |
| Kernchemie | Untersuchung radioaktiver Substanzen | |
| Geochemie | Untersuchung der chemischen Zusammensetzung der Erde (zB Gesteine, Mineralien & Atmosphäre) | |
| Bioanorganische Chemie | Untersuchung der Wechselwirkungen zwischen Metallionen und lebendem Gewebe | |
| Koordinationschemie | ||
| Biochemistry | Biochemie | Untersuchung chemischer Reaktionen (und Veränderungen) bei Lebewesen |
| Molekularbiochemie | Untersuchung von Biomolekülen mit ihren Funktionen | |
| Klinische Biochemie | Untersuchung chemischer Veränderungen bei Lebewesen, die durch verschiedene Krankheiten verursacht werden | |
| Molekularbiologie | Untersuchung der verschiedenen Arten der DNA-, RNA- und Proteinbiosynthese (und ihrer Beziehungen) | |
| Agrarbiochemie | Untersuchung der Chemie der Fauna (dh Pflanzen) | |
| Analytical Chemistry | Untersuchung standardisierter experimenteller Methoden in der Chemie (dh quantitative Bestimmung der chemischen Eigenschaften eines Stoffes) | |
| Astrochemistry | Untersuchung der Reaktionen chemischer Elemente und Moleküle im Universum | |
| Cosmochemistry | Untersuchung der chemischen Zusammensetzung der im Universum gefundenen Stoffe | |
| Environmental chemistry | Untersuchung chemischer und biochemischer Phänomene in der Umwelt |
Einführung
Der Prozess der Emission von Partikeln aus Kernen aufgrund der nuklearen Instabilität; ist als Radioaktivität bekannt.
Die Substanz, die solche Energie / Strahlen freisetzt, ist als radioaktive Substanz bekannt.
Die unsichtbaren Strahlen, die von einer solchen radioaktiven Substanz freigesetzt werden, sind als radioaktive Strahlen bekannt.
Ebenso ist Radioaktivität ein Kernphänomen, das (natürlich) aufgrund der Kerninstabilität von Atomen auftritt.
1896 beobachtete Henri Becquerel erstmals die Phänomene der Radioaktivität, doch der Begriff "Radioaktivität" wurde von Marie Curie geprägt.
Marie Curie entdeckte 1898 die radioaktiven Elemente Polonium und Radium.
Für ihre Entdeckung gewann Marie Curie den Nobelpreis.
Radioaktive Strahlen
Nach langen Jahren des Experimentierens entdeckte Ernest Rutherford zusammen mit seinem Kollegen (Hans Geiger und seinem Schüler Ernest Marsden) Alphastrahlen, Betastrahlen und Gammastrahlen.
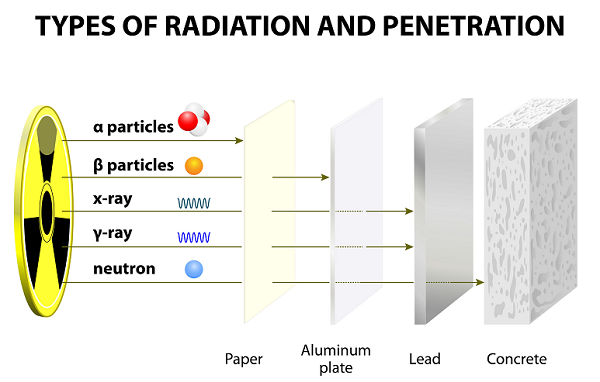
Diese Strahlen werden infolge des Zerfalls von Atomen emittiert.
Alpha (α) -Partikel
Alpha-Teilchen bestehen normalerweise aus zwei Protonen und zwei Neutronen, die eng miteinander verbunden sind.
Alpha-Partikel werden während des radioaktiven Zerfalls (oder Alpha-Zerfalls) aus den Kernradio-Nukliden freigesetzt.
Die Alpha-Teilchen sind identisch mit dem Kern eines normalen Heliumatoms oder eines doppelt ionisierten Heliumatoms.
Im Vergleich zu anderen Partikeln (dh Gamma und Beta) sind Alpha-Partikel schwer und langsam. Daher haben Alpha-Partikel eine sehr geringe Reichweite in der Luft.
Aufgrund der langsamen Geschwindigkeit haben Alpha-Partikel sehr schwache Durchdringungskräfte. Diese Partikel werden sogar durch ein dünnes Papierblatt gestoppt (siehe Abbildung oben).
Aufgrund der doppelten positiven Ladung sind Alpha-Partikel stark ionisierend.
Beta (β) -Partikel
Beta-Teilchen sind die sich schnell bewegenden Elektronen, die von einigen Radionukliden während des radioaktiven Zerfalls (auch als Beta-Zerfall bekannt) emittiert werden.
Beta-Partikel sind viel leichter und tragen eine einzige negative Ladung.
Beta-Partikel ionisieren selten als die Alpha-Partikel.
Aufgrund des geringeren Gewichts können Beta-Partikel viel weiter als Alpha-Partikel wandern. Beta-Partikel können jedoch durch mehrere Blätter Papier oder ein Blatt Aluminium gestoppt werden.
Beta-Partikel sind negativ geladen und werden von positiv geladenen Partikeln angezogen.
Gamma-Partikel
Gammapartikel sind das Bündel hoher Energie, nämlich elektromagnetische Energie (Photon), die von den radioaktiven Elementen während des radioaktiven Zerfalls emittiert wird.
Unter allen drei Teilchen (Alpha, Beta und Gamma) sind Gamma-Teilchen die energiereichsten Photonen.
Gammapartikel, die die Form elektromagnetischer Strahlung (EMR) haben, stammen aus dem Kern.
Die Wellenlängen von Gamma sind die kürzesten unter allen drei.
Gammapartikel haben keine Ladung und sind neutral; Daher werden sie von magnetischen und elektrischen Feldern nicht beeinflusst.
Verwendung radioaktiver Elemente
Radioaktive Elemente werden verwendet in -
Medizinischer Bereich (Behandlung vieler Krankheiten)
Industrieller Prozess
Energieerzeugung - Kernreaktoren
Einführung
Kernreaktionen setzen eine enorme Menge an Energie frei (bekannt als Kernenergie), die zur Stromerzeugung in einem Kernkraftwerk verwendet wird.

Die Kernenergie, die normalerweise von erzeugt wird nuclear fission, nuclear fusion, und nuclear decay.
1938 führten die deutschen Chemiker Otto Hahn, Fritz Strassmann und die österreichische Physikerin Lise Meitner die Experimente durch, bei denen die Produkte aus mit Neutronen bombardiertem Uran hergestellt wurden. Als Ergebnis dieses Experiments spaltete das relativ kleine Neutron den Kern der massiven Uranatome in zwei ungefähr gleiche Teile und setzte massive Energie frei.
Die nuklearen Experimente von Otto Hahn und seinen Kollegen sind als Kernspaltung beliebt.
Kernspaltung
Der Prozess der Kernspaltung erzeugt freie Neutronen und Gammaphotonen, wobei dabei auch eine sehr große Energiemenge freigesetzt wird.
Die Kernspaltung ist eine exotherme Reaktion, bei der große Mengen an Energie in Form von elektromagnetischer Strahlung sowie kinetischer Energie freigesetzt werden können.
Kernspaltung kann manchmal auf natürliche Weise (dh ohne Neutronenbeschuss) als eine Art radioaktiver Zerfall auftreten.
Arten der Kernspaltung
Im Folgenden sind die wichtigsten Arten der Kernspaltung aufgeführt:
Chain Reaction and
Fission Reaction
Lassen Sie uns sie kurz diskutieren -
Kettenreaktion
Wenn eine einzelne Kernreaktion eine oder mehrere nachfolgende Kernreaktionen verursacht, spricht man von einer Kettenreaktion.
Eine solche Kettenreaktion erhöht die Möglichkeit einer sich selbst ausbreitenden Reihe von Kernreaktionen.
Die Kernkettenreaktionen setzen pro Reaktion millionenfach mehr Energie frei als jede andere chemische Reaktion. Daher ist es auch als explosive oder unkontrollierte Kettenreaktion bekannt.
Wenn ein schweres Atom eine Kernspaltung erfährt, zerfällt es normalerweise in zwei oder mehr Spaltfragmente. Während des Prozesses werden mehrere freie Neutronen, Gammastrahlen und Neutrinos emittiert und letztendlich eine große Menge Energie freigesetzt.
Es folgen die beiden Beispiele für Kettenreaktionen -
235 U + → Neutronenspaltungsfragmente + 2,4 Neutronen + 192,9 MeV
235 Pu + → Neutronenspaltungsfragmente + 2,9 Neutronen + 198,9 MeV
In Atombomben wird die Kettenreaktionstechnologie verwendet, da sie eine konsistente Energiequelle erfordert.
Spaltreaktionen
Die Spaltreaktion, bei der Neutronen (die durch Spaltung von Brennstoffatomen erzeugt werden) verwendet werden, um noch mehr Spaltung zur Freisetzung nachhaltiger Energie zu induzieren, wird als Spaltreaktion bezeichnet.
Solche Reaktionen sind langsam und kontrollierbar; daher auch als kontrollierte Kettenreaktion bekannt.
Der Strom (Strom) erzeugende Kernreaktor ist ein ideales Beispiel für eine kontrollierte Kettenreaktion.
Aufgrund der Eigenschaften und der Art der Verwendung wird die Spaltung / kontrollierte Kettenreaktion wie folgt klassifiziert:
Power reactors
Research reactors
Breeder reactors
Diese Leistungsreaktoren wandeln im Allgemeinen die kinetische Energie von Spaltprodukten in Wärme um; Ferner wird die Wärme verwendet, um ein Arbeitsfluid zu erwärmen, das eine Wärmekraftmaschine antreibt, die letztendlich mechanische oder elektrische Energie erzeugt.
Grundbestandteile des Kernreaktors
Im Folgenden sind die wesentlichen Bestandteile eines Kernreaktors aufgeführt:
Nuclear fuels- Wie Uran ( 233 U, 235 U), Thorium (Th 232 ), Plutonium (Pu 239 ).
Moderators- Dient zur Steuerung der emittierten Neutronen. ZB schweres Wasser, Beryllium, Graphit usw.
Coolant- Es wird verwendet, um den Reaktor zu kühlen. ZB Wasser, Dampf, Helium, CO 2 , Luft, geschmolzene Metalle usw.
Control rods- Es wird verwendet, um die Spaltreaktion auszuführen und zu stoppen. Zu diesem Zweck werden beispielsweise Cadmium- oder Borstäbe verwendet.
Kernfusion
Der Prozess, bei dem zwei leichte Kerne zu einem schweren Kern verschmolzen werden, ist als Kernfusion bekannt. Während dieses Prozesses wird eine enorme Menge an Energie freigesetzt, die als Kernenergie bekannt ist.
Das beste Beispiel für Kernfusion ist - Wasserstoffbombe.
Eine Wasserstoffbombe ist etwa 1000-mal stärker als eine Atombombe.
Einführung
Das Material (das ein Element, eine Verbindung oder eine Legierung sein kann), das charakteristisch hart, glänzend und undurchsichtig ist und die Eigenschaft hat, Wärme und Elektrizität zu leiten, wird als Metall bezeichnet.
Metalle kommen natürlicherweise in unreiner Form in der Erdkruste vor, dh in Erzen. Und es wird durch Bergbauprozesse gewonnen.
Unter allen bekannten 118 Elementen (des Periodensystems) sind etwa 91 Elemente Metalle.

Merkmale von Metallen
Im Folgenden sind die wesentlichen Merkmale von Metallen aufgeführt:
Metalle sind im Allgemeinen formbar - das heißt, ihre Form kann dauerhaft geändert werden, ohne zu brechen und zu reißen.
Metalle sind schmelzbar - es bedeutet; es kann leicht geschmolzen oder geschmolzen werden.
Metalle sind duktil - es bedeutet; es kann jede Form gegeben werden, sogar ein dünnes Blatt oder Draht.
Metalle leiten Wärme und Strom gut; Blei ist jedoch eine Ausnahme, da es keinen Strom führt.
Metalle reagieren auf natürliche Weise mit verschiedenen Nichtmetallen und bilden Verbindungen. Metalle können mit Basen und Säuren reagieren. ZB 4 Na + O 2 → 2 Na 2 O (Natriumoxid) usw.
Legierungen
Eine Legierung ist ein Produkt der Mischung aus zwei oder mehr Elementen, in denen Metall dominiert.
Um ein wünschenswertes Produkt herzustellen oder herzustellen, werden verschiedene Metalle (in verschiedenen Verhältnissen) gemischt (dh Legierungen). Beispielsweise tragen Eisenlegierungen, nämlich Edelstahl, Gusseisen, Legierungsblech usw., einen großen Anteil sowohl nach Menge als auch nach kommerziellem Wert bei.
Metalle werden normalerweise aus Legierungen hergestellt, um sie korrosionsbeständiger, weniger spröde, attraktiver zu machen usw.
Metallterminologien
Base Metal- In der Chemie bedeutet Basismetall - das Metall, das leicht oxidiert oder korrodiert werden kann und leicht mit HCl (verdünnte Salzsäure) reagiert und Wasserstoff bildet. ZB Eisen, Nickel, Zink, Blei usw.
Ferrous Metal- "Eisen" ist ein lateinisches Wort, das die Substanz "Eisen enthaltend" bedeutet. ZB Stahl usw.
Heavy Metal- Das Metall, das viel dichter als das normale Metall ist, wird als Schwermetall eingestuft. Die Schwermetalle sind in geringen Konzentrationen giftig oder giftig. ZB Quecksilber (Hg), Arsen (As), Chrom (Cr), Cadmium (Cd), Thallium (Tl) und Blei (Pb).
Precious Metal- Die metallischen Elemente, die seltene metallische chemische Elemente von hohem wirtschaftlichem Wert aufweisen, werden als Edelmetall eingestuft. ZB Platin, Gold, Silber, Palladium usw.
Noble Metal- Die Metalle, die gegen Korrosion oder Oxidation beständig sind. ZB Ruthenium (Ru), Rhodium (Rh), Palladium (Pd) usw.
Anwendung von Metallen
Es folgen die wesentlichen Anwendungen der Metalle -
Da Metalle ein guter Wärme- und Stromleiter sind; Daher wird es als Elektrokabel und in vielen anderen Elektrogeräten einschließlich Elektromotoren usw. verwendet, z. B. Kupfer, Silber, Aluminium usw.
Schwermetalle werden beim Bau von Brücken, Pools und für viele solche Zwecke verwendet.
Viele Metalle werden zur Herstellung verschiedener Haushaltsgegenstände wie Utensilien, Töpfe, Öfen usw. verwendet.
Metalle werden häufig zur Herstellung vieler Arten von Werkzeugen verwendet, die von einem einfachen Schraubendreher bis zu einer schweren Stangenrolle reichen.
Edelmetalle sehen wunderschön aus und sind attraktiv (z. B. Gold, Silber usw.). Daher werden sie als Ornamente verwendet.
Für Kühlkörper wird ein bestimmtes Metall verwendet, das die empfindlichen Geräte vor Überhitzung schützt.
Radioaktive Metalle (zB Uran und Plutonium) werden zur Erzeugung von Kernenergie verwendet.
Quecksilber ist ein Metall, das bei Raumtemperatur in flüssiger Form verbleibt. es wird im Thermometer verwendet.
Der Zweig der Wissenschaft und Technologie, der die Eigenschaften von Metallen sowie deren Herstellung und Reinigung untersucht, ist bekannt als metallurgy.
Natürlich vorkommende feste anorganische Substanz ist bekannt als mineral.
Natürlich vorkommendes festes Material, aus dem wertvolles Mineral oder Metall gewonnen werden kann, ist bekannt als ore.
Die folgende Tabelle zeigt die Hauptelemente und ihre Erze -
| Element | Erze | Chemische Zusammensetzung |
|---|---|---|
| Aluminium | Bauxit | Al 2 O 3 2H 2 O. |
| Korund | Al 2 O 3 | |
| Kryolith | Na 3 AlF 6 | |
| Dyspore | Al 2 O 3 · H 2 O. | |
| Kupfer | Kupferpyrit | CuFeS 2 |
| Malachit | 2CuCO 3 Cu (OH) 2 | |
| Eisen | Hematit | Fe 2 O 3 |
| Magnetit | Fe 3 O 4 | |
| Siderit | FeCO 3 | |
| Natrium | Natriumcarbonat | Na 2 CO 3 |
| Natriumchlorid | NaCl | |
| Natriumnitrat | NaNO 3 | |
| Natriumsulfat | Na 2 SO 4 | |
| Kalium | Kaliumchlorid | KCl |
| Kaliumcarbonat | K 2 CO 3 | |
| Kaliumnitrat | KNO 3 | |
| Magnesium | Magnesit | MgCO 3 |
| Dolomit | CaMg (CO 3 ) 2 | |
| Bittersalz | MgSO 4 | |
| Kalzium | Kalziumkarbonat | CaCO 3 |
| Zinn | Kassiterit | SnO 2 |
| Führen | Galena | PbS |
| Cerussit | PbCO 3 | |
| Anglesite | PbSO 4 | |
| Silber | Argentite | Ag 2 S. |
| Tetrahedrit | Sb 4 S 3 | |
| Zink | Zinkcarbonat (bekannt als Calamin) | ZnCO 3 |
| Zinksulfid | ZnS | |
| Merkur | Zinnober | HgS |
| Mangan | Pyrolusit | MnO 2 |
| Phosphor | Phosphorit | Ca 3 (PO 4 ) 2 |
| Fluorapatit | Ca 5 (PO 4 ) 3 F. | |
| Chlorapatit | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Gold | Calaverite | AuTe 2 |
| Sylvanite | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzit | Ag 3 AuTe 2 | |
| Antimon | Stibnit | Sb 2 S 3 |
| Stibiconit | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Kobalt | Kobaltit | CoAsS |
| Nickel | Pentlandit | ((Ni, Fe) S) |
| Chrom | Chromit | (FeCr 2 O 4 ) |
Einführung
Natrium ist eine weiche, silbrige Farbe und ein hochreaktives Alkalimetall.
Im Periodensystem wird Natrium in Gruppe 1 gehalten, da es ein einzelnes Elektron in seiner äußeren Hülle hat.
Das Symbol für Natrium ist 'Na,'was eigentlich aus dem lateinischen Wort genommen wurde ‘natrium.’
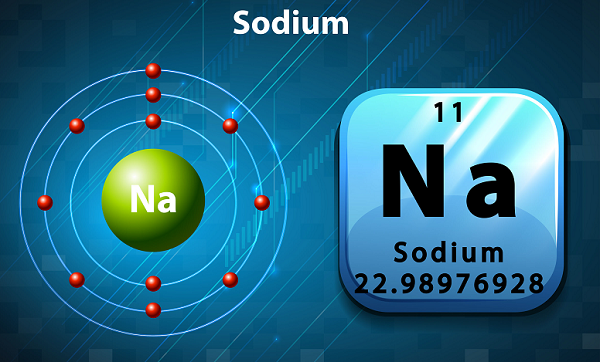
In Bezug auf die Häufigkeit ist Natrium das sechste Element in der Erdkruste.
Natrium kommt in verschiedenen Mineralien vor, darunter Feldspat, Sodalith und Steinsalz (NaCl).
Im Jahr 1807 isolierte Humphry Davy erstmals Natrium durch Elektrolyse von Natriumhydroxid.
Bis dahin sind 20 Natriumisotope bekannt, aber insgesamt sind nur 23 Na stabil.
Hauptmerkmale von Natrium
Im Folgenden sind die Hauptmerkmale des Natriumelements aufgeführt:
Natriummetall ist ein weiches Element, das leicht mit einem Messer geschnitten werden kann.
Natrium ist ein guter Wärme- und Stromleiter.
Aufgrund der geringen Atommasse und des großen Atomradius ist Natrium eines der am wenigsten dichten Elemente (drittes am wenigsten dichtes Element - die ersten beiden sind Lithium und Kalium).
Natrium kann auf dem Wasser schwimmen.
Natrium entlang seiner Verbindungen leuchtet gelb (siehe Bild unten).

Natriumverbindungen haben eine sehr hohe kommerzielle Bedeutung und eine hohe Nachfrage in den Branchen Glas, Papier, Seife und Textilien.
Natriumverbindungen
Im Folgenden sind einige der wichtigsten Beispiele für Natriumverbindungen aufgeführt:
Tafelsalz - (NaCl)
Soda - (Na 2 CO 3 )
Backpulver - (NaHCO 3 )
Ätznatron - (NaOH)
Natriumnitrat - (NaNO 3 )
Natriumthiosulfat - (Na 2 S 2 O 3 · 5H 2 O)
Borax - (Na 2 B 4 O 7 · 10H 2 O)
Vorkommen von Natrium
Die Erdkruste enthält etwa 2,27% Natrium.
Natrium ist das fünfthäufigste Metall; Die anderen vier sind Aluminium, Eisen, Kalzium und Magnesium.
Im ozeanischen Wasser wurden pro Liter etwa 1,08 × 10 4 Milligramm Natrium gefunden.
Natrium kommt nicht als reines Element vor, da es hochreaktiv ist.
Verwendung von Natrium
Im Folgenden sind die Hauptverwendungen von Natrium aufgeführt -
Natriumchlorid ist sehr nützlich zum Enteisen und Enteisen sowie als Konservierungsmittel.
Beim Kochen wird Natriumbicarbonat verwendet.
Natrium und einige seiner Verbindungen werden in Arzneimitteln verwendet.
Im Vergleich zu Kalium (das ein besseres Ion ist) wird Natrium aufgrund seines niedrigeren Preises und Atomgewichts häufiger verwendet.
In der organischen Chemie wird Natriumhydrid als verschiedene Reaktion verwendet.
Metallisches Natrium wird hauptsächlich zur Herstellung von Natriumborhydrid, Natriumtriphenylphosphin, Azid, Indigo usw. verwendet.
In einigen schnellen Reaktoren wird flüssiges Natrium als Wärmeübertragungsflüssigkeit verwendet, da es die Eigenschaft einer guten Wärmeleitfähigkeit aufweist.
Natrium ist auch ein essentielles Mineral für die menschliche Gesundheit, da es den Blutdruck, das Blutvolumen, das osmotische Gleichgewicht und den pH-Wert reguliert.
Die Mindestmenge von 500 Milligramm Natrium wird täglich für einen gesunden menschlichen Körper benötigt.
Einführung
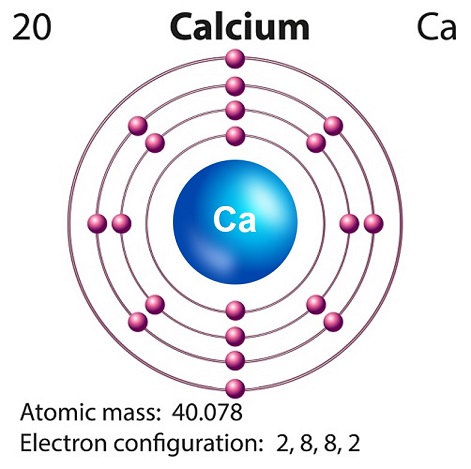
Calcium ist ein weiches grau-gelbes alkalisches Element, das hauptsächlich in der Erdkruste vorkommt.
Das Symbol von Calcium ist “Ca” und Ordnungszahl ist “20.”
Freies Kalzium kommt in der Natur kaum vor, da es hochreaktiv ist.
Calcium wird normalerweise in der Supernova-Nukleosynthese hergestellt.
Hauptmerkmale von Kalzium
Calcium ist eines der am häufigsten vorkommenden Metalle in vielen Tieren.
Calcium ist ein sehr wichtiger Bestandteil von Zähnen, Knochen und Muscheln.
Calciumcarbonat und Calciumcitrat sind die wichtigsten Nahrungsergänzungsmittel, die für eine gute Gesundheit erforderlich sind.
Die Weltgesundheitsorganisation (WHO) hat Kalzium als wesentliche Arzneimittel aufgeführt.
Im Vergleich zu anderen Metallen weisen das Calciumion und die meisten anderen Calciumverbindungen eine geringe Toxizität auf.
Wenn Kalzium mit Wasser oder Säure in Kontakt kommt, reagiert es mit ihnen und wird gefährlich.
Wenn Kalzium mit Luft in Kontakt kommt, reagiert es schnell und bildet eine grauweiße Beschichtung aus Kalziumnitrid und Kalziumoxid.
Die meisten Calciumsalze sind normalerweise farblos.
Wenn Kalzium verbrannt wird, erscheint die Farbe seiner Flamme ziegelrot (siehe das Bild unten).

Calciummetall hat einen vergleichsweise höheren spezifischen elektrischen Widerstand als Aluminium oder Kupfer.
Auftreten
Calcium kommt normalerweise in Sedimentgesteinen vor.
Die Mineralien (Sedimente), in denen Kalzium gefunden wird, sind Kalzit, Dolomit und Gips.
Calcium kommt auch in magmatischen und metamorphen Gesteinen vor, hauptsächlich in Silikatmineralien wie Amphibolen, Plagioklasen, Pyroxenen und Granaten.
Calcium kommt auch in vielen Lebensmitteln vor, nämlich in Milchprodukten, Mandeln, Haselnüssen, Sojabohnen, Brokkoli, Löwenzahnblättern, Feigen und vielen anderen.
Calciumverbindungen
Calciumoxid - CaO
Calciumhydroxid - Ca (OH) 2
Calciumchlorid - CaCl 2
Calciumhypochlorit (Bleichpulver) - Ca (ClO) 2
Calciumphosphat - Ca 3 (PO 4 ) 2
Verwendung von Kalzium
Calcium hat ein breites Anwendungsspektrum, von denen bedeutende -
Calciumcarbonat (CaCO 3 ) wird zur Herstellung von Zement verwendet.
Calciumcarbonat (CaCO 3 ) wird auch zur Herstellung von Zahnpasta verwendet.
In Insektiziden wird Calciumarsenat (Ca 3 (AsO 4 ) 2 ) verwendet.
Calciumchlorid (CaCl 2 ) wird sowohl zur Eisentfernung als auch zur Staubbekämpfung eingesetzt.
Calciumcitrat (Ca 3 (C 6 H 5 O 7 ) 2 ) wird üblicherweise als Lebensmittelkonservierungsmittel verwendet.
Calciumgluconat (Ca (C 6 H 11 O 7 ) 2 ) wird häufig als Lebensmittelzusatzstoff sowie in Vitaminpillen verwendet.
Calciumhypochlorit (Ca (OCl) 2 ) wird im Allgemeinen als Schwimmbaddesinfektionsmittel, als Bleichmittel verwendet.
Einführung
Das Metall mit silbrig-weißen, weichen, nicht magnetischen und duktilen Metalleigenschaften ist als Aluminium bekannt.
Das Symbol für Aluminium ist ‘Al’ und seine Ordnungszahl ist ‘13.’
Das chemische Element Aluminium gehört zur Borgruppe.

- Bauxit ist das Haupterz des Aluminiums.
Hauptmerkmale von Aluminium
Aluminiummetall ist ein chemisch reaktives Element.
Aluminium hat das Potenzial, Korrosion zu widerstehen, und der Prozess dieses spezifischen Widerstands wird als Passivierung bezeichnet.
Aluminium ist ein vergleichsweise haltbares, leichtes, weiches, formbares und duktiles Metall.
Aluminium ist nicht magnetisch und entzündet sich nicht leicht.
Ein Aluminiumfilm ist ein sehr guter Reflektor für sichtbares Licht, da er mehr als 90 Prozent der einfallenden Strahlen reflektiert.
Aluminium reagiert üblicherweise mit Wasser und bildet Wasserstoff.
Aluminium ist das Metall mit geringer Dichte und hat die Eigenschaft, Korrosion zu widerstehen.
Aluminium hat die Eigenschaft der Wärme- und Stromleitfähigkeit und ist daher ein guter Leiter.
Vorkommen von Aluminium
Aluminium macht (ungefähr) 8 Prozent der Erdkruste aus.
Aluminium ist nach Sauerstoff und Silizium das dritthäufigste Element. Es ist jedoch das am häufigsten vorkommende Metall in der Kruste.
Wenn Wasserstoff mit Magnesium verschmilzt, entsteht stabiles Aluminium.
Aluminium kommt natürlicherweise in Oxiden oder Silikaten vor.
Verbindungen aus Aluminium
Es folgen die Hauptverbindungen von Aluminium -
Aluminiumoxid - Al 2 O 3
Aluminiumchlorid - AlCl 3
Aluminiumsulfat - Al 2 (SO 4 ) 3
Aluminiumhydroxid - AI (OH) 3
Aluminiumcarbid - Al 4 C 3
Verwendung von Aluminium
Aluminium ist sowohl in der Industrie als auch im Alltag vielfältig einsetzbar. bedeutend von ihnen sind -
Aluminium wird in Transportindustrien wie Eisenbahnen, Automobilen, Flugzeugen, Raumfahrzeugen, Lastwagen, Seeschiffen, Fahrrädern usw. verwendet.
Aluminium wird zum Verpacken bestimmter Materialien verwendet.
Aluminium wird für die Konstruktion von Türen, Fenstern, Gebäudedraht, Ummantelung, Dach usw. verwendet.
Aluminium wird hauptsächlich zur Herstellung von Elektrokabeln verwendet.
Aluminium wird zur Herstellung von Haushaltsgeräten und vielen anderen Haushaltsgegenständen wie Kochutensilien verwendet.
Aluminium wird in Baseballschlägern, Uhren und vielen anderen solchen Dingen verwendet.
Aluminium wird in fotografischen Geräten verwendet.
Aluminium wird in elektronischen Geräten verwendet.
Aluminium wird als Lichtreflektor verwendet, da es ein guter Lichtreflektor ist. Grundsätzlich sind einige Materialien speziell zur Lichtreflexion aluminiumbeschichtet.
Aluminium wird zur Herstellung von Wasserstoffgas durch Reaktion mit Salzsäure verwendet.
Aluminium wird zur Herstellung von Musikinstrumenten verwendet.
Einführung
Magnesium ist ein glänzend graues festes Element.
Das Symbol für Magnesium ist ‘Mg’ und Ordnungszahl ist ‘12.’

China ist mit rund 80% des Weltmarktanteils der größte Magnesiumlieferant.
Hauptmerkmale von Magnesium
Die Dichte von Magnesium beträgt zwei Drittel der Dichte von Aluminium.
Unter allen Alkalimetallen der Erde hat Magnesium den niedrigsten Schmelzpunkt (dh ungefähr 1.202 0 F) und den niedrigsten Siedepunkt (ungefähr 1.994 0 F).
Magnesium reagiert normalerweise bei Raumtemperatur mit Wasser.
Manchmal wird Magnesium auch als Zünder für Thermit verwendet.
Magnesium erzeugt beim Verbrennen an der Luft ein strahlend weißes Licht, das auch starke ultraviolette Wellenlängen enthält.

Magnesium erzeugt bei Verbrennungen intensives helles und weißes Licht (siehe Bild oben).
Vorkommen von Magnesium
Magnesium ist das achthäufigste Element in der Erdkruste.
Magnesium kommt normalerweise in großen Ablagerungen von Magnesit, Dolomit und anderen solchen Mineralien vor.
Das lösliche Magnesiumion befindet sich im Mineralwasser.
Magnesium ist nach Natrium und Chlor das dritthäufigste im Meerwasser gelöste Element.
Magnesium kommt natürlich nur in Kombination mit einigen anderen Elementen vor.
Magnesium ist das elfthäufigste Element im menschlichen Körper und für alle Zellen und Enzyme essentiell.
Magnesiumionen interagieren häufig mit Polyphosphatverbindungen, einschließlich ATP, DNA und RNA.
Verbindungen von Magnesium
Es folgen die Hauptverbindungen von Magnesium -
Magnesiumcarbonat - MgCO 3
Magnesiumchlorid - MgCl 2
Magnesiumcitrat - C 6 H 6 MgO 7
Magnesiumhydroxid - Mg (OH) 2
Magnesiumoxid - MgO
Magnesiumsulfat - MgSO 4
Magnesiumsulfat-Heptahydrat - (MgSO 4 · 7H 2 O)
Magnesiumsulfat-Heptahydrat ist allgemein bekannt als Epsom salt.
Verwendung von Magnesium
Magnesium hat in unserem Leben ein breites Anwendungsspektrum. Einige bedeutende Verwendungen von Magnesium sind jedoch -
Magnesium ist nach Eisen und Aluminium das dritthäufigste Element.
Magnesium wird insbesondere in superstarken, leichten Materialien und Legierungen verwendet.
Magnesium wird auch als Triebwerksmaterial in der Flugzeugindustrie verwendet.
Magnesium wird auch zur Reinigung der Lösungsmittel verwendet; wie bei der Herstellung des super-trockenen Ethanols.
Viele der großen Automobilmarken, darunter Mercedes, Porsche, BMW, Volkswagen, Chevrolet usw., verwenden Magnesium, um ihre hochwertigen Autos herzustellen.
Aufgrund seines geringen Gewichts und seiner guten elektrischen und mechanischen Eigenschaften wird Magnesium üblicherweise zur Herstellung von Laptops und Tablet-Computern, Mobiltelefonen, Kameras und vielen anderen elektronischen Bauteilen verwendet.
Magnesiumsulfit wird üblicherweise zur Herstellung von Papier verwendet.
Einführung
Mangan ist ein chemisches Element, das normalerweise in Kombination mit dem Eisen vorkommt.
Das Symbol für Mangan ist ‘Mn’ und Ordnungszahl ist ’25.’
Mangan ist ein Metall, das für den industriellen Einsatz sehr wichtig ist.

1774 isolierte Johan Gottlieb Gahn erstmals 1774 eine unreine Manganmetallprobe.
Eigenschaften von Mangan
Im Folgenden sind die wichtigsten Merkmale und Eigenschaften von Mangan aufgeführt:
Mangan ist ähnlich wie Eisen ein silbergraues Metall.
Mangan kann leicht oxidiert werden, ist jedoch sehr schwer zu schmelzen, da es sehr hart und spröde ist.
In der Luft wird Mangan langsam angelaufen (Oxidation).
Mangan ist ein Element, das Teil der Eisengruppe ist.
Vorkommen von Mangan
Mangan ist die 12 - te häufigste Element der Erdkruste.
Der Boden enthält normalerweise etwa 7–9000 ppm Mangan mit durchschnittlich 440 ppm.
Meerwasser hat nur etwa 10 ppm Mangan; Die Atmosphäre enthält etwa 0,01 µg / m3.
Pyrolusit (MnO 2 ) ist das wichtigste Manganerz.
Verbindungen von Mangan
Im Folgenden sind die Hauptverbindungen von Mangan aufgeführt -
Mangan (II) oxid - MnO
Mangan (I) oxid - Mn 2 O 3
Mangandioxid - MnO 2
Manganchlorid - MnCl 2
Kaliumpermanganat - KMnO 4
Mangan (II) sulfat - MnSO 4
Mangan (II) carbonat - MnCO 3
Mangan (II) sulfid - MnS
Mangan (II) -nitrat - Mn (NO 3 ) 2
Mangan (II) -bromid - MnBr 2
Manganheptoxid - Mn 2 O 7
Dimangandecacarbonyl - C 10 O 10 Mn 2
Mangan (II) -iodid - MnI 2
Mangan (II) fluorid - MnF 2
Verwendung von Mangan
Im Folgenden sind die Hauptverwendungen von Mangan aufgeführt -
Mangan ist einer der wichtigsten Bestandteile der Stahlproduktion.
Manganphosphatierung wird üblicherweise zum Schutz vor Rost und Korrosion auf Stahl verwendet.
In der Biologie wirken Mangan (II) -Ionen als Cofaktoren für die Vielzahl von Enzymen.
Mangan ist auch wichtig für das Phänomen der Sauerstoffentwicklung von photosynthetischen Pflanzen.
Mangandioxid wird auch zur Herstellung von Sauerstoff und Chlor sowie zum Trocknen von schwarzen Farben verwendet.
Einführung
Eisen ist das häufigste Element, das hauptsächlich im äußeren und inneren Erdkern vorkommt.
Das Symbol des Eisens ist ‘Fe’ und Ordnungszahl ist ‘26.’

Eisen ist eines der frühesten bekannten Elemente, das von Menschen verwendet wird.
Hauptmerkmale von Eisen
Im Folgenden sind die Hauptmerkmale von Eisen aufgeführt -
Reines Eisenelement ist weich, duktil und formbar.
Der Siedepunkt von Eisen liegt zwischen 1533 ° C und 2450 ° C.
Eisen wird leicht vom Magneten angezogen.
In dry air, iron remains inactive and does not react (with air); however, in moist air, it reacts and forms rust.
Pure iron normally does not react with pure water; however, it reacts easily with ordinary of polluted water and rust forms.
Iron reacts with halogen and Sulphur to form halide and sulphide accordingly.
Occurrence of Iron
The inner and outer cores of the earth are largely made up of iron and nickel.
Most likely, iron is the most abundantly available element of the earth; however, it is the fourth most abundantly available element of the crust.
Types of Iron
Following are the major types iron −
Hematite - Fe2O3
Magnetite - Fe3O4
Siderite - FeCO3
Compounds of Iron
Following are the major compounds of iron −
Iron (II) oxide - FeO
Iron (III) chloride - FeCl3
Iron (III) oxide-hydroxide - Fe(OH)3
Iron (II) sulfide - FeS
Iron (II) chloride - FeCl2
Iron phosphate - FePO4
Ferrate (VI) - (FeO4)2-
Iron (II) acetate - Fe(C2H3O2)2
Iron (III) sulfide - Fe2S3
Iron (III) chromate - Fe2(CrO4)3
Iron (II) hydroxide - Fe(OH)2
Iron (III) acetate - C14H27Fe3O
Iron (II) oxalate - FeC2O4
Iron (II) fluride - FeF2
Uses of Iron
Among all the metals, iron is most widely used (about 90 percent of world’s total metal production).
In most of the heavy industries, iron is the most essential element.
Industries like railway, ship building, automobile, engineering construction, etc., everywhere, iron is essentially required.
Introduction
Copper is a soft, ductile, and malleable metal.
Copper has very high thermal and electrical conductivity.
The symbol of copper is ‘Cu’ and atomic number is ’29.’

Copper is known to people since (about) c. 8000 BC.
Copper is the first metal, which was smelted from its ore around c. 5000 BC.
Salient Features of Copper
Copper was the first metal that cast into a shape (in a mold).
Copper was the first metal that successful alloyed with another metal, e.g. copper alloyed with tin and resultantly bronze is prepared. It is done about c. 3500 BC.
First metal to be purposefully alloyed with another metal, tin, to create bronze, c. 3500 BC.
Copper has a natural reddish-orange color; it is visible once the its surface is exposed.
Copper is a very good conductor of electricity and heat.
Copper is an element of group 11 of the periodic table.
Copper normally does not react with water; however, it does react slowly with atmospheric oxygen and form a layer of brown-black copper oxide.
The brown-black copper oxide usually protects the underlying metal from further corrosion just like passivation.
Passivation is a process of use of a light coat of a protective material, such as metal oxide, which is used to create a protective shell against the corrosion.
Occurrence of Copper
Copper is commonly found in the earth’s crust.
In 1857, the largest mass of elemental copper (weighing about 420 tones) discovered. It was found on the Keweenaw Peninsula located in Michigan, US.
Alloys of Copper
The metal alloys, which have the copper as their major constituent, is known as copper alloys.
Copper alloys are highly resistant to corrosion.
The best (traditional) example of copper alloy is bronze (made by mixing tin and brass).
Following are the major alloys of copper −
Brass
Bronze
Auricupride
Chinese silver
Corinthian bronze
Electrum, Green gold
Grey gold
Niello
Panchaloha
Rose, red, and pink gold
Spangold
Shibuichi
Tibetan silver
White gold
Compounds of Copper
Following are the major compounds of the copper −
Cupric acetate - Cu(CH3COO)2
Copper(I) oxide - Cu2O
Copper(II) oxide - CuO
Copper(II) chloride - CuCl2
Dicopper chloride trihydroxide - Cu2(OH)3Cl
Copper(I) chloride - CuCl
Copper(II) nitrate - Cu(NO3)2
Copper Cyanide - CuCN
Uses of Copper
Copper is largely used in making electric wires.
Copper is used in electric motors.
Copper is used in roofing, plumbing, and in many other industries.
Copper paint is used in painting boats and many other materials.
Many of the home appliances are made up of either pure copper or its alloys.
Introduction
Silver is a soft, lustrous transition, and white metal.
Silver has the highest electrical and thermal conductivity; and, it has also the highest reflectivity of any metal.

The symbol of silver is ‘Ag’ and atomic number is ’47.’
Salient Features of Silver
Silver is a precious metal used since long time by human beings.
Silver is an element of group 11 of the periodic table.
Silver has an excellent white metallic luster commonly used in a high polish.
As silver has no color; therefore, it has high reflectivity (of light).
Silver has very high electrical and thermal conductivity. Its electric conductivity is the highest – higher than copper.
Among all the metals, silver also has the lowest contact resistance.
Occurrence of Silver
The metal silver is usually found in the Earth's crust in the pure form.
Silver also found as an alloy with the gold and some other metals.
Silver is also found in some minerals, such as argentite and chlorargyrite.
Silver is largely produced as a byproduct of gold, copper, zinc, lead, etc.
Alloys of Silver
Following are the major alloys of silver −
Argentium sterling silver
Britannia silver
Doré bullion
Electrum
Goloid
Platinum sterling
Sterling silver
Tibetan silver
Compounds of Silver
Following are the major compound of silver −
Silver chloride - AgCl
Silver iodide - Agl
Silver bromide - AgBr
Silver oxide - Ag2O
Silver sulfide - Ag2S
Silver fluoride - AgF
Silver cyanide - AgCN
Silver carbonate - Ag2CO3
Silver acetate - AgC2H3O2
Silver sulfate - Ag2SO4
Silver chromate - Ag2CrO4
Silver oxalate - Ag2C2O4
Silver chlorate - AgClO3
Uses of Silver
Following are the major uses of silver −
From the ancient period, silver is being used in making coins.
Silver is also used in making ornaments.
Many of the home pots and other utensils were also used to be made by silver.
Silver has also medicinal use, as it is used as an antibiotic coating in medical devices.
Because of having very high electric conductivity, silver is commonly used in some electronic devices.
Besides, silver has many other uses, such as in photography, in chemical equipment, nanoparticles, etc.
Introduction
Gold is a bright, reddish yellow, soft, dense, malleable, and ductile metal naturally found in the earth’s crust.
The symbol of gold is ‘Au’ and atomic number is ‘79.’

Gold is (chemically) a transition metal and belongs to group 11 of the periodic table.
Salient Features of Gold
Gold, which remains in a solid state under standard conditions, is the least reactive element.
Gold is resistant to most of the acids.
Gold does dissolve in aqua regia; aqua regia is a mixture of nitric acid and hydrochloric acid.
However, gold is insoluble in nitric acid.
Gold usually dissolves in alkaline solutions of cyanide.
Cyanide solutions are commonly used in mining and electroplating.
Gold also dissolves in mercury and forms ‘amalgam alloys.’
Gold does not react with oxygen at any temperature.
Occurrence of Gold
Gold commonly occurs as a free element i.e. in the natural form.
Gold occurs as nuggets or else found in in rocks, grains, in veins, and in some other alluvial deposits.
Gold also occurs in a solid solution forms with the native element such as silver (as electrum).
At some places, gold also naturally alloyed with copper and palladium.
Alloys of Gold
Following are the major alloys of gold −
Colored gold
Crown gold
Electrum
Rose gold
Tumbaga
White gold
Compounds of Gold
Following are the major compounds of the gold −
Gold (III) chloride - AuCl3
Gold (I) chloride - AuCl
Cyanide - CN
Chloroauric acid - HAuCl4
Gold (III) oxide - Au2O3
Gold bromide - AuBr
Aqua regia - HNO3+3HCl
Gold bromide - AuBr3
Gold (III) hydroxide - AuH3O3
Gold fluoride - AuF3
Gold (V) fluoride - AuF5
Gold sulfide - Au2S
Fulminating gold
Gold salts
Gold heptafluoride
Uses of Gold
Gold is one of the oldest elements that human being have been using for thousands of years.
As it is highly precious and provides a beautiful look, hence it is characteristically used in making ornaments.
As per the recent trend (of the world), about 50% gold is used in making jewelry, 40% used in investments, and remaining 10% is used in industry.
Introduction
Platinum is a malleable, ductile, dense, and highly unreactive chemical element.
The symbol of platinum is ‘Pt’ and its atomic number is ‘78.’

The name of platinum is derived from a Spanish term i.e. ‘platina,’ which means "little silver."
Platinum is the most precious and the rarest metal (element) on the earth.
Salient Features of Platinum
Following are the important features of the platinum −
Platinum is a silver white metal.
Platinum is an element of group 10 of the periodic table.
Platinum is one of the rarest elements in the crust of the earth.
Platinum is one of the least reactive elements.
Platinum has six natural isotopes.
Platinum is one of the most highly valuable and precious metals.
Platinum is characteristically resists corrosion in all conditions. Because of this reason, it is considered as noble metal.
Platinum is normally insoluble in nitric and hydrochloric acid, but dissolves in hot aqua regia.
After dissolving into the hot aqua regia, platinum gives aqueous chloroplatinic acid (see the image given below).

Occurrence of Platinum
Platinum is commonly found as the native (natural) platinum and as alloy with the other platinum-group.
Platinum usually occurs in the ores of nickel and copper.
Platinum also occurs naturally in the alluvial sands (commonly found in rivers).
Platinum occurs with the concentration of only (about) 0.005 ppm in the Earth's crust.
Alloys of Platinum
Platinum-iridium is one of the most significant alloys of platinum.
Compounds of Platinum
Following are the major compounds of platinum −
Platinum (II) chloride - Pt Cl2
Platinum (IV) chloride - PtCl4
Adam’s catalyst - PtO2
Platinum hexafluoride - PtF6
Potassium tetrachloropla - K2PtCl4
Krogmann’s salt - K2Pt(CN)4Br
Chloroplatinic acid - H2PtCl6
Sodium hexachloropl - Na2PtCl6
Aqua regia - HNO3+3HCl
Uses of Platinum
Platinum is used largely for vehicle emissions control devices.
Platinum is used in petroleum refining and many other chemical productions.
Platinum is used in electronic devices, such as in hard disk (drives).
Platinum is also used in jewelry.
Apart from all these usages, platinum is also used in medicine (anti-cancer drugs), glassmaking equipment, electrodes, turbine engines, investment, etc.
Einführung
Im Periodensystem ist Zink das erste Element der Gruppe 12.
Das Symbol für Zink ist ‘Zn’ und die Ordnungszahl ist ‘30.’
In Bezug auf die Verfügbarkeit, Zink ist der 24 th häufigste Element in der Erdkruste gefunden und es hat fünf stabile Isotope.

Das häufigste Zinkerz ist Sphalerit (Zinkblende), ein Zinksulfidmineral.
Der deutsche Chemiker Andreas Sigismund Marggraf entdeckte das reine metallische Zink erstmals 1746.
Interessanterweise verbrannten Alchemisten Zink in der Luft und bildeten etwas anderes, und das nannten sie "philosopher's wool" oder "white snow. "
Hauptmerkmale von Zink
Die Farbe von Zink ist bläulich-weiß und es ist glänzendes und diamagnetisches Metall.
Zinkmetall ist normalerweise hart und spröde; jedoch bei , wenn die Temperatur steigt von 100 0 C, wird es formbar.
Wenn die Temperatur erhöht 210 0 C, dann wieder das Zinkmetall wird spröde und kann durch Schlagen leicht pulverisiert werden.
Zink ist ein Stromleiter.
Vorkommen von Zink
Zink wird normalerweise in Verbindung mit einigen anderen unedlen Metallen wie Kupfer und Blei gefunden.
Sphalerit ist eine Form von Zinksulfid und das am stärksten abgebaute Erz.
Sphalerit enthält etwa 60 bis 62% Zink.
Legierungen von Zink
Es folgen die Hauptlegierungen von Zink -
Brass
Nickel Silber
Neusilber
Verbindungen von Zink
Es folgen die Hauptverbindungen von Zink -
Zinkoxid - ZnO
Zinksulfid - ZnS
Zinkhalogenide - ZnF 2
Zinknitrat - Zn (NO 3 ) 2
Zinkchlorat - Zn (ClO 3 ) 2
Zinksulfat - ZnSO 4
Zinkphosphat - Zn 3 (PO 4 ) 2
Zinkmolybdat - ZnMoO 4
Zinkchromat - ZnCrO 4
Zink Arsenit - Zn (AsO 2 ) 2
Zinkacetat - Zn (O 2 CCH 3 ) 2
Verwendung von Zink
Zink ist eines der wichtigsten Elemente für die öffentliche Gesundheit.
Zink wird hauptsächlich als Korrosionsschutzmittel und zur Beschichtung von Eisen- und Stahlwerkstoffen verwendet.
Zink wird üblicherweise als Anode oder Brennstoff der Zink-Luft-Batterie verwendet.
Zinkoxid wird häufig als Weißpigment (siehe Abbildung unten) in Farben verwendet.

Zinkoxid wird auch als Katalysator bei der Herstellung von Kautschuk verwendet.
Zink ist ein wesentliches Element für unsere Gesundheit. Es wird normalerweise als Zusatzmaterial in den Formen Zinkoxid, Zinkacetat oder Zinkgluconat verwendet.
Zink ist normalerweise ein antioxidatives Material.
Zinkmangel im menschlichen Körper kann zu Depressionen führen.
Nach der Körperverletzung wird Zink verwendet, um den Heilungsprozess zu beschleunigen.
Zinkpyrithion wird üblicherweise in Shampoos verwendet, um Schuppen vorzubeugen.
Chelatiertes Zink wird normalerweise in Zahnpasten und Mundwässern (flüssig) verwendet, da es Mundgeruch verhindert.
Zink schützt die Haut auch vor Sonnenbrand und wird daher in Körperlotionen verwendet.
Einführung
Quecksilber ist ein chemisches Element, das normalerweise als 'quicksilver. '
Früher wurde Quecksilber als 'hydrargyrum. '
Das Symbol des Quecksilbers ist ‘Hg’ und Ordnungszahl ist ‘80.’

Das rote Pigment Zinnoberrot wird durch Mahlen von natürlichem Zinnober oder synthetischem Quecksilbersulfid extrahiert.
Hauptmerkmale von Quecksilber
Quecksilber ist ein schweres und silberweißes Metall.
Quecksilber normalerweise in flüssigem Zustand erhältlich; Im Normalzustand verbleiben nur die wenigen Metallelemente bei Raumtemperatur in flüssigem Zustand.
Quecksilber ist der schlechte Wärmeleiter, aber es ist ein guter Stromleiter.
Der Gefrierpunkt von Quecksilber ist -38,83 0 C und der Siedepunkt 356,73 0 C.
Quecksilbervergiftung durch die Aufnahme jeglicher Form von Quecksilber. Es wird auch durch Einatmen von Quecksilberdampf verursacht.
Quecksilber löst viele Metalle einschließlich Gold und Silber unter Bildung von Amalgamen auf.
Vorkommen von Merkur
Quecksilber ist eines der seltensten Elemente in der Erdkruste.
Die reichsten Quecksilbererze enthalten etwa 2,5 Prozent Quecksilber (bezogen auf die Masse).
Quecksilber kommt entweder als natürliches (natürliches) Element oder in Mineralien aus Corderoit, Zinnober, Livingstonit usw. vor.
Quecksilber ist die Region des jungen Berggürtels gefunden; der Gürtel, der die dichteren Felsen immer wieder in die Erdkruste drückt. Zum Beispiel vulkanische Regionen oder sogar Regionen mit heißen Quellen.
Quecksilberlegierungen
Amalgam ist die Hauptlegierung von Quecksilber.
Verbindungen von Quecksilber
Es folgen die Hauptverbindungen von Quecksilber -
Quecksilber (II) chlorid - HgCl 2
Quecksilber (II) oxid - HgO
Quecksilbersulfid - HgS
Quecksilber (I) - Chlorid - Hg 2 Cl 2
Dimethylmer - C 2 H 6 Hg
Quecksilber (II) -nitrat - Hg (NO 3 ) 2
Quecksilber (II) acetat - C 4 H 6 O 4 Hg
Quecksilber (II) sulfat - HgSO 4
Quecksilber (I) -iodid - Hg 2 I 2
Quecksilberselenid - HgSe
Quecksilber (II) fulminat - Hg (CNO) 2
Quecksilber (II) -bromid - HgBr 2
Quecksilber (II) -iodid - HgI 2
Quecksilber (I) oxid - Hg 2 O.
Quecksilber (I) fluorid - Hg 2 F 2
Quecksilberamidochlorid - ClH 2 HgN
Diethylquecksilber - C 4 H 10 Hg
Verwendung von Quecksilber
Quecksilber wird hauptsächlich in der chemischen Industrie eingesetzt.
Quecksilber wird in elektrischen und elektronischen Anwendungen eingesetzt.
Quecksilber wird in den Thermometern verwendet, mit denen wir die Temperatur messen.
Quecksilber wird zusammen mit seinen Verbindungen üblicherweise in verschiedenen Arzneimitteln verwendet.
Einführung
Plutonium ist im Grunde ein Aktinidmetall und erscheint silbergrau.
Das Element, dessen Ordnungszahl zwischen 89 und 103 liegt, ist als Actinidenelement bekannt.
Das Symbol für Plutonium ist ‘Pu’ und Ordnungszahl ist ‘94.’

Plutonium besitzt normalerweise sechs Allotrope.
Plutonium ist benannt nach 'Pluto. '
Plutonium wurde erstmals 1940 von einer Gruppe von Wissenschaftlern entdeckt, nämlich Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan und Arthur C. Wahl.
Hauptmerkmale von Plutonium
Plutonium ist ein radioaktives chemisches Element.
Wenn Plutonium der Luft ausgesetzt wird, wird es angelaufen und bildet beim Oxidieren eine matte Beschichtung.
Plutonium reagiert mit vielen Elementen, einschließlich Halogenen, Stickstoff, Kohlenstoff, Silizium und Wasserstoff.
Aufgrund des Spaltprozesses werden Neutronen freigesetzt und wandeln Uran-238-Kerne in Plutonium-239 um.
Plutonium-239 und Plutonium-241 sind beide spaltbar und können daher eine nukleare Kettenreaktion aufrechterhalten. Es ist sehr gut in Atomwaffen und Kernreaktoren anwendbar.
Der Schmelzpunkt von Plutonium beträgt 640 0 C und sein Siedepunkt beträgt 3.228 0 C.
Die Freisetzung des Heliumkerns (einer Hochenergie) ist die häufigste Form des radioaktiven Zerfalls des Plutoniums.
Vorkommen von Plutonium
Das Plutonium kommt natürlich nur in Spuren innerhalb der Uranvorkommen vor.
Plutonium wird auch durch Verbrennen des Urans (während der Entwicklung der Kernenergie) gewonnen.
Legierungen von Plutonium
Es folgen die Hauptlegierungen von Plutonium -
Plutonium-Gallium ist eine der wichtigsten Legierungen von Plutonium und Gallium.
Plutonium-Gallium wird in den Atomwaffengruben verwendet.
Plutonium-Gallium hat die Eigenschaft einer sehr geringen Wärmeausdehnung.
Einige andere Legierungen von Plutonium sind -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Verbindungen von Plutonium
Plutonium (IV) oxid - PuO 2
Plutonium (III) chlorid - PuCl 3
Plutoniumtetrafluorid - PuF 4
Verwendung von Plutonium
Das Isotop Plutonium-239 ist eines der wesentlichen Elemente bei der Entwicklung der Atomwaffen.
In den Kernkraftwerken wird Plutonium als Brennstoff verwendet.
Einführung
Uran ist das Metall der Aktinidenreihe des Periodensystems.
Das Symbol für Uran ist ‘U’ und Ordnungszahl ist ’92.’
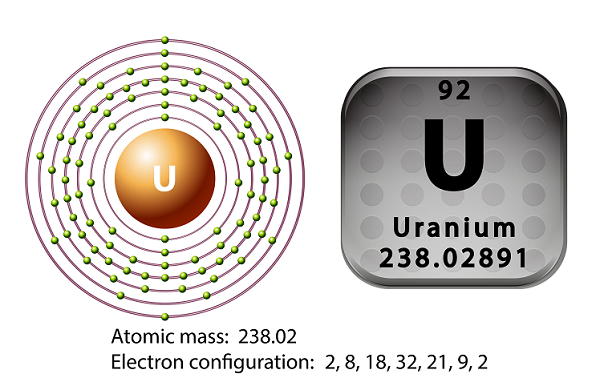
Martin Heinrich Klaproth hatte 1789 das Element Uran entdeckt und nach dem Namen Uranus benannt.
Hauptmerkmale von Uran
Uran ist ein silberweißes Metall.
Ein Uranatom hat 92 Elektronen sowie 92 Protonen, von denen 6 Valenzelektronen sind.
Aufgrund instabiler Isotope ist Uran ein schwaches radioaktives Element.
Uran-238 ist das häufigste Isotop von Uran.
Uran kommt auf natürliche Weise in sehr geringen Konzentrationen vor, dh in einigen ppm in Gestein, Boden und Wasser.
Uran zerfällt allmählich (langsam), indem es sein Alpha-Teilchen emittiert.
Uran hat eine schlechte elektrische Leitfähigkeit (also einen schlechten Stromleiter).
Uran ist formbar, duktil und geringfügig paramagnetisch
Vorkommen von Uran
Uran wird (natürlich) als Uran-238, Uran-235 und Uran-234 gefunden.
Die Halbwertszeit von Uran-238 beträgt ungefähr 4,47 Milliarden Jahre, fast das Alter der Erde, und die Halbwertszeit von Uran-235 beträgt ungefähr 704 Millionen Jahre.
Legierungen von Uran
Es folgen die Hauptlegierungen von Uran -
Staballoy
Uranhydrid
Verbindungen von Uran
Es folgen die Hauptverbindungen von Uran -
Urannitrid - U 2 N 3
Uranpentafluorid - UF 5
Urancarbid - UC
Uranylfluorid - UO 2 F 2
Urandioxid - UO 2
Uranhexafluorid - UF 6
Triuranoxoxid - U 3 O 8
Urantetrafluorid - UF 4
Urantrioxid - UO 3
Urantetrachlorid - Ucl 4
Uranylnitrat - UO 2 (NO 3 ) 2
Verwendung von Uran
Uran wird als Stromquelle in Atom-U-Booten (insbesondere vom Militär) verwendet.
Uran wird zur Herstellung von Atomwaffen verwendet.
Uran wird auch als Vorschaltgerät für Schiffe verwendet.
Einführung
Blei ist ein schweres chemisches Element (Metall), dh es hat eine hohe Dichte.
Das Symbol für Blei ist ‘Pb’ und Ordnungszahl ist ‘82.’

Blei neigt dazu, sich zu binden; Ebenso kann es Ketten, Bindungen, Ringe und polyedrische Strukturen bilden.
Hauptmerkmale von Blei
Blei ist weiches und formbares Metall; es hat einen relativ niedrigen Schmelzpunkt.
Blei ist ein relativ unreaktives Element und neigt dazu, eine Bundesbindung zu bilden.
Wenn Blei geschnitten wird, erscheint es bläulich-weiß gefärbt.
Blei erzeugt beim Brennen eine bläulich-weiße Flamme (siehe Abbildung unten).

Bleiverbindungen befinden sich typischerweise in der Oxidationsstufe +2.
Vorkommen von Blei
Blei ist dem prähistorischen Volk Westasiens bekannt.
Blei befindet sich in der Erdkruste; es wird selten tief in der Erde gefunden.
Blei wird normalerweise in Kombination mit Schwefel gefunden.
Galena ist das wichtigste bleihaltige Mineral, das hauptsächlich in Zinkerzen vorkommt.
Legierungen von Blei
Es folgen die Hauptlegierungen von Blei -
Molybdochalkos (Kupfer)
Lot (Zinn)
Terne (Zinn)
Bleiverbindungen
Es folgen die Hauptverbindungen von Blei -
Bleimonoxid - PbO
Bleidioxid - PbO 2
Verwendung von Blei
Blei wird seit Hunderten von Jahren zur Herstellung von Kugeln verwendet.
Blei wird üblicherweise als Schutzhülle für die Unterwasserkabel verwendet (nur weil es die Eigenschaft der Korrosionsbeständigkeit aufweist).
Bleiblätter werden auch als architektonische Metalle verwendet, insbesondere in Dachmaterialien.
Blei wird auch in Säurebatterien verwendet.
Bleiverbindungen sind üblicherweise als Farbstoffe und Halbleiter.
Bleiverbindungen werden auch in Kunststoffen, Kerzen, Glas usw. verwendet.
Blei wird üblicherweise im Polyvinylchlorid verwendet (dh zur Beschichtung von Stromkabeln).
Vorsicht
Das Vorhandensein von Blei (in übermäßiger Qualität) im Körper kann das Gehirn und die Nieren schwer schädigen. es kann sogar zum Schluss führen.
Einführung
Thorium ist eines der radioaktiven Aktinidmetalle, die in großen Mengen natürlich vorkommen.
Das Symbol für Thorium ist ‘Th’ und Ordnungszahl ist ’90.’

1829 entdeckte ein norwegischer Mineralogist, Morten Thrane Esmark, erstmals Thorium.
Jöns Jacob Berzelius, der schwedische Chemiker, identifizierte und nannte es "Thorium" nach dem Namen "Thor", dem nordischen Gott des Donners.
Hauptmerkmale von Thorium
Thorium ist ein paramagnetisches und weiches radioaktives Actinidmetall.
Die Farbe des Thoriummetalls ist silbrig; Wenn es der Luft ausgesetzt wird, läuft es schwarz an und bildet Dioxid.
Alle Isotope von Thorium sind instabil und es ist ein schwaches radioaktives Element.
Unter allen signifikanten radioaktiven Elementen ist die Halbwertszeit von Thorium die längste, dh etwa 14,05 Milliarden Jahre.
Der Schmelzpunkt von Thorium liegt bei etwa 1750 ° C.
Vorkommen von Thorium
Thorium ist ein Urelement, das in seiner gegenwärtigen Form existiert, seit die Erde gebildet wurde.
Thorium, das in der Erdkruste gefunden wird, wird aus dem Monazitsand raffiniert.
Monazit, das weltweit in großen Mengen vorkommt, ist die wichtigste Thoriumquelle.
Legierungen von Thorium
Mag-Thor und Thorium-Aluminium sind die wichtigsten Legierungen von Thorium, Magnesium und Aluminium.
Verbindungen von Thorium
Es folgen die Hauptverbindungen von Thorium -
Thoriumdioxid - ThO 2
Thorium (IV) sulfid - ThS 2
Thorium (IV) -iodid - ThI 4
Thoriumtetra - ThF 4
Thorium (IV-Chlorid - ThCl 4
Thorium (IV) -carbid - ThC
Einige andere sind -
Thorite
Thorium (IV) -nitrat
Thorium (IV) orthosilicat
Verwendung von Thorium
Thorium wird normalerweise beim Gas-Wolfram-Lichtbogenschweißen (GTAW) verwendet, da es (Thorium) die Hochtemperaturfestigkeit von Wolframelektroden erhöht und dementsprechend die Lichtbogenstabilität verbessert.
In elektronischen Geräten erhöht das Aufbringen einer Thoriumbeschichtung auf Wolframdraht die Elektronenemission von erhitzten Kathoden.
In der chemischen Industrie ist das Dioxid von Thorium nämlich ‘thoria’ wird häufig verwendet.
Einführung
Im Periodensystem ist Wasserstoff das leichteste Element, sein Atomgewicht beträgt lediglich 1,008.
Das Symbol für Wasserstoff ist ‘H’ und die Ordnungszahl ist ‘1.’

Im frühen 16. th Jahrhundert, wurde zum ersten Mal von Wasserstoffgas künstlich durch die Reaktion von Säuren und Metallen hergestellt.
Henry Cavendish erkannte das Wasserstoffgas erstmals in der Zeit von 1766 bis 1761 als diskrete Substanz, da es beim Verbrennen Wasser produziert.
Hauptmerkmale von Wasserstoff
In ihrem Plasmazustand bestehen die nicht verbleibenden Sterne hauptsächlich aus Wasserstoff.
Bei Standardtemperatur und -druck erscheint Wasserstoff farblos, geschmacklos, geruchlos, nichtmetallisch, ungiftig und leicht brennbar.
Die Summenformel von Wasserstoff lautet H 2 .
Auf der Erde liegt Wasserstoff in molekularen Formen vor, beispielsweise in Wasser oder anderen organischen Verbindungen.
Wasserstoff spielt auch eine wichtige Rolle bei Säure-Base-Reaktionen.
Wasserstoffgas ist in der Luft leicht entflammbar.
Reine Wasserstoff-Sauerstoff-Flammen strahlen ultraviolettes Licht aus; Darüber hinaus sind Mischungen mit hohem Sauerstoffgehalt für das bloße Auge nahezu unsichtbar.
Wasserstoff kann mit fast jedem oxidierenden Element reagieren.
Bei Raumtemperatur reagiert Wasserstoff normalerweise spontan und bösartig mit Chlor und Fluor und bildet die entsprechenden Halogenwasserstoffe.
Vorkommen von Wasserstoff
Wasserstoff ist mit etwa 75 Prozent der gesamten baryonischen Masse die am häufigsten vorkommende chemische Existenz im Universum.
Im gesamten Universum kommt Wasserstoff typischerweise im Atom- und Plasmazustand vor. Die Eigenschaften unterscheiden sich jedoch stark von denen des molekularen Wasserstoffs.
Auf der Erde existiert Wasserstoff als zweiatomiges Gas, dh H 2 .
Aufgrund seines geringen Gewichts entweicht Wasserstoff leicht aus der Erdatmosphäre.
Wasserstoff ist das dritthäufigste Element auf der Erdoberfläche, jedoch hauptsächlich in Form von Kohlenwasserstoffen und Wasser.
Wasserstoffverbindungen
Es folgen die Hauptverbindungen von Wasserstoff -
Wasser - H 2 O.
Ammoniak - NH 3
Chlorwasserstoff - HCl
Fluorwasserstoff - HF
Schwefelwasserstoff - H 2 S.
Methan - CH 4
Hydroxid - OH -
Bromwasserstoff - HBr
Jodwasserstoff - HI
Cyanwasserstoff - HCN
Phosphin - PH 3
Selenwasserstoff - H 2 Se
Methanol - CH 3 OH
Lithiumhydrid - LiH
Bicarbonat - HCO 3
Tellurwasserstoff - H 2 Te
Flüssiger Wasserstoff - H 2
Cyanid - CN
Calciumhydrid - CaH 2
Schweres Wasser - D 2 O.
Diboran - B 2 H 6
Natriumhydrid - NaH
Kaliumhydrid - KH
Verwendung von Wasserstoff
Die größte Menge an H 2 wird bei der Verarbeitung fossiler Brennstoffe sowie bei der Herstellung von Ammoniak verwendet.
Wasserstoff (H 2 ) wird in der Erdöl- und Chemieindustrie in großem Umfang eingesetzt.
H 2 wird typischerweise als Hydrierungsmittel verwendet, insbesondere zur Erhöhung des Sättigungsgrades von ungesättigten Fetten und Ölen.
H 2 wird auch als Schutzgas bei Schweißverfahren wie dem atomaren Wasserstoffschweißen usw. verwendet.
Einführung
Helium ist das zweitleichteste (nach Wasserstoff) und zweithäufigste Element im Universum.
Das Symbol von Helium ist ‘He’ und Ordnungszahl ist ‘2.’

Im Periodensystem ist Helium das erste in der Edelgasgruppe.
Helium ist nach dem Namen des griechischen Sonnengottes benannt. 'Helios. '
Hauptmerkmale von Helium
Helium ist ein farbloses, geruchloses, geschmackloses, inertes, ungiftiges und einatomiges Gas.
Der Siedepunkt (-268,9 0 C) von Helium ist der niedrigste unter allen Elementen.
Helium besteht typischerweise aus zwei Elektronen in Atomorbitalen und ist von einem Kern umgeben, der aus zwei Protonen und zwei Neutronen besteht.
Vorkommen von Helium
Das meiste im Universum gefundene Helium gehört dazu helium-4und es wird angenommen, dass es während des Urknalls gebildet wurde.
Ein Großteil des neuen Heliums wird typischerweise durch Kernfusion von Wasserstoff in Sternen einschließlich der Sonne erzeugt.
Though there is continuous creation of new helium; nevertheless, the availability of helium on the earth is substantially low because being the light weight element, it easily escapes into space.
In heterosphere (outer atmosphere) of the earth, helium is one of the most abundantly found elements (gases).
In the earth’s crust, helium is characteristically found in large amounts in the minerals of uranium and thorium.
Compounds of Helium
Following are the major compounds of helium −
Disodium helide - Na2He
Cristobalite He II (Silicates) - SiO2He
Dihelium arsenolite - As4O6•2He
Isotopes of Helium
There are about nine known isotopes of helium, but following two are the most stable isotopes −
Helium-3 and
Helium-4
Uses of Helium
Because of having low density, low boiling point, low solubility, high thermal conductivity, helium is widely used element; the most popular example is – use of helium in balloon.
Major chunk of helium has cryogenic applications, such as, cooling the superconducting magnets used in medical MRI scanners and NMR spectrometers.
Helium is also used as a protective gas in growing silicon and germanium crystals.
Helium is also used in and gas chromatography and in titanium and zirconium production.
Helium is used in supersonic wind tunnels.
Helium is also applied as a shielding gas in an arc welding processes.
Introduction
Oxygen is the member of group 16 on the periodic table; however, most of the time, it is treated differently from its group.
The symbol of oxygen is ‘O’ and atomic number is ‘8.’

Oxygen has about nine allotropes and the most common allotrope is diatomic oxygen (i.e. O2). Other important allotrope is Ozone i.e. O3.
Oxygen, first time, was noticed by Swedish pharmacist Carl Wilhelm Scheele.
Salient Features of Oxygen
Oxygen is characteristically categorized as the member of “chalcogen” group.
The word "chalcogen" is derived from a Greek word “khalkόs,” which means “copper” and the Latin-Greek word “Genēs,” which means born or produced.
Oxygen is a highly reactive gas (or nonmetallic element); hence, it is an oxidizing agent that readily forms oxides with most of the elements and compounds.
Oxygen has six valence electrons.
The melting point of oxygen is -218.80C and the boiling point is -1830C.
Occurrence of Oxygen
With about 20.8 percent share (in total earth’s atmospheric constituents), oxygen is the second ranked element of the earth’s atmosphere.
Oxygen occurs almost in sphere of the earth namely atmosphere, hydrosphere, and lithosphere.
During the photosynthesis process, free oxygen is produced by all green plants.
Oxygen occurs as constituent copper ores.
A human body contains about 65 percent oxygen.
By mass, almost half of the earth’s crust is composed of oxygen (i.e. its oxides).
By mass, oxygen is the third-most abundant element that found in the universe; the first and second are hydrogen and helium accordingly.
Oxygen (i.e. O2) is a colorless and odorless diatomic gas.
Oxygen dissolves in water very easily; however, the solubility of oxygen in the water is temperature-dependent.
Compounds of Oxygen
Following are the major compounds of oxygen −
Oxide
Peroxide
Carbon dioxide - CO2
Hydroxide - OH-
Ozone - O3
Mercury (II) oxide - HgO
Chlorate - ClO3
Aluminum oxide - Al2O3
Carbon monoxide - CO
Hypochlorite - ClO-
Silicon dioxide - SiO2
Hypofluorous acid - HOF
Sodium peroxide - Na2O2
Potassium chlorate - KClO3
Oxygen difluoride - OF2
Sodium oxide - Na2O
Uses of Oxygen
Oxygen (O2) is the most essential requirements for the respiration, without it, life cannot be imagined.
Oxygen is used in medicine.
Oxygen therapy is typically used to treat some diseases, such as, emphysema, pneumonia, some heart disorders, etc.
Some of the underwater activities, such as scuba diving, submarines, etc. also use artificial oxygen.

Aircrafts, mountaineers, etc. also use artificial oxygen.
Oxygen is also used in some of the industries, e.g. smelting of iron ore into steel – in this process, about 55% of oxygen is used.
Introduction
Carbon is a non-metallic and tetravalent element.
Tetravalent means – carbon makes four electrons available to form the covalent chemical bonds.
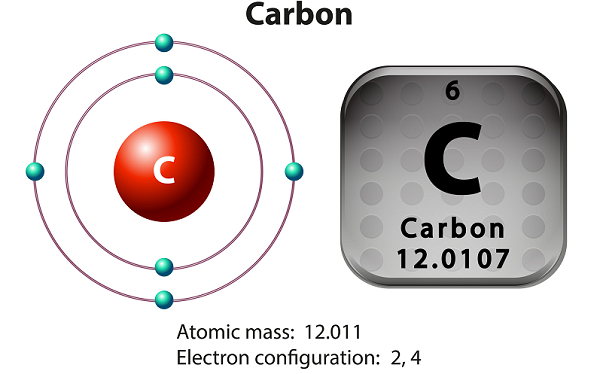
Carbon has three isotopes that occur naturally – namely 12C, 13C, and 14C.
Among them, 12C and 13C are stable, but 14C is a radioactive isotope. Half-life of 14C is about 5,730 years.
Salient Features of Carbon
The physical properties of carbon largely depend on its allotropes.
Major allotropes of carbon are graphite, diamond, and amorphous carbon.
Graphite is opaque, black, and very soft; hence, it used to form a streak on the paper.
Diamond very hard (the hardest naturally occurring material) and transparent.
Graphite is a good conductor of electricity.
Diamond is bad conductor of electricity.
Carbon most likely has the highest sublimation point among all the elements.
Occurrence of Carbon
In terms of mass, carbon is the fourth most abundant chemical element found in the universe (after hydrogen, helium, and oxygen).
Carbon is available in abundance in the Sun, stars, comets, and in the atmospheres of most of the planets.
Carbon is found in the earth’s atmosphere and dissolved in water.
Hydrocarbons, such as coal, petroleum, and natural gas, all of them contain carbon.
Carbon is also found in methane hydrates, which found in polar regions and under the seas.
Some of the rocks enriched of carbon are coal, limestone, dolomite, etc.
Coal is very rich in carbon; hence, it is the largest commercial source of mineral carbon.
Coal shares about 4,000 gigatonnes or 80% of total fossil fuel.
Compounds of Carbon
Following are the major compounds of Carbon −
Cyanogen - CN2
Hydrogen cyanide - HCN
Cyanamide - CN2H2
Isocyanic acid - HNCO
Cyanogen chloride - CNCl
Chlorosulfonyl isocyanate - CNClO3S
Cyanuric chloride - NCCl3
Carbon disulfide - CS2
Carbonyl sulfide - OCS
Carbon monosulfide - CS
Uses of Carbon
Depending upon the allotrops, carbon is used in range of applications.
Carbon is one of the most essential elements of life without it, we cannot imagine life on the earth.
The fossil fuel namely methane gas and crude oil (petroleum), coal etc. are used in everyday life.
Graphite, combining with clay, used in making 'lead' used in pencils.
Charcoal is also used as a drawing material in artwork, iron smelting, barbecue grilling, etc.
Diamond is usually used in jewelry.
Industrial diamonds are used in cutting, drilling, and polishing tools for machining the metals and stone.
Fossil hydrocarbons, and carbon fiber are used in making plastic.
Introduction
Nitrogen is a chemical element of group of 15 of the periodic table; among all the elements of group 15, it is the lightest element.
The symbol of nitrogen is ‘N’ and atomic number is 7.

In 1772, Scottish physician Daniel Rutherford, first discovered and isolated carbon.
However, the name ‘nitrogen’ was first given by Jean-Antoine-Claude Chaptal in 1790.
Salient Features of Nitrogen
Nitrogen has two stable isotopes namely 14N and 15N.
Free nitrogen atoms normally easily react with most of the elements and form nitrides.
The molecules of N2 is colorless, odorless, tasteless, and diamagnetic gas at standard conditions.
The melting point of N2 is −2100C and the boiling point is −1960C.
Nitrogen compounds repetitively interchange between the atmosphere and living organisms, making a nitrogen cycle.
Occurrence of Nitrogen
Nitrogen is most abundantly found element on the earth, as it constitutes about 78.1% of the entire volume of the earth’s atmosphere.
Nitrogen gas, which is an industrial gas, largely produced by the fractional distillation of liquid air.
Compounds of Nitrogen
Following are the major compounds of Nitrogen −
Ammonium - NH4+
Ammonia - NH3
Nitric acid - HNO3
Nitrite - NO2-
Nitrogen dioxide - NO2
Dinitrogen pentroxide - N2O5
Hydrazine - N2H4
Dinitrogen - N2
Cyanide - CN
Ammonium nitrate - (NH4)(NO3)
Nitrogen trichloride - NCl3
Nitrogen trifluoride - NF3
Nitrogen triiodide - NI3
Pyridine - C5H5N
Nitronium ion - NO2+
Hydrazoic acid - HN3
Ammonium sulfate - (NH4)2SO4
Uses of Nitrogen
Nitrogen compounds are extensively used in wide range of fields and industries.
Pure nitrogen is used as food additive.
Used in fire suppression systems especially for the information technology equipment.
Also used in manufacturing stainless steel.
Nitrogen is also used to inflate the tires of some of the aircraft and race cars.
Liquid nitrogen is used as a refrigerant.
The laws of nature related to chemistry is known as chemical laws.
Chemical reactions, normally, are administrated by certain laws, which are observed and formulated in words become fundamental concepts in chemistry.
Following are the significant chemical laws −
| Laws | Explanation |
|---|---|
| Avogadro's Law | “Equal volumes of all gases, at the same temperature and pressure, have the same number of molecules” |
| Beer–Lambert law, (or simply Beer's law or Lambert–Beer law) | “Explains the attenuation of light to the properties of the material through which it (light) passes” |
| Boyle's Law | “The absolute pressure exerted by a given mass of an ideal gas is inversely proportional to the volume it occupies if the temperature and amount of gas remain unchanged within a closed system” |
| Charles' Law (also known as Law of Volume) | “When the pressure on a sample of a dry gas is held constant, the Kelvin temperature and the volume will be directly related” |
| Fick's Laws of Diffusion | Describes “diffusion” (of flux) |
| Gay-Lussac's Law | "All gases have the same mean thermal expansivity at constant pressure over the same range of temperature" |
| Le Chatelier's Principle ("The Equilibrium Law") | “When any system at equilibrium is subjected to change in concentration, temperature, volume, or pressure, then the system readjusts itself to counteract (partially) the effect of the applied change and a new equilibrium is established” |
| Henry's Law | “The law calculates the concentration of gas in the solution under pressure” |
| Hess's Law | “The change of enthalpy in a chemical reaction (it means, the heat of reaction at constant pressure) is independent of the pathway between the initial and final states” |
| Law of conservation of energy | “Energy can neither be created nor be destroyed” |
| Raoult's Law | “The partial vapor pressure of each component of an ideal mixture of liquids is equal to the vapor pressure of the pure component multiplied by its mole fraction in the mixture” |
| Faraday's Law Electrolysis | “The amount of substance produced at an electrode is directly proportional to the quantity of electricity passed” |
| Atomic Theory | “Matter is composed of distinct units known as atoms” |
| Köhler Theory | “Explains the process in which water vapor condenses and forms the liquid cloud drops” |
| Van 't Hoff Equation | “Describes change in the equilibrium constant of a chemical reaction” |
| Transition State Theory | “The reaction rates of elementary chemical reactions” |
| Grotthuss–Draper Law | “It describes that the light which is absorbed by a system/surface can bring a photochemical change” |
| Kinetic Theory of Gases | “Describes the behavior of a hypothetical ideal gas” |
| Aufbau Principle | “Explains that the electrons orbiting the atoms first fill the lowest energy levels and then second higher levels and so on and so forth” |
| Hund's Rule | “ Explains that every orbital in a sublevel is singly occupied before any orbital is doubly occupied” |
| Collision Theory | “Based on the kinetic theory of gases, collision theory describes that the gas-phase chemical reactions occur when molecules collide with sufficient kinetic energy” |
Introduction
Most likely copper was the first element, which was mined and used by humans.
The evidence of earliest use of copper was found in Anatolia, which belongs to 6,000 BCE.
The lead was most likely the second element that humans start using.
The oldest known artifact of lead is statuette, which was found in a temple of Osiris, Abydos, Egypt.
The statuette of Osiris temple belongs to (about) 3,800 BCE.
The oldest known gold treasure was discovered in Varna, Necropolis (Bulgaria).
This gold treasure belongs to (about) 4,400 BCE.
Discovery of silver is almost same as of gold; its evidence was found in Asia Minor.
Some evidence say that the iron was known from (about) 5,000 BCE.
The oldest known iron objects, which was used by the humans, were found in Egypt (belongs to 4000 BCE).
The following table illustrates the significant elements with their discovery date and discovers −
| Element | Discoverer | Discovery Date |
|---|---|---|
| Copper | Middle East (Place) | About 9,000 BCE |
| Lead | Egypt (Place) | About 7,000 BCE |
| Gold | Bulgaria (Place) | About 6,000 BCE |
| Silver | Asia Minor (Place) | About 5,000 BCE |
| Iron | Egypt (Place) | About 5,000 BCE |
| Tin | About 3,500 BCE | |
| Sulfur | Chinese/India | About 2,000 BCE |
| Mercury | Egypt | 2,000 BCE |
| Phosphorus | H. Brand | 1669 |
| Cobalt | G. Brandt | 1735 |
| Platinum | A. de Ulloa | 1748 |
| Nickel | F. Cronstedt | 1751 |
| Bismuth | C.F. Geoffroy | 1753 |
| Magnesium | J. Black | 1755 |
| Hydrogen | H. Cavendish | 1766 |
| Oxygen | W. Scheele | 1771 |
| Nitrogen | D. Rutherford | 1772 |
| Barium | W. Scheele | 1772 |
| Chlorine | W. Scheele | 1774 |
| Manganese | W. Scheele | 1774 |
| Molybdenum | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirconium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Beryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Boron | L. Gay-Lussac and L.J. Thénard | 1808 |
| Fluorine | A. M. Ampère | 1810 |
| Iodine | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S. L Hermann, F. Stromeyer, and J.C.H. Roloff | 1817 |
| Selenium | J. Berzelius and G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | H.C.Ørsted | 1825 |
| Bromine | J. Balard and C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen and G. R. Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich and T. Richter | 1863 |
| Helium | P. Janssen and N. Lockyer | 1868 |
| Neon | W. Ramsay and W. Travers | 1898 |
| Xenon | W. Ramsay and W. Travers | 1898 |
| Fermium | A. Ghiorso et al | 1952 |
| Nobelium | E. D. Donets, V. A. Shchegolev and V. A. Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris and P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
The following table illustrates significant elements and their valence −
| Element | Valence | Symbol | Atomic No. |
|---|---|---|---|
| Hydrogen | -1, +1 | H | 1 |
| Helium | 0 | He | 2 |
| Lithium | 1 | Li | 3 |
| Beryllium | 2 | Be | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Carbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oxygen | -1, -2, 0, 2, 1, | O | 8 |
| Fluorine | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminum | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphorus | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlorine | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Ca | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganese | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Iron | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Copper | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | As | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Bromine | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |