Electrónica básica - Materiales
La materia está formada por moléculas que constan de átomos. Según la teoría de Bohr, "el átomo consta de un núcleo cargado positivamente y una serie de electrones cargados negativamente que giran alrededor del núcleo en varias órbitas". Cuando un electrón se eleva de un estado inferior a un estado superior, se dice que esexcited. Mientras se excita, si el electrón se elimina completamente del núcleo, se dice que el átomo está ionizado. Entonces, el proceso de elevar el átomo desde el estado normal a este estado ionizado se llamaionization.
La siguiente figura muestra la estructura de un átomo.
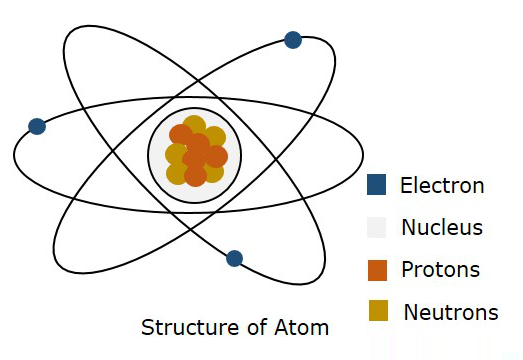
Según el modelo de Bohr, se dice que un electrón se mueve en un Orbit, mientras que según la mecánica cuántica, se dice que un electrón está en algún lugar del espacio libre del átomo, llamado como Orbital. Se demostró que esta teoría de la mecánica cuántica era correcta. Por lo tanto, un límite tridimensional donde es probable que se encuentre un electrón se llama comoAtomic Orbital.
Números cuánticos
Cada orbital, donde se mueve un electrón, difiere en su energía y forma. Los niveles de energía de los orbitales se pueden representar mediante un conjunto discreto de integrales y medias integrales conocidas como números cuánticos. Hay cuatro números cuánticos que se utilizan para definir una función de onda.
Número cuántico principal
El primer número cuántico que describe un electrón es el Principal quantum number. Su símbolo esn. Especifica el tamaño o el orden (nivel de energía) del número. A medida que aumenta el valor de n, la distancia promedio del electrón al núcleo también aumenta, y también aumenta la energía del electrón. El nivel de energía principal puede entenderse como un caparazón.
Número cuántico de momento angular
Este número cuántico tiene lcomo su símbolo. Esta l indica la forma del orbital. Va de 0 a n-1.
l = 0, 1, 2… n-1
Para el primer caparazón, n = 1.
es decir, para n-1, l = 0 es el único valor posible de l cuando n = 1.
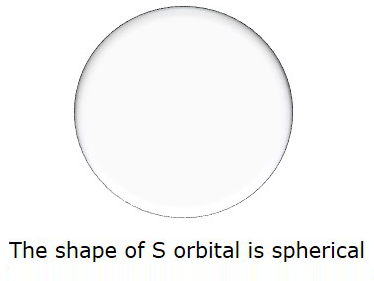
Entonces, cuando l = 0, se llama como Sorbital. La forma de S es esférica. La siguiente figura representa la forma de S.
Si n = 2, entonces l = 0, 1 ya que estos son los dos valores posibles para n = 2.
Sabemos que es un orbital S para l = 0, pero si l = 1, es P orbital.
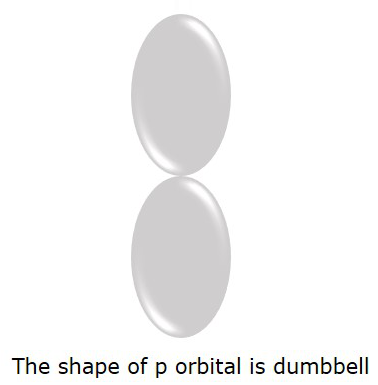
El orbital P donde es más probable que se encuentren los electrones está en dumbbellforma. Se muestra en la siguiente figura.
Número cuántico magnético
Este número cuántico se denota por mlque representa la orientación de un orbital alrededor del núcleo. Los valores de m l dependen de l.
$$ m_ {l} = \ int (-l \: \: a \: + l) $$
Para l = 0, m l = 0 esto representa el orbital S.
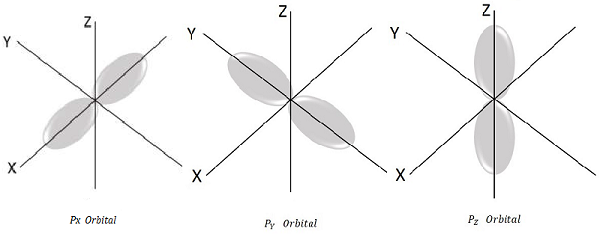
Para l = 1, m l = -1, 0, +1 estos son los tres valores posibles y esto representa el orbital P.
Por tanto, tenemos tres orbitales P como se muestra en la siguiente figura.
Número cuántico de giro
Esto está representado por msy el electrón aquí gira sobre el eje. El movimiento del giro del electrón podría ser en sentido horario o antihorario, como se muestra a continuación.
Los posibles valores para este número cuántico de espín serán como,
$$ m_ {s} = + \ frac {1} {2} \: \: arriba $$
Para un movimiento llamado spin up, el resultado es la mitad positiva.
$$ m_ {s} = - \ frac {1} {2} \: \: abajo $$
Para un movimiento llamado giro hacia abajo, el resultado es la mitad negativa.
Estos son los cuatro números cuánticos.
Principio de exclusión de Pauli
Según el principio de exclusión de Pauli, no two electrons in an atom can have the same set of four identical quantum numbers. Es decir, si dos electrones cualesquiera tienen los mismos valores de n, s, ml (como acabamos de comentar anteriormente), el valor l definitivamente sería diferente en ellos. Por tanto, no hay dos electrones que tengan la misma energía.
Conchas electrónicas
Si n = 1 es una capa, entonces l = 0 es una subcapa.
Asimismo, n = 2 es una capa y l = 0, 1 es una subcapa.
Las capas de electrones correspondientes an = 1, 2, 3… .. están representadas por K, L, M, N respectivamente. Las subcapas u orbitales correspondientes a l = 0, 1, 2, 3, etc. se indican mediante s, p, d, f, etc. respectivamente.
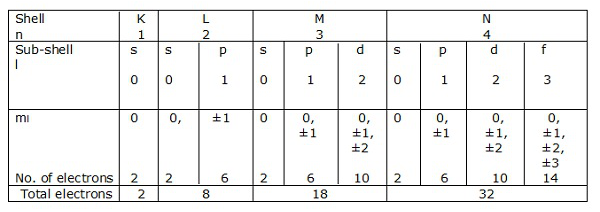
Echemos un vistazo a las configuraciones electrónicas de carbono, silicio y germanio (Grupo IV - A).

Se observa que la subcapa p más externa en cada caso contiene solo dos electrones. Pero el número posible de electrones es seis. Por tanto, hay cuatrovalence electronsen cada capa exterior más externa. Entonces, cada electrón en un átomo tiene una energía específica. La disposición atómica dentro de las moléculas en cualquier tipo de sustancia es casi así. Pero el espaciamiento entre los átomos difiere de un material a otro.