Podstawowa elektronika - materiały
Materia składa się z cząsteczek, które składają się z atomów. Zgodnie z teorią Bohra „atom składa się z dodatnio naładowanego jądra i pewnej liczby ujemnie naładowanych elektronów, które krążą wokół jądra po różnych orbitach”. Mówi się, że kiedy elektron zostaje podniesiony z niższego stanu do wyższego stanuexcited. Choć ekscytujące, jeśli elektron zostanie całkowicie usunięty z jądra, mówi się, że atom jest zjonizowany. Tak więc proces podnoszenia atomu ze stanu normalnego do stanu zjonizowanego nazywa się asionization.
Poniższy rysunek przedstawia strukturę atomu.
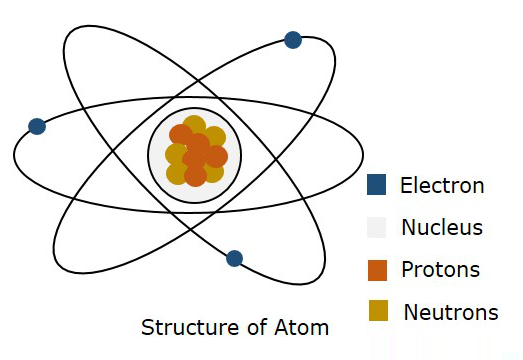
Zgodnie z modelem Bohra mówi się, że elektron porusza się w konkretnym miejscu Orbitpodczas gdy zgodnie z mechaniką kwantową mówi się, że elektron znajduje się gdzieś w wolnej przestrzeni atomu, zwanej as Orbital. Ta teoria mechaniki kwantowej okazała się słuszna. Stąd trójwymiarowa granica, w której prawdopodobnie zostanie znaleziony elektron, nazywana jest asAtomic Orbital.
Liczby kwantowe
Każdy orbital, po którym porusza się elektron, ma inną energię i kształt. Poziomy energii orbitali można przedstawić za pomocą dyskretnego zbioru całek i półcałek, znanych jako liczby kwantowe. Istnieją cztery liczby kwantowe używane do zdefiniowania funkcji falowej.
Główna liczba kwantowa
Pierwsza liczba kwantowa opisująca elektron to liczba Principal quantum number. Jej symbolem jestn. Określa wielkość lub kolejność (poziom energii) liczby. Wraz ze wzrostem wartości n wzrasta również średnia odległość od elektronu do jądra, rośnie również energia elektronu. Główny poziom energii można rozumieć jako powłokę.
Moment pędu Liczba kwantowa
Ta liczba kwantowa ma ljako jego symbol. To l wskazuje na kształt orbity. Waha się od 0 do n-1.
l = 0, 1, 2… n-1
Dla pierwszej powłoki n = 1.
tj. dla n-1, l = 0 jest jedyną możliwą wartością l jako n = 1.
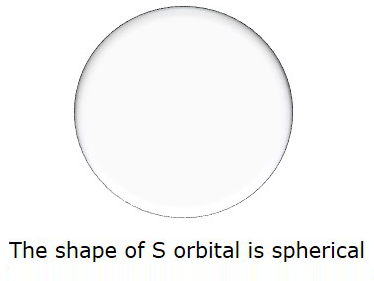
Tak więc, gdy l = 0, nazywa się to Sorbitalny. Kształt litery S jest kulisty. Poniższy rysunek przedstawia kształt S.
Jeśli n = 2, to l = 0, 1, ponieważ są to dwie możliwe wartości dla n = 2.
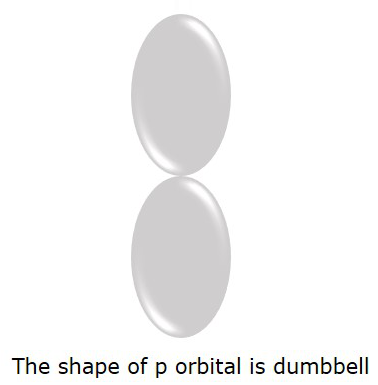
Wiemy, że jest to orbital S dla l = 0, ale jeśli l = 1, to jest P orbitalny.
Orbital P, w którym elektrony są bardziej prawdopodobne, znajduje się w dumbbellkształt. Przedstawiono to na poniższym rysunku.
Magnetyczna liczba kwantowa
Ta liczba kwantowa jest oznaczona przez mlktóry reprezentuje orientację orbitalu wokół jądra. Wartości m l zależą od l.
$$ m_ {l} = \ int (-l \: \: to \: + l) $$
Dla l = 0, m l = 0 oznacza to orbitę S.
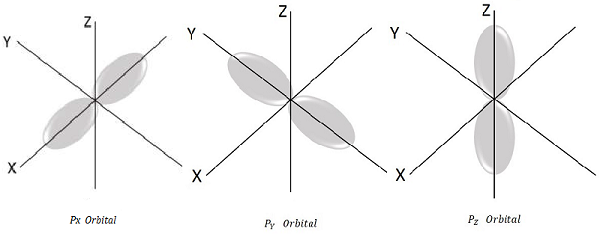
Dla l = 1, m l = -1, 0, +1 są to trzy możliwe wartości i to reprezentuje orbital P.
Stąd mamy trzy orbitale P, jak pokazano na poniższym rysunku.
Spin Quantum number
Jest to reprezentowane przez msa elektron tutaj wiruje wokół osi. Ruch wirowania elektronu może być zgodny lub przeciwny do ruchu wskazówek zegara, jak pokazano poniżej.
Możliwe wartości tej liczby kwantowej spinowej będą następujące:
$$ m_ {s} = + \ frac {1} {2} \: \: up $$
W przypadku ruchu zwanego spin up, wynik jest dodatni w połowie.
$$ m_ {s} = - \ frac {1} {2} \: \: down $$
W przypadku ruchu zwanego spin down wynik jest ujemny w połowie.
To są cztery liczby kwantowe.
Zasada wykluczenia Pauliego
Zgodnie z zasadą wykluczenia Pauliego, no two electrons in an atom can have the same set of four identical quantum numbers. Oznacza to, że jeśli dowolne dwa elektrony mają takie same wartości n, s, ml (jak omówiliśmy powyżej), to wartość l byłaby w nich zdecydowanie inna. Dlatego żadne dwa elektrony nie będą miały takiej samej energii.
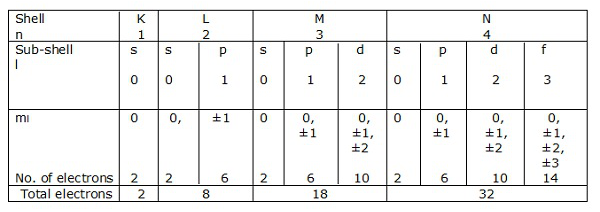
Muszle elektroniczne
Jeśli n = 1 jest powłoką, to l = 0 jest podpowłoką.
Podobnie n = 2 to powłoka, a l = 0, 1 to podpowłoka.
Powłoki elektronów odpowiadające n = 1, 2, 3… .. są reprezentowane odpowiednio przez K, L, M, N. Podpowłoki lub orbitale odpowiadające l = 0, 1, 2, 3 itd. Są oznaczone odpowiednio przez s, p, d, f itd.
Przyjrzyjmy się konfiguracjom elektronicznym węgla, krzemu i germanu (grupa IV - A).

Zaobserwowano, że najbardziej zewnętrzna podpowłoka p zawiera w każdym przypadku tylko dwa elektrony. Ale możliwa liczba elektronów to sześć. Stąd są czteryvalence electronsw każdej najbardziej zewnętrznej skorupie. Zatem każdy elektron w atomie ma określoną energię. Układ atomów wewnątrz cząsteczek w każdej substancji jest prawie taki. Ale odstępy między atomami różnią się w zależności od materiału.