Химия - Кальций
Введение
Кальций - это мягкий серовато-желтый щелочной элемент, обнаруженный в основном в земной коре.
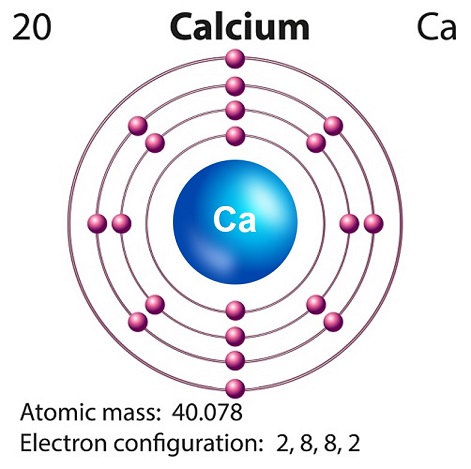
Символ кальция “Ca” и атомный номер “20.”
Свободный кальций почти не существует в природе, так как он очень реактивен.
Кальций обычно производится при нуклеосинтезе сверхновых.
Существенные особенности кальция
Кальций - один из самых распространенных по массе металлов, обнаруженных у многих животных.
Кальций - очень важный компонент зубов, костей и скорлупы.
Карбонат кальция и цитрат кальция - основные пищевые добавки, необходимые для хорошего здоровья.
Всемирная организация здравоохранения (ВОЗ) внесла кальций в список основных лекарственных средств.
По сравнению с другими металлами ион кальция и большинство других соединений кальция имеют низкую токсичность.
Если кальций контактирует с водой или кислотой, он вступает с ними в реакцию и становится опасным.
Если кальций вступает в контакт с воздухом, он быстро вступает в реакцию и образует серо-белый налет из нитрида кальция и оксида кальция.
Большинство солей кальция обычно бесцветны.
Когда кальций горит, цвет его пламени становится кирпично-красным (см. Изображение, приведенное ниже).

Металлический кальций имеет сравнительно более высокое электрическое сопротивление, чем алюминий или медь.
Вхождение
Кальций обычно встречается в осадочных породах.
Минералы (осадочные), в которых содержится кальций, представляют собой кальцит, доломит и гипс.
Кальций также содержится в магматических и метаморфических породах, в основном в силикатных минералах, таких как амфиболы, плагиоклазы, пироксены и гранаты.
Кальций также содержится во многих пищевых продуктах, а именно в молочных продуктах, миндале, фундуке, соевых бобах, брокколи, листьях одуванчика, инжире и многих других.
Соединения кальция
Оксид кальция - CaO
Гидроксид кальция - Ca (OH) 2
Хлорид кальция - CaCl 2
Гипохлорит кальция (отбеливающий порошок) - Ca (ClO) 2
Фосфат кальция - Ca 3 (PO 4 ) 2
Использование кальция
Кальций имеет широкий спектр применения, значительными из них являются:
Карбонат кальция (CaCO 3 ) используется в производстве цемента.
Карбонат кальция (CaCO 3 ) также используется при изготовлении зубной пасты.
В инсектицидах используется арсенат кальция (Ca 3 (AsO 4 ) 2 ).
Хлорид кальция (CaCl 2 ) используется для удаления льда, а также для борьбы с пылью.
Цитрат кальция (Ca 3 (C 6 H 5 O 7 ) 2 ) обычно используется в качестве пищевого консерванта.
Глюконат кальция (Ca (C 6 H 11 O 7 ) 2 ) часто используется в качестве пищевой добавки, а также в витаминных таблетках.
Гипохлорит кальция (Ca (OCl) 2 ) обычно используется в качестве дезинфицирующего средства для бассейнов и в качестве отбеливающего средства.