Химия, часть 2 - Краткое руководство
Введение
Химия - это раздел естествознания, изучающий структуру, состав и изменяющиеся свойства веществ.
Химия изучает мельчайшие части вещества, то есть атом (вместе со всеми его свойствами), и большие материалы (например, золото, серебро, железо и т. Д.) И их свойства.
Химия также изучает межмолекулярные силы (которые придают материи общие свойства) и взаимодействия между веществами посредством химических реакций.

В 1998 году профессор Рэймонд Чанг определил химию как -
«Химия» означает изучение материи и изменений, которым она претерпевает.
Считается, что изучение химии началось с теории четырех элементов, предложенной Аристотелем.
Теория четырех элементов утверждает, что «огонь, воздух, земля и вода были основными элементами, из которых все образовано как комбинация».
Именно из-за его классической работы “The Sceptical Chymist,” Роберт Бойль известен как отец-основатель химии.
Бойль сформулировал закон, получивший известность как «закон Бойля».
Закон Бойля - это экспериментальный газовый закон, который анализирует взаимосвязь между давлением газа и объемом соответствующего контейнера.
Отстаивая свой закон, Бойль отверг классическую теорию «четырех элементов».
Американские ученые Линус Полинг и Гилберт Н. Льюис совместно предложили электронную теорию химических связей и молекулярных орбиталей.
Организация Объединенных Наций объявила 2011 год «Международным годом химии».
В химии материя определяется как все, что имеет массу покоя и объем, а также занимает пространство.
В matter состоит из частиц.
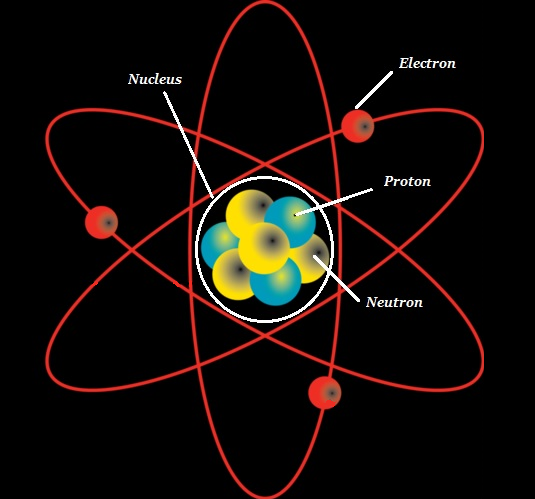
В atom это фундаментальная единица химии.
Атом состоит из плотного ядра, известного как atomic nucleus и он окружен пространством, известным как electron cloud.
Ядро (атома) состоит из protons (+ve charged particles) и neutrons (neutral or uncharged particles); вместе эти двое известны какnucleons (как показано на изображении ниже).
Химический элемент - это чистая форма вещества; он состоит из одного типа атомов.
Таблица Менделеева - это стандартизированное представление всех доступных химических элементов.
Соединение - это чистая форма вещества; он состоит из более чем одного элемента.
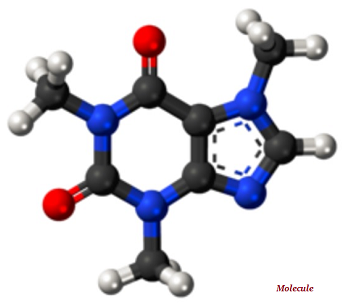
Молекула - это мельчайшая неделимая часть чистого химического вещества; Молекула обладает отличительным набором химических свойств (см. изображение ниже).
Следующая таблица иллюстрирует отрасли химии -
| Ветка | Подотрасль | Определение |
|---|---|---|
| Physical Chemistry | Физическая химия | Изучение физических свойств молекул |
| Химическая кинетика | Изучение скорости химических реакций | |
| Электрохимия | Изучение взаимодействия атомов, молекул, ионов и электрического тока (т.е. перенос электрона между электродом и электролитом или частицами) | |
| Химия поверхности | изучение химических реакций на поверхности (веществ) | |
| Термохимия | Изучите связь между химическим действием и количеством поглощенного тепла. | |
| Квантовая химия | Изучение применения квантовой механики в физических моделях | |
| Спектроскопия | Исследование спектров света или излучения | |
| Фотохимия | изучение химических эффектов, вызванных светом | |
| Organic Chemistry | Органическая химия | Изучение структуры, свойств и подготовка химических (углеродных) соединений (например, топлива, пластмасс, пищевых добавок и лекарств) |
| Стереохимия | Изучение относительного пространственного расположения атомов (в молекулах) | |
| Физико-органическая химия | изучение структуры и реакционной способности (взаимосвязи) в органических молекулах | |
| Полимерная химия | Изучение полимерных молекул (состав и создание) | |
| Металлоорганическая химия | Изучение химических веществ, содержащих связи (особенно между углеродом и металлом) | |
| Медицинская химия | Изучение разработки, разработки и синтеза лекарств и лекарств | |
| Inorganic chemistry | Неорганическая химия | Изучение всех неорганических материалов (например, минералов, металлов, катализаторов, кристаллических структур и т. Д.) |
| Металлоорганическая химия | Изучение химических соединений, содержащих связи (особенно между углеродом и металлом) | |
| Химия твердого тела | Изучение химических соединений, содержащих связи между углеродом и металлом. | |
| Ядерная химия | Исследование радиоактивных веществ | |
| Геохимия | Изучение химического состава Земли (например, горных пород, минералов и атмосферы) | |
| Биоинорганическая химия | Изучение взаимодействия ионов металлов с живой тканью | |
| Координационная химия | ||
| Biochemistry | Биохимия | Изучение химической реакции (и изменений) в живых существах |
| Молекулярная биохимия | Изучение биомолекул и их функций | |
| Клиническая биохимия | Изучение химических изменений у живых существ, вызванных различными заболеваниями. | |
| Молекулярная биология | Изучение различных типов биосинтеза ДНК, РНК и белков (и их взаимосвязей) | |
| Биохимия сельского хозяйства | Изучение химии фауны (т.е. растений) | |
| Analytical Chemistry | Изучение стандартизированных экспериментальных методов в химии (т.е. количественное определение химических свойств вещества) | |
| Astrochemistry | Изучение реакций химических элементов и молекул, обнаруженных во Вселенной. | |
| Cosmochemistry | Изучение химического состава веществ, обнаруженных во Вселенной. | |
| Environmental chemistry | Изучение химических и биохимических явлений, происходящих в окружающей среде. |
Введение
Процесс вылета частиц из ядер из-за ядерной нестабильности; известен как радиоактивность.
Вещество, которое выделяет такую энергию / лучи, известно как радиоактивное вещество.
Невидимые лучи, испускаемые таким радиоактивным веществом, известны как радиоактивные лучи.
Точно так же радиоактивность - это ядерное явление, которое происходит (естественно) из-за ядерной нестабильности атомов.
В 1896 году Анри Беккерель впервые наблюдал явление радиоактивности, но термин «радиоактивность» был придуман Марией Кюри.
Мария Кюри открыла радиоактивные элементы, а именно полоний и радий в 1898 году.
За свое открытие Мария Кюри получила Нобелевскую премию.
Радиоактивные лучи
После долгих лет экспериментов Эрнест Резерфорд вместе со своим коллегой (Хансом Гейгером и его учеником Эрнестом Марсденом) открыли альфа-лучи, бета-лучи и гамма-лучи.
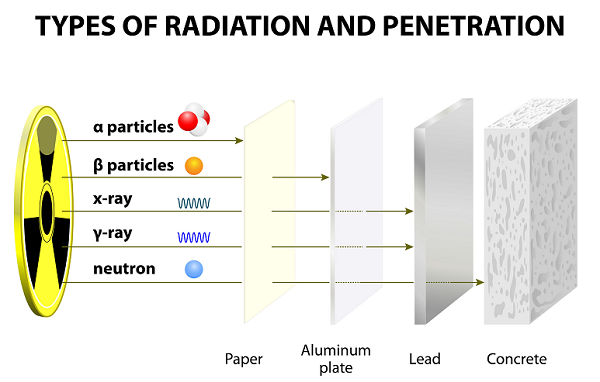
Эти лучи испускаются в результате распада атомов.
Альфа (α) частицы
Альфа-частицы обычно состоят из двух протонов и двух нейтронов, которые тесно связаны между собой.
Альфа-частицы высвобождаются во время радиоактивного распада (или альфа-распада) из ядер радионуклидов.
Альфа-частицы идентичны ядру либо нормального атома гелия, либо дважды ионизованного атома гелия.
По сравнению с другими частицами (например, гамма и бета) альфа-частицы тяжелые и медленные. Следовательно, альфа-частицы имеют очень малый радиус действия в воздухе.
Из-за низкой скорости альфа-частицы обладают очень слабой проникающей способностью; эти частицы даже задерживаются тонким листом бумаги (см. изображение, приведенное выше).
Из-за двойного положительного заряда альфа-частицы сильно ионизируются.
Бета (β) частицы
Бета-частицы - это быстро движущиеся электроны, испускаемые некоторыми радионуклидами во время радиоактивного распада (также известного как бета-распад).
Бета-частицы имеют гораздо меньший вес и несут один отрицательный заряд.
Бета-частицы реже ионизируются, чем альфа-частицы.
Из-за меньшего веса бета-частицы могут перемещаться намного дальше, чем альфа-частицы; однако бета-частицы можно остановить несколькими листами бумаги или одним листом алюминия.
Бета-частицы заряжены отрицательно и притягиваются к положительно заряженным частицам.
Гамма (ү) частицы
Гамма-частицы представляют собой пучок высокой энергии, а именно электромагнитной энергии (фотона), излучаемой радиоактивными элементами во время радиоактивного распада.
Среди всех трех частиц (альфа, бета и гамма) гамма-частицы являются фотонами с наибольшей энергией.
Гамма-частицы, представляющие собой форму электромагнитного излучения (ЭМИ), исходят из ядра.
Длины волн гамма-излучения самые короткие из всех трех.
Гамма-частицы не имеют заряда и нейтральны; поэтому на них не действуют магнитные и электрические поля.
Использование радиоактивных элементов
Радиоактивные элементы используются в -
Медицинская сфера (лечение многих заболеваний)
Промышленный процесс
Производство энергии - Ядерные реакторы
Введение
Ядерные реакции высвобождают огромное количество энергии (известной как ядерная энергия), которая используется для производства электроэнергии на атомной электростанции.

Ядерная энергия, обычно производимая nuclear fission, nuclear fusion, и nuclear decay.
В 1938 году немецкие химики Отто Хан, Фриц Штрассманн и австрийский физик Лизе Мейтнер провели эксперименты, в которых продукты нейтронной бомбардировки урана. В результате этого эксперимента относительно крошечный нейтрон разделил ядро массивных атомов урана на две примерно равные части и высвободил огромную энергию.
Ядерные эксперименты Отто Хана и его коллег известны как ядерное деление.
Ядерное деление
В процессе ядерного деления образуются свободные нейтроны и гамма-фотоны, при этом также высвобождается очень большое количество энергии.
Ядерное деление - это экзотермическая реакция, которая может выделять большое количество энергии в форме электромагнитного излучения, а также кинетической энергии.
Ядерное деление иногда может происходить естественным путем (то есть без нейтронной бомбардировки) как тип радиоактивного распада.
Типы ядерного деления
Ниже приведены основные типы ядерного деления.
Chain Reaction and
Fission Reaction
Давайте кратко их обсудим -
Цепная реакция
Когда одна единственная ядерная реакция вызывает одну или несколько последующих ядерных реакций, это называется цепной реакцией.
Такая цепная реакция увеличивает возможность самораспространяющейся серии ядерных реакций.
Цепные ядерные реакции выделяют в миллион раз больше энергии на реакцию, чем любая другая химическая реакция; поэтому она также известна как взрывная или неконтролируемая цепная реакция.
Когда тяжелый атом подвергается ядерному делению, он обычно распадается на два или более фрагментов деления. Во время процесса испускается несколько свободных нейтронов, гамма-лучей и нейтрино, и в конечном итоге выделяется большое количество энергии.
Ниже приведены два примера цепной реакции.
235 U + → нейтрон Осколки деления + 2,4 нейтрона + 192,9 МэВ
235 Pu + → нейтрон Осколки деления + 2,9 нейтрона + 198,9 МэВ
В атомной бомбе используется технология цепной реакции, так как она требует постоянного источника энергии.
Реакции деления
Реакция деления, в которой нейтроны (образующиеся при делении атомов топлива) используются, чтобы вызвать еще большее деление для высвобождения устойчивой энергии, известна как реакции деления.
Такие реакции медленные и контролируемые; следовательно, также известна как управляемая цепная реакция.
Ядерный реактор, вырабатывающий энергию (электричество), является идеальным примером управляемой цепной реакции.
Исходя из свойств и типа использования, деление / управляемая цепная реакция классифицируется как -
Power reactors
Research reactors
Breeder reactors
Эти энергетические реакторы обычно преобразуют кинетическую энергию продуктов деления в тепло; кроме того, тепло используется для нагрева рабочей жидкости, которая приводит в действие тепловой двигатель, который в конечном итоге вырабатывает механическую или электрическую энергию.
Основные компоненты ядерного реактора
Ниже приведены основные компоненты ядерного реактора -
Nuclear fuels- Такие как уран ( 233 U, 235 U), торий (Th 232 ), плутоний (Pu 239 ).
Moderators- Используется для контроля испускаемых нейтронов. Например, тяжелая вода, бериллий, графит и т. Д.
Coolant- Используется для охлаждения реактора. Например, вода, пар, гелий, CO 2 , воздух, расплавленные металлы и т. Д.
Control rods- Он используется для запуска и остановки реакции деления. Например, для этой цели используются стержни из кадмия или бора.
Термоядерная реакция
Процесс слияния двух легких ядер с образованием тяжелого ядра известен как ядерный синтез; во время этого процесса высвобождается огромное количество энергии, известной как ядерная энергия.
Лучший пример ядерного синтеза - водородная бомба.
Водородная бомба примерно в 1000 раз мощнее атомной бомбы.
Введение
Материал (который может быть элементом, соединением или сплавом), который обычно является твердым, блестящим, непрозрачным и обладает свойством проводить тепло и электричество, известен как металл.
Металлы естественным образом находятся в земной коре в нечистой форме, то есть в рудах. И он добывается в процессе добычи.
Среди всех известных 118 элементов (периодической таблицы) около 91 элемента являются металлами.

Особенности металлов
Ниже приведены важные особенности металлов -
Металлы, как правило, податливы - это означает, что его форма может постоянно изменяться, не ломаясь и не трескаясь.
Металлы легкоплавкие - значит; он легко плавится или плавится.
Металлы пластичные - значит; ему можно придать любую форму даже тонкому листу или проволоке.
Металлы хорошо проводят тепло и электричество; Свинец - исключение, так как он не переносит электричество.
Металлы естественным образом вступают в реакцию с различными неметаллами и образуют соединения. Металлы могут реагировать с основаниями и кислотами. Например, 4 Na + O 2 → 2 Na 2 O (оксид натрия) и т. Д.
Сплавы
Сплав - это продукт смеси двух или более элементов, в котором преобладает металл.
Чтобы произвести или изготовить желаемый продукт, смешиваются разные металлы (в разных соотношениях) (т.е. сплавы). Например, сплавы железа, а именно нержавеющая сталь, чугун, легированные листы и т. Д., Составляют значительную долю как по количеству, так и по коммерческой стоимости.
Металлы обычно делают из сплавов, чтобы сделать их более устойчивыми к коррозии, менее хрупкими, придать привлекательный цвет и т. Д.
Металлические термины
Base Metal- В химии основной металл означает металл, который легко окисляется или корродирует, а также легко реагирует с HCl (разбавленной соляной кислотой) и образует водород. Например, железо, никель, цинк, свинец и т. Д.
Ferrous Metal- «Железо» - латинское слово, которое означает вещество, «содержащее железо». Напр. Сталь и др.
Heavy Metal- Металл, который намного плотнее обычного металла, относится к категории хэви-метал. Тяжелые металлы токсичны или ядовиты при низких концентрациях. Например, ртуть (Hg), мышьяк (As), хром (Cr), кадмий (Cd), таллий (Tl) и свинец (Pb).
Precious Metal- Металлические элементы, которые имеют редкий металлический химический элемент высокой экономической ценности, относятся к категории драгоценных металлов. Например, платина, золото, серебро, палладий и т. Д.
Noble Metal- Металлы, устойчивые к коррозии или окислению. Например, рутений (Ru), родий (Rh), палладий (Pd) и т. Д.
Применение металлов
Ниже приведены важные применения металлов -
Ведь металлы хорошо проводят тепло и электричество; поэтому он используется в качестве электрического провода и во многих других электроприборах, включая электродвигатели и т. д. Например, медь, серебро, алюминий и т. д.
Тяжелые металлы используются в строительстве мостов, бассейнов и для многих других целей.
Многие металлы используются для изготовления различных предметов домашнего обихода, таких как посуда, горшки, печи и т. Д.
Металлы часто используются для производства многих типов инструментов, от простой отвертки до тяжелого стержневого катка.
Драгоценные металлы имеют красивый внешний вид и привлекательны (например, золото, серебро и т. Д.); поэтому они используются как украшения.
Для радиаторов используется особый металл, который защищает чувствительное оборудование от перегрева.
Радиоактивные металлы (например, уран и плутоний) используются в производстве ядерной энергии.
Ртуть - это металл, который остается в жидком виде при комнатной температуре; он используется в термометре.
Раздел науки и техники, изучающий свойства металлов, их производство и очистку, известен как metallurgy.
Встречающееся в природе твердое неорганическое вещество известно как mineral.
Природный твердый материал, из которого можно извлечь ценный минерал или металл, известен как ore.
В следующей таблице показаны основные элементы и их руды -
| Элемент | Руды | Химический состав |
|---|---|---|
| Алюминий | Бокситы | Al 2 O 3 2H 2 O |
| Корунд | Al 2 O 3 | |
| Криолит | Na 3 AlF 6 | |
| Диспор | Al 2 O 3 .H 2 O | |
| Медь | Медный пирит | CuFeS 2 |
| Малахит | 2CuCO 3 Cu (OH) 2 | |
| Железо | Гематит | Fe 2 O 3 |
| Магнетит | Fe 3 O 4 | |
| Сидерит | FeCO 3 | |
| Натрий | Карбонат натрия | Na 2 CO 3 |
| Хлорид натрия | NaCl | |
| Нитрат натрия | NaNO 3 | |
| Сульфат натрия | Na 2 SO 4 | |
| Калий | Хлористый калий | KCl |
| Карбонат калия | К 2 СО 3 | |
| Азотнокислый калий | KNO 3 | |
| Магний | Магнезит | MgCO 3 |
| Доломит | CaMg (CO 3 ) 2 | |
| Английская соль | MgSO 4 | |
| Кальций | Карбонат кальция | CaCO 3 |
| Банка | Касситерит | SnO 2 |
| привести | Галенит | PbS |
| Церуссит | PbCO 3 | |
| Англезит | PbSO 4 | |
| Серебряный | Аргентит | Ag 2 S |
| Тетраэдрит | Сб 4 С 3 | |
| Цинк | Карбонат цинка (известный как каламин) | ZnCO 3 |
| Сульфид цинка | ZnS | |
| Меркурий | Киноварь | HgS |
| Марганец | Пиролюзит | MnO 2 |
| Фосфор | Фосфорит | Ca 3 (PO 4 ) 2 |
| Фторапатит | Ca 5 (PO 4 ) 3 F | |
| Хлорапатит | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Золото | Калаверит | AuTe 2 |
| Сильванит | (Ag, Au) Te 2 | |
| Нагьягите | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| Сурьма | Стибнит | Сб 2 С 3 |
| Стибиконит | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Кобальт | Кобальтит | CoAsS |
| Никель | Пентландит | ((Ni, Fe) S) |
| Хром | Хромит | (FeCr 2 O 4 ) |
Введение
Натрий - мягкий серебристый металл с высокой реакционной способностью.
В периодической таблице натрий находится в группе 1, так как у него один электрон на внешней оболочке.
Символ натрия - 'Na,'которое фактически было взято из латинского слова ‘natrium.’
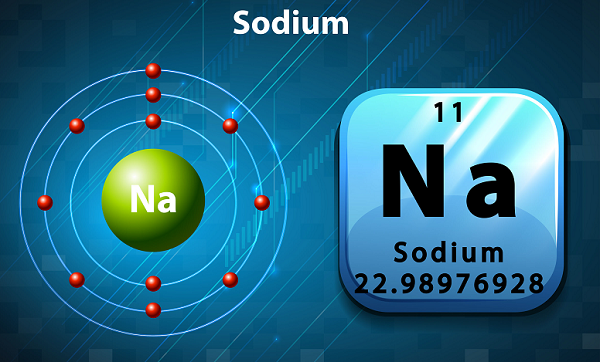
По содержанию натрий - шестой элемент земной коры.
Натрий содержится в различных минералах, включая полевой шпат, содалит и каменную соль (NaCl).
В 1807 году Хамфри Дэви впервые выделил натрий электролизом гидроксида натрия.
К настоящему времени известно 20 изотопов натрия, но среди всех стабильно только 23 Na.
Существенные особенности натрия
Ниже приведены основные характеристики элемента натрия:
Металлический натрий - мягкий элемент, который легко разрезать ножом.
Натрий - хороший проводник тепла и электричества.
Из-за низкой атомной массы и большого атомного радиуса натрий является одним из наименее плотных элементов (третий наименее плотный элемент - первые два - литий и калий).
Натрий может плавать в воде.
Натрий вместе с его соединениями светится желтым цветом (см. Изображение ниже).

Соединения натрия имеют очень большое коммерческое значение и пользуются большим спросом в производстве стекла, бумаги, мыла и текстиля.
Соединения натрия
Ниже приведены некоторые из важных примеров соединений натрия.
Поваренная соль - (NaCl)
Кальцинированная сода - (Na 2 CO 3 )
Пищевая сода - (NaHCO 3 )
Каустическая сода - (NaOH)
Нитрат натрия - (NaNO 3 )
Тиосульфат натрия - (Na 2 S 2 O 3 · 5H 2 O)
Бура - (Na 2 B 4 O 7 · 10H 2 O)
Появление натрия
Кора Земли содержит около 2,27% натрия.
Натрий занимает пятое место среди металлов по распространенности; другие четыре - это алюминий, железо, кальций и магний.
В океанической воде около 1,08 × 104 миллиграмма натрия на литр.
Натрий не встречается в чистом виде, так как он очень реактивен.
Использование натрия
Ниже приведены основные виды использования натрия:
Хлорид натрия очень полезен для защиты от обледенения и защиты от обледенения, а также в качестве консерванта.
В кулинарии используется бикарбонат натрия.
Натрий и некоторые его соединения используются в лекарствах.
По сравнению с калием (который является лучшим ионом) чаще используется натрий из-за его более низкой цены и атомного веса.
В органической химии гидрид натрия используется в качестве различных реакций.
Металлический натрий в основном используется для производства боргидрида натрия, трифенилфосфина натрия, азида, индиго и т. Д.
В некоторых быстрых реакторах в качестве теплоносителя используется жидкий натрий, поскольку он обладает хорошей теплопроводностью.
Натрий также является важным минералом для здоровья человека, поскольку он регулирует кровяное давление, объем крови, осмотическое равновесие и значение pH.
Минимальное количество натрия 500 миллиграммов требуется каждый день для здорового человеческого тела.
Введение
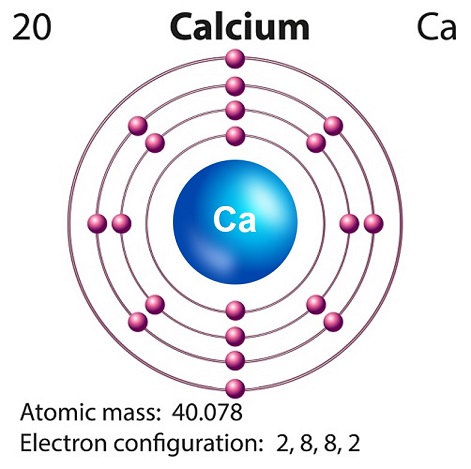
Кальций - это мягкий серовато-желтый щелочной элемент, обнаруженный в основном в земной коре.
Символ кальция “Ca” и атомный номер “20.”
Свободный кальций практически не существует в природе, так как он очень реактивен.
Кальций обычно производится при нуклеосинтезе сверхновых.
Существенные особенности кальция
Кальций - один из самых распространенных металлов по массе, обнаруживаемых у многих животных.
Кальций - очень важный компонент зубов, костей и скорлупы.
Карбонат кальция и цитрат кальция - основные пищевые добавки, необходимые для хорошего здоровья.
Всемирная организация здравоохранения (ВОЗ) внесла кальций в список основных лекарственных средств.
По сравнению с другими металлами ион кальция и большинство других соединений кальция обладают низкой токсичностью.
Если кальций контактирует с водой или кислотой, он вступает с ними в реакцию и становится опасным.
Если кальций вступает в контакт с воздухом, он быстро реагирует и образует серо-белый налет из нитрида кальция и оксида кальция.
Большинство солей кальция обычно бесцветны.
Когда кальций горит, цвет его пламени становится кирпично-красным (см. Изображение, приведенное ниже).

Металлический кальций имеет сравнительно более высокое электрическое сопротивление, чем алюминий или медь.
Вхождение
Кальций обычно встречается в осадочных породах.
Минералы (осадочные), в которых содержится кальций, представляют собой кальцит, доломит и гипс.
Кальций также содержится в магматических и метаморфических породах, в основном в силикатных минералах, таких как амфиболы, плагиоклазы, пироксены и гранаты.
Кальций также содержится во многих пищевых продуктах, а именно в молочных продуктах, миндале, фундуке, соевых бобах, брокколи, листьях одуванчика, инжире и многих других.
Соединения кальция
Оксид кальция - CaO
Гидроксид кальция - Ca (OH) 2
Хлорид кальция - CaCl 2
Гипохлорит кальция (отбеливающий порошок) - Ca (ClO) 2
Фосфат кальция - Ca 3 (PO 4 ) 2
Использование кальция
Кальций имеет широкий спектр применения, значительными из них являются:
Карбонат кальция (CaCO 3 ) используется в производстве цемента.
Карбонат кальция (CaCO 3 ) также используется при изготовлении зубной пасты.
В инсектицидах используется арсенат кальция (Ca 3 (AsO 4 ) 2 ).
Хлорид кальция (CaCl 2 ) используется для удаления льда, а также для борьбы с пылью.
Цитрат кальция (Ca 3 (C 6 H 5 O 7 ) 2 ) обычно используется в качестве пищевого консерванта.
Глюконат кальция (Ca (C 6 H 11 O 7 ) 2 ) часто используется в качестве пищевой добавки, а также в витаминных таблетках.
Гипохлорит кальция (Ca (OCl) 2 ) обычно используется в качестве дезинфицирующего средства для бассейнов и в качестве отбеливающего средства.
Введение
Металл серебристо-белого цвета, мягкий, немагнитный и пластичный, известен как алюминий.
Символ алюминия ‘Al’ и его атомный номер ‘13.’
Химический элемент алюминий относится к группе бора.

- Боксит - основная руда алюминия.
Существенные особенности алюминия
Металлический алюминий - химически активный элемент.
Алюминий обладает способностью противостоять коррозии, и процесс повышения этого удельного сопротивления известен как пассивация.
Алюминий - сравнительно прочный, легкий, мягкий, податливый и пластичный металл.
Алюминий немагнитен и плохо воспламеняется.
Алюминиевая пленка является очень хорошим отражателем видимого света, поскольку она отражает более 90 процентов входящих лучей.
Алюминий обычно реагирует с водой и образует водород.
Алюминий - это металл с низкой плотностью и устойчивостью к коррозии.
Алюминий обладает свойством теплопроводности и электропроводности и, следовательно, является хорошим проводником.
Появление алюминия
Алюминий составляет около 8 процентов земной коры.
После кислорода и кремния алюминий является третьим по распространенности элементом; однако это самый распространенный металл в коре.
Когда водород плавится с магнием, образуется стабильный алюминий.
Алюминий естественным образом находится в оксидном или силикатном состоянии.
Соединения алюминия
Ниже приведены основные соединения алюминия:
Глинозем - Al 2 O 3
Хлорид алюминия - AlCl 3
Сульфат алюминия - Al 2 (SO 4 ) 3
Гидроксид алюминия - Al (OH) 3
Карбид алюминия - Al 4 C 3
Использование алюминия
Алюминий широко применяется как в промышленности, так и в повседневной жизни; значительными из них являются -
Алюминий используется в транспортной отрасли, такой как железная дорога, автомобили, самолеты, космические корабли, грузовики, морские суда, велосипеды и т. Д.
Алюминий используется в упаковке некоторых специфических материалов.
Алюминий используется в конструкции дверей, окон, строительной проволоки, обшивки, кровли и т. Д.
Алюминий широко используется в производстве электрического провода.
Алюминий используется в производстве бытовой техники и многих других предметов домашнего обихода, например, кухонной утвари.
Алюминий используется в бейсбольных битах, часах и многих других подобных вещах.
Алюминий используется в фотоаппаратуре.
Алюминий используется в электронных приборах.
В качестве светоотражателя используется алюминий, так как он является хорошим светоотражателем; в основном, некоторые материалы имеют алюминиевое покрытие, специально предназначенное для отражения света.
Алюминий используется в производстве газообразного водорода путем реакции с соляной кислотой.
Алюминий используется в производстве музыкальных инструментов.
Введение
Магний - это блестящий серый твердый элемент.
Символ магния - ‘Mg’ и атомный номер ‘12.’

Китай, на долю которого приходится около 80% мирового рынка, является крупнейшим поставщиком магния.
Существенные особенности магния
Плотность магния составляет две трети плотности алюминия.
Среди всех щелочных металлов Земли, магний имеет низкую температуру плавления (т.е. около 1,202 0 F) и самую низкую температуру кипения (около 1,994 0 F).
Магний обычно реагирует с водой при комнатной температуре.
Иногда магний также используется в качестве воспламенителя для термитов.
Магний, когда горит на воздухе, излучает ярко-белый свет, который также включает сильные ультрафиолетовые волны.

Магний при горении дает интенсивный яркий белый свет (см. Изображение, приведенное выше).
Появление магния
По массе магний является восьмым по содержанию элементом земной коры.
Магний обычно находится в крупных месторождениях магнезита, доломита и других подобных минералов.
Растворимый ион магния содержится в минеральной воде.
После натрия и хлора магний является третьим по распространенности элементом, растворенным в морской воде.
В природе магний встречается только в сочетании с некоторыми другими элементами.
По массе магний является 11- м наиболее распространенным элементом в организме человека и необходим для всех клеток и ферментов.
Ионы магния часто взаимодействуют с полифосфатными соединениями, включая АТФ, ДНК и РНК.
Соединения магния
Ниже приведены основные соединения магния -
Карбонат магния - MgCO 3
Хлорид магния - MgCl 2
Цитрат магния - C 6 H 6 MgO 7
Гидроксид магния - Mg (OH) 2
Оксид магния - MgO
Сульфат магния - MgSO 4
Гептагидрат сульфата магния - (MgSO 4 · 7H 2 O)
Гептагидрат сульфата магния широко известен как Epsom salt.
Использование магния
Магний широко используется в нашей жизни; однако некоторые важные применения магния -
После железа и алюминия магний является третьим наиболее часто используемым элементом.
Магний особенно используется в сверхпрочных и легких материалах и сплавах.
Магний также используется в качестве материалов для двигателей в авиастроении.
Магний также используется для очистки растворителей; например, при приготовлении сверхсухого этанола.
Многие крупные автомобильные бренды, включая Mercedes, Porsche, BMW, Volkswagen, Chevrolet и т. Д., Используют магний при производстве своих высококачественных автомобилей.
Из-за небольшого веса и хороших электрических и механических свойств магний обычно используется в производстве ноутбуков и планшетных компьютеров, мобильных телефонов, фотоаппаратов и многих других электронных компонентов.
Сульфит магния обычно используется при производстве бумаги.
Введение
Марганец - это химический элемент, который обычно встречается в сочетании с железом.
Символ марганца - ‘Mn’ и атомный номер ’25.’
Марганец - металл, очень важный для промышленного использования.

В 1774 году Йохан Готлиб Ган впервые выделил нечистый образец металлического марганца в 1774 году.
Особенности марганца
Ниже приведены основные характеристики и характеристики марганца.
Как и железо, марганец - металл серебристо-серого цвета.
Марганец легко окисляется, но плавить его очень сложно, так как он очень твердый и хрупкий.
На воздухе марганец медленно тускнеет (окисление).
Марганец - это элемент, входящий в группу железа.
Появление марганца
Марганец - 12- й элемент земной коры по содержанию.
Почва обычно содержит около 7–9000 частей на миллион марганца, в среднем 440 частей на миллион.
В морской воде содержится всего около 10 частей на миллион марганца; тогда как в атмосфере содержится около 0,01 мкг / м3.
Пиролюзит (MnO 2 ) - важнейшая руда марганца.
Соединения марганца
Ниже приведены основные соединения марганца:
Оксид марганца (II) - MnO
Оксид марганца (I) - Mn 2 O 3
Диоксид марганца - MnO 2
Хлорид марганца - MnCl 2
Перманганат калия - KMnO 4
Сульфат марганца (II) - MnSO 4
Карбонат марганца (II) - MnCO 3
Сульфид марганца (II) - MnS
Нитрат марганца (II) - Mn (NO 3 ) 2
Бромид марганца (II) - MnBr 2
Гептоксид марганца - Mn 2 O 7
Диманганец декакарбонил - C 10 O 10 Mn 2
Иодид марганца (II) - MnI 2
Фторид марганца (II) - MnF 2
Использование марганца
Ниже приведены основные виды использования марганца:
Марганец - один из важнейших компонентов производства стали.
Фосфатирование марганцем обычно используется для защиты стали от ржавчины и коррозии.
В биологии ионы марганца (II) действуют как кофакторы для большого количества ферментов.
Марганец также играет важную роль в процессе выделения кислорода фотосинтезирующими растениями.
Диоксид марганца также используется при производстве кислорода и хлора и при сушке черных красок.
Введение
Железо - наиболее распространенный элемент, который содержится в основном как во внешнем, так и во внутреннем ядре Земли.
Символ железа ‘Fe’ и атомный номер ‘26.’

Железо - один из самых первых известных элементов, используемых людьми.
Существенные особенности железа
Ниже приведены основные характеристики железа.
Элемент из чистого железа мягкий, пластичный и податливый.
Точка кипения диапазонов железы между 1533 0 С и 2450 0 С.
Железо легко притягивается к магниту.
В сухом воздухе железо остается бездействующим и не вступает в реакцию (с воздухом); однако во влажном воздухе он реагирует и образует ржавчину.
Чистое железо обычно не вступает в реакцию с чистой водой; однако он легко вступает в реакцию с обычной загрязненной водой и формами ржавчины.
Железо реагирует с галогеном и серой с образованием галогенида и сульфида соответственно.
Появление железа
Внутреннее и внешнее ядра Земли в основном состоят из железа и никеля.
Скорее всего, железо - самый доступный элемент земли; однако это четвертый по численности доступный элемент коры.
Типы железа
Ниже приведены основные типы железа.
Гематит - Fe 2 O 3
Магнетит - Fe 3 O 4
Сидерит - FeCO 3
Соединения железа
Ниже приведены основные соединения железа:
Оксид железа (II) - FeO
Хлорид железа (III) - FeCl 3
Оксид-гидроксид железа (III) - Fe (OH) 3
Сульфид железа (II) - FeS
Хлорид железа (II) - FeCl 2
Фосфат железа - FePO 4
Феррат (VI) - (FeO 4 ) 2-
Ацетат железа (II) - Fe (C 2 H 3 O 2 ) 2
Сульфид железа (III) - Fe 2 S 3
Хромат железа (III) - Fe 2 (CrO 4 ) 3
Гидроксид железа (II) - Fe (OH) 2
Ацетат железа (III) - C 14 H 27 Fe 3 O
Оксалат железа (II) - FeC 2 O 4
Флюрид железа (II) - FeF 2
Использование железа
Среди всех металлов наиболее широко используется железо (около 90 процентов от общего объема производства металлов в мире).
В большинстве отраслей тяжелой промышленности самым важным элементом является железо.
Железо необходимо в таких отраслях, как железная дорога, судостроение, автомобилестроение, машиностроение и т.д.
Введение
Медь - мягкий, пластичный и ковкий металл.
Медь обладает очень высокой теплопроводностью и электропроводностью.
Символ меди - ‘Cu’ и атомный номер ’29.’

Медь известна людям с (около) c. 8000 г. до н.э.
Медь - первый металл, выплавленный из руды около c. 5000 г. до н.э.
Существенные особенности меди
Медь была первым металлом, который отливал форму (в форме).
Медь была первым металлом, который успешно сплавился с другим металлом, например медью, легированной оловом, и в результате была получена бронза. Это сделано около c. 3500 г. до н.э.
Первый металл, который будет целенаправленно сплавлен с другим металлом, оловом, для создания бронзы, c. 3500 г. до н.э.
Медь имеет естественный красновато-оранжевый цвет; он виден, когда его поверхность обнажена.
Медь - очень хороший проводник электричества и тепла.
Медь является элементом 11 группы периодической таблицы Менделеева.
Медь обычно не реагирует с водой; однако он медленно реагирует с атмосферным кислородом и образует слой коричнево-черного оксида меди.
Коричнево-черный оксид меди обычно защищает металл от дальнейшей коррозии, как и пассивация.
Пассивация - это процесс использования легкого слоя защитного материала, такого как оксид металла, который используется для создания защитной оболочки от коррозии.
Появление меди
Медь обычно содержится в земной коре.
В 1857 году обнаружена самая большая масса элементарной меди (около 420 тонн). Он был обнаружен на полуострове Кивинау в штате Мичиган, США.
Сплавы меди
Металлические сплавы, в которых медь является основным компонентом, известны как медные сплавы.
Медные сплавы обладают высокой устойчивостью к коррозии.
Лучшим (традиционным) примером медного сплава является бронза (полученная путем смешивания олова и латуни).
Ниже приведены основные сплавы меди -
Brass
Bronze
Auricupride
Китайское серебро
Коринфская бронза
Электрум, Зеленое золото
Серое золото
Niello
Panchaloha
Розовое, красное и розовое золото
Spangold
Shibuichi
Тибетское серебро
белое золото
Соединения меди
Ниже приведены основные соединения меди:
Ацетат меди - Cu (CH 3 COO) 2
Оксид меди (I) - Cu 2 O
Оксид меди (II) - CuO
Хлорид меди (II) - CuCl 2
Тригидроксид дихлорида меди - Cu 2 (OH) 3 Cl
Хлорид меди (I) - CuCl
Нитрат меди (II) - Cu (NO 3 ) 2
Цианид меди - CuCN
Использование меди
Медь широко используется в производстве электрических проводов.
Медь используется в электродвигателях.
Медь используется в кровле, сантехнике и во многих других отраслях промышленности.
Медная краска используется для окраски лодок и многих других материалов.
Многие из бытовых приборов сделаны либо из чистой меди, либо из ее сплавов.
Введение
Серебро - мягкий, блестящий переход и белый металл.
Серебро имеет самую высокую электрическую и теплопроводность; кроме того, он имеет самую высокую отражательную способность из всех металлов.

Символ серебра - ‘Ag’ и атомный номер ’47.’
Отличительные особенности серебра
Серебро - драгоценный металл, издавна используемый людьми.
Серебро является элементом 11 группы периодической таблицы.
Серебро имеет превосходный белый металлический блеск, обычно используемый для полировки.
Как серебро не имеет цвета; следовательно, он имеет высокую отражательную способность (света).
Серебро обладает очень высокой электрической и теплопроводностью. Электропроводность у него самая высокая - выше меди.
Среди всех металлов серебро также имеет самое низкое контактное сопротивление.
Появление серебра
Металлическое серебро обычно находится в земной коре в чистом виде.
Серебро также находится в сплаве с золотом и некоторыми другими металлами.
Серебро также содержится в некоторых минералах, таких как аргентит и хлораргирит.
Серебро в основном производится как побочный продукт золота, меди, цинка, свинца и т. Д.
Сплавы серебра
Ниже приведены основные сплавы серебра.
Серебро 925 пробы
Британия серебро
Доре слиток
Electrum
Goloid
Платина стерлингов
Серебро 925 пробы
Тибетское серебро
Соединения серебра
Ниже приведены основные соединения серебра -
Хлорид серебра - AgCl
Иодид серебра - Agl
Бромид серебра - AgBr
Оксид серебра - Ag 2 O
Сульфид серебра - Ag 2 S
Фторид серебра - AgF
Цианид серебра - AgCN
Карбонат серебра - Ag 2 CO 3
Ацетат серебра - AgC 2 H 3 O 2
Сульфат серебра - Ag 2 SO 4
Хромат серебра - Ag 2 CrO 4
Оксалат серебра - Ag 2 C 2 O 4
Хлорат серебра - AgClO 3
Использование серебра
Ниже приведены основные виды использования серебра.
С древних времен серебро использовалось для изготовления монет.
Серебро также используется для изготовления украшений.
Многие домашние горшки и другая утварь также изготавливались из серебра.
Серебро также используется в медицинских целях, поскольку оно используется в качестве антибиотического покрытия в медицинских устройствах.
Из-за очень высокой электропроводности серебро обычно используется в некоторых электронных устройствах.
Кроме того, у серебра есть много других применений, например, в фотографии, в химическом оборудовании, в наночастицах и т. Д.
Введение
Золото - это яркий, красновато-желтый, мягкий, плотный, ковкий и пластичный металл, который естественным образом встречается в земной коре.
Символ золота - ‘Au’ и атомный номер ‘79.’

Золото (химически) является переходным металлом и принадлежит к группе 11 периодической таблицы.
Отличительные особенности золота
Золото, которое при стандартных условиях остается в твердом состоянии, является наименее химически активным элементом.
Золото устойчиво к большинству кислот.
Золото растворяется в царской водке; Царская водка представляет собой смесь азотной и соляной кислот.
Однако золото не растворяется в азотной кислоте.
Золото обычно растворяется в щелочных растворах цианида.
Растворы цианида обычно используются в горнодобывающей промышленности и гальванике.
Золото также растворяется в ртути и образует ‘amalgam alloys.’
Золото не реагирует с кислородом ни при каких температурах.
Появление золота
Золото обычно встречается как свободный элемент, то есть в естественной форме.
Золото встречается в виде самородков или в породах, зернах, жилах и некоторых других аллювиальных отложениях.
Золото также встречается в виде твердых растворов с самородным элементом, таким как серебро (как электрум).
В некоторых местах золото также естественно легировалось медью и палладием.
Сплавы золота
Ниже приведены основные сплавы золота -
Цветное золото
Корона золото
Electrum
Розовое золото
Tumbaga
белое золото
Соединения золота
Ниже приведены основные соединения золота:
Хлорид золота (III) - AuCl 3
Хлорид золота (I) - AuCl
Цианид - CN
Хлороауриновая кислота - HAuCl 4
Оксид золота (III) - Au 2 O 3
Бромид золота - AuBr
Царская водка - HNO 3 + 3HCl
Бромид золота - AuBr 3
Гидроксид золота (III) - AuH 3 O 3
Фторид золота - AuF 3
Фторид золота (V) - AuF 5
Сульфид золота - Au 2 S
Горячее золото
Соли золота
Гептафторид золота
Использование золота
Золото - один из древнейших элементов, которые человек использовал на протяжении тысяч лет.
Поскольку он очень драгоценен и придает красивый вид, его обычно используют для изготовления украшений.
Согласно недавней мировой тенденции, около 50% золота используется в производстве ювелирных изделий, 40% используется в инвестициях, а оставшиеся 10% используются в промышленности.
Введение
Платина - ковкий, пластичный, плотный и крайне инертный химический элемент.
Символ платины - ‘Pt’ и его атомный номер ‘78.’

Название платины происходит от испанского термина «платина», что означает «little silver. "
Платина - самый драгоценный и самый редкий металл (элемент) на Земле.
Основные характеристики платины
Ниже приведены важные особенности платины:
Платина - серебристо-белый металл.
Платина является элементом 10 группы периодической таблицы.
Платина - один из самых редких элементов земной коры.
Платина - один из наименее реактивных элементов.
Платина имеет шесть природных изотопов.
Платина - один из самых ценных и драгоценных металлов.
Платина отличается устойчивостью к коррозии в любых условиях. По этой причине он считается благородным металлом.
Платина обычно нерастворима в азотной и соляной кислотах, но растворяется в горячей царской водке .
После растворения в горячей царской водке платина дает водный раствор платинохлористоводородной кислоты (см. Изображение, приведенное ниже).

Появление платины
Платина обычно встречается как самородная (природная) платина и как сплав с другой платиной группы.
Платина обычно встречается в рудах никеля и меди.
Платина также встречается в природе в аллювиальных песках (обычно в реках).
Платина встречается в земной коре с концентрацией всего (около) 0,005 ppm.
Сплавы платины
Платина-иридий - один из самых значительных сплавов платины.
Соединения платины
Ниже приведены основные соединения платины:
Хлорид платины (II) - Pt Cl 2
Хлорид платины (IV) - PtCl 4
Катализатор Адама - PtO 2
Гексафторид платины - PtF 6
Тетрахлоропла калия - K 2 PtCl 4
Соль Крогмана - K 2 Pt (CN) 4 Br
Хлороплатиновая кислота - H 2 PtCl 6
Гексахлоропл натрия - Na 2 PtCl 6
Царская водка - HNO 3 + 3HCl
Использование платины
Платина в основном используется в устройствах контроля выбросов транспортных средств.
Платина используется в нефтепереработке и многих других химических производствах.
Платина используется в электронных устройствах, например, в жестких дисках (накопителях).
Платина также используется в ювелирных изделиях.
Помимо всех этих применений, платина также используется в медицине (противораковые препараты), стекольном оборудовании, электродах, турбинных двигателях, инвестициях и т. Д.
Введение
В периодической таблице цинк является первым элементом группы 12.
Символ цинка ‘Zn’ а атомный номер ‘30.’
С точки зрения доступности цинк является 24- м наиболее распространенным элементом земной коры и имеет пять стабильных изотопов.

Самая распространенная цинковая руда - сфалерит (цинковая обманка), который является минералом сульфида цинка.
Немецкий химик Андреас Сигизмунд Маргграф впервые открыл чистый металлический цинк в 1746 году.
Интересно, что алхимики сожгли цинк в воздухе и создали нечто иное, и они назвали это "philosopher's wool" или же "white snow. "
Существенные особенности цинка
Цвет цинка голубовато-белый, это блестящий диамагнитный металл.
Металлический цинк обычно твердый и хрупкий; однако, в том, когда температура возрастает от 100 0 C, он становится пластичным.
При увеличении температуры 210 0 C, то металлический цинк снова становится хрупким и легко может быть измельчены с биением.
Цинк - проводник электричества.
Появление цинка
Цинк обычно встречается в сочетании с некоторыми другими неблагородными металлами, такими как медь и свинец.
Сфалерит представляет собой форму сульфида цинка и является наиболее добываемой рудой.
Сфалерит содержит от 60 до 62% цинка.
Сплавы цинка
Ниже приведены основные сплавы цинка -
Brass
Нейзильбер
Немецкое серебро
Соединения цинка
Ниже приведены основные соединения цинка:
Оксид цинка - ZnO
Сульфид цинка - ZnS
Галогениды цинка - ZnF 2
Нитрат цинка - Zn (NO 3 ) 2
Хлорат цинка - Zn (ClO 3 ) 2
Сульфат цинка - ZnSO 4
Фосфат цинка - Zn 3 (PO 4 ) 2
Молибдат цинка - ZnMoO 4
Хромат цинка - ZnCrO 4
Арсенит цинка - Zn (AsO 2 ) 2
Ацетат цинка - Zn (O 2 CCH 3 ) 2
Использование цинка
Цинк - один из важнейших элементов для здоровья человека.
Цинк широко используется в качестве антикоррозионного средства и покрытия железных и стальных материалов.
Цинк обычно используется в качестве анода или топлива воздушно-цинковой батареи.
Оксид цинка широко используется в качестве белого пигмента (см. Изображение ниже) в красках.

Оксид цинка также используется в качестве катализатора при производстве резины.
Цинк - важнейший элемент нашего здоровья; он обычно используется в качестве дополнительных материалов в таких формах, как оксид цинка, ацетат цинка или глюконат цинка.
Цинк обычно является антиоксидантным материалом.
Дефицит цинка в организме человека может вызвать серьезное депрессивное расстройство.
После телесных повреждений цинк используется для ускорения процесса заживления.
Пиритион цинка обычно используется в шампунях для предотвращения перхоти.
Хелатный цинк обычно используется в зубных пастах и жидкостях для полоскания рта, поскольку он предотвращает неприятный запах изо рта.
Цинк также защищает кожу от солнечных ожогов, поэтому используется в лосьонах для тела.
Введение
Ртуть - это химический элемент, который обычно называют «quicksilver. '
Раньше ртуть называлась 'hydrargyrum. '
Символ ртути - ‘Hg’ и атомный номер ‘80.’

Красный пигмент киноварь получают путем измельчения либо натуральной киновари, либо синтетического сульфида ртути.
Отличительные особенности Меркурия
Ртуть - тяжелый серебристо-белый металл.
Ртуть обычно бывает в жидком состоянии; в нормальном состоянии это только несколько металлических элементов, которые остаются в жидком состоянии при комнатной температуре.
Ртуть плохо проводит тепло, но хорошо проводит электричество.
Точка замерзания ртути -38,83 0 С и точка кипения 356,73 0 С.
Отравление ртутью вызвано приемом внутрь любой формы ртути. Это также вызвано вдыханием паров ртути.
Ртуть растворяет многие металлы, включая золото и серебро, с образованием амальгам.
Возникновение Меркурия
Меркурий - один из самых редких элементов в земной коре.
Самые богатые ртутные руды содержат около 2,5% ртути (по массе).
Ртуть встречается либо в виде природного (природного) элемента, либо в минералах кордероита, киновари, ливингстонита и др.
Меркурий находится в районе молодого горного пояса; пояс, который продолжает прижимать более плотные породы к земной коре. Например, вулканический регион или даже регионы горячих источников.
Сплавы ртути
Амальгама - основной сплав ртути.
Соединения ртути
Ниже приведены основные соединения ртути:
Хлорид ртути (II) - HgCl 2
Оксид ртути (II) - HgO
Сульфид ртути - HgS
Ртуть (I) - хлорид - Hg 2 Cl 2
Диметилмер - C 2 H 6 Hg
Нитрат ртути (II) - Hg (NO 3 ) 2
Ацетат ртути (II) - C 4 H 6 O 4 Hg
Сульфат ртути (II) - HgSO 4
Иодид ртути (I) - Hg 2 I 2
Селенид ртути - HgSe
Фульминат ртути (II) - Hg (CNO) 2
Бромид ртути (II) - HgBr 2
Иодид ртути (II) - HgI 2
Оксид ртути (I) - Hg 2 O
Фторид ртути (I) - Hg 2 F 2
Амидохлорид ртути - ClH 2 HgN
Диэтилртуть - C 4 H 10 Hg
Использование ртути
Ртуть широко используется в химической промышленности.
Ртуть используется в электрических и электронных устройствах.
Ртуть используется в термометрах, которые мы используем для измерения температуры.
Ртуть вместе с ее соединениями обычно используются в различных лекарствах.
Введение
Плутоний - это в основном металл-актинид, и он выглядит как серебристо-серый.
Элемент, атомный номер которого находится в диапазоне от 89 до 103, известен как актинидный элемент.
Символ плутония - ‘Pu’ и атомный номер ‘94.’

Плутоний обычно имеет шесть аллотропов.
Плутоний назван в честь 'Pluto. '
Плутоний был впервые открыт в 1940 году группой ученых, а именно Гленном Т. Сиборгом, Джозефом В. Кеннеди, Эдвином М. Макмилланом и Артуром К. Валь.
Существенные особенности плутония
Плутоний - радиоактивный химический элемент.
Плутоний при контакте с воздухом тускнеет, а при окислении образует тусклый слой.
Плутоний реагирует со многими элементами, включая галогены, азот, углерод, кремний и водород.
В процессе деления нейтроны выделяются и превращают ядра урана-238 в плутоний-239.
Плутоний-239 и плутоний-241 оба являются делящимися, и, следовательно, они могут поддерживать ядерную цепную реакцию. Он очень хорошо применим в ядерном оружии и ядерных реакторах.
Температура плавления плутония 640 0 С , а его температура кипения 3228 0 С.
Высвобождение ядра гелия (высокоэнергетического) является наиболее распространенной формой радиоактивного распада плутония.
Появление плутония
Плутоний в природе встречается только в следовых количествах в урановых месторождениях.
Плутоний также извлекается путем сжигания урана (при разработке ядерной энергетики).
Сплавы плутония
Ниже приведены основные сплавы плутония:
Плутоний-галлий - один из важных сплавов плутония, а также галлия.
Плутоний-галлий используется в ямах ядерного оружия.
Плутоний-галлий обладает свойством очень низкого теплового расширения.
Некоторые другие сплавы плутония -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Соединения плутония
Оксид плутония (IV) - PuO 2
Хлорид плутония (III) - PuCl 3
Тетрафторид плутония - PuF 4
Использование плутония
Изотоп плутоний-239 - один из важных элементов в разработке ядерного оружия.
Плутоний используется в качестве топлива на атомных электростанциях.
Введение
Уран - металл актинидного ряда периодической таблицы.
Символ урана ‘U’ и атомный номер ’92.’
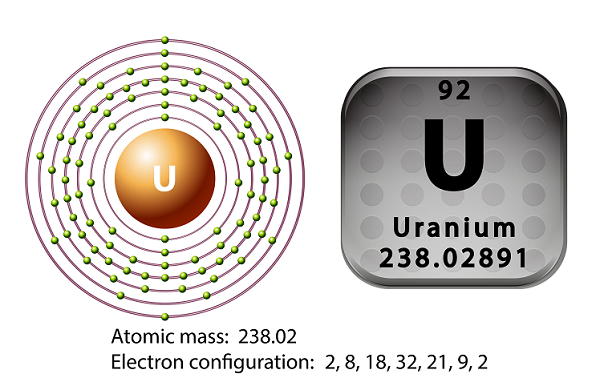
В 1789 году Мартин Генрих Клапрот открыл элемент уран и назвал его в честь Урана.
Основные характеристики урана
Уран - серебристо-белый металл.
Атом урана имеет 92 электрона, а также 92 протона, из которых 6 являются валентными электронами.
Из-за наличия нестабильных изотопов уран является слабым радиоактивным элементом.
Уран-238 - самый распространенный изотоп урана.
Уран встречается в природе в очень низких концентрациях, то есть несколько частей на миллион в горных породах, почве и воде.
Уран постепенно (медленно) распадается, испуская альфа-частицы.
Уран имеет плохую электропроводность (поэтому плохо проводит электричество).
Уран ковкий, пластичный и немного парамагнитный.
Появление урана
Уран (естественно) встречается как уран-238, уран-235 и уран-234.
Период полураспада урана-238 составляет около 4,47 миллиарда лет, что почти соответствует возрасту Земли, а период полураспада урана-235 составляет около 704 миллионов лет.
Сплавы урана
Ниже приведены основные сплавы урана -
Staballoy
Гидрид урана
Соединения урана
Ниже приведены основные соединения урана -
Нитрид урана - U 2 N 3
Пентафторид урана - UF 5
Карбид урана - UC
Фторид уранила - UO 2 F 2
Диоксид урана - UO 2
Гексафторид урана - UF 6
Оксоксид триурана - U 3 O 8
Тетрафторид урана - UF 4
Триоксид урана - UO 3
Тетрахлорид урана - Ucl 4
Уранилнитрат - UO 2 (NO 3 ) 2
Использование урана
Уран используется в качестве источника энергии на атомных подводных лодках (особенно в военных).
Уран используется при создании ядерного оружия.
Уран также используется в качестве балласта для кораблей.
Введение
Свинец - тяжелый химический элемент (металл), т.е. имеет высокую плотность.
Символ свинца ‘Pb’ и атомный номер ‘82.’

Свинец имеет тенденцию связывать себя; аналогично, он может образовывать цепи, связи, кольца и многогранные структуры.
Основные характеристики свинца
Свинец - мягкий и ковкий металл; он имеет относительно низкую температуру плавления.
Свинец - относительно инертный элемент, и он имеет тенденцию образовывать заветные узы.
При огранке свинец приобретает голубовато-белый оттенок.
При горении свинец дает голубовато-белое пламя (см. Изображение ниже).

Соединения свинца обычно находятся в степени окисления +2.
Появление свинца
Свинец известен доисторическим людям Западной Азии.
Свинец находится в земной коре; его редко можно найти глубоко под землей.
Свинец обычно встречается в сочетании с серой.
Галенит является основным свинцовым минералом, в основном содержащимся в цинковых рудах.
Сплавы свинца
Ниже приведены основные сплавы свинца.
Молибдочалкос (медь)
Припой (олово)
Терне (жесть)
Соединения свинца
Ниже приведены основные соединения свинца:
Окись свинца - PbO
Диоксид свинца - PbO 2
Использование свинца
Свинец использовался для изготовления пуль на протяжении сотен лет.
Свинец обычно используется в качестве защитной оболочки для подводных кабелей (только потому, что он обладает свойством коррозионной стойкости).
Свинцовые листы также используются в качестве архитектурных металлов, особенно в кровельных материалах.
Свинец также используется в кислотных батареях.
Свинцовые соединения обычно используются в качестве красителей и полупроводников.
Соединения свинца также используются в пластике, свечах, стекле и т. Д.
Свинец обычно используется в поливинилхлориде (т.е. используется для покрытия электрических шнуров).
Предостережение
Присутствие свинца (в чрезмерном качестве) в организме может вызвать серьезные повреждения мозга и почек; в конечном итоге это может даже привести к смерти.
Введение
Торий - один из радиоактивных металлов-актинидов, которые встречаются в природе в больших количествах.
Символ тория ‘Th’ и атомный номер ’90.’

В 1829 году норвежский минералог Мортен Трейн Эсмарк впервые обнаружил торий.
Йонс Якоб Берцелиус, шведский химик, идентифицировал и назвал его «торий» в честь имени «Тора», норвежского бога грома.
Существенные особенности тория
Торий - парамагнитный и мягкий радиоактивный актинидный металл.
Цвет металлического тория серебристый; при контакте с воздухом он тускнеет и образует диоксид.
Все изотопы тория нестабильны и это слабый радиоактивный элемент.
Среди всех значимых радиоактивных элементов период полураспада тория самый длинный, то есть около 14,05 миллиарда лет.
Температура плавления тория около 1750 0 С.
Появление тория
Торий - это изначальный элемент, который существует в нынешнем виде еще до образования Земли.
Торий, содержащийся в земной коре, получают из монацитовых песков.
Монацит, который встречается в больших количествах по всему миру, является наиболее важным источником тория.
Сплавы тория
Маг-Тор и торий-алюминий - наиболее важные сплавы тория, магния и алюминия.
Соединения тория
Ниже приведены основные соединения тория:
Диоксид тория - ThO 2
Сульфид тория (IV) - ThS 2
Иодид тория (IV) - ThI 4
Тетрафторид тория - ThF 4
Торий (IV хлорид - ThCl 4
Карбид тория (IV) - ThC
Некоторые другие -
Thorite
Нитрат тория (IV)
Ортосиликат тория (IV)
Использование тория
Торий обычно используется при дуговой сварке вольфрамовым электродом (GTAW), поскольку он (торий) увеличивает жаропрочность вольфрамовых электродов и, соответственно, улучшает стабильность дуги.
В электронном оборудовании нанесение ториевого покрытия на вольфрамовую проволоку увеличивает эмиссию электронов нагретых катодов.
В химической промышленности именно диоксид тория ‘thoria’ обычно используется.
Введение
В периодической таблице водород является самым легким элементом, его атомный вес всего 1,008.
Символ водорода ‘H’ а атомный номер ‘1.’

В начале 16 - го века, газообразный водород впервые был искусственно путем реакции кислот и металлов.
Генри Кавендиш впервые признал водородный газ дискретным веществом в период 1766–1781 годов, поскольку при сгорании он производит воду.
Существенные особенности водорода
В плазменном состоянии неостаточные звезды состоят в основном из водорода.
При стандартной температуре и давлении водород кажется бесцветным, безвкусным, неметаллическим, нетоксичным и легковоспламеняющимся двухатомным газом без запаха.
Молекулярная формула водорода - H 2 .
На Земле водород существует в молекулярных формах, например, в воде или других органических соединениях.
Водород также играет важную роль в кислотно-основных реакциях.
Газообразный водород в воздухе легко воспламеняется.
Чистое водородно-кислородное пламя излучает ультрафиолетовый свет; кроме того, при высоком содержании кислорода смеси почти не видны невооруженным глазом.
Водород может реагировать практически со всеми окисляющими элементами.
При комнатной температуре водород обычно самопроизвольно и жестко реагирует с хлором и фтором и образует соответствующие галогениды водорода.
Возникновение водорода
Состоящий примерно на 75 процентов всей барионной массы, водород является наиболее распространенным химическим веществом во Вселенной.
Во Вселенной водород обычно находится в атомарном и плазменном состояниях; однако свойства совершенно отличны от свойств молекулярного водорода.
На Земле водород существует в виде двухатомного газа, то есть H 2 .
Из-за небольшого веса водород легко уходит из атмосферы Земли.
Водород является третьим по распространенности элементом на поверхности Земли, но в основном он находится в форме углеводородов и воды.
Соединения водорода
Ниже приведены основные соединения водорода:
Вода - H 2 O
Аммиак - NH 3
Хлороводород - HCl
Фтористый водород - HF
Сероводород - H 2 S
Метан - CH 4
Гидроксид - OH -
Бромистый водород - HBr
Йодоводород - HI
Цианистый водород - HCN
Фосфин - PH 3
Селенид водорода - H 2 Se
Метанол - CH 3 OH
Гидрид лития - LiH
Бикарбонат - HCO 3
Теллурид водорода - H 2 Te
Жидкий водород - H 2
Цианид - CN
Гидрид кальция - CaH 2
Тяжелая вода - D 2 O
Диборан - B 2 H 6
Гидрид натрия - NaH
Гидрид калия - KH
Использование водорода
Наибольшее количество H 2 используется при переработке ископаемого топлива, а также при производстве аммиака.
Водород (H 2 ) широко используется в нефтяной и химической промышленности.
H 2 обычно используется в качестве гидрирующего агента, особенно для увеличения уровня насыщения ненасыщенных жиров и масел.
H 2 также используется в качестве защитного газа при сварке, например, при сварке с использованием атомарного водорода и т. Д.
Введение
Гелий - второй по легкости (после водорода) и второй по распространенности элемент во Вселенной.
Символ гелия - ‘He’ и атомный номер ‘2.’

В периодической таблице гелий занимает первое место в группе благородных газов.
Гелий назван в честь греческого бога Солнца.Helios. '
Отличительные особенности гелия
Гелий - это бесцветный, без запаха, вкуса, инертный, нетоксичный и одноатомный газ.
Точка кипения (-268,9 0 С) гелия является наименьшим среди всех элементов.
Гелий обычно состоит из двух электронов на атомных орбиталях и окружен ядром, которое состоит из двух протонов и двух нейтронов.
Появление гелия
Большая часть гелия во Вселенной принадлежит helium-4, и считается, что он образовался во время Большого взрыва.
Основная доля нового гелия обычно создается в результате ядерного синтеза водорода в звездах, включая Солнце.
Хотя происходит непрерывное создание нового гелия; тем не менее, доступность гелия на Земле существенно низка, поскольку, будучи легким элементом, он легко улетает в космос.
В гетеросфере (внешней атмосфере) Земли гелий является одним из наиболее часто встречающихся элементов (газов).
В земной коре гелий обычно содержится в больших количествах в минералах урана и тория.
Соединения гелия
Ниже приведены основные соединения гелия:
Динатрий гелид - Na 2 He
Кристобалит He II (силикаты) - SiO 2 He
Дигелий арсенолит - As 4 O 6 • 2He
Изотопы гелия
Существует около девяти известных изотопов гелия, но следующие два являются наиболее стабильными изотопами:
Гелий-3 и
Helium-4
Использование гелия
Из-за низкой плотности, низкой температуры кипения, низкой растворимости, высокой теплопроводности гелий является широко используемым элементом; самый популярный пример - использование гелия в воздушном шаре.
Основной кусок гелия используется в криогенных целях, например, для охлаждения сверхпроводящих магнитов, используемых в медицинских сканерах МРТ и спектрометрах ЯМР.
Гелий также используется в качестве защитного газа при выращивании кристаллов кремния и германия.
Гелий также используется в газовой хроматографии и производстве титана и циркония.
Гелий используется в сверхзвуковых аэродинамических трубах.
Гелий также применяется в качестве защитного газа в процессах дуговой сварки.
Введение
Кислород входит в группу 16 Менделеева; однако в большинстве случаев к нему относятся иначе, чем к его группе.
Символ кислорода ‘O’ и атомный номер ‘8.’

Кислород имеет около девяти аллотропов, и наиболее распространенным аллотропом является двухатомный кислород (то есть O 2 ). Другой важный аллотроп - это озон, то есть O 3 .
Кислород впервые заметил шведский фармацевт Карл Вильгельм Шееле.
Основные характеристики кислорода
Кислород обычно относится к группе «халькогенов».
Слово «халькоген» происходит от греческого слова «khalkόs, Что означает «медь» и латинско-греческое слово «Genēs, », Что означает рожденный или произведенный.
Кислород - это газ с высокой реакционной способностью (или неметаллический элемент); следовательно, это окислитель, который легко образует оксиды с большинством элементов и соединений.
Кислород имеет шесть валентных электронов.
Температура плавления кислорода -218,8 0 С , а температура кипения -183 0 С.
Появление кислорода
Кислород, на долю которого приходится около 20,8% (от общего количества компонентов атмосферы Земли), является вторым по значению элементом атмосферы Земли.
Кислород находится почти в сфере Земли, а именно в атмосфере, гидросфере и литосфере.
В процессе фотосинтеза свободный кислород вырабатывается всеми зелеными растениями.
Кислород присутствует в составе медных руд.
Человеческое тело содержит около 65 процентов кислорода.
По массе почти половина земной коры состоит из кислорода (то есть его оксидов).
По массе кислород является третьим по распространенности элементом во Вселенной; первая и вторая - водород и гелий соответственно.
Кислород (т.е. O 2 ) - это двухатомный газ без цвета и запаха.
Кислород очень легко растворяется в воде; однако растворимость кислорода в воде зависит от температуры.
Соединения кислорода
Ниже приведены основные соединения кислорода:
Oxide
Peroxide
Двуокись углерода - CO 2
Гидроксид - OH -
Озон - O 3
Оксид ртути (II) - HgO
Хлорат - ClO 3
Оксид алюминия - Al 2 O 3
Окись углерода - CO
Гипохлорит - ClO -
Диоксид кремния - SiO 2
Гипофтористая кислота - HOF
Перекись натрия - Na 2 O 2
Хлорат калия - KClO 3
Дифторид кислорода - OF 2
Оксид натрия - Na 2 O
Использование кислорода
Кислород (O 2 ) - важнейшая потребность в дыхании, без него невозможно представить жизнь.
Кислород используется в медицине.
Кислородная терапия обычно используется для лечения некоторых заболеваний, таких как эмфизема, пневмония, некоторые сердечные заболевания и т. Д.
В некоторых подводных занятиях, таких как подводное плавание с аквалангом, подводные лодки и т. Д., Также используется искусственный кислород.

Самолеты, альпинисты и т. Д. Также используют искусственный кислород.
Кислород также используется в некоторых отраслях промышленности, например при выплавке железной руды в сталь - в этом процессе используется около 55% кислорода.
Введение
Углерод - это неметаллический и четырехвалентный элемент.
Тетравалентный означает - углерод делает четыре электрона доступными для образования ковалентных химических связей.
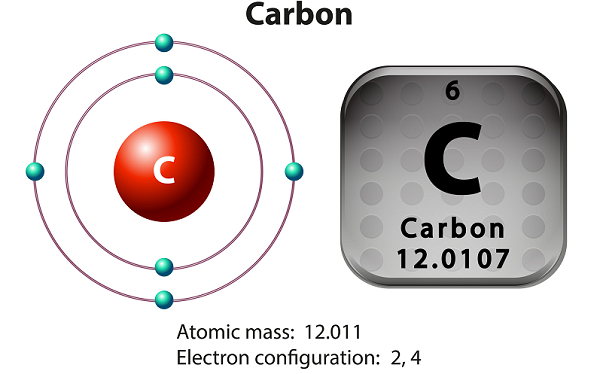
У углерода есть три изотопа, которые встречаются в природе, а именно 12 C, 13 C и 14 C.
Среди них 12 C и 13 C стабильны, но 14 C - радиоактивный изотоп. Период полураспада 14 C составляет около 5730 лет.
Существенные особенности углерода
Физические свойства углерода во многом зависят от его аллотропов.
Основные аллотропы углерода - графит, алмаз и аморфный углерод.
Графит непрозрачный, черный и очень мягкий; следовательно, раньше он образовывал полосу на бумаге.
Алмаз очень твердый (самый твердый из природных материалов) и прозрачный.
Графит - хороший проводник электричества.
Алмаз - плохой проводник электричества.
Углерод, скорее всего, имеет самую высокую точку сублимации среди всех элементов.
Появление углерода
По массе углерод является четвертым по распространенности химическим элементом во Вселенной (после водорода, гелия и кислорода).
Углерод присутствует в изобилии на Солнце, звездах, кометах и в атмосферах большинства планет.
Углерод содержится в атмосфере Земли и растворяется в воде.
Углеводороды, такие как уголь, нефть и природный газ, все они содержат углерод.
Углерод также содержится в гидратах метана, которые встречаются в полярных регионах и под морем.
Некоторые из пород, обогащенных углеродом, - это уголь, известняк, доломит и т. Д.
Уголь очень богат углеродом; следовательно, это крупнейший коммерческий источник минерального углерода.
На уголь приходится около 4000 гигатонн, или 80% от общего объема ископаемого топлива.
Соединения углерода
Ниже приведены основные соединения углерода:
Цианоген - CN 2
Цианистый водород - HCN
Цианамид - CN 2 H 2
Изоциановая кислота - HNCO
Хлорид цианогена - CNCl
Хлорсульфонилизоцианат - CNClO 3 S
Цианур хлорид - NCCl 3
Сероуглерод - CS 2
Карбонилсульфид - OCS
Моносульфид углерода - CS
Использование углерода
В зависимости от аллотропов углерод используется в различных областях.
Углерод - один из важнейших элементов жизни без него, мы не можем представить жизнь на Земле.
Ископаемое топливо, а именно газообразный метан и сырая нефть (нефть), уголь и т. Д., Используются в повседневной жизни.
Графит в сочетании с глиной используется для изготовления «грифеля» карандашей.
Древесный уголь также используется в качестве материала для рисования в художественных работах, выплавке чугуна, приготовлении барбекю и т. Д.
Бриллиант обычно используется в украшениях.
Промышленные алмазы используются в режущих, сверлильных и полировальных инструментах для обработки металлов и камня.
Ископаемые углеводороды и углеродное волокно используются в производстве пластика.
Введение
Азот - химический элемент 15-й группы таблицы Менделеева; среди всех элементов группы 15 это самый легкий элемент.
Символ азота ‘N’ и атомный номер 7.

В 1772 году шотландский врач Дэниел Резерфорд впервые обнаружил и выделил углерод.
Однако название «азот» впервые дал Жан-Антуан-Клод Шапталь в 1790 году.
Существенные особенности азота
Азот имеет два стабильных изотопа, а именно 14 N и 15 N.
Свободные атомы азота обычно легко реагируют с большинством элементов и образуют нитриды.
Молекулы N 2 бесцветный, без запаха, без вкуса и диамагнитный газ при стандартных условиях.
Температура плавления N 2 является -210 0 С , а температура кипения -196 0 С.
Соединения азота периодически обмениваются между атмосферой и живыми организмами, создавая азотный цикл.
Появление азота
Азот является наиболее распространенным элементом на Земле, так как он составляет около 78,1% всего объема земной атмосферы.
Газообразный азот, который является промышленным газом, в основном производится путем фракционной перегонки жидкого воздуха.
Соединения азота
Ниже приведены основные соединения азота:
Аммоний - NH 4+
Аммиак - NH 3
Азотная кислота - HNO 3
Нитрит - NO 2-
Диоксид азота - NO 2
Пентроксид диазота - N 2 O 5
Гидразин - N 2 H 4
Динитроген - N 2
Цианид - CN
Аммиачная селитра - (NH 4 ) (NO 3 )
Трихлорид азота - NCl 3
Трифторид азота - НФ 3
Трииодид азота - НИ 3
Пиридин - C 5 H 5 N
Ион нитрония - NO 2+
Гидразойная кислота - HN 3
Сульфат аммония - (NH 4 ) 2 SO 4
Использование азота
Соединения азота широко используются в самых разных областях и отраслях промышленности.
Чистый азот используется в качестве пищевой добавки.
Используется в системах пожаротушения, особенно для оборудования информационных технологий.
Также используется при производстве нержавеющей стали.
Азот также используется для накачивания шин некоторых самолетов и гоночных автомобилей.
Жидкий азот используется в качестве хладагента.
Законы природы, связанные с химией, известны как химические законы.
Химические реакции обычно управляются определенными законами, которые соблюдаются и формулируются на словах, становясь фундаментальными понятиями в химии.
Ниже приведены важные химические законы -
| Законы | Объяснение |
|---|---|
| Закон Авогадро | «Одинаковые объемы всех газов при одинаковой температуре и давлении содержат одинаковое количество молекул» |
| Закон Бера – Ламберта (или просто закон Бера или закон Ламберта – Бера) | «Объясняет ослабление света свойствами материала, через который он (свет) проходит» |
| Закон Бойля | «Абсолютное давление, оказываемое данной массой идеального газа, обратно пропорционально объему, которое он занимает, если температура и количество газа остаются неизменными в замкнутой системе» |
| Закон Чарльза (также известный как Закон объема) | «Когда давление на образец сухого газа поддерживается постоянным, температура Кельвина и объем будут напрямую связаны» |
| Законы диффузии Фика | Описывает «диффузию» (потока). |
| Закон Гей-Люссака | «Все газы имеют одинаковое среднее тепловое расширение при постоянном давлении в одном и том же диапазоне температур» |
| Принцип Ле Шателье («Закон равновесия») | «Когда любая система, находящаяся в равновесии, подвергается изменению концентрации, температуры, объема или давления, тогда система корректируется, чтобы противодействовать (частично) эффекту применяемого изменения, и устанавливается новое равновесие» |
| Закон Генри | «По закону рассчитывается концентрация газа в растворе под давлением» |
| Закон Гесса | «Изменение энтальпии в химической реакции (это означает, что теплота реакции при постоянном давлении) не зависит от пути между начальным и конечным состояниями» |
| Закон сохранения энергии | «Энергия не может быть ни создана, ни уничтожена» |
| Закон Рауля | «Парциальное давление пара каждого компонента идеальной смеси жидкостей равно давлению пара чистого компонента, умноженному на его мольную долю в смеси» |
| Электролиз по закону Фарадея | «Количество вещества, производимого на электроде, прямо пропорционально количеству пропущенного электричества» |
| Атомная теория | «Материя состоит из отдельных единиц, известных как атомы» |
| Теория Келера | «Объясняет процесс, в котором водяной пар конденсируется и образует капли жидкого облака» |
| Van 't Hoff Equation | “Describes change in the equilibrium constant of a chemical reaction” |
| Transition State Theory | “The reaction rates of elementary chemical reactions” |
| Grotthuss–Draper Law | “It describes that the light which is absorbed by a system/surface can bring a photochemical change” |
| Kinetic Theory of Gases | “Describes the behavior of a hypothetical ideal gas” |
| Aufbau Principle | “Explains that the electrons orbiting the atoms first fill the lowest energy levels and then second higher levels and so on and so forth” |
| Hund's Rule | “ Explains that every orbital in a sublevel is singly occupied before any orbital is doubly occupied” |
| Collision Theory | “Based on the kinetic theory of gases, collision theory describes that the gas-phase chemical reactions occur when molecules collide with sufficient kinetic energy” |
Introduction
Most likely copper was the first element, which was mined and used by humans.
The evidence of earliest use of copper was found in Anatolia, which belongs to 6,000 BCE.
The lead was most likely the second element that humans start using.
The oldest known artifact of lead is statuette, which was found in a temple of Osiris, Abydos, Egypt.
The statuette of Osiris temple belongs to (about) 3,800 BCE.
The oldest known gold treasure was discovered in Varna, Necropolis (Bulgaria).
This gold treasure belongs to (about) 4,400 BCE.
Discovery of silver is almost same as of gold; its evidence was found in Asia Minor.
Some evidence say that the iron was known from (about) 5,000 BCE.
The oldest known iron objects, which was used by the humans, were found in Egypt (belongs to 4000 BCE).
The following table illustrates the significant elements with their discovery date and discovers −
| Element | Discoverer | Discovery Date |
|---|---|---|
| Copper | Middle East (Place) | About 9,000 BCE |
| Lead | Egypt (Place) | About 7,000 BCE |
| Gold | Bulgaria (Place) | About 6,000 BCE |
| Silver | Asia Minor (Place) | About 5,000 BCE |
| Iron | Egypt (Place) | About 5,000 BCE |
| Tin | About 3,500 BCE | |
| Sulfur | Chinese/India | About 2,000 BCE |
| Mercury | Egypt | 2,000 BCE |
| Phosphorus | H. Brand | 1669 |
| Cobalt | G. Brandt | 1735 |
| Platinum | A. de Ulloa | 1748 |
| Nickel | F. Cronstedt | 1751 |
| Bismuth | C.F. Geoffroy | 1753 |
| Magnesium | J. Black | 1755 |
| Hydrogen | H. Cavendish | 1766 |
| Oxygen | W. Scheele | 1771 |
| Nitrogen | D. Rutherford | 1772 |
| Barium | W. Scheele | 1772 |
| Chlorine | W. Scheele | 1774 |
| Manganese | W. Scheele | 1774 |
| Molybdenum | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirconium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Beryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Boron | L. Gay-Lussac and L.J. Thénard | 1808 |
| Fluorine | A. M. Ampère | 1810 |
| Iodine | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S. L Hermann, F. Stromeyer, and J.C.H. Roloff | 1817 |
| Selenium | J. Berzelius and G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | H.C.Ørsted | 1825 |
| Bromine | J. Balard and C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen and G. R. Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich and T. Richter | 1863 |
| Helium | P. Janssen and N. Lockyer | 1868 |
| Neon | W. Ramsay and W. Travers | 1898 |
| Xenon | W. Ramsay and W. Travers | 1898 |
| Fermium | A. Ghiorso et al | 1952 |
| Nobelium | E. D. Donets, V. A. Shchegolev and V. A. Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris and P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
The following table illustrates significant elements and their valence −
| Element | Valence | Symbol | Atomic No. |
|---|---|---|---|
| Hydrogen | -1, +1 | H | 1 |
| Helium | 0 | He | 2 |
| Lithium | 1 | Li | 3 |
| Beryllium | 2 | Be | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Carbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oxygen | -1, -2, 0, 2, 1, | O | 8 |
| Fluorine | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminum | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphorus | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlorine | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Ca | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganese | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Iron | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Copper | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | As | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Bromine | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |