เคมี - แคลเซียม
บทนำ
แคลเซียมเป็นธาตุอัลคาไลน์ที่มีสีเทาอมเหลืองซึ่งพบมากในเปลือกโลก
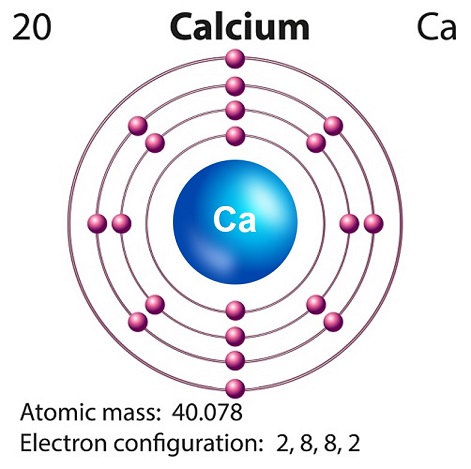
สัญลักษณ์ของแคลเซียมคือ “Ca” และเลขอะตอมคือ “20.”
แคลเซียมอิสระแทบจะไม่มีอยู่ในธรรมชาติเนื่องจากมีปฏิกิริยาสูง
โดยปกติแล้วแคลเซียมจะเกิดจากการสังเคราะห์ด้วยนิวเคลียสของซูเปอร์โนวา
คุณสมบัติเด่นของแคลเซียม
แคลเซียมเป็นโลหะที่มีมากที่สุดชนิดหนึ่งโดยมวลที่พบในสัตว์หลายชนิด
แคลเซียมเป็นส่วนประกอบที่สำคัญมากของฟันกระดูกและเปลือกหอย
แคลเซียมคาร์บอเนตและแคลเซียมซิเตรตเป็นผลิตภัณฑ์เสริมอาหารหลักที่จำเป็นสำหรับการมีสุขภาพที่ดี
องค์การอนามัยโลก (WHO) ระบุว่าแคลเซียมเป็นยาจำเป็น
เมื่อเปรียบเทียบกับโลหะอื่น ๆ แคลเซียมไอออนและสารประกอบแคลเซียมอื่น ๆ ส่วนใหญ่มีความเป็นพิษต่ำ
หากแคลเซียมสัมผัสกับน้ำหรือกรดจะทำปฏิกิริยากับสารเหล่านี้และกลายเป็นอันตราย
ถ้าแคลเซียมสัมผัสกับอากาศจะทำปฏิกิริยาอย่างรวดเร็วและก่อตัวเป็นแคลเซียมไนไตรด์และแคลเซียมออกไซด์เคลือบสีเทา - ขาว
โดยปกติเกลือแคลเซียมส่วนใหญ่จะไม่มีสี
เมื่อแคลเซียมถูกเผาสีของเปลวไฟจะปรากฏเป็นสีแดงอิฐ (ดูภาพด้านล่าง)

โลหะแคลเซียมมีความต้านทานไฟฟ้าสูงกว่าอลูมิเนียมหรือทองแดง
การเกิดขึ้น
แคลเซียมมักเกิดในหินตะกอน
แร่ธาตุ (ตะกอน) ที่แคลเซียมพบ ได้แก่ แคลไซต์โดโลไมต์และยิปซั่ม
แคลเซียมยังพบในหินอัคนีและหินแปรส่วนใหญ่อยู่ในแร่ซิลิเกตเช่นแอมฟิโบลพลาจิโอเคลสไพร็อกซีเนสและโกเมน
แคลเซียมยังพบในผลิตภัณฑ์อาหารหลายชนิดเช่นผลิตภัณฑ์จากนมอัลมอนด์เฮเซลนัทถั่วเหลืองบรอกโคลีใบแดนดิไลออนมะเดื่อและอื่น ๆ อีกมากมาย
สารประกอบของแคลเซียม
แคลเซียมออกไซด์- CaO
แคลเซียมไฮดรอกไซด์- Ca (OH) 2
แคลเซียมคลอไรด์- CaCl 2
แคลเซียมไฮโปคลอไรต์ (ผงฟอกสี) - Ca (ClO) 2
แคลเซียมฟอสเฟต- Ca 3 (PO 4 ) 2
การใช้แคลเซียม
แคลเซียมมีการใช้งานที่หลากหลายโดยที่สำคัญ ได้แก่ -
แคลเซียมคาร์บอเนต (CaCO 3 ) ใช้ในการผลิตปูนซีเมนต์
แคลเซียมคาร์บอเนต (CaCO 3 ) ยังใช้ในการทำยาสีฟัน
ในยาฆ่าแมลงจะใช้แคลเซียมอาร์ซีเนต (Ca 3 (AsO 4 ) 2 )
แคลเซียมคลอไรด์ (CaCl 2 ) ใช้ในการกำจัดน้ำแข็งและในการควบคุมฝุ่น
แคลเซียมซิเตรต (Ca 3 (C 6 H 5 O 7 ) 2 ) นิยมใช้เป็นสารถนอมอาหาร
แคลเซียมกลูโคเนต (Ca (C 6 H 11 O 7 ) 2 ) มักใช้เป็นวัตถุเจือปนอาหารเช่นเดียวกับยาเม็ดวิตามิน
แคลเซียมไฮโปคลอไรต์ (Ca (OCl) 2 ) โดยทั่วไปใช้เป็นสารฆ่าเชื้อในสระว่ายน้ำเป็นสารฟอกขาว