เคมีตอนที่ 2 - คู่มือฉบับย่อ
บทนำ
เคมีเป็นสาขาหนึ่งของวิทยาศาสตร์ธรรมชาติที่ศึกษาเกี่ยวกับโครงสร้างองค์ประกอบและคุณสมบัติที่เปลี่ยนแปลงของสสาร
เคมีศึกษาส่วนที่เล็กที่สุดของสสารเช่นอะตอม (พร้อมกับคุณสมบัติทั้งหมดของมัน) กับวัสดุขนาดใหญ่ (เช่นทองเงินเหล็ก ฯลฯ ) และคุณสมบัติของมัน
เคมียังศึกษาแรงระหว่างโมเลกุล (ซึ่งให้คุณสมบัติทั่วไปแก่สสาร) และปฏิสัมพันธ์ระหว่างสารผ่านปฏิกิริยาเคมี

ในปี 1998 ศาสตราจารย์ Raymond Chang ได้กำหนดวิชาเคมีว่า -
"เคมี" หมายถึงการศึกษาสสารและการเปลี่ยนแปลงที่เกิดขึ้น
เชื่อกันว่าการศึกษาทางเคมีเริ่มต้นด้วยทฤษฎีของธาตุทั้งสี่ที่ขับเคลื่อนโดยอริสโตเติล
ทฤษฎีธาตุทั้งสี่กล่าวว่า“ ไฟอากาศดินและน้ำเป็นองค์ประกอบพื้นฐานที่ทุกอย่างประกอบขึ้นจากการรวมกัน”
เนื่องจากงานคลาสสิกของเขาคือ “The Sceptical Chymist,” Robert Boyle เป็นที่รู้จักในฐานะบิดาแห่งเคมีผู้ก่อตั้ง
บอยล์กำหนดกฎหมายกลายเป็นที่นิยมในนาม 'กฎหมายของบอยล์'
กฎของบอยล์เป็นกฎของก๊าซทดลองที่วิเคราะห์ความสัมพันธ์ระหว่างความดันของก๊าซกับปริมาตรของภาชนะที่เกี่ยวข้อง
บอยล์ปฏิเสธทฤษฎี 'สี่องค์ประกอบ' แบบคลาสสิกด้วยการสนับสนุนกฎหมายของเขา
นักวิทยาศาสตร์ชาวอเมริกัน Linus Pauling และ Gilbert N. Lewis ร่วมกันขับเคลื่อนทฤษฎีอิเล็กทรอนิกส์ของพันธะเคมีและออร์บิทัลระดับโมเลกุล
องค์การสหประชาชาติประกาศให้ปี 2554 เป็น 'ปีเคมีสากล'
สสารถูกกำหนดในทางเคมีว่าเป็นสิ่งที่มีมวลและปริมาตรที่เหลือและใช้พื้นที่ด้วย
matter ประกอบด้วยอนุภาค
atom เป็นหน่วยพื้นฐานของเคมี
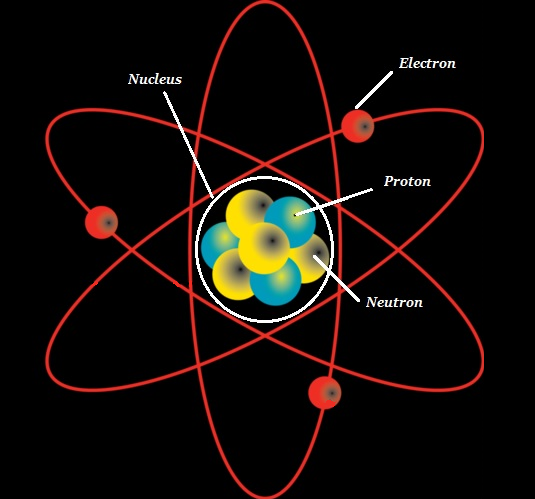
อะตอมประกอบด้วยแกนหนาแน่นที่เรียกว่า atomic nucleus และล้อมรอบด้วยพื้นที่ที่เรียกว่า electron cloud.
นิวเคลียส (ของอะตอม) ประกอบด้วย protons (+ve charged particles) และ neutrons (neutral or uncharged particles); โดยรวมแล้วทั้งสองเรียกว่าnucleons (ดังแสดงในภาพด้านล่าง)
องค์ประกอบทางเคมีเป็นรูปแบบที่บริสุทธิ์ของสาร ประกอบด้วยอะตอมชนิดเดียว
ตารางธาตุคือการแสดงองค์ประกอบทางเคมีที่มีอยู่ทั้งหมดตามมาตรฐาน
สารประกอบเป็นรูปแบบที่บริสุทธิ์ของสาร ประกอบด้วยองค์ประกอบมากกว่าหนึ่งรายการ
โมเลกุลเป็นส่วนที่เล็กที่สุดที่แยกไม่ออกของสารเคมีบริสุทธิ์ โมเลกุลมีคุณสมบัติทางเคมีที่โดดเด่น (ดูภาพด้านล่าง)
ตารางต่อไปนี้แสดงให้เห็นถึงสาขาเคมี -
| สาขา | สาขาย่อย | คำจำกัดความ |
|---|---|---|
| Physical Chemistry | เคมีกายภาพ | การศึกษาคุณสมบัติทางกายภาพของโมเลกุล |
| จลนศาสตร์เคมี | การศึกษาอัตราการเกิดปฏิกิริยาเคมี | |
| ไฟฟ้าเคมี | การศึกษาปฏิสัมพันธ์ของอะตอมโมเลกุลไอออนและกระแสไฟฟ้า (เช่นการถ่ายโอนอิเล็กตรอนระหว่างอิเล็กโทรดกับอิเล็กโทรไลต์หรือสปีชีส์) | |
| เคมีพื้นผิว | การศึกษาปฏิกิริยาเคมีที่พื้นผิว (ของสาร) | |
| อุณหเคมี | ศึกษาความสัมพันธ์ระหว่างการกระทำทางเคมีและปริมาณความร้อนที่ดูดซับ | |
| เคมีควอนตัม | การศึกษาการประยุกต์ใช้กลศาสตร์ควอนตัมในแบบจำลองทางกายภาพ | |
| สเปกโทรสโกปี | การศึกษาสเปกตรัมของแสงหรือรังสี | |
| โฟโตเคมี | การศึกษาผลกระทบทางเคมีที่เกิดจากแสง | |
| Organic Chemistry | เคมีอินทรีย์ | การศึกษาโครงสร้างคุณสมบัติและการเตรียมสารประกอบทางเคมี (คาร์บอน) (เช่นเชื้อเพลิงพลาสติกวัตถุเจือปนอาหารและยา) |
| Stereochemistry | การศึกษาการจัดเรียงเชิงพื้นที่สัมพัทธ์ของอะตอม (ในโมเลกุล) | |
| เคมีอินทรีย์เชิงกายภาพ | การศึกษาโครงสร้างและการเกิดปฏิกิริยา (ความสัมพันธ์ระหว่างกัน) ในโมเลกุลอินทรีย์ | |
| เคมีพอลิเมอร์ | การศึกษาโมเลกุลของโพลิเมอร์ (องค์ประกอบและการสร้าง) | |
| เคมีออร์แกโนเมทัลลิก | การศึกษาสารเคมีที่มีพันธะ (โดยเฉพาะระหว่างคาร์บอนกับโลหะ) | |
| เคมียา | ศึกษาการออกแบบพัฒนาและสังเคราะห์ยาและเวชภัณฑ์ | |
| Inorganic chemistry | เคมีอนินทรีย์ | การศึกษาวัสดุทั้งหมดที่ไม่ใช่อินทรีย์ (เช่นแร่ธาตุโลหะตัวเร่งปฏิกิริยาโครงสร้างผลึก ฯลฯ ) |
| เคมีออร์แกโนเมทัลลิก | การศึกษาสารประกอบทางเคมีที่มีพันธะ (โดยเฉพาะระหว่างคาร์บอนกับโลหะ) | |
| เคมีโซลิดสเตต | การศึกษาสารประกอบทางเคมีที่มีพันธะระหว่างคาร์บอนและโลหะ | |
| เคมีนิวเคลียร์ | การศึกษาสารกัมมันตภาพรังสี | |
| ธรณีเคมี | การศึกษาองค์ประกอบทางเคมีของโลก (เช่นหินแร่ธาตุและบรรยากาศ) | |
| เคมีชีวนินทรีย์ | การศึกษาปฏิสัมพันธ์ระหว่างไอออนของโลหะกับเนื้อเยื่อของสิ่งมีชีวิต | |
| เคมีประสานงาน | ||
| Biochemistry | ชีวเคมี | การศึกษาปฏิกิริยาเคมี (และการเปลี่ยนแปลง) ในสิ่งมีชีวิต |
| ชีวเคมีระดับโมเลกุล | การศึกษาชีวโมเลกุลควบคู่ไปกับหน้าที่ของมัน | |
| ชีวเคมีคลินิก | ศึกษาการเปลี่ยนแปลงทางเคมีในสิ่งมีชีวิตที่เกิดจากโรคที่แตกต่างกัน | |
| อณูชีววิทยา | การศึกษาความแตกต่างของ DNA, RNA และการสังเคราะห์โปรตีน (และความสัมพันธ์) | |
| ชีวเคมีเกษตร | การศึกษาเคมีของสัตว์ (เช่นพืช) | |
| Analytical Chemistry | การศึกษาวิธีการทดลองที่เป็นมาตรฐานทางเคมี (เช่นการกำหนดเชิงปริมาณของคุณสมบัติทางเคมีของสาร) | |
| Astrochemistry | ศึกษาปฏิกิริยาขององค์ประกอบทางเคมีและโมเลกุลที่พบในจักรวาล | |
| Cosmochemistry | ศึกษาองค์ประกอบทางเคมีของสสารที่พบในจักรวาล | |
| Environmental chemistry | ศึกษาปรากฏการณ์ทางเคมีและชีวเคมีที่เกิดขึ้นในสิ่งแวดล้อม |
บทนำ
กระบวนการปลดปล่อยอนุภาคออกจากนิวเคลียสเนื่องจากความไม่เสถียรของนิวเคลียร์ เรียกว่ากัมมันตภาพรังสี
สารที่ปล่อยพลังงาน / รังสีดังกล่าวเรียกว่าสารกัมมันตภาพรังสี
รังสีที่มองไม่เห็นซึ่งปล่อยออกมาจากสารกัมมันตภาพรังสีดังกล่าวเรียกว่ารังสีกัมมันตภาพรังสี
ในทำนองเดียวกันกัมมันตภาพรังสีเป็นปรากฏการณ์นิวเคลียร์ที่เกิดขึ้น (ตามธรรมชาติ) เนื่องจากความไม่เสถียรของอะตอมนิวเคลียร์
ในปีพ. ศ. 2439 Henri Becquerel ได้สังเกตเห็นปรากฏการณ์ของกัมมันตภาพรังสีเป็นครั้งแรก แต่คำว่า 'กัมมันตภาพรังสี' ได้รับการบัญญัติโดย Marie Curie
Marie Curie ค้นพบธาตุกัมมันตภาพรังสี ได้แก่ Polonium และ Radium ในปี พ.ศ. 2441
สำหรับการค้นพบของเธอ Marie Curie ได้รับรางวัลโนเบล
รังสีกัมมันตภาพรังสี
หลังจากทดลองมานานหลายปีเออร์เนสต์รัทเทอร์ฟอร์ดพร้อมกับเพื่อนร่วมงานของเขา (ฮันส์ไกเกอร์และเออร์เนสต์มาร์สเดนนักเรียนของเขา) ได้ค้นพบรังสีอัลฟารังสีเบต้าและรังสีแกมมา
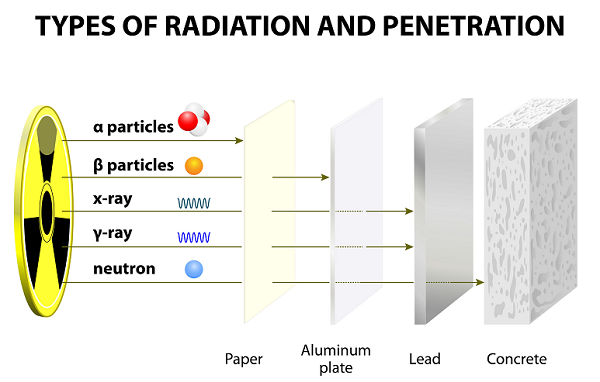
รังสีเหล่านี้เปล่งออกมาอันเป็นผลมาจากการแตกตัวของอะตอม
อนุภาคอัลฟ่า (α)
อนุภาคอัลฟ่ามักประกอบด้วยโปรตอนสองตัวและนิวตรอนสองตัวซึ่งเกาะติดกันแน่น
อนุภาคอัลฟ่าจะถูกปลดปล่อยออกมาในระหว่างการสลายตัวของกัมมันตภาพรังสี (หรือการสลายตัวของแอลฟา) จากนิวไคลด์วิทยุนิวเคลียส
อนุภาคแอลฟาจะเหมือนกับนิวเคลียสของอะตอมฮีเลียมปกติหรืออะตอมของฮีเลียมที่แตกตัวเป็นไอออนสองเท่า
เมื่อเปรียบเทียบกับอนุภาคอื่น ๆ (เช่นแกมมาและเบต้า) อนุภาคแอลฟาจะหนักและช้า ดังนั้นอนุภาคแอลฟาจึงมีช่วงที่เล็กมากในอากาศ
เนื่องจากความเร็วที่ช้าอนุภาคอัลฟ่าจึงมีอำนาจทะลุทะลวงที่อ่อนแอมาก อนุภาคเหล่านี้ถูกหยุดลงด้วยแผ่นกระดาษบาง ๆ (ดูภาพด้านบน)
เนื่องจากมีประจุบวกสองเท่าอนุภาคแอลฟาจึงแตกตัวเป็นไอออนได้สูง
อนุภาคเบต้า (β)
อนุภาคเบต้าคืออิเล็กตรอนที่เคลื่อนที่เร็วซึ่งปล่อยออกมาจากนิวไคลด์วิทยุบางชนิดในระหว่างการสลายตัวของกัมมันตภาพรังสี (หรือที่เรียกว่าการสลายตัวของเบต้า)
อนุภาคเบต้ามีน้ำหนักเบากว่ามากและมีประจุลบเพียงครั้งเดียว
อนุภาคเบต้าแทบจะไม่แตกตัวเป็นไอออนมากกว่าอนุภาคแอลฟา
เนื่องจากมีน้ำหนักเบาอนุภาคเบต้าจึงเดินทางได้ไกลกว่าอนุภาคแอลฟา อย่างไรก็ตามอนุภาคเบต้าสามารถหยุดได้โดยกระดาษหลายแผ่นหรืออลูมิเนียมแผ่นเดียว
อนุภาคเบต้ามีประจุลบและดึงดูดเข้าหาอนุภาคที่มีประจุบวก
อนุภาคแกมมา (ү)
อนุภาคแกมมาเป็นกลุ่มของพลังงานสูงคือพลังงานแม่เหล็กไฟฟ้า (โฟตอน) ที่ปล่อยออกมาจากองค์ประกอบกัมมันตภาพรังสีในระหว่างการสลายตัวของกัมมันตภาพรังสี
ในบรรดาอนุภาคทั้งสาม (แอลฟาเบต้าและแกมมา) อนุภาคแกมมาเป็นโฟตอนที่มีพลังมากที่สุด
อนุภาคแกมมาซึ่งเป็นรูปแบบของรังสีแม่เหล็กไฟฟ้า (EMR) เกิดจากนิวเคลียส
ความยาวคลื่นของแกมมาสั้นที่สุดในบรรดาทั้งสาม
อนุภาคแกมมาไม่มีประจุและเป็นกลาง ดังนั้นจึงไม่ได้รับผลกระทบจากสนามแม่เหล็กและไฟฟ้า
การใช้องค์ประกอบกัมมันตภาพรังสี
ธาตุกัมมันตภาพรังสีถูกใช้ใน -
สาขาการแพทย์ (รักษาโรคต่างๆ)
กระบวนการอุตสาหกรรม
การผลิตพลังงาน - เครื่องปฏิกรณ์นิวเคลียร์
บทนำ
ปฏิกิริยานิวเคลียร์ปลดปล่อยพลังงานจำนวนมหาศาล (เรียกว่าพลังงานนิวเคลียร์) ซึ่งกำลังถูกใช้เพื่อผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์

พลังงานนิวเคลียร์ที่ผลิตโดยปกติ nuclear fission, nuclear fusion, และ nuclear decay.
ในปีพ. ศ. 2481 นักเคมีชาวเยอรมัน Otto Hahn, Fritz Strassmann และ Lise Meitner นักฟิสิกส์ชาวออสเตรียได้ทำการทดลองเกี่ยวกับผลิตภัณฑ์ของยูเรเนียมที่ถูกทำลายด้วยนิวตรอน จากผลการทดลองนี้นิวตรอนขนาดค่อนข้างเล็กได้แยกนิวเคลียสของอะตอมยูเรเนียมขนาดใหญ่ออกเป็นสองชิ้นเท่า ๆ กันและปล่อยพลังงานมหาศาลออกมา
การทดลองนิวเคลียร์ของ Otto Hahn และเพื่อนร่วมงานได้รับความนิยมในฐานะนิวเคลียร์ฟิชชัน
นิวเคลียร์
กระบวนการนิวเคลียร์ฟิชชันทำให้เกิดนิวตรอนอิสระและโฟตอนแกมมาในขณะที่การทำเช่นนี้ยังปลดปล่อยพลังงานจำนวนมาก
นิวเคลียร์ฟิชชันเป็นปฏิกิริยาคายความร้อนซึ่งสามารถปลดปล่อยพลังงานจำนวนมากในรูปแบบของรังสีแม่เหล็กไฟฟ้าและพลังงานจลน์
นิวเคลียร์ฟิชชันบางครั้งอาจเกิดขึ้นได้ตามธรรมชาติ (กล่าวคือไม่มีการทิ้งระเบิดนิวตรอน) เป็นการสลายกัมมันตภาพรังสีชนิดหนึ่ง
ประเภทของนิวเคลียร์ฟิชชัน
ต่อไปนี้เป็นประเภทหลักของนิวเคลียร์ฟิชชัน -
Chain Reaction and
Fission Reaction
มาคุยกันสั้น ๆ -
ปฏิกิริยาลูกโซ่
เมื่อปฏิกิริยานิวเคลียร์หนึ่งปฏิกิริยาทำให้เกิดปฏิกิริยานิวเคลียร์หนึ่งปฏิกิริยาขึ้นไปเรียกว่าปฏิกิริยาลูกโซ่
ปฏิกิริยาลูกโซ่ดังกล่าวเพิ่มความเป็นไปได้ของปฏิกิริยานิวเคลียร์แบบแพร่กระจายตัวเอง
ปฏิกิริยาลูกโซ่นิวเคลียร์ปลดปล่อยพลังงานต่อปฏิกิริยามากกว่าปฏิกิริยาเคมีอื่น ๆ ถึงล้านเท่า ดังนั้นจึงเรียกอีกอย่างหนึ่งว่าปฏิกิริยาลูกโซ่ระเบิดหรือไม่มีการควบคุม
เมื่ออะตอมหนักสัมผัสกับนิวเคลียร์ฟิชชันโดยปกติจะแตกออกเป็นชิ้นส่วนฟิชชันสองชิ้นขึ้นไป ในระหว่างกระบวนการนี้จะมีการปล่อยนิวตรอนอิสระรังสีแกมมาและนิวตริโนจำนวนมากออกมาและในที่สุดพลังงานจำนวนมากจะถูกปลดปล่อยออกมา
ต่อไปนี้เป็นสองตัวอย่างของปฏิกิริยาลูกโซ่ -
235 U + →ชิ้นส่วนฟิชชันนิวตรอน + 2.4 นิวตรอน + 192.9 MeV
235 Pu + →ชิ้นส่วนนิวตรอนฟิชชัน + 2.9 นิวตรอน + 198.9 MeV
ในระเบิดปรมาณูใช้เทคโนโลยีปฏิกิริยาลูกโซ่เนื่องจากต้องการแหล่งพลังงานที่สม่ำเสมอ
ปฏิกิริยาฟิชชัน
ปฏิกิริยาฟิชชันที่นิวตรอน (เกิดจากฟิชชันของอะตอมเชื้อเพลิง) ถูกใช้เพื่อกระตุ้นให้เกิดฟิชชันมากขึ้นสำหรับการปลดปล่อยพลังงานที่ยั่งยืนเรียกว่าปฏิกิริยาฟิชชัน
ปฏิกิริยาดังกล่าวช้าและควบคุมได้ ดังนั้นจึงเรียกอีกอย่างว่าปฏิกิริยาลูกโซ่ควบคุม
พลังงาน (ไฟฟ้า) ที่ผลิตเครื่องปฏิกรณ์นิวเคลียร์เป็นตัวอย่างในอุดมคติของปฏิกิริยาลูกโซ่ควบคุม
ขึ้นอยู่กับคุณสมบัติและประเภทของการใช้ปฏิกิริยาลูกโซ่ฟิชชัน / ควบคุมถูกจัดประเภทเป็น -
Power reactors
Research reactors
Breeder reactors
เครื่องปฏิกรณ์กำลังเหล่านี้โดยทั่วไปจะเปลี่ยนพลังงานจลน์ของผลิตภัณฑ์ฟิชชันเป็นความร้อน ยิ่งไปกว่านั้นความร้อนจะใช้เพื่อให้ความร้อนกับของเหลวที่ใช้งานได้ซึ่งขับเคลื่อนเครื่องยนต์ความร้อนซึ่งในที่สุดจะสร้างพลังงานกลหรือไฟฟ้า
ส่วนประกอบพื้นฐานของเครื่องปฏิกรณ์นิวเคลียร์
ต่อไปนี้เป็นส่วนประกอบสำคัญของเครื่องปฏิกรณ์นิวเคลียร์ -
Nuclear fuels- เช่นยูเรเนียม ( 233 U, 235 U), ทอเรียม (Th 232 ), พลูโตเนียม (Pu 239 )
Moderators- ใช้เพื่อควบคุมนิวตรอนที่ปล่อยออกมา เช่นน้ำหนักเบริลเลียมกราไฟต์ ฯลฯ
Coolant- ใช้เพื่อทำให้เครื่องปฏิกรณ์เย็นลง เช่นน้ำไอน้ำฮีเลียม CO 2อากาศโลหะหลอมเหลวเป็นต้น
Control rods- ใช้เพื่อเรียกใช้และหยุดปฏิกิริยาฟิชชัน เช่นแคดเมียมหรือแท่งโบรอนถูกใช้เพื่อจุดประสงค์ดังกล่าว
นิวเคลียร์ฟิวชั่น
กระบวนการที่นิวเคลียสแสงสองอันหลอมรวมกันเพื่อสร้างนิวเคลียสหนักเรียกว่าฟิวชันนิวเคลียร์ ในระหว่างกระบวนการนี้พลังงานจำนวนมหาศาลจะถูกปลดปล่อยออกมาซึ่งเรียกว่าพลังงานนิวเคลียร์
ตัวอย่างที่ดีที่สุดของนิวเคลียร์ฟิวชันคือ - ระเบิดไฮโดรเจน
ระเบิดไฮโดรเจนมีพลังมากกว่าระเบิดอะตอมประมาณ 1,000 เท่า
บทนำ
วัสดุ (ซึ่งอาจเป็นองค์ประกอบสารประกอบหรือโลหะผสม) ที่มีลักษณะแข็งเป็นเงาทึบแสงและมีคุณสมบัติในการนำความร้อนและไฟฟ้าเรียกว่าโลหะ
โลหะมีอยู่ตามธรรมชาติในเปลือกโลกในรูปแบบที่ไม่บริสุทธิ์เช่นแร่ และสกัดผ่านกระบวนการขุด
ในบรรดาธาตุที่เป็นที่รู้จักทั้งหมด 118 ธาตุ (ของตารางธาตุ) มีธาตุประมาณ 91 ธาตุเป็นโลหะ

คุณสมบัติของโลหะ
คุณสมบัติที่สำคัญของโลหะมีดังต่อไปนี้ -
โดยทั่วไปโลหะจะอ่อนตัวได้ - หมายความว่ารูปร่างของมันสามารถเปลี่ยนแปลงได้อย่างถาวรโดยไม่แตกหักและแตก
โลหะหลอมได้ - หมายความว่า; สามารถหลอมรวมหรือหลอมได้ง่าย
โลหะมีความเหนียว - หมายถึง; สามารถกำหนดรูปร่างได้แม้กระทั่งแผ่นบาง ๆ หรือลวด
โลหะเป็นตัวนำความร้อนและไฟฟ้าที่ดี ฮีเวอร์ตะกั่วเป็นข้อยกเว้นเนื่องจากไม่มีไฟฟ้า
โลหะจะทำปฏิกิริยากับอโลหะและสารประกอบในรูปแบบต่างๆตามธรรมชาติ โลหะสามารถทำปฏิกิริยากับเบสและกรดได้ เช่น 4 Na + O 2 → 2 Na 2 O (โซเดียมออกไซด์) เป็นต้น
โลหะผสม
โลหะผสมเป็นผลิตภัณฑ์จากส่วนผสมขององค์ประกอบสองอย่างขึ้นไปที่โลหะมีอำนาจเหนือกว่า
ในการผลิตหรือผลิตผลิตภัณฑ์ที่ต้องการจะมีการผสมโลหะที่แตกต่างกัน (ในอัตราส่วนที่แตกต่างกัน) (เช่นโลหะผสม) เช่นโลหะผสมของเหล็ก ได้แก่ เหล็กกล้าไร้สนิมเหล็กหล่อแผ่นโลหะผสม ฯลฯ มีส่วนช่วยในสัดส่วนที่มากทั้งตามปริมาณและมูลค่าทางการค้า
โลหะมักเป็นโลหะผสมโดยมีจุดประสงค์เพื่อให้ทนต่อการกัดกร่อนได้ดีขึ้นเปราะน้อยลงเพื่อให้ได้สีที่น่าสนใจเป็นต้น
ศัพท์โลหะ
Base Metal- ในทางเคมีความหมายของโลหะฐานคือ - โลหะที่สามารถออกซิไดซ์หรือสึกกร่อนได้ง่ายรวมทั้งทำปฏิกิริยากับ HCl (กรดไฮโดรคลอริกเจือจาง) และสร้างไฮโดรเจนได้ง่าย เช่นเหล็กนิกเกิลสังกะสีตะกั่วเป็นต้น
Ferrous Metal- "Ferrous" เป็นคำภาษาละตินซึ่งหมายถึงสาร "ที่มีธาตุเหล็ก" เช่นเหล็กเป็นต้น
Heavy Metal- โลหะที่หนาแน่นกว่าโลหะปกติมากจัดอยู่ในประเภทโลหะหนัก โลหะหนักเป็นพิษหรือเป็นพิษที่ความเข้มข้นต่ำ เช่นปรอท (Hg) สารหนู (As) โครเมียม (Cr) แคดเมียม (Cd) แทลเลียม (Tl) และตะกั่ว (Pb)
Precious Metal- ธาตุโลหะซึ่งมีองค์ประกอบทางเคมีของโลหะหายากที่มีมูลค่าทางเศรษฐกิจสูงจัดอยู่ในประเภทโลหะมีค่า เช่นทองคำขาวทองเงินแพลเลเดียมเป็นต้น
Noble Metal- โลหะที่ทนต่อการกัดกร่อนหรือออกซิเดชั่น เช่นรูทีเนียม (Ru) โรเดียม (Rh) แพลเลเดียม (Pd) เป็นต้น
การใช้โลหะ
ต่อไปนี้คือการใช้งานที่สำคัญของโลหะ -
เนื่องจากโลหะเป็นตัวนำความร้อนและไฟฟ้าที่ดี ดังนั้นจึงใช้เป็นสายไฟฟ้าและในเครื่องใช้ไฟฟ้าอื่น ๆ เช่นมอเตอร์ไฟฟ้า ฯลฯ เช่นทองแดงเงินอลูมิเนียมเป็นต้น
โลหะหนักถูกนำมาใช้ในการสร้างสะพานสระน้ำและเพื่อวัตถุประสงค์ดังกล่าวหลายประการ
โลหะหลายชนิดถูกนำไปใช้ในการผลิตของใช้ในบ้านต่างๆเช่นเครื่องใช้หม้อเตา ฯลฯ
โลหะมักใช้ในการผลิตเครื่องมือหลายประเภทตั้งแต่ตัวขับสกรูธรรมดาไปจนถึงลูกกลิ้งแบบแท่งหนัก
โลหะมีค่ามีรูปลักษณ์ที่สวยงามและน่าดึงดูด (เช่นทองเงินเป็นต้น); จึงใช้เป็นเครื่องประดับ
โลหะเฉพาะบางชนิดใช้สำหรับฮีตซิงก์เพื่อป้องกันอุปกรณ์ที่บอบบางจากความร้อนสูงเกินไป
โลหะกัมมันตรังสี (เช่นยูเรเนียมและพลูโตเนียม) ถูกใช้ในการสร้างพลังงานนิวเคลียร์
ปรอทเป็นโลหะที่ยังคงอยู่ในรูปของเหลวที่อุณหภูมิห้อง ใช้ในเครื่องวัดอุณหภูมิ
สาขาวิทยาศาสตร์และเทคโนโลยีที่ศึกษาคุณสมบัติของโลหะและการผลิตและการทำให้บริสุทธิ์เรียกว่า metallurgy.
สารอนินทรีย์ที่เกิดขึ้นเองตามธรรมชาติเรียกว่าก mineral.
วัสดุแข็งที่เกิดขึ้นตามธรรมชาติซึ่งสามารถสกัดแร่หรือโลหะที่มีค่าได้เรียกว่า ore.
ตารางต่อไปนี้แสดงองค์ประกอบหลักและแร่ -
| ธาตุ | Ores | องค์ประกอบทางเคมี |
|---|---|---|
| อลูมิเนียม | บอกไซต์ | Al 2 O 3 2H 2 O |
| คอรันดัม | Al 2 O 3 | |
| ไครโอไลท์ | นา3 AlF 6 | |
| Dyspore | Al 2 O 3 .H 2 O | |
| ทองแดง | ทองแดง Pyrite | CuFeS 2 |
| มาลาไคต์ | 2CuCO 3 Cu (OH) 2 | |
| เหล็ก | เฮมาไทต์ | เฟ2 O 3 |
| Magnetite | เฟ3 O 4 | |
| ไซเดอร์ไรท์ | เฟโก3 | |
| โซเดียม | โซเดียมคาร์บอเนต | นา2 CO 3 |
| เกลือแกง | NaCl | |
| โซเดียมไนเตรต | NaNO 3 | |
| โซเดียมซัลเฟต | นา2 SO 4 | |
| โพแทสเซียม | โพแทสเซียมคลอไรด์ | KCl |
| โพแทสเซียมคาร์บอเนต | K 2 CO 3 | |
| โพแทสเซียมไนเตรต | KNO 3 | |
| แมกนีเซียม | Magnesite | MgCO 3 |
| โดโลไมต์ | CaMg (CO 3 ) 2 | |
| เกลือเอปซอม | MgSO 4 | |
| แคลเซียม | แคลเซียมคาร์บอเนต | CaCO 3 |
| ดีบุก | แคสซิเทอไรต์ | สโน2 |
| ตะกั่ว | Galena | PbS |
| Cerussite | PbCO 3 | |
| Anglesite | PbSO 4 | |
| เงิน | Argentite | Ag 2 S |
| Tetrahedrite | Sb 4 S 3 | |
| สังกะสี | สังกะสีคาร์บอเนต (เรียกว่าคาลาไมน์) | ZnCO 3 |
| สังกะสีซัลไฟด์ | ZnS | |
| ปรอท | ชาด | HgS |
| แมงกานีส | ไพโรลูไซต์ | MnO 2 |
| ฟอสฟอรัส | ฟอสฟอรัส | Ca 3 (PO 4 ) 2 |
| Fluorapatite | Ca 5 (PO 4 ) 3 F | |
| คลอราปาไทต์ | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| ทอง | Calaverite | AuTe 2 |
| ซิลวาไนต์ | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| พลวง | สติบไนต์ | Sb 2 S 3 |
| Stibiconite | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| โคบอลต์ | โคบอลต์ | CoAsS |
| นิกเกิล | Pentlandite | ((นิเฟ) ส) |
| โครเมียม | Chromite | (FeCr 2 O 4 ) |
บทนำ
โซเดียมเป็นโลหะอัลคาไลที่อ่อนนุ่มและมีปฏิกิริยาสูง
ในตารางธาตุโซเดียมจะถูกเก็บไว้ในกลุ่มที่ 1 เนื่องจากมีอิเล็กตรอนเดี่ยวอยู่ในเปลือกนอก
สัญลักษณ์ของโซเดียมคือNa,ซึ่งได้รับจริงมาจากคำภาษาละติน ‘natrium.’
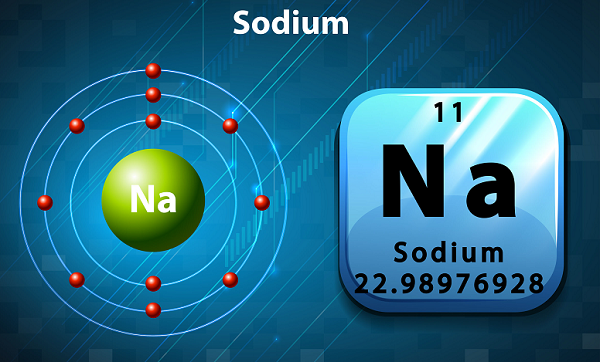
ในแง่ของความอุดมสมบูรณ์โซเดียมเป็นองค์ประกอบที่หกที่พบในเปลือกโลก
โซเดียมมีอยู่ในแร่ธาตุหลายชนิดรวมทั้งเฟลด์สปาร์โซดาไลต์และเกลือสินเธาว์ (NaCl)
ในปี 1807 ฮัมฟรีเดวี่ได้ทำการแยกโซเดียมโดยการอิเล็กโทรไลซิสของโซเดียมไฮดรอกไซด์เป็นครั้งแรก
ตามเวลานั้นทราบถึง 20 ไอโซโทปของโซเดียม แต่ในบรรดาทั้งหมดมีเพียง23 Na เท่านั้นที่เสถียร
คุณสมบัติเด่นของโซเดียม
ต่อไปนี้เป็นคุณสมบัติหลักขององค์ประกอบโซเดียม -
โลหะโซเดียมเป็นองค์ประกอบที่อ่อนนุ่มที่สามารถตัดด้วยมีดได้อย่างง่ายดาย
โซเดียมเป็นตัวนำความร้อนและไฟฟ้าที่ดี
เนื่องจากมีมวลอะตอมต่ำและรัศมีอะตอมใหญ่โซเดียมจึงเป็นหนึ่งในองค์ประกอบที่มีความหนาแน่นน้อยที่สุด (ธาตุที่มีความหนาแน่นน้อยที่สุดอันดับสาม - สองอันดับแรกคือลิเธียมและโพแทสเซียม)
โซเดียมสามารถลอยน้ำได้
โซเดียมตามสารประกอบจะเรืองแสงเป็นสีเหลือง (ดูภาพด้านล่าง)

สารประกอบโซเดียมมีความสำคัญทางการค้าสูงมากและมีความต้องการสูงในอุตสาหกรรมแก้วกระดาษสบู่และสิ่งทอ
สารประกอบโซเดียม
ต่อไปนี้เป็นตัวอย่างที่สำคัญบางส่วนของสารประกอบโซเดียม -
เกลือแกง- (NaCl)
โซดาแอช- (Na 2 CO 3 )
เบกกิ้งโซดา- (NaHCO 3 )
โซดาไฟ- (NaOH)
โซเดียมไนเตรต- (NaNO 3 )
โซเดียมไธโอซัลเฟต- (Na 2 S 2 O 3 · 5H 2 O)
บอแรกซ์- (Na 2 B 4 O 7 · 10H 2 O)
การเกิดโซเดียม
เปลือกโลกมีโซเดียมประมาณ 2.27%
โซเดียมเป็น 5 THโลหะมากที่สุด; อีกสี่อย่าง ได้แก่ อลูมิเนียมเหล็กแคลเซียมและแมกนีเซียม
ในน้ำทะเลโซเดียมประมาณ 1.08 × 104 มิลลิกรัมต่อลิตร
ไม่พบโซเดียมเป็นองค์ประกอบบริสุทธิ์เนื่องจากมีปฏิกิริยาสูง
การใช้โซเดียม
ต่อไปนี้คือการใช้โซเดียมที่สำคัญ -
โซเดียมคลอไรด์มีประโยชน์อย่างมากในการต่อต้านไอซิ่งและการขจัดไอซิ่งรวมทั้งสารกันบูด
ในการปรุงอาหารจะใช้โซเดียมไบคาร์บอเนต
โซเดียมและสารประกอบบางชนิดใช้ในยา
เมื่อเปรียบเทียบกับโพแทสเซียม (ซึ่งเป็นไอออนที่ดีกว่า) โซเดียมจะถูกใช้บ่อยกว่าเนื่องจากราคาและน้ำหนักอะตอมที่ต่ำกว่า
ในเคมีอินทรีย์โซเดียมไฮไดรด์ถูกใช้เป็นปฏิกิริยาต่างๆ
โซเดียมเมทัลลิกใช้เป็นหลักในการผลิตโซเดียมโบโรไฮไดรด์โซเดียมไตรฟีนิลฟอสฟีนอะไซด์ครามเป็นต้น
ในเครื่องปฏิกรณ์แบบเร็วบางชนิดโซเดียมเหลวถูกใช้เป็นของเหลวถ่ายเทความร้อนเนื่องจากมีคุณสมบัติในการนำความร้อนได้ดี
โซเดียมยังเป็นแร่ธาตุที่จำเป็นต่อสุขภาพของมนุษย์เนื่องจากควบคุมความดันโลหิตปริมาณเลือดสมดุลออสโมติกและค่า pH
โซเดียมอย่างน้อย 500 มิลลิกรัมทุกวันเพื่อให้ร่างกายมนุษย์แข็งแรง
บทนำ
แคลเซียมเป็นธาตุอัลคาไลน์ที่มีสีเทาอมเหลืองซึ่งพบมากในเปลือกโลก
สัญลักษณ์ของแคลเซียมคือ “Ca” และเลขอะตอมคือ “20.”
แคลเซียมอิสระแทบจะไม่มีอยู่ในธรรมชาติเนื่องจากมีปฏิกิริยาสูง
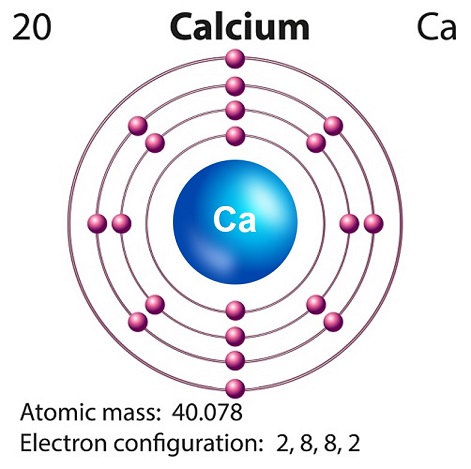
โดยปกติแล้วแคลเซียมจะเกิดจากการสังเคราะห์นิวเคลียสของซูเปอร์โนวา
คุณสมบัติเด่นของแคลเซียม
แคลเซียมเป็นโลหะที่มีมากที่สุดชนิดหนึ่งโดยมวลที่พบในสัตว์หลายชนิด
แคลเซียมเป็นส่วนประกอบที่สำคัญมากของฟันกระดูกและเปลือกหอย
แคลเซียมคาร์บอเนตและแคลเซียมซิเตรตเป็นผลิตภัณฑ์เสริมอาหารหลักที่จำเป็นสำหรับการมีสุขภาพที่ดี
องค์การอนามัยโลก (WHO) ระบุว่าแคลเซียมเป็นยาจำเป็น
เมื่อเปรียบเทียบกับโลหะอื่น ๆ แคลเซียมไอออนและสารประกอบแคลเซียมอื่น ๆ ส่วนใหญ่มีความเป็นพิษต่ำ
หากแคลเซียมสัมผัสกับน้ำหรือกรดจะทำปฏิกิริยากับสารเหล่านี้และกลายเป็นอันตราย
ถ้าแคลเซียมสัมผัสกับอากาศจะทำปฏิกิริยาอย่างรวดเร็วและก่อตัวเป็นแคลเซียมไนไตรด์และแคลเซียมออกไซด์เคลือบสีเทา - ขาว
โดยปกติเกลือแคลเซียมส่วนใหญ่จะไม่มีสี
เมื่อแคลเซียมถูกเผาสีของเปลวไฟจะปรากฏเป็นสีแดงอิฐ (ดูภาพด้านล่าง)

โลหะแคลเซียมมีความต้านทานไฟฟ้าสูงกว่าอลูมิเนียมหรือทองแดง
การเกิดขึ้น
แคลเซียมมักเกิดในหินตะกอน
แร่ธาตุ (ตะกอน) ที่แคลเซียมพบ ได้แก่ แคลไซต์โดโลไมต์และยิปซั่ม
แคลเซียมยังพบในหินอัคนีและหินแปรส่วนใหญ่อยู่ในแร่ซิลิเกตเช่นแอมฟิโบลพลาจิโอคลาเอสไพร็อกซีเนสและโกเมน
แคลเซียมยังพบในผลิตภัณฑ์อาหารหลายชนิดเช่นผลิตภัณฑ์จากนมอัลมอนด์เฮเซลนัทถั่วเหลืองบรอกโคลีใบแดนดิไลออนมะเดื่อและอื่น ๆ อีกมากมาย
สารประกอบของแคลเซียม
แคลเซียมออกไซด์- CaO
แคลเซียมไฮดรอกไซด์- Ca (OH) 2
แคลเซียมคลอไรด์- CaCl 2
แคลเซียมไฮโปคลอไรต์ (ผงฟอกสี) - Ca (ClO) 2
แคลเซียมฟอสเฟต- Ca 3 (PO 4 ) 2
การใช้แคลเซียม
แคลเซียมมีการใช้งานที่หลากหลายโดยที่สำคัญ ได้แก่ -
แคลเซียมคาร์บอเนต (CaCO 3 ) ใช้ในการผลิตปูนซีเมนต์
แคลเซียมคาร์บอเนต (CaCO 3 ) ยังใช้ในการทำยาสีฟัน
ในยาฆ่าแมลงจะใช้แคลเซียมอาร์ซีเนต (Ca 3 (AsO 4 ) 2 )
แคลเซียมคลอไรด์ (CaCl 2 ) ใช้ในการกำจัดน้ำแข็งและในการควบคุมฝุ่น
แคลเซียมซิเตรต (Ca 3 (C 6 H 5 O 7 ) 2 ) นิยมใช้เป็นสารถนอมอาหาร
แคลเซียมกลูโคเนต (Ca (C 6 H 11 O 7 ) 2 ) มักใช้เป็นวัตถุเจือปนอาหารเช่นเดียวกับยาเม็ดวิตามิน
แคลเซียมไฮโปคลอไรต์ (Ca (OCl) 2 ) มักใช้เป็นสารฆ่าเชื้อในสระว่ายน้ำเป็นสารฟอกขาว
บทนำ
โลหะที่มีคุณสมบัติเป็นโลหะสีเงิน - ขาวอ่อนไม่มีแม่เหล็กและโลหะเหนียวเรียกว่าอลูมิเนียม
สัญลักษณ์ของอลูมิเนียมคือ ‘Al’ และเลขอะตอมของมันคือ ‘13.’
อลูมิเนียมองค์ประกอบทางเคมีอยู่ในกลุ่มโบรอน

- บอกไซต์เป็นแร่หลักของอลูมิเนียม
คุณสมบัติเด่นของอลูมิเนียม
โลหะอลูมิเนียมเป็นองค์ประกอบที่มีปฏิกิริยาทางเคมี
อลูมิเนียมมีศักยภาพในการต้านทานการกัดกร่อนและกระบวนการของความต้านทานนี้เรียกว่าทู่
อลูมิเนียมเป็นโลหะที่มีความทนทานน้ำหนักเบาอ่อนตัวอ่อนและเหนียว
อลูมิเนียมไม่เป็นแม่เหล็กและไม่ติดไฟง่าย
ฟิล์มอลูมิเนียมเป็นตัวสะท้อนแสงที่มองเห็นได้ดีมากเนื่องจากสะท้อนรังสีที่เข้ามาได้มากกว่า 90 เปอร์เซ็นต์
โดยทั่วไปอลูมิเนียมจะทำปฏิกิริยากับน้ำและสร้างไฮโดรเจน
อลูมิเนียมเป็นโลหะที่มีความหนาแน่นต่ำและมีคุณสมบัติต้านทานการกัดกร่อน
อลูมิเนียมมีคุณสมบัติในการนำความร้อนและไฟฟ้าดังนั้นจึงเป็นตัวนำที่ดี
การเกิดอลูมิเนียม
อะลูมิเนียมประกอบขึ้นเป็น (ประมาณ) 8 เปอร์เซ็นต์ของเปลือกโลก
รองจากออกซิเจนและซิลิกอนอลูมิเนียมเป็นองค์ประกอบที่มีมากเป็นอันดับสาม อย่างไรก็ตามมันเป็นโลหะที่มีมากที่สุดในเปลือกโลก
เมื่อไฮโดรเจนหลอมรวมกับแมกนีเซียมจะสร้างอลูมิเนียมที่เสถียร
อลูมิเนียมพบได้ตามธรรมชาติในสถานะออกไซด์หรือซิลิเกต
สารประกอบอลูมิเนียม
ต่อไปนี้เป็นสารประกอบหลักของอลูมิเนียม -
อลูมินา- อัล2โอ3
อลูมิเนียมคลอไรด์- AlCl 3
อะลูมิเนียมซัลเฟต- Al 2 (SO 4 ) 3
อะลูมิเนียมไฮดรอกไซด์- Al (OH) 3
อะลูมิเนียมคาร์ไบด์- Al 4 C 3
การใช้อลูมิเนียม
อลูมิเนียมมีการใช้งานที่หลากหลายทั้งในอุตสาหกรรมและในชีวิตประจำวัน ที่สำคัญคือ -
อลูมิเนียมถูกนำมาใช้ในอุตสาหกรรมการขนส่งเช่นรถไฟรถยนต์เครื่องบินยานอวกาศรถบรรทุกเรือเดินทะเลจักรยานเป็นต้น
อลูมิเนียมใช้ในการบรรจุวัสดุเฉพาะบางชนิด
อลูมิเนียมใช้ในการก่อสร้างประตูหน้าต่างลวดอาคารปลอกหลังคา ฯลฯ
อลูมิเนียมส่วนใหญ่ใช้ในการทำสายไฟฟ้า
อลูมิเนียมใช้ในการทำเครื่องใช้ในบ้านและของใช้ในบ้านอื่น ๆ อีกมากมายเช่นเครื่องทำอาหาร
อลูมิเนียมใช้ในไม้เบสบอลนาฬิกาและของใช้ประเภทอื่น ๆ อีกมากมาย
อลูมิเนียมใช้ในอุปกรณ์ถ่ายภาพ
อลูมิเนียมใช้ในเครื่องใช้ไฟฟ้า
อลูมิเนียมใช้เป็นตัวสะท้อนแสงเนื่องจากเป็นตัวสะท้อนแสงที่ดี โดยพื้นฐานแล้ววัสดุบางส่วนเป็นอลูมิเนียมเคลือบพิเศษเพื่อสะท้อนแสง
อลูมิเนียมใช้ในการผลิตก๊าซไฮโดรเจนโดยทำปฏิกิริยากับกรดไฮโดรคลอริก
อลูมิเนียมใช้ในการผลิตเครื่องดนตรี
บทนำ
แมกนีเซียมเป็นองค์ประกอบของแข็งสีเทามันวาว
สัญลักษณ์ของแมกนีเซียมคือ ‘Mg’ และเลขอะตอมคือ ‘12.’

จีนเป็นผู้จัดหาแมกนีเซียมรายใหญ่ที่สุดด้วยส่วนแบ่งตลาดโลกประมาณ 80%
คุณสมบัติเด่นของแมกนีเซียม
ความหนาแน่นของแมกนีเซียมเป็นสองในสามของความหนาแน่นของอลูมิเนียม
ในบรรดาโลหะอัลคาไลทั้งหมดของโลกแมกนีเซียมมีจุดหลอมเหลวต่ำสุด (เช่นประมาณ 1,202 0 F) และจุดเดือดต่ำสุด (ประมาณ 1,994 0 F)
แมกนีเซียมมักจะทำปฏิกิริยากับน้ำที่อุณหภูมิห้อง
บางครั้งแมกนีเซียมยังใช้เป็นตัวจุดไฟสำหรับเทอร์ไมท์
แมกนีเซียมเมื่อเผาไหม้ในอากาศจะทำให้เกิดแสงสีขาวสดใสซึ่งรวมถึงความยาวคลื่นอัลตราไวโอเลตที่รุนแรงด้วย

แมกนีเซียมเมื่อถูกไฟไหม้จะทำให้เกิดแสงสีขาวสว่างจ้ามาก (ดูภาพด้านบน)
การเกิดแมกนีเซียม
โดยมวลแมกนีเซียมเป็นองค์ประกอบที่มีมากที่สุดอันดับ 8 ที่พบในเปลือกโลก
แมกนีเซียมมักพบในแหล่งแร่แมกนีเซียมโดโลไมต์และแร่ธาตุอื่น ๆ จำนวนมาก
แมกนีเซียมไอออนที่ละลายน้ำพบได้ในน้ำแร่
รองจากโซเดียมและคลอรีนแมกนีเซียมเป็นองค์ประกอบที่มีมากเป็นอันดับสามที่ละลายในน้ำทะเล
แมกนีเซียมเกิดขึ้นตามธรรมชาติร่วมกับองค์ประกอบอื่น ๆ เท่านั้น
โดยมวลแมกนีเซียมเป็น 11 THธาตุที่มีมากที่สุดในร่างกายมนุษย์และเป็นสิ่งจำเป็นที่เซลล์และเอนไซม์ทั้งหมด
ไอออนของแมกนีเซียมมักทำปฏิกิริยากับสารประกอบโพลีฟอสเฟตเช่น ATP, DNA และ RNA
สารประกอบของแมกนีเซียม
ต่อไปนี้เป็นสารประกอบหลักของแมกนีเซียม -
แมกนีเซียมคาร์บอเนต- MgCO 3
แมกนีเซียมคลอไรด์- MgCl 2
แมกนีเซียมซิเตรต- C 6 H 6 MgO 7
Magnesium hydroxide - Mg(OH)2
Magnesium oxide - MgO
Magnesium sulfate - MgSO4
Magnesium sulfate heptahydrate - (MgSO4·7H2O)
Magnesium sulfate heptahydrate is commonly known as Epsom salt.
Usages of Magnesium
Magnesium has wide range of usage in our lives; however, some significant usages of magnesium are −
After iron and aluminum, magnesium is third most commonly used element.
Magnesium is especially used in super-strong, lightweight materials, and alloys.
Magnesium is also used as engine materials in the aircraft industry.
Magnesium is also used to purify the solvents; such as in preparing the super-dry ethanol.
Many of the automotive big brands including Mercedes, Porsche, BMW, Volkswagen, Chevrolet, etc. use magnesium in making their highly quality cars.
Because of having low weight and good electrical and mechanical properties, magnesium is commonly used in manufacturing laptops and tablet computers, mobile phones, cameras, and many other electronic components.
Magnesium sulfite is usually used in manufacturing paper.
Introduction
Manganese is a chemical element that usually found in combination with the iron.
The symbol of manganese is ‘Mn’ and atomic number is ’25.’
Manganese is a metal very important for the industrial use.

In 1774, Johan Gottlieb Gahn, first time isolated an impure sample of manganese metal in 1774.
Features of Manganese
Following are the major features and characteristics of manganese −
Similar to iron, manganese is silvery-gray metal.
Manganese can be oxidized easily, but very difficult to fuse it, as it is very hard and brittle.
In air, manganese gets tarnished slowly (oxidization).
Manganese is an element, which is part of the iron group.
Occurrence of Manganese
Manganese is the 12th most abundant element of the earth’s crust.
Soil usually contains about 7–9000 ppm of manganese with an average of 440 ppm.
Seawater has only about 10 ppm manganese; whereas, the atmosphere contains about 0.01 µg/m3.
Pyrolusite (MnO2) is the most important ore of manganese.
Compounds of Manganese
Following are the major compounds of manganese −
Manganese (II) oxide - MnO
Manganese (I) oxide - Mn2O3
Manganese dioxide - MnO2
Manganese chloride - MnCl2
Potassium permanganate - KMnO4
Manganese (II) sulfate - MnSO4
Manganese (II) carbonate - MnCO3
Manganese (II) sulfide - MnS
Manganese (II) nitrate - Mn(NO3)2
Manganese (II) bromide - MnBr2
Manganese heptoxide - Mn2O7
Dimanganese decacarbonyl - C10O10Mn2
Manganese (II) iodide - MnI2
Manganese (II) fluoride - MnF2
Uses of Manganese
Following are the major uses of manganese −
Manganese is one of the most essential constituents of steel production.
Manganese phosphating is commonly used for the rust and corrosion prevention on steel.
In biology, manganese(II) ions act as cofactors for the large variety of enzymes.
Manganese is also important in the oxygen-evolving phenomenon of photosynthetic plants.
Manganese dioxide is also used in the manufacture of oxygen and chlorine and in drying black paints.
Introduction
Iron is the most common element found in largely in outer as well inner core of the earth.
The symbol of iron is ‘Fe’ and atomic number is ‘26.’

Iron is one of the earliest known elements that is being used by human beings.
Salient Features of Iron
Following are the major features of iron −
Pure iron element is soft, ductile, and malleable.
The boiling point of iron ranges between 15330C and 24500C.
Iron easily gets attracted towards magnet.
In dry air, iron remains inactive and does not react (with air); however, in moist air, it reacts and forms rust.
Pure iron normally does not react with pure water; however, it reacts easily with ordinary of polluted water and rust forms.
Iron reacts with halogen and Sulphur to form halide and sulphide accordingly.
Occurrence of Iron
The inner and outer cores of the earth are largely made up of iron and nickel.
Most likely, iron is the most abundantly available element of the earth; however, it is the fourth most abundantly available element of the crust.
Types of Iron
Following are the major types iron −
Hematite - Fe2O3
Magnetite - Fe3O4
Siderite - FeCO3
Compounds of Iron
Following are the major compounds of iron −
Iron (II) oxide - FeO
Iron (III) chloride - FeCl3
Iron (III) oxide-hydroxide - Fe(OH)3
Iron (II) sulfide - FeS
Iron (II) chloride - FeCl2
Iron phosphate - FePO4
Ferrate (VI) - (FeO4)2-
Iron (II) acetate - Fe(C2H3O2)2
Iron (III) sulfide - Fe2S3
Iron (III) chromate - Fe2(CrO4)3
Iron (II) hydroxide - Fe(OH)2
Iron (III) acetate - C14H27Fe3O
Iron (II) oxalate - FeC2O4
Iron (II) fluride - FeF2
Uses of Iron
Among all the metals, iron is most widely used (about 90 percent of world’s total metal production).
In most of the heavy industries, iron is the most essential element.
Industries like railway, ship building, automobile, engineering construction, etc., everywhere, iron is essentially required.
Introduction
Copper is a soft, ductile, and malleable metal.
Copper has very high thermal and electrical conductivity.
The symbol of copper is ‘Cu’ and atomic number is ’29.’

Copper is known to people since (about) c. 8000 BC.
Copper is the first metal, which was smelted from its ore around c. 5000 BC.
Salient Features of Copper
Copper was the first metal that cast into a shape (in a mold).
Copper was the first metal that successful alloyed with another metal, e.g. copper alloyed with tin and resultantly bronze is prepared. It is done about c. 3500 BC.
First metal to be purposefully alloyed with another metal, tin, to create bronze, c. 3500 BC.
Copper has a natural reddish-orange color; it is visible once the its surface is exposed.
Copper is a very good conductor of electricity and heat.
Copper is an element of group 11 of the periodic table.
Copper normally does not react with water; however, it does react slowly with atmospheric oxygen and form a layer of brown-black copper oxide.
The brown-black copper oxide usually protects the underlying metal from further corrosion just like passivation.
Passivation is a process of use of a light coat of a protective material, such as metal oxide, which is used to create a protective shell against the corrosion.
Occurrence of Copper
Copper is commonly found in the earth’s crust.
In 1857, the largest mass of elemental copper (weighing about 420 tones) discovered. It was found on the Keweenaw Peninsula located in Michigan, US.
Alloys of Copper
The metal alloys, which have the copper as their major constituent, is known as copper alloys.
Copper alloys are highly resistant to corrosion.
The best (traditional) example of copper alloy is bronze (made by mixing tin and brass).
Following are the major alloys of copper −
Brass
Bronze
Auricupride
Chinese silver
Corinthian bronze
Electrum, Green gold
Grey gold
Niello
Panchaloha
Rose, red, and pink gold
Spangold
Shibuichi
Tibetan silver
White gold
Compounds of Copper
Following are the major compounds of the copper −
Cupric acetate - Cu(CH3COO)2
Copper(I) oxide - Cu2O
Copper(II) oxide - CuO
Copper(II) chloride - CuCl2
Dicopper chloride trihydroxide - Cu2(OH)3Cl
Copper(I) chloride - CuCl
Copper(II) nitrate - Cu(NO3)2
Copper Cyanide - CuCN
Uses of Copper
Copper is largely used in making electric wires.
Copper is used in electric motors.
Copper is used in roofing, plumbing, and in many other industries.
Copper paint is used in painting boats and many other materials.
Many of the home appliances are made up of either pure copper or its alloys.
Introduction
Silver is a soft, lustrous transition, and white metal.
Silver has the highest electrical and thermal conductivity; and, it has also the highest reflectivity of any metal.

The symbol of silver is ‘Ag’ and atomic number is ’47.’
Salient Features of Silver
Silver is a precious metal used since long time by human beings.
Silver is an element of group 11 of the periodic table.
Silver has an excellent white metallic luster commonly used in a high polish.
As silver has no color; therefore, it has high reflectivity (of light).
Silver has very high electrical and thermal conductivity. Its electric conductivity is the highest – higher than copper.
Among all the metals, silver also has the lowest contact resistance.
Occurrence of Silver
The metal silver is usually found in the Earth's crust in the pure form.
Silver also found as an alloy with the gold and some other metals.
Silver is also found in some minerals, such as argentite and chlorargyrite.
Silver is largely produced as a byproduct of gold, copper, zinc, lead, etc.
Alloys of Silver
Following are the major alloys of silver −
Argentium sterling silver
Britannia silver
Doré bullion
Electrum
Goloid
Platinum sterling
Sterling silver
Tibetan silver
Compounds of Silver
Following are the major compound of silver −
Silver chloride - AgCl
Silver iodide - Agl
Silver bromide - AgBr
Silver oxide - Ag2O
Silver sulfide - Ag2S
Silver fluoride - AgF
Silver cyanide - AgCN
Silver carbonate - Ag2CO3
Silver acetate - AgC2H3O2
Silver sulfate - Ag2SO4
Silver chromate - Ag2CrO4
Silver oxalate - Ag2C2O4
Silver chlorate - AgClO3
Uses of Silver
Following are the major uses of silver −
From the ancient period, silver is being used in making coins.
Silver is also used in making ornaments.
Many of the home pots and other utensils were also used to be made by silver.
Silver has also medicinal use, as it is used as an antibiotic coating in medical devices.
Because of having very high electric conductivity, silver is commonly used in some electronic devices.
Besides, silver has many other uses, such as in photography, in chemical equipment, nanoparticles, etc.
Introduction
Gold is a bright, reddish yellow, soft, dense, malleable, and ductile metal naturally found in the earth’s crust.
The symbol of gold is ‘Au’ and atomic number is ‘79.’

Gold is (chemically) a transition metal and belongs to group 11 of the periodic table.
Salient Features of Gold
Gold, which remains in a solid state under standard conditions, is the least reactive element.
Gold is resistant to most of the acids.
Gold does dissolve in aqua regia; aqua regia is a mixture of nitric acid and hydrochloric acid.
However, gold is insoluble in nitric acid.
Gold usually dissolves in alkaline solutions of cyanide.
Cyanide solutions are commonly used in mining and electroplating.
Gold also dissolves in mercury and forms ‘amalgam alloys.’
Gold does not react with oxygen at any temperature.
Occurrence of Gold
Gold commonly occurs as a free element i.e. in the natural form.
Gold occurs as nuggets or else found in in rocks, grains, in veins, and in some other alluvial deposits.
Gold also occurs in a solid solution forms with the native element such as silver (as electrum).
At some places, gold also naturally alloyed with copper and palladium.
Alloys of Gold
Following are the major alloys of gold −
Colored gold
Crown gold
Electrum
Rose gold
Tumbaga
White gold
Compounds of Gold
Following are the major compounds of the gold −
Gold (III) chloride - AuCl3
Gold (I) chloride - AuCl
Cyanide - CN
Chloroauric acid - HAuCl4
Gold (III) oxide - Au2O3
Gold bromide - AuBr
Aqua regia - HNO3+3HCl
Gold bromide - AuBr3
Gold (III) hydroxide - AuH3O3
Gold fluoride - AuF3
Gold (V) fluoride - AuF5
Gold sulfide - Au2S
Fulminating gold
Gold salts
Gold heptafluoride
Uses of Gold
Gold is one of the oldest elements that human being have been using for thousands of years.
As it is highly precious and provides a beautiful look, hence it is characteristically used in making ornaments.
As per the recent trend (of the world), about 50% gold is used in making jewelry, 40% used in investments, and remaining 10% is used in industry.
Introduction
Platinum is a malleable, ductile, dense, and highly unreactive chemical element.
The symbol of platinum is ‘Pt’ and its atomic number is ‘78.’

The name of platinum is derived from a Spanish term i.e. ‘platina,’ which means "little silver."
Platinum is the most precious and the rarest metal (element) on the earth.
Salient Features of Platinum
Following are the important features of the platinum −
Platinum is a silver white metal.
Platinum is an element of group 10 of the periodic table.
Platinum is one of the rarest elements in the crust of the earth.
Platinum is one of the least reactive elements.
Platinum has six natural isotopes.
Platinum is one of the most highly valuable and precious metals.
Platinum is characteristically resists corrosion in all conditions. Because of this reason, it is considered as noble metal.
Platinum is normally insoluble in nitric and hydrochloric acid, but dissolves in hot aqua regia.
After dissolving into the hot aqua regia, platinum gives aqueous chloroplatinic acid (see the image given below).

Occurrence of Platinum
Platinum is commonly found as the native (natural) platinum and as alloy with the other platinum-group.
Platinum usually occurs in the ores of nickel and copper.
Platinum also occurs naturally in the alluvial sands (commonly found in rivers).
Platinum occurs with the concentration of only (about) 0.005 ppm in the Earth's crust.
Alloys of Platinum
Platinum-iridium is one of the most significant alloys of platinum.
Compounds of Platinum
Following are the major compounds of platinum −
Platinum (II) chloride - Pt Cl2
Platinum (IV) chloride - PtCl4
Adam’s catalyst - PtO2
Platinum hexafluoride - PtF6
Potassium tetrachloropla - K2PtCl4
Krogmann’s salt - K2Pt(CN)4Br
Chloroplatinic acid - H2PtCl6
Sodium hexachloropl - Na2PtCl6
Aqua regia - HNO3+3HCl
Uses of Platinum
Platinum is used largely for vehicle emissions control devices.
Platinum is used in petroleum refining and many other chemical productions.
Platinum is used in electronic devices, such as in hard disk (drives).
Platinum is also used in jewelry.
Apart from all these usages, platinum is also used in medicine (anti-cancer drugs), glassmaking equipment, electrodes, turbine engines, investment, etc.
บทนำ
ในตารางธาตุสังกะสีเป็นองค์ประกอบแรกของกลุ่ม 12
สัญลักษณ์ของสังกะสีคือ ‘Zn’ และเลขอะตอมคือ ‘30.’
ในแง่ของความพร้อมสังกะสีเป็น 24 THธาตุที่มีมากที่สุดที่พบในเปลือกโลกและมันมีห้าไอโซโทป

แร่สังกะสีที่พบมากที่สุดคือสฟาเลอไรต์ (สังกะสีเบลนด์) ซึ่งเป็นแร่สังกะสีซัลไฟด์
Andreas Sigismund Marggraf นักเคมีชาวเยอรมันได้ค้นพบสังกะสีโลหะบริสุทธิ์เป็นครั้งแรกในปี 1746
ที่น่าสนใจคือนักเล่นแร่แปรธาตุเผาสังกะสีในอากาศและสร้างสิ่งที่แตกต่างออกไปและพวกเขาก็ตั้งชื่อสิ่งนั้น "philosopher's wool" หรือ "white snow.”
คุณสมบัติเด่นของสังกะสี
สีของสังกะสีเป็นสีขาวอมฟ้าและเป็นโลหะที่มีความมันวาวและมีเส้นผ่านศูนย์กลาง
โดยปกติโลหะสังกะสีจะแข็งและเปราะ อย่างไรก็ตามเมื่ออุณหภูมิเพิ่มขึ้นจาก 100 0 C ก็จะกลายเป็นอ่อนได้
เมื่ออุณหภูมิเพิ่มขึ้น 210 0 C โลหะสังกะสีจะเปราะอีกครั้งและสามารถบดได้ง่ายโดยการตี
สังกะสีเป็นสื่อนำไฟฟ้า
การเกิดสังกะสี
สังกะสีมักพบร่วมกับโลหะฐานอื่น ๆ เช่นทองแดงและตะกั่ว
Sphalerite เป็นรูปแบบของสังกะสีซัลไฟด์และเป็นแร่ที่ขุดได้มากที่สุด
Sphalerite มีสังกะสีประมาณ 60 ถึง 62%
โลหะผสมสังกะสี
ต่อไปนี้เป็นโลหะผสมที่สำคัญของสังกะสี -
Brass
เงินนิกเกิล
เงินเยอรมัน
สารประกอบสังกะสี
ต่อไปนี้เป็นสารประกอบหลักของสังกะสี -
สังกะสีออกไซด์- ZnO
สังกะสีซัลไฟด์- ZnS
สังกะสีเฮไลด์- ZnF 2
สังกะสีไนเตรต- Zn (NO 3 ) 2
สังกะสีคลอเรต- Zn (ClO 3 ) 2
สังกะสีซัลเฟต- ZnSO 4
สังกะสีฟอสเฟต- Zn 3 (PO 4 ) 2
สังกะสีโมลิบเดต- ZnMoO 4
สังกะสีโครเมต- ZnCrO 4
สังกะสีอาร์ซีไนต์- Zn (AsO 2 ) 2
สังกะสีอะซิเตท- Zn (O 2 CCH 3 ) 2
การใช้สังกะสี
สังกะสีเป็นหนึ่งในองค์ประกอบที่สำคัญที่สุดสำหรับสุขภาพของประชาชน
สังกะสีส่วนใหญ่ใช้เป็นสารป้องกันการกัดกร่อนและเคลือบวัสดุเหล็กและเหล็กกล้า
สังกะสีมักใช้เป็นขั้วบวกหรือเชื้อเพลิงของแบตเตอรี่สังกะสี - อากาศ
ซิงค์ออกไซด์ถูกนำมาใช้เป็นเม็ดสีขาวอย่างกว้างขวาง (ดูภาพด้านล่าง) ในสี

สังกะสีออกไซด์ยังใช้เป็นตัวเร่งปฏิกิริยาในการผลิตยาง
สังกะสีเป็นองค์ประกอบที่จำเป็นต่อสุขภาพของเราเป็นหลัก โดยปกติจะใช้เป็นวัสดุเสริมในรูปแบบเช่นสังกะสีออกไซด์สังกะสีอะซิเตตหรือสังกะสีกลูโคเนต
สังกะสีเป็นวัสดุต้านอนุมูลอิสระ
การขาดสังกะสีในร่างกายมนุษย์อาจทำให้เกิดโรคซึมเศร้าได้
หลังจากได้รับบาดเจ็บทางร่างกายสังกะสีจะถูกใช้เพื่อเร่งกระบวนการบำบัด
สังกะสีไพริไทโอนมักใช้ในแชมพูเพื่อป้องกันรังแค
Chelated สังกะสีมักใช้ในยาสีฟันและน้ำยาบ้วนปาก (ของเหลว) เนื่องจากช่วยป้องกันกลิ่นปาก
สังกะสียังช่วยปกป้องผิวจากการถูกแดดเผาดังนั้นจึงใช้ในโลชั่นบำรุงผิว
บทนำ
ปรอทเป็นองค์ประกอบทางเคมีซึ่งมักเรียกว่า 'quicksilver. '
เดิมปรอทมีชื่อเรียกว่าhydrargyrum. '
สัญลักษณ์ของปรอทคือ ‘Hg’ และเลขอะตอมคือ ‘80.’

เม็ดสีแดงถูกสกัดโดยการบดซินนาบาร์ธรรมชาติหรือเมอร์คิวริกซัลไฟด์สังเคราะห์
คุณสมบัติเด่นของปรอท
ปรอทเป็นโลหะหนักและสีเงิน
โดยปกติปรอทจะอยู่ในสถานะของเหลว ในสภาพปกติมันเป็นเพียงองค์ประกอบโลหะบางส่วนที่ยังคงอยู่ในสถานะของเหลวที่อุณหภูมิห้อง
ปรอทเป็นตัวนำความร้อนที่ไม่ดี แต่เป็นตัวนำไฟฟ้าที่ดี
จุดเยือกแข็งของปรอทคือ −38.83 0 C และจุดเดือดคือ 356.73 0 C
พิษของสารปรอทเกิดจากการกินปรอททุกรูปแบบ นอกจากนี้ยังเกิดจากการสูดดมไอปรอท
ปรอทละลายโลหะหลายชนิดรวมทั้งทองและเงินเพื่อสร้างอะมัลกัม
การเกิดขึ้นของดาวพุธ
ดาวพุธเป็นหนึ่งในองค์ประกอบที่หายากที่สุดในเปลือกโลก
แร่ปรอทที่ร่ำรวยที่สุดมีปรอทประมาณ 2.5 เปอร์เซ็นต์ (ในแง่ของมวล)
สารปรอทพบได้ทั้งในแร่ธาตุพื้นเมือง (ตามธรรมชาติ) หรือในแร่ corderoite, ชาด, ลิฟวิงสตัน ฯลฯ
พบดาวพุธบริเวณแถบภูเขาเล็ก สายพานที่บังคับให้หินที่หนาแน่นขึ้นกับเปลือกโลก ตัวอย่างเช่นภูมิภาคภูเขาไฟหรือแม้แต่พื้นที่น้ำพุร้อน
โลหะผสมของปรอท
อมัลกัมเป็นโลหะผสมหลักของปรอท
สารประกอบของปรอท
ต่อไปนี้เป็นสารประกอบหลักของปรอท -
ปรอท (II) คลอไรด์- HgCl 2
ปรอท (II) ออกไซด์- HgO
ปรอทซัลไฟด์- HgS
ปรอท (I) - คลอไรด์- Hg 2 Cl 2
ไดเมทิลเมอร์- C 2 H 6 Hg
ปรอท (II) ไนเตรต- Hg (NO 3 ) 2
ปรอท (II) อะซิเตท- C 4 H 6 O 4 Hg
ปรอท (II) ซัลเฟต- HgSO 4
ปรอท (I) ไอโอไดด์- Hg 2 I 2
สารปรอทซีลีไนด์- HgSe
ปรอท (II) ฟูลมิเนต- Hg (CNO) 2
สารปรอท (II) โบรไมด์- HgBr 2
ปรอท (II) ไอโอไดด์- HgI 2
ปรอท (I) ออกไซด์- Hg 2 O
ปรอท (I) ฟลูออไรด์- Hg 2 F 2
Mercuric อะมิโดคลอไรด์- ClH 2 HgN
ไดเอทิลเมอร์คิวรี่- C 4 H 10 Hg
การใช้สารปรอท
สารปรอทส่วนใหญ่ใช้ในอุตสาหกรรมเคมี
ปรอทใช้ในงานไฟฟ้าและอิเล็กทรอนิกส์
ปรอทถูกใช้ในเทอร์มอมิเตอร์ที่เราใช้วัดอุณหภูมิ
สารปรอทพร้อมกับสารประกอบมักใช้ในยาต่างๆ
บทนำ
พลูโตเนียมเป็นโลหะแอกทิไนด์และมีลักษณะเป็นสีเทาเงิน
ธาตุซึ่งมีเลขอะตอมอยู่ระหว่าง 89 ถึง 103 เรียกว่าธาตุแอกทิไนด์
สัญลักษณ์ของพลูโตเนียมคือ ‘Pu’ และเลขอะตอมคือ ‘94.’

โดยปกติพลูโตเนียมมีสารแอลโลโทรปหกชนิด
พลูโตเนียมตั้งชื่อตาม 'Pluto. '
พลูโตเนียมถูกค้นพบครั้งแรกในปี 2483 โดยกลุ่มนักวิทยาศาสตร์ ได้แก่ Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan และ Arthur C. Wahl
คุณสมบัติเด่นของพลูโตเนียม
พลูโตเนียมเป็นองค์ประกอบทางเคมีกัมมันตภาพรังสี
พลูโตเนียมเมื่อสัมผัสกับอากาศจะทำให้มัวหมองและเมื่อถูกออกซิไดซ์จะเกิดการเคลือบที่หมองคล้ำ
พลูโตเนียมทำปฏิกิริยากับธาตุหลายชนิดเช่นฮาโลเจนไนโตรเจนคาร์บอนซิลิกอนและไฮโดรเจน
เนื่องจากกระบวนการฟิชชันนิวตรอนจึงถูกปลดปล่อยออกมาและเปลี่ยนนิวเคลียสของยูเรเนียม -238 เป็นพลูโตเนียม -239
พลูโตเนียม -233 และพลูโตเนียม -224 ทั้งสองเป็นฟิสไซล์ดังนั้นจึงสามารถดำรงปฏิกิริยาลูกโซ่นิวเคลียร์ได้ สามารถใช้ได้ดีในอาวุธนิวเคลียร์และเครื่องปฏิกรณ์นิวเคลียร์
จุดหลอมเหลวของพลูโตเนียมคือ 640 0 C และจุดเดือดคือ 3,228 0 C
การปลดปล่อยนิวเคลียสของฮีเลียม (พลังงานสูง) เป็นรูปแบบการสลายกัมมันตภาพรังสีที่พบบ่อยที่สุดสำหรับพลูโตเนียม
การเกิดพลูโตเนียม
โดยธรรมชาติแล้วพลูโตเนียมจะพบในปริมาณร่องรอยภายในแหล่งสะสมของยูเรเนียมเท่านั้น
พลูโตเนียมยังถูกสกัดโดยการเผายูเรเนียม (ในขณะที่พัฒนาพลังงานนิวเคลียร์)
โลหะผสมของพลูโตเนียม
ต่อไปนี้เป็นโลหะผสมที่สำคัญของพลูโตเนียม -
พลูโตเนียม - แกลเลียมเป็นโลหะผสมที่สำคัญชนิดหนึ่งของพลูโตเนียมเช่นเดียวกับแกลเลียม
พลูโตเนียม - แกลเลียมถูกใช้ในหลุมอาวุธนิวเคลียร์
พลูโตเนียม - แกลเลียมมีคุณสมบัติในการขยายตัวทางความร้อนต่ำมาก
โลหะผสมอื่น ๆ ของพลูโตเนียม ได้แก่ -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
สารประกอบของพลูโตเนียม
พลูโตเนียม (IV) ออกไซด์- PuO 2
พลูโตเนียม (III) คลอไรด์- PuCl 3
พลูโตเนียมเตตระฟลูออไรด์- PuF 4
การใช้พลูโตเนียม
ไอโซโทปพลูโตเนียม -236 เป็นองค์ประกอบสำคัญอย่างหนึ่งในการพัฒนาอาวุธนิวเคลียร์
พลูโตเนียมถูกใช้เป็นเชื้อเพลิงในโรงไฟฟ้านิวเคลียร์
บทนำ
ยูเรเนียมเป็นโลหะของอนุกรมแอกติไนด์ของตารางธาตุ
สัญลักษณ์ของยูเรเนียมคือ ‘U’ และเลขอะตอมคือ ’92.’
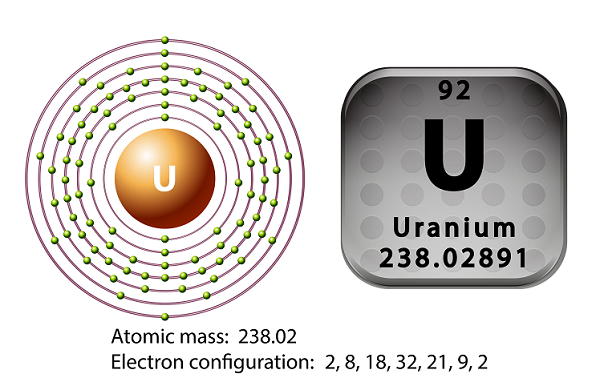
ในปี 1789 Martin Heinrich Klaproth ได้ค้นพบธาตุยูเรเนียมและตั้งชื่อตามชื่อของดาวยูเรนัส
คุณสมบัติเด่นของยูเรเนียม
ยูเรเนียมเป็นโลหะสีเงินสีขาว
อะตอมของยูเรเนียมมีอิเล็กตรอน 92 ตัวและโปรตอน 92 ตัวซึ่ง 6 ตัวเป็นเวเลนซ์อิเล็กตรอน
เนื่องจากมีไอโซโทปที่ไม่เสถียรยูเรเนียมจึงเป็นธาตุกัมมันตภาพรังสีที่อ่อนแอ
ยูเรเนียม -238 เป็นไอโซโทปที่พบมากที่สุดของยูเรเนียม
ยูเรเนียมเกิดขึ้นตามธรรมชาติในความเข้มข้นต่ำมากคือไม่กี่ส่วนต่อล้านในหินดินและน้ำ
ยูเรเนียมจะสลายตัวทีละน้อย (อย่างช้าๆ) โดยการปล่อยอนุภาคแอลฟาออกมา
ยูเรเนียมมีการนำไฟฟ้าต่ำ (ตัวนำไฟฟ้าไม่ดี)
ยูเรเนียมเป็นพาราแมกเนติกที่อ่อนตัวได้เหนียวและเล็กน้อย
การเกิดยูเรเนียม
ยูเรเนียม (ตามธรรมชาติ) พบเป็นยูเรเนียม -238 ยูเรเนียม -235 และยูเรเนียม -233
ครึ่งชีวิตของยูเรเนียม -238 นั้นมีอายุเกือบเท่ากับโลกประมาณ 4.47 พันล้านปีและครึ่งชีวิตของยูเรเนียม -235 อยู่ที่ประมาณ 704 ล้านปี
โลหะผสมของยูเรเนียม
ต่อไปนี้เป็นโลหะผสมที่สำคัญของยูเรเนียม -
Staballoy
ยูเรเนียมไฮไดรด์
สารประกอบของยูเรเนียม
ต่อไปนี้เป็นสารประกอบหลักของยูเรเนียม -
ยูเรเนียมไนไตรด์- U 2 N 3
ยูเรเนียมเพนตาฟลูออไรด์- UF 5
ยูเรเนียมคาร์ไบด์- UC
ยูรานิลฟลูออไรด์- UO 2 F 2
ยูเรเนียมไดออกไซด์- UO 2
ยูเรเนียมเฮกซาฟลูออไรด์- UF 6
ไตรยูเรเนียมออกไซด์- U 3 O 8
ยูเรเนียมเตตระฟลูออไรด์- UF 4
ยูเรเนียมไตรออกไซด์- UO 3
ยูเรเนียมเตตระคลอไรด์- Ucl 4
ยูรานิลไนเตรต- UO 2 (NO 3 ) 2
การใช้ยูเรเนียม
ยูเรเนียมใช้เป็นแหล่งพลังงานในเรือดำน้ำนิวเคลียร์ (โดยเฉพาะทางทหาร)
ยูเรเนียมใช้ในการผลิตอาวุธนิวเคลียร์
ยูเรเนียมยังใช้เป็นบัลลาสต์สำหรับเรือ
บทนำ
ตะกั่วเป็นองค์ประกอบทางเคมีหนัก (โลหะ) กล่าวคือมีความหนาแน่นสูง
สัญลักษณ์ของตะกั่วคือ ‘Pb’ และเลขอะตอมคือ ‘82.’

ตะกั่วมีแนวโน้มที่จะผูกมัดตัวเอง ในทำนองเดียวกันมันสามารถสร้างโซ่พันธะวงแหวนและโครงสร้างหลายเหลี่ยม
คุณลักษณะเด่นของตะกั่ว
ตะกั่วเป็นโลหะอ่อนและอ่อนได้ มีจุดหลอมเหลวค่อนข้างต่ำ
ตะกั่วเป็นองค์ประกอบที่ไม่เกิดปฏิกิริยาและมีแนวโน้มที่จะสร้างพันธสัญญา
เมื่อตัดตะกั่วจะปรากฏเป็นสีขาวอมฟ้า
ขณะเผาไหม้ตะกั่วจะให้เปลวไฟสีขาวอมฟ้า (ดูภาพด้านล่าง)

โดยทั่วไปสารประกอบของตะกั่วจะพบในสถานะออกซิเดชัน +2
การเกิดตะกั่ว
สารตะกั่วเป็นที่รู้จักของคนก่อนประวัติศาสตร์ในเอเชียตะวันตก
พบสารตะกั่วในเปลือกโลก แทบจะไม่พบในส่วนลึกของโลก
มักพบสารตะกั่วร่วมกับกำมะถัน
Galena เป็นแร่ที่มีตะกั่วเป็นส่วนประกอบหลักซึ่งส่วนใหญ่พบในแร่สังกะสี
โลหะผสมของตะกั่ว
ต่อไปนี้เป็นโลหะผสมที่สำคัญของตะกั่ว -
Molybdochalkos (ทองแดง)
บัดกรี (ดีบุก)
Terne (ดีบุก)
สารประกอบของตะกั่ว
ต่อไปนี้เป็นสารประกอบหลักของตะกั่ว -
ตะกั่วมอนอกไซด์- PbO
ตะกั่วไดออกไซด์- PbO 2
การใช้ตะกั่ว
มีการใช้ตะกั่วในการทำหัวกระสุนมานานหลายร้อยปี
ตะกั่วมักใช้เป็นปลอกป้องกันสำหรับสายเคเบิลใต้น้ำ (เฉพาะเนื่องจากมีคุณสมบัติในการต้านทานการกัดกร่อน)
แผ่นตะกั่วยังใช้เป็นโลหะทางสถาปัตยกรรมโดยเฉพาะในวัสดุมุงหลังคา
ตะกั่วยังใช้ในแบตเตอรี่กรด
สารประกอบของตะกั่วมักเป็นสารให้สีและสารกึ่งตัวนำ
สารประกอบตะกั่วยังใช้ในพลาสติกเทียนแก้ว ฯลฯ
ตะกั่วมักใช้ในโพลีไวนิลคลอไรด์ (เช่นใช้ในการเคลือบสายไฟฟ้า)
ข้อควรระวังล่วงหน้า
การมีตะกั่ว (ในคุณภาพที่มากเกินไป) ในร่างกายอาจทำให้เกิดความเสียหายอย่างรุนแรงต่อสมองและไต มันอาจทำให้เสียชีวิตในที่สุด
บทนำ
ทอเรียมเป็นหนึ่งในโลหะแอกทิไนด์กัมมันตภาพรังสีที่เกิดขึ้นตามธรรมชาติในปริมาณมาก
สัญลักษณ์ของทอเรียมคือ ‘Th’ และเลขอะตอมคือ ’90.’

ในปี พ.ศ. 2372 มอร์เทนเธราเนเอสมาร์กนักแร่วิทยาชาวนอร์เวย์ได้ค้นพบทอเรียมเป็นครั้งแรก
Jöns Jacob Berzelius นักเคมีชาวสวีเดนระบุและตั้งชื่อมันว่า 'ทอเรียม' ตามชื่อ 'ธ อร์' เทพเจ้าแห่งฟ้าร้องของชาวนอร์ส
คุณสมบัติเด่นของทอเรียม
ทอเรียมเป็นโลหะแอกทิไนด์กัมมันตภาพรังสีพาราแมกเนติกและอ่อนนุ่ม
สีของโลหะทอเรียมเป็นสีเงิน เมื่อสัมผัสกับอากาศจะทำให้มัวหมองเป็นสีดำและก่อตัวเป็นไดออกไซด์
ไอโซโทปทั้งหมดของทอเรียมไม่เสถียรและเป็นธาตุกัมมันตภาพรังสีอ่อน ๆ
ในบรรดาธาตุกัมมันตภาพรังสีที่สำคัญทั้งหมดครึ่งชีวิตของทอเรียมนั้นยาวนานที่สุดคือประมาณ 14.05 พันล้านปี
จุดหลอมเหลวของทอเรียมอยู่ที่ประมาณ 1750 0 C
การเกิดทอเรียม
ทอเรียมเป็นองค์ประกอบดั้งเดิมที่มีอยู่ในรูปแบบปัจจุบันตั้งแต่ก่อนที่โลกจะก่อตัวขึ้น
ทอเรียมที่พบในเปลือกโลกถูกกลั่นจากทรายโมนาไซท์
Monazite ที่เกิดขึ้นในปริมาณมากทั่วโลกเป็นแหล่งที่สำคัญที่สุดของทอเรียม
โลหะผสมของทอเรียม
Mag-Thor และทอเรียม - อลูมิเนียมเป็นโลหะผสมที่สำคัญที่สุดของทอเรียมแมกนีเซียมและอลูมิเนียม
สารประกอบของทอเรียม
ต่อไปนี้เป็นสารประกอบหลักของทอเรียม -
ทอเรียมไดออกไซด์- ThO 2
ทอเรียม (IV) ซัลไฟด์- ThS 2
ทอเรียม (IV) ไอโอไดด์- ThI 4
ทอเรียมเตตระฟลูออไรด์- ThF 4
ทอเรียม (IV คลอไรด์- ThCl 4
ทอเรียม (IV) คาร์ไบด์- ThC
บางคนมี -
Thorite
ทอเรียม (IV) ไนเตรต
ทอเรียม (IV) orthosilicate
การใช้ทอเรียม
โดยปกติทอเรียมจะใช้ในการเชื่อมอาร์กทังสเตนแก๊ส (GTAW) เนื่องจาก (ทอเรียม) จะเพิ่มความแข็งแรงที่อุณหภูมิสูงของอิเล็กโทรดทังสเตนและปรับปรุงเสถียรภาพของส่วนโค้ง
ในอุปกรณ์อิเล็กทรอนิกส์การเคลือบทอเรียมบนลวดทังสเตนช่วยเพิ่มการปล่อยอิเล็กตรอนของแคโทดที่ให้ความร้อน
ในอุตสาหกรรมเคมีไดออกไซด์ของทอเรียม ได้แก่ ‘thoria’ มักใช้
บทนำ
ในตารางธาตุไฮโดรเจนเป็นธาตุที่เบาที่สุดน้ำหนักอะตอมเท่ากับ 1.008 เท่านั้น
สัญลักษณ์ของไฮโดรเจนคือ ‘H’ และเลขอะตอมคือ ‘1.’

ในช่วงต้นยุค 16 THศตวรรษก๊าซไฮโดรเจนเป็นครั้งแรกเทียมที่ผลิตจากปฏิกิริยาของกรดและโลหะ
เฮนรีคาเวนดิชยอมรับครั้งแรกว่าก๊าซไฮโดรเจนเป็นสารที่ไม่ต่อเนื่องในช่วงปี ค.ศ. 1766-81 เนื่องจากผลิตน้ำเมื่อถูกเผาไหม้
คุณสมบัติเด่นของไฮโดรเจน
ในสถานะพลาสม่าของพวกมันดาวฤกษ์ที่ไม่เหลืออยู่ประกอบด้วยไฮโดรเจนเป็นหลัก
ที่อุณหภูมิและความดันมาตรฐานไฮโดรเจนจะไม่มีสีไม่มีรสไม่มีกลิ่นไม่มีโลหะไม่มีพิษและก๊าซไดอะตอมที่ติดไฟได้สูง
สูตรโมเลกุลของไฮโดรเจนเป็น H 2
บนโลกไฮโดรเจนมีอยู่ในรูปแบบโมเลกุลตัวอย่างเช่นน้ำหรือสารประกอบอินทรีย์อื่น ๆ
ไฮโดรเจนยังมีบทบาทสำคัญในปฏิกิริยากรด - เบส
ก๊าซไฮโดรเจนเป็นก๊าซไวไฟสูงในอากาศ
เปลวไฟไฮโดรเจน - ออกซิเจนบริสุทธิ์แผ่แสงอัลตราไวโอเลต ยิ่งไปกว่านั้นการผสมออกซิเจนสูงแทบจะมองไม่เห็นด้วยตาเปล่า
ไฮโดรเจนสามารถทำปฏิกิริยากับเกือบทุกองค์ประกอบที่ออกซิไดซ์
ที่อุณหภูมิห้องโดยปกติไฮโดรเจนจะทำปฏิกิริยากับคลอรีนและฟลูออรีนตามธรรมชาติและก่อตัวเป็นไฮโดรเจนเฮไลด์ที่สอดคล้องกัน
การเกิดไฮโดรเจน
ประกอบด้วยประมาณ 75 เปอร์เซ็นต์ของมวลแบริโอนิกทั้งหมดไฮโดรเจนเป็นสารเคมีที่พบมากที่สุดในจักรวาล
ทั่วทั้งจักรวาลโดยทั่วไปแล้วไฮโดรเจนจะพบในสถานะของอะตอมและพลาสมา อย่างไรก็ตามคุณสมบัติค่อนข้างแตกต่างจากโมเลกุลของไฮโดรเจน
บนโลกไฮโดรเจนอยู่เป็นก๊าซอะตอมสองอะตอมคือ H 2
เนื่องจากมีน้ำหนักเบาไฮโดรเจนจึงหลุดออกจากชั้นบรรยากาศของโลกได้อย่างง่ายดาย
ไฮโดรเจนเป็นองค์ประกอบที่มีมากเป็นอันดับสามที่พบบนพื้นผิวโลก แต่ส่วนใหญ่พบในรูปของไฮโดรคาร์บอนและน้ำ
สารประกอบของไฮโดรเจน
ต่อไปนี้เป็นสารประกอบหลักของไฮโดรเจน -
น้ำ- H 2 O
แอมโมเนีย- NH 3
ไฮโดรเจนคลอไรด์- HCl
ไฮโดรเจนฟลูออไรด์- HF
ไฮโดรเจนซัลไฟด์- H 2 S
มีเทน- CH 4
ไฮดรอกไซด์- OH -
ไฮโดรเจนโบรไมด์- HBr
ไฮโดรเจนไอโอไดด์- HI
ไฮโดรเจนไซยาไนด์- HCN
ฟอสฟีน- PH 3
ไฮโดรเจนซีลีไนด์- H 2 Se
เมทานอล- CH 3 OH
ลิเธียมไฮไดรด์- LiH
ไบคาร์บอเนต- HCO 3
ไฮโดรเจนเทลลูไรด์- H 2 Te
ไฮโดรเจนเหลว- H 2
ไซยาไนด์- CN
แคลเซียมไฮไดรด์- CaH 2
น้ำหนัก- D 2 O
ไดโบราเน- B 2 H 6
โซเดียมไฮไดรด์- NaH
โพแทสเซียมไฮไดรด์- KH
การใช้ไฮโดรเจน
H 2จำนวนมากที่สุดถูกใช้ในกระบวนการผลิตเชื้อเพลิงฟอสซิลและในการผลิตแอมโมเนีย
ไฮโดรเจน (H 2 ) ถูกใช้อย่างกว้างขวางในอุตสาหกรรมปิโตรเลียมและเคมี
โดยทั่วไปแล้วH 2จะใช้เป็นสารเติมไฮโดรเจนโดยเฉพาะอย่างยิ่งในการเพิ่มระดับความอิ่มตัวของไขมันและน้ำมันไม่อิ่มตัว
H 2ยังใช้เป็นก๊าซป้องกันในขั้นตอนการเชื่อมเช่นการเชื่อมอะตอมไฮโดรเจนเป็นต้น
บทนำ
ฮีเลียมเป็นธาตุที่มีน้ำหนักเบาที่สุดเป็นอันดับสอง (รองจากไฮโดรเจน) และมีธาตุมากเป็นอันดับสองในจักรวาล
สัญลักษณ์ของฮีเลียมคือ ‘He’ และเลขอะตอมคือ ‘2.’

ในตารางธาตุฮีเลียมเป็นกลุ่มแรกในกลุ่มก๊าซมีตระกูล
ฮีเลียมได้รับการตั้งชื่อตามชื่อของเทพเจ้าแห่งดวงอาทิตย์ของกรีก 'Helios. '
คุณสมบัติเด่นของฮีเลียม
ฮีเลียมเป็นก๊าซที่ไม่มีสีไม่มีกลิ่นรสจืดเฉื่อยไม่เป็นพิษและเป็นก๊าซเชิงเดี่ยว
จุดเดือด (-268.9 0 C) ของฮีเลียมต่ำที่สุดในบรรดาองค์ประกอบทั้งหมด
โดยทั่วไปฮีเลียมประกอบด้วยอิเล็กตรอนสองตัวในวงโคจรของอะตอมและล้อมรอบด้วยนิวเคลียสซึ่งประกอบด้วยโปรตอนสองตัวและนิวตรอนสองตัว
การเกิดฮีเลียม
ฮีเลียมส่วนใหญ่ที่พบในจักรวาลเป็นของ helium-4และเชื่อกันว่าก่อตัวขึ้นในช่วงบิ๊กแบง
ส่วนแบ่งหลักของฮีเลียมใหม่มักถูกสร้างขึ้นโดยการหลอมรวมนิวเคลียร์ของไฮโดรเจนในดาวฤกษ์รวมทั้งดวงอาทิตย์ด้วย
แม้ว่าจะมีการสร้างฮีเลียมใหม่อย่างต่อเนื่อง อย่างไรก็ตามความพร้อมใช้งานของฮีเลียมบนโลกนั้นต่ำมากเนื่องจากเป็นองค์ประกอบที่มีน้ำหนักเบาจึงหลุดออกไปในอวกาศได้ง่าย
ในเฮเทอโรสเฟียร์ (บรรยากาศชั้นนอก) ของโลกฮีเลียมเป็นองค์ประกอบ (ก๊าซ) ที่พบมากที่สุดชนิดหนึ่ง
ในเปลือกโลกฮีเลียมพบได้ในปริมาณมากในแร่ธาตุของยูเรเนียมและทอเรียม
สารประกอบของฮีเลียม
ต่อไปนี้เป็นสารประกอบหลักของฮีเลียม -
ไดโซเดียมเฮไลด์- นา2เขา
Cristobalite He II (ซิลิเกต) - SiO 2 He
Dihelium arsenolite - As 4 O 6 • 2He
ไอโซโทปของฮีเลียม
มีไอโซโทปของฮีเลียมอยู่ประมาณ 9 ไอโซโทป แต่ต่อไปนี้เป็นไอโซโทปที่เสถียรที่สุด -
ฮีเลียม -3 และ
Helium-4
การใช้ฮีเลียม
เนื่องจากมีความหนาแน่นต่ำจุดเดือดต่ำความสามารถในการละลายต่ำการนำความร้อนสูงจึงใช้องค์ประกอบฮีเลียม ตัวอย่างที่นิยมมากที่สุดคือ - การใช้ฮีเลียมในบอลลูน
ฮีเลียมส่วนใหญ่มีการใช้งานด้านการแช่แข็งเช่นการระบายความร้อนของแม่เหล็กตัวนำยิ่งยวดที่ใช้ในเครื่องสแกน MRI ทางการแพทย์และเครื่องสเปกโตรมิเตอร์ NMR
ฮีเลียมยังใช้เป็นก๊าซป้องกันในการเจริญเติบโตของผลึกซิลิกอนและเจอร์เมเนียม
ฮีเลียมยังใช้ในและโครมาโตกราฟีของแก๊สและในการผลิตไทเทเนียมและเซอร์โคเนียม
ฮีเลียมถูกใช้ในอุโมงค์ลมความเร็วเหนือเสียง
ฮีเลียมยังใช้เป็นก๊าซป้องกันในกระบวนการเชื่อมอาร์ก
บทนำ
ออกซิเจนเป็นสมาชิกของกลุ่ม 16 ในตารางธาตุ อย่างไรก็ตามโดยส่วนใหญ่แล้วจะได้รับการปฏิบัติที่แตกต่างจากกลุ่ม
สัญลักษณ์ของออกซิเจนคือ ‘O’ และเลขอะตอมคือ ‘8.’

ออกซิเจนมีประมาณ 9 allotropes และ allotrope ที่พบมากที่สุดคือออกซิเจนไดอะตอม (เช่น O 2 ) อัญรูปอื่น ๆ ที่สำคัญคือโอโซนคือ O 3
Carl Wilhelm Scheele เภสัชกรชาวสวีเดนสังเกตเห็นออกซิเจนเป็นครั้งแรก
คุณสมบัติเด่นของออกซิเจน
ออกซิเจนถูกจัดประเภทตามลักษณะเฉพาะเป็นสมาชิกของกลุ่ม "chalcogen"
คำว่า "chalcogen" มาจากคำภาษากรีก "khalkόs"ซึ่งหมายถึง" ทองแดง "และคำในภาษาละติน - กรีก"Genēs,” ซึ่งหมายถึงเกิดหรือผลิต
ออกซิเจนเป็นก๊าซที่มีปฏิกิริยาสูง (หรือองค์ประกอบที่ไม่ใช่โลหะ) ด้วยเหตุนี้จึงเป็นสารออกซิไดซ์ที่สร้างออกไซด์ได้ง่ายโดยมีองค์ประกอบและสารประกอบส่วนใหญ่
ออกซิเจนมีเวเลนซ์อิเล็กตรอนหกตัว
จุดหลอมเหลวของออกซิเจนคือ -218.8 0 C และจุดเดือดคือ -183 0 C
การเกิดออกซิเจน
ด้วยส่วนแบ่งประมาณ 20.8 เปอร์เซ็นต์ (ในองค์ประกอบชั้นบรรยากาศทั้งหมดของโลก) ออกซิเจนเป็นองค์ประกอบอันดับที่สองของชั้นบรรยากาศของโลก
ออกซิเจนเกิดขึ้นเกือบในทรงกลมของโลก ได้แก่ บรรยากาศไฮโดรสเฟียร์และลิโธสเฟียร์
ในระหว่างกระบวนการสังเคราะห์แสงพืชสีเขียวทั้งหมดผลิตออกซิเจนอิสระ
ออกซิเจนเกิดขึ้นเป็นแร่ทองแดงที่เป็นส่วนประกอบ
ร่างกายมนุษย์มีออกซิเจนประมาณ 65 เปอร์เซ็นต์
โดยมวลเกือบครึ่งหนึ่งของเปลือกโลกประกอบด้วยออกซิเจน (เช่นออกไซด์ของมัน)
โดยมวลออกซิเจนเป็นองค์ประกอบที่มีมากเป็นอันดับสามที่พบในเอกภพ ตัวแรกและตัวที่สองคือไฮโดรเจนและฮีเลียมตามลำดับ
ออกซิเจน (เช่น O 2 ) เป็นก๊าซไดอะตอมที่ไม่มีสีและไม่มีกลิ่น
ออกซิเจนละลายในน้ำได้ง่ายมาก อย่างไรก็ตามความสามารถในการละลายของออกซิเจนในน้ำขึ้นอยู่กับอุณหภูมิ
สารประกอบของออกซิเจน
ต่อไปนี้เป็นสารประกอบหลักของออกซิเจน -
Oxide
Peroxide
คาร์บอนไดออกไซด์- CO 2
ไฮดรอกไซด์- OH -
โอโซน- O 3
ปรอท (II) ออกไซด์- HgO
คลอเรต- ClO 3
อลูมิเนียมออกไซด์- Al 2 O 3
คาร์บอนมอนอกไซด์- CO
ไฮโปคลอไรต์- ClO -
ซิลิคอนไดออกไซด์- SiO 2
กรดไฮโปฟลูออเรส- HOF
โซเดียมเปอร์ออกไซด์- นา2โอ2
โพแทสเซียมคลอเรต- KClO 3
difluoride ออกซิเจน- ของ2
โซเดียมออกไซด์- Na 2 O
การใช้ออกซิเจน
ออกซิเจน (O 2 ) เป็นข้อกำหนดที่จำเป็นที่สุดสำหรับการหายใจหากไม่มีสิ่งนี้ชีวิตจะไม่สามารถจินตนาการได้
ออกซิเจนถูกใช้ในทางการแพทย์
โดยทั่วไปแล้วการบำบัดด้วยออกซิเจนจะใช้ในการรักษาโรคบางชนิดเช่นถุงลมโป่งพองปอดบวมความผิดปกติของหัวใจเป็นต้น
กิจกรรมใต้น้ำบางอย่างเช่นการดำน้ำลึกเรือดำน้ำ ฯลฯ ยังใช้ออกซิเจนเทียม

เครื่องบินนักปีนเขา ฯลฯ ยังใช้ออกซิเจนเทียม
ออกซิเจนยังใช้ในบางอุตสาหกรรมเช่นการถลุงแร่เหล็กเป็นเหล็กกล้า - ในกระบวนการนี้ใช้ออกซิเจนประมาณ 55%
บทนำ
คาร์บอนเป็นองค์ประกอบที่ไม่ใช่โลหะและเตตราวาเลนต์
Tetravalent หมายถึง - คาร์บอนทำให้อิเล็กตรอนสี่ตัวพร้อมใช้งานเพื่อสร้างพันธะเคมีโควาเลนต์
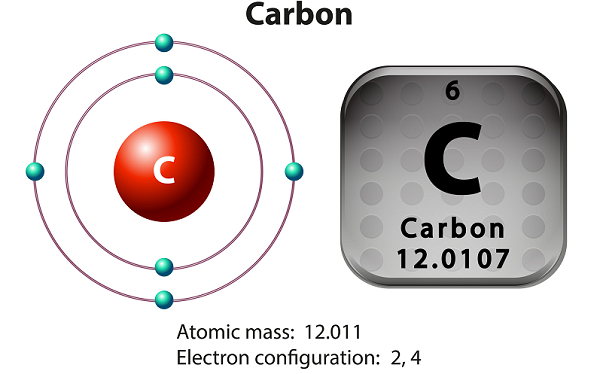
คาร์บอนมีสามไอโซโทปที่เกิดขึ้นเองตามธรรมชาติ ได้แก่12 C, 13 C และ14 C
ในหมู่พวกเขา12 C และ13 C มีความเสถียร แต่14 C เป็นไอโซโทปกัมมันตรังสี ครึ่งชีวิต14 C ประมาณ 5,730 ปี
คุณสมบัติเด่นของคาร์บอน
คุณสมบัติทางกายภาพของคาร์บอนส่วนใหญ่ขึ้นอยู่กับ allotropes
แอลโลโทรปที่สำคัญของคาร์บอน ได้แก่ กราไฟต์เพชรและคาร์บอนอสัณฐาน
กราไฟท์มีสีขุ่นดำและอ่อนนุ่มมาก ด้วยเหตุนี้จึงใช้เพื่อสร้างริ้วบนกระดาษ
เพชรแข็งมาก (วัสดุที่เกิดขึ้นเองตามธรรมชาติยากที่สุด) และโปร่งใส
กราไฟท์เป็นตัวนำไฟฟ้าที่ดี
เพชรเป็นตัวนำไฟฟ้าที่ไม่ดี
คาร์บอนมีจุดระเหิดสูงที่สุดในบรรดาองค์ประกอบทั้งหมด
การเกิดคาร์บอน
ในแง่ของมวลคาร์บอนเป็นองค์ประกอบทางเคมีที่พบมากเป็นอันดับสี่ในจักรวาล (รองจากไฮโดรเจนฮีเลียมและออกซิเจน)
คาร์บอนมีอยู่มากมายในดวงอาทิตย์ดวงดาวดาวหางและในชั้นบรรยากาศของดาวเคราะห์ส่วนใหญ่
คาร์บอนพบในชั้นบรรยากาศของโลกและละลายในน้ำ
ไฮโดรคาร์บอนเช่นถ่านหินปิโตรเลียมและก๊าซธรรมชาติทั้งหมดมีคาร์บอน
นอกจากนี้ยังพบคาร์บอนในมีเธนไฮเดรตซึ่งพบในบริเวณขั้วโลกและใต้ทะเล
หินบางส่วนที่อุดมด้วยคาร์บอน ได้แก่ ถ่านหินหินปูนโดโลไมต์เป็นต้น
ถ่านหินอุดมไปด้วยคาร์บอนมาก ด้วยเหตุนี้จึงเป็นแหล่งแร่คาร์บอนเชิงพาณิชย์ที่ใหญ่ที่สุด
ถ่านหินมีสัดส่วนประมาณ 4,000 กิกะตันหรือ 80% ของเชื้อเพลิงฟอสซิลทั้งหมด
สารประกอบของคาร์บอน
ต่อไปนี้เป็นสารประกอบหลักของคาร์บอน -
ไซยาโนเจน- CN 2
ไฮโดรเจนไซยาไนด์- HCN
ไซยาไนด์- CN 2 H 2
กรดไอโซไซยานิก- HNCO
ไซยาโนเจนคลอไรด์- CNCl
คลอโรซัลโฟนิลไอโซไซยาเนต- CNClO 3 S
ไซยานูริกคลอไรด์- NCCl 3
คาร์บอนไดซัลไฟด์- CS 2
คาร์บอนิลซัลไฟด์- โอซีเอ
คาร์บอนมอนอกไซด์- CS
การใช้คาร์บอน
คาร์บอนถูกใช้ในช่วงของการใช้งาน
คาร์บอนเป็นองค์ประกอบที่สำคัญที่สุดอย่างหนึ่งของชีวิตหากไม่มีมันเราไม่สามารถจินตนาการถึงสิ่งมีชีวิตบนโลกได้
เชื้อเพลิงฟอสซิล ได้แก่ ก๊าซมีเธนและน้ำมันดิบ (ปิโตรเลียม) ถ่านหินเป็นต้นใช้ในชีวิตประจำวัน
กราไฟท์รวมกับดินเหนียวใช้ในการทำ 'ตะกั่ว' ที่ใช้ในดินสอ
ถ่านยังใช้เป็นวัสดุวาดภาพในงานศิลปะการถลุงเหล็กการย่างบาร์บีคิว ฯลฯ
เพชรมักใช้ในเครื่องประดับ
เพชรอุตสาหกรรมใช้ในการตัดเจาะและขัดเครื่องมือสำหรับการตัดเฉือนโลหะและหิน
ฟอสซิลไฮโดรคาร์บอนและคาร์บอนไฟเบอร์ใช้ในการทำพลาสติก
บทนำ
ไนโตรเจนเป็นองค์ประกอบทางเคมีของกลุ่ม 15 ของตารางธาตุ ในบรรดาองค์ประกอบทั้งหมดของกลุ่ม 15 เป็นองค์ประกอบที่เบาที่สุด
สัญลักษณ์ของไนโตรเจนคือ ‘N’ และเลขอะตอมคือ 7.

ในปี 1772 Daniel Rutherford แพทย์ชาวสก็อตแลนด์ได้ค้นพบและแยกคาร์บอนได้เป็นครั้งแรก
อย่างไรก็ตามชื่อ 'ไนโตรเจน' เป็นครั้งแรกโดย Jean-Antoine-Claude Chaptal ในปี 1790
คุณสมบัติเด่นของไนโตรเจน
ไนโตรเจนมีไอโซโทปเสถียร 2 ชนิดคือ14 N และ15 N
โดยปกติแล้วอะตอมของไนโตรเจนอิสระจะทำปฏิกิริยากับธาตุส่วนใหญ่และสร้างไนไตรด์ได้อย่างง่ายดาย
โมเลกุลของ N 2ไม่มีสีไม่มีกลิ่นไม่มีรสและก๊าซไดอะแมกเนติกในสภาวะมาตรฐาน
จุดหลอมเหลวของ N 2คือ −210 0 C และจุดเดือดคือ −196 0 C
สารประกอบไนโตรเจนแลกเปลี่ยนซ้ำ ๆ กันระหว่างบรรยากาศและสิ่งมีชีวิตทำให้วัฏจักรไนโตรเจน
การเกิดไนโตรเจน
ไนโตรเจนเป็นองค์ประกอบที่พบได้มากที่สุดในโลกเนื่องจากมีปริมาณประมาณ 78.1% ของปริมาตรทั้งหมดของบรรยากาศโลก
ก๊าซไนโตรเจนซึ่งเป็นก๊าซอุตสาหกรรมส่วนใหญ่เกิดจากการกลั่นแบบเศษส่วนของอากาศเหลว
สารประกอบไนโตรเจน
ต่อไปนี้เป็นสารประกอบหลักของไนโตรเจน -
แอมโมเนียม- NH 4+
แอมโมเนีย- NH 3
กรดไนตริก- HNO 3
ไนไตรต์- NO 2-
ไนโตรเจนไดออกไซด์- NO 2
ไดไนโตรเจนเพนโทรไซด์- N 2 O 5
ไฮดราซีน- N 2 H 4
ไดไนโตรเจน- N 2
ไซยาไนด์- CN
แอมโมเนียมไนเตรต- (NH 4 ) (NO 3 )
ไนโตรเจนไตรคลอไรด์- NCl 3
ไนโตรเจนไตรฟลูออไรด์- NF 3
ไนโตรเจนไตรโอไดด์- NI 3
ไพริดีน- C 5 H 5 N
ไนโตรเนียมไอออน- NO 2+
กรดไฮดราโซอิก- HN 3
แอมโมเนียมซัลเฟต- (NH 4 ) 2 SO 4
การใช้ไนโตรเจน
สารประกอบไนโตรเจนถูกนำไปใช้อย่างกว้างขวางในหลากหลายสาขาและอุตสาหกรรม
ไนโตรเจนบริสุทธิ์ใช้เป็นวัตถุเจือปนอาหาร
ใช้ในระบบดับเพลิงโดยเฉพาะสำหรับอุปกรณ์เทคโนโลยีสารสนเทศ
ใช้ในการผลิตเหล็กกล้าไร้สนิม
ไนโตรเจนยังใช้ในการขยายยางของเครื่องบินและรถแข่งบางรุ่น
ไนโตรเจนเหลวใช้เป็นสารทำความเย็น
กฎของธรรมชาติที่เกี่ยวข้องกับเคมีเรียกว่ากฎทางเคมี
โดยปกติแล้วปฏิกิริยาเคมีจะดำเนินการโดยกฎหมายบางอย่างซึ่งสังเกตเห็นและกำหนดเป็นคำได้กลายเป็นแนวคิดพื้นฐานทางเคมี
ต่อไปนี้เป็นกฎหมายเคมีที่สำคัญ -
| กฎหมาย | คำอธิบาย |
|---|---|
| กฎหมายของ Avogadro | "ปริมาณก๊าซทั้งหมดที่อุณหภูมิและความดันเท่ากันมีจำนวนโมเลกุลเท่ากัน" |
| กฎหมายเบียร์ - แลมเบิร์ต (หรือกฎของเบียร์หรือกฎหมายแลมเบิร์ต - เบียร์) | “ อธิบายการลดทอนของแสงต่อคุณสมบัติของวัสดุที่ (แสง) ผ่าน” |
| กฎหมายของบอยล์ | “ ความดันสัมบูรณ์ที่กระทำโดยมวลที่กำหนดของก๊าซในอุดมคตินั้นแปรผกผันกับปริมาตรที่มีอยู่หากอุณหภูมิและปริมาณของก๊าซยังคงไม่เปลี่ยนแปลงภายในระบบปิด” |
| กฎของชาร์ลส์ (หรือที่เรียกว่ากฎแห่งปริมาตร) | “ เมื่อความดันของก๊าซแห้งตัวอย่างคงที่อุณหภูมิเคลวินและปริมาตรจะสัมพันธ์กันโดยตรง” |
| กฎแห่งการแพร่กระจายของฟิค | อธิบายถึง“ การแพร่กระจาย” (ของฟลักซ์) |
| กฎหมายของเกย์ - ลัสซัค | "ก๊าซทั้งหมดมีค่าการขยายตัวทางความร้อนเฉลี่ยเท่ากันที่ความดันคงที่ในช่วงอุณหภูมิเดียวกัน" |
| หลักการของ Le Chatelier ("กฎแห่งความสมดุล") | “ เมื่อระบบใด ๆ ที่สมดุลอยู่ภายใต้การเปลี่ยนแปลงของความเข้มข้นอุณหภูมิปริมาตรหรือความดันระบบจะปรับตัวเองใหม่เพื่อต่อต้าน (บางส่วน) ผลของการเปลี่ยนแปลงที่นำไปใช้และสร้างสมดุลใหม่” |
| กฎหมายของเฮนรี่ | "กฎหมายคำนวณความเข้มข้นของก๊าซในสารละลายภายใต้ความกดดัน" |
| กฎหมายของ Hess | “ การเปลี่ยนแปลงของเอนทาลปีในปฏิกิริยาเคมี (หมายถึงความร้อนของปฏิกิริยาที่ความดันคงที่) ไม่ขึ้นกับทางเดินระหว่างสถานะเริ่มต้นและสถานะสุดท้าย” |
| กฎหมายว่าด้วยการอนุรักษ์พลังงาน | “ พลังงานไม่สามารถสร้างหรือถูกทำลายได้” |
| กฎของ Raoult | "ความดันไอบางส่วนของส่วนประกอบแต่ละส่วนของของเหลวในอุดมคติจะเท่ากับความดันไอของส่วนประกอบบริสุทธิ์คูณด้วยเศษโมลในส่วนผสม" |
| กระแสไฟฟ้าตามกฎของฟาราเดย์ | “ ปริมาณของสารที่ผลิตที่ขั้วไฟฟ้าเป็นสัดส่วนโดยตรงกับปริมาณไฟฟ้าที่ส่งผ่าน” |
| ทฤษฎีอะตอม | “ สสารประกอบด้วยหน่วยที่แตกต่างกันซึ่งเรียกว่าอะตอม” |
| ทฤษฎีKöhler | “ อธิบายกระบวนการที่ไอน้ำรวมตัวและก่อตัวเป็นหยดของเหลว” |
| สมการของ Van 't Hoff | “ อธิบายการเปลี่ยนแปลงค่าคงที่สมดุลของปฏิกิริยาเคมี” |
| ทฤษฎีการเปลี่ยนสถานะ | “ อัตราการเกิดปฏิกิริยาเคมีเบื้องต้น” |
| Grotthuss – Draper Law | “ มันอธิบายว่าแสงที่ระบบ / พื้นผิวดูดซับสามารถทำให้เกิดการเปลี่ยนแปลงทางเคมีแสงได้” |
| ทฤษฎีจลน์ของก๊าซ | “ อธิบายพฤติกรรมของก๊าซในอุดมคติเชิงสมมุติ” |
| หลักการ Aufbau | “ อธิบายว่าอิเล็กตรอนที่โคจรรอบอะตอมก่อนจะเติมระดับพลังงานต่ำสุดจากนั้นจึงเพิ่มระดับที่สูงขึ้นเป็นอันดับสองไปเรื่อย ๆ ” |
| กฎของ Hund | “ อธิบายว่าทุกออร์บิทัลในระดับย่อยจะถูกครอบครองเดี่ยวก่อนที่ออร์บิทัลใด ๆ จะถูกครอบครองเป็นสองเท่า” |
| ทฤษฎีการชนกัน | “ ตามทฤษฎีจลน์ของก๊าซทฤษฎีการชนอธิบายว่าปฏิกิริยาเคมีเฟสของก๊าซเกิดขึ้นเมื่อโมเลกุลชนกันด้วยพลังงานจลน์ที่เพียงพอ” |
บทนำ
ทองแดงส่วนใหญ่เป็นองค์ประกอบแรกที่มนุษย์ขุดและใช้
พบหลักฐานการใช้ทองแดงที่เก่าแก่ที่สุดในอนาโตเลียซึ่งเป็นของ 6,000 ก่อนคริสตศักราช
ตะกั่วน่าจะเป็นองค์ประกอบที่สองที่มนุษย์เริ่มใช้
สิ่งประดิษฐ์ที่เก่าแก่ที่สุดที่รู้จักกันดีคือรูปปั้นซึ่งพบในวิหารของ Osiris, Abydos, Egypt
รูปปั้นของวิหาร Osiris เป็นของ (ประมาณ) 3,800 BCE
สมบัติทองคำที่เก่าแก่ที่สุดที่รู้จักถูกค้นพบในวาร์นาเนโครโพลิส (บัลแกเรีย)
สมบัติทองคำนี้เป็นของ (ประมาณ) 4,400 ก่อนคริสตศักราช
การค้นพบเงินเกือบจะเหมือนกับทองคำ พบหลักฐานในเอเชียไมเนอร์
หลักฐานบางอย่างกล่าวว่าเหล็กเป็นที่รู้จักจาก (ประมาณ) 5,000 คริสตศักราช
พบวัตถุเหล็กที่เก่าแก่ที่สุดที่มนุษย์ใช้ในอียิปต์ (เป็นของ 4000 ก่อนคริสตศักราช)
ตารางต่อไปนี้แสดงองค์ประกอบสำคัญพร้อมวันที่ค้นพบและการค้นพบ -
| ธาตุ | ผู้ค้นพบ | วันที่ค้นพบ |
|---|---|---|
| ทองแดง | ตะวันออกกลาง (สถานที่) | ประมาณ 9,000 คริสตศักราช |
| ตะกั่ว | อียิปต์ (สถานที่) | ประมาณ 7,000 ก่อนคริสตศักราช |
| ทอง | บัลแกเรีย (สถานที่) | ประมาณ 6,000 คริสตศักราช |
| เงิน | เอเชียไมเนอร์ (สถานที่) | ประมาณ 5,000 ก่อนคริสตศักราช |
| เหล็ก | อียิปต์ (สถานที่) | ประมาณ 5,000 ก่อนคริสตศักราช |
| ดีบุก | ประมาณ 3,500 ก่อนคริสตศักราช | |
| กำมะถัน | จีน / อินเดีย | ประมาณ 2,000 ก่อนคริสตศักราช |
| ปรอท | อียิปต์ | 2,000 ก่อนคริสตศักราช |
| ฟอสฟอรัส | เอชแบรนด์ | 1669 |
| โคบอลต์ | G. Brandt | 1735 |
| แพลตตินั่ม | A. de Ulloa | พ.ศ. 2291 |
| นิกเกิล | F. Cronstedt | พ.ศ. 2294 |
| บิสมัท | CF Geoffroy | พ.ศ. 2296 |
| แมกนีเซียม | เจแบล็ค | พ.ศ. 2298 |
| ไฮโดรเจน | เอชคาเวนดิช | พ.ศ. 2309 |
| ออกซิเจน | ว. ชีเล | พ.ศ. 2314 |
| ไนโตรเจน | ง. รัทเทอร์ฟอร์ด | พ.ศ. 2315 |
| แบเรียม | ว. ชีเล | พ.ศ. 2315 |
| คลอรีน | ว. ชีเล | พ.ศ. 2317 |
| แมงกานีส | ว. ชีเล | พ.ศ. 2317 |
| โมลิบดีนัม | ว. ชีเล | พ.ศ. 2324 |
| ทังสเตน | ว. ชีเล | พ.ศ. 2324 |
| เซอร์โคเนียม | เอช. Klaproth | พ.ศ. 2332 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Beryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Boron | L. Gay-Lussac and L.J. Thénard | 1808 |
| Fluorine | A. M. Ampère | 1810 |
| Iodine | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S. L Hermann, F. Stromeyer, and J.C.H. Roloff | 1817 |
| Selenium | J. Berzelius and G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | H.C.Ørsted | 1825 |
| Bromine | J. Balard and C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen and G. R. Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich and T. Richter | 1863 |
| Helium | P. Janssen and N. Lockyer | 1868 |
| Neon | W. Ramsay and W. Travers | 1898 |
| Xenon | W. Ramsay and W. Travers | 1898 |
| Fermium | A. Ghiorso et al | 1952 |
| Nobelium | E. D. Donets, V. A. Shchegolev and V. A. Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris and P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
The following table illustrates significant elements and their valence −
| Element | Valence | Symbol | Atomic No. |
|---|---|---|---|
| Hydrogen | -1, +1 | H | 1 |
| Helium | 0 | He | 2 |
| Lithium | 1 | Li | 3 |
| Beryllium | 2 | Be | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Carbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oxygen | -1, -2, 0, 2, 1, | O | 8 |
| Fluorine | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminum | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphorus | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlorine | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Ca | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganese | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Iron | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Copper | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | As | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Bromine | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |