Temel Elektronik - Malzemeler
Madde, atomlardan oluşan moleküllerden oluşur. Bohr'un teorisine göre, "atom, pozitif yüklü çekirdek ve çeşitli yörüngelerde çekirdek etrafında dönen bir dizi negatif yüklü elektrondan oluşur". Bir elektron daha düşük bir durumdan daha yüksek bir duruma yükseltildiğinde,excited. Heyecan verirken elektron çekirdekten tamamen çıkarılırsa atomun iyonize olduğu söylenir. Dolayısıyla atomu normal durumdan bu iyonize duruma yükseltme işlemineionization.
Aşağıdaki şekil bir atomun yapısını göstermektedir.
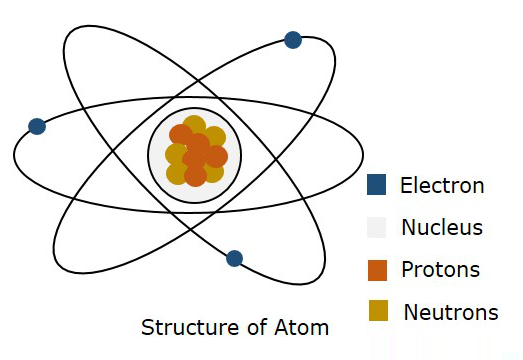
Bohr'un modeline göre, bir elektronun belirli bir OrbitKuantum mekaniğine göre, bir elektronun atomun boş uzayında bir yerde olduğu söylenir. Orbital. Bu kuantum mekaniği teorisinin doğru olduğu kanıtlandı. Bu nedenle, bir elektronun bulunmasının muhtemel olduğu üç boyutlu bir sınır olarak adlandırılır.Atomic Orbital.
Kuantum sayıları
Bir elektronun hareket ettiği her yörünge, enerjisi ve şekli bakımından farklılık gösterir. Orbitallerin enerji seviyeleri, kuantum sayıları olarak bilinen ayrık integraller ve yarı integraller kümesi kullanılarak gösterilebilir. Bir dalga fonksiyonunu tanımlamak için kullanılan dört kuantum numarası vardır.
Ana kuantum sayısı
Bir elektronu tanımlayan ilk kuantum numarası, Principal quantum number. Sembolün. Numaranın boyutunu veya sırasını (enerji seviyesi) belirtir. N'nin değeri arttıkça elektrondan çekirdeğe olan ortalama mesafe de artar, elektronun enerjisi de artar. Ana enerji seviyesi bir kabuk olarak anlaşılabilir.
Açısal Momentum Kuantum sayısı
Bu kuantum sayısının lsembolü olarak. Bu l yörüngenin şeklini gösterir. 0 ile n-1 arasında değişir.
l = 0, 1, 2… n-1
İlk kabuk için n = 1.
yani, n-1 için l = 0, n = 1 olarak l'nin tek olası değeridir.
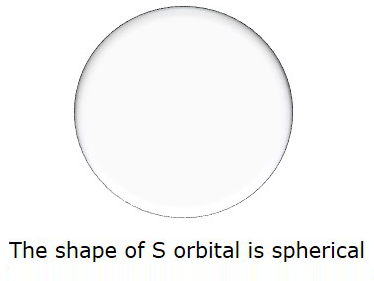
Yani, l = 0 olduğunda, Sorbital. S'nin şekli küreseldir. Aşağıdaki şekil S'nin şeklini temsil etmektedir.
Eğer n = 2 ise, l = 0, 1 çünkü bunlar n = 2 için olası iki değerdir.
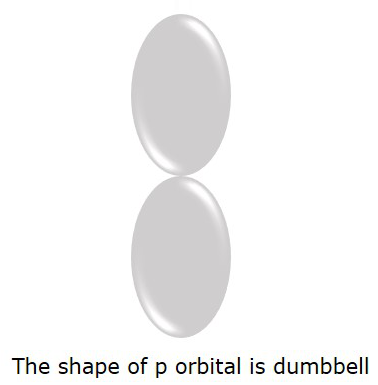
L = 0 için S orbital olduğunu biliyoruz, ancak l = 1 ise P orbital.
Elektronların bulunma olasılığının daha yüksek olduğu P yörüngesi dumbbellşekil. Aşağıdaki şekilde gösterilmiştir.
Manyetik Kuantum numarası
Bu kuantum sayısı şu şekilde gösterilir: mlçekirdeğin etrafındaki bir yörüngenin yönünü temsil eder. M l değerleri l'ye bağlıdır.
$$ m_ {l} = \ int (-l \: \: - \: + l) $$
L = 0, m l = 0 için bu S yörüngesini temsil eder.
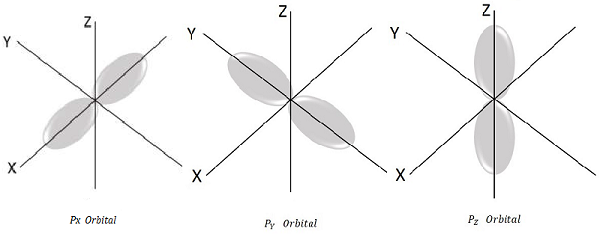
L = 1, m l = -1, 0, +1 için bunlar olası üç değerdir ve bu P orbitalini temsil eder.
Dolayısıyla aşağıdaki şekilde gösterildiği gibi üç P orbitalimiz var.
Spin Quantum numarası
Bu temsil edilmektedir msve buradaki elektron eksen üzerinde dönüyor. Elektronun dönme hareketi, aşağıda gösterildiği gibi saat yönünde veya saat yönünün tersine olabilir.
Bu spin kuantum sayısı için olası değerler şöyle olacaktır:
$$ m_ {s} = + \ frac {1} {2} \: \: yukarı $$
Döndürme denilen bir hareket için sonuç pozitif yarıdır.
$$ m_ {s} = - \ frac {1} {2} \: \: down $$
Döndürme aşağı denen bir hareket için sonuç negatif yarıdır.
Bunlar dört kuantum sayısıdır.
Pauli Dışlama İlkesi
Pauli Dışlama İlkesine göre, no two electrons in an atom can have the same set of four identical quantum numbers. Bu, herhangi iki elektronun aynı n, s, ml değerlerine sahip olması durumunda (yukarıda tartıştığımız gibi), o zaman l değerinin içlerinde kesinlikle farklı olacağı anlamına gelir. Dolayısıyla, iki elektron aynı enerjiye sahip olmayacaktır.
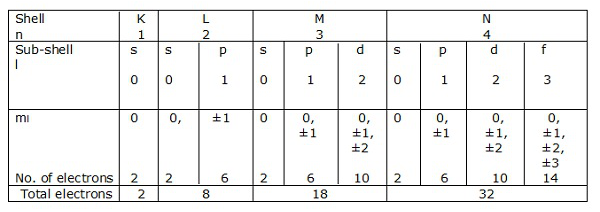
Elektronik mermiler
Eğer n = 1 bir kabuksa, o zaman l = 0 bir alt kabuktur.
Benzer şekilde, n = 2 bir kabuktur ve l = 0, 1 bir alt kabuktur.
N = 1, 2, 3… .. 'e karşılık gelen elektron kabukları sırasıyla K, L, M, N ile temsil edilir. L = 0, 1, 2, 3 vs.'ye karşılık gelen alt kabuklar veya orbitaller sırasıyla s, p, d, f vb. İle gösterilir.
Karbon, silikon ve germanyumun elektronik konfigürasyonlarına bir göz atalım (Grup IV - A).

Her durumda en dıştaki p alt kabuğunun sadece iki elektron içerdiği gözlenmiştir. Ancak olası elektron sayısı altıdır. Dolayısıyla dört tane varvalence electronsen dıştaki kabukların her birinde. Yani bir atomdaki her elektronun belirli bir enerjisi vardır. Her tür maddede bulunan moleküllerin içindeki atomik düzenleme hemen hemen bunun gibidir. Ancak atomlar arasındaki boşluk malzemeden malzemeye farklılık gösterir.