Kimia Bagian 1 - Panduan Cepat
pengantar
Segala sesuatu yang ditemukan di alam semesta ini terdiri dari beberapa bahan, para ilmuwan menamakannya “matter.” Misalnya makanan yang kita makan, udara yang kita hirup, batu, awan, bintang, tumbuhan, hewan, air, debu, semuanya dikategorikan sebagai materi.
Karakteristik Partikel Materi
Partikel materi sangat kecil, biasanya, tidak terlihat dengan mata telanjang.

Partikel materi terus bergerak terus menerus, yang dikenal sebagai “kinetic energy.”
Energi kinetik partikel secara langsung bergantung pada suhu, saat suhu meningkat, kecepatan gerakan juga meningkat.
Partikel materi memiliki gaya tarik; oleh karena itu, mereka menarik satu sama lain.
Gaya tarik partikel membuat partikel tetap bersama; akan tetapi, kekuatan gaya tarik bervariasi dari satu jenis materi ke materi lainnya.
Serikat Materi
Materi memiliki tiga kondisi berikut -
Solid State
Liquid State
Gaseous State

Mari kita bahas secara singkat -
Solid State
Semua bahan padat memiliki bentuk yang pasti, batas yang berbeda, dan volume yang tetap.
Sebagian besar material padat memiliki kompresibilitas yang dapat diabaikan.
Semua bahan padat memiliki kecenderungan alami untuk mempertahankan bentuknya saat terkena gaya luar.
Bahan padat bisa pecah di bawah gaya yang diterapkan, tetapi sangat sulit untuk mengubah bentuknya, karena kaku.
Keadaan cair
Tidak seperti benda padat, cairan tidak memiliki bentuk tetap; namun, mereka memiliki volume tetap.
Cairan mengambil bentuk wadah tempat mereka disimpan.
Cairan memiliki sifat mengalir dan berubah bentuk.
Negara Gas
Materi berupa udara, yang tidak padat atau cair, disebut gas. Misalnya oksigen, nitrogen, hidrogen, dll.
Tidak seperti padatan, gas tidak memiliki ukuran dan bentuk yang pasti.
Gas-gas tersebut, seperti elpiji (LPG - digunakan untuk memasak); gas alam terkompresi (CNG - digunakan sebagai bahan bakar dalam kendaraan), dll. memiliki kompresibilitas tinggi; Oleh karena itu, volume gas yang besar dapat dikompresi menjadi silinder kecil dan dapat diangkut dengan mudah.
Gas, biasanya, menunjukkan sifat berdifusi dengan sangat cepat ke dalam gas lain. Inilah alasan mengapa kita bisa mencium (baik atau buruk) dari kejauhan.
Materi Dapat Mengubah Statusnya
Air bisa ada di ketiga kondisi, misalnya Es sebagai padat; air (H2O) sebagai cairan; dan uap air sebagai gas. Diagram berikut menggambarkan transformasi air di berbagai keadaan -

Suhu, di mana padatan meleleh dan berubah menjadi cair (pada tekanan atmosfir tertentu), dikenal sebagai “melting point.”
Titik leleh suatu benda padat merupakan indikasi kekuatan gaya tarik antar partikelnya.
Titik leleh es adalah 273,16 K, yaitu 0 0 C.
Proses peleburan (yaitu perubahan bentuk padat menjadi cair) dikenal sebagai fusion.
Jumlah energi panas, yang dibutuhkan untuk mengubah 1 kg bahan padat menjadi bahan cair pada tekanan atmosfer tertentu, dikenal sebagai latent heat fusi.
Suhu di mana cairan mulai mendidih pada tekanan atmosfir tertentu dikenal sebagai “boiling point.”
Titik didih air adalah 373 K yaitu 100 0 C.
Perubahan wujud materi secara langsung dari padat ke gas tanpa berubah menjadi wujud cair (atau sebaliknya) dikenal sebagai “sublimation.”
Fenomena yaitu perubahan cairan menjadi uap pada suhu berapapun di bawah titik didihnya dikenal sebagai “evaporation.”
Karbon dioksida padat (CO 2 ) disimpan di bawah tekanan tinggi.

CO 2 padat diubah langsung menjadi gas setelah tekanan turun menjadi 1 atmosfer.
Atmosphere(atm) adalah satuan pengukur tekanan yang diberikan oleh gas dan satuan tekanan adalah Pascal (Pa); 1 atmosfer = 1,01 × 105 Pa.
Keempat Materi
Plasma adalah keadaan yang terdiri dari partikel super energik dan super bersemangat.

Partikel super tereksitasi ditemukan dalam bentuk gas terionisasi. Misalnya tabung fluoresen (yang berisi gas helium) dan lampu neon sign (yang mengandung gas neon) terdiri dari plasma.
pengantar
Zat murni adalah yang terdiri dari satu jenis partikel atau partikel.

Campuran dari dua atau lebih komponen murni tanpa zat yang tidak diinginkan dikenal sebagai Mixtures, misalnya, air, mineral, tanah, dll.
Campuran homogen dari dua atau lebih zat dikenal sebagai solution. Misalnya limun, air soda dll.
Larutan bisa dalam bentuk apapun seperti - bisa dalam bentuk cair, padat, atau gas.
Alloysadalah contoh lain dari campuran yang mengandung campuran logam yang homogen; mereka tidak dapat dipisahkan menjadi komponen-komponennya dengan metode fisik. Misalnya, kuningan merupakan campuran seng (kurang lebih 30%) dan tembaga (sekitar 70%).
Fitur Penting dari Solusi
Larutan biasanya merupakan campuran yang homogen.
Partikel larutan bahkan lebih kecil dari diameter 1 nm (10-9 meter) dan karenanya, ini tidak terlihat dengan mata telanjang.
Jalur cahaya tidak terlihat dalam suatu larutan.
Partikel terlarut tidak dapat dipisahkan dari campuran dengan proses filtrasi sederhana.
Partikel-partikel terlarut tidak mengendap saat dibiarkan tanpa gangguan.
Pada suhu tertentu, ketika tidak ada lagi zat terlarut yang dapat dilarutkan dalam suatu larutan, itu disebut sebagai ‘saturated solution.’
Pada suhu tertentu, jumlah partikel terlarut yang ada dalam larutan jenuh, disebut sebagai solubility.’
Penangguhan
Suspensi adalah campuran heterogen di mana partikel zat terlarut tidak larut, melainkan tetap tersuspensi di seluruh sebagian besar media, yang dikenal sebagai ‘suspension.’
Fitur penting dari Suspensi
Partikel suspensi terlihat jelas dengan mata telanjang.

Partikel-partikel suspensi menyebarkan seberkas cahaya yang melewatinya dan jalurnya juga terlihat.
Partikel salut dapat dipisahkan dari campuran dengan proses filtrasi sederhana.
Koloid
Campuran heterogen dikenal sebagai ‘colloid.’ Misalnya kabut, kabut, asap, krim wajah, dll.

Ukuran partikel koloid terlalu kecil untuk dilihat dengan mata telanjang.
Partikel koloid cukup besar untuk menyebarkan seberkas cahaya yang melewatinya dan membuat jalur terlihat.
Partikel koloid tidak dapat dipisahkan dari campuran melalui proses filtrasi sederhana.
Teknik penyaringan khusus yaitu centrifugation, dapat digunakan untuk memisahkan partikel koloid.
Kromatografi
Proses pemisahan komponen suatu campuran disebut sebagai chromatography; biasanya digunakan untuk pemisahan warna.
Teknik kromatografi digunakan untuk pemisahan zat terlarut yang larut dalam pelarut yang sama.
Distilasi
Proses pemurnian cairan dengan alat pemanas dan pendingin dikenal sebagai distilasi.
Kristalisasi
Proses yang memisahkan padatan murni dalam bentuk kristalnya dari larutan dikenal sebagai ‘crystallization.’
Elemen
Pada 1661, Robert Boyle adalah ilmuwan pertama yang menggunakan istilah tersebut element; Antoine Laurent Lavoisier, seorang ahli kimia Perancis, adalah orang pertama yang secara eksperimental mendefinisikan istilah unsur.
Unsur sebagai bentuk dasar materi yang tidak dapat dipecah menjadi zat yang lebih sederhana melalui reaksi kimia.
Elemen biasanya dapat dikategorikan sebagai metals, non-metals, dan metalloids.
Logam
Bahan padat, yang biasanya keras, ulet, mudah dibentuk, mengkilap, dan dapat melebur dengan konduktivitas listrik dan termal yang baik, dikenal sebagai metal. Misal emas, perak, tembaga, alumunium, dll.

Mercury adalah satu-satunya logam yang tetap cair pada suhu kamar.
Bukan metal
Semua unsur atau zat, yang bukan logam, dikenal sebagai bukan logam. Misalnya hidrogen, oksigen, yodium, karbon, dll.
Non-logam memiliki variasi warna dan merupakan konduktor panas dan listrik yang buruk.
Non-logam tidak berkilau, nyaring, atau lunak.
Senyawa
Suatu substansi, terdiri dari dua atau lebih elemen, dikenal sebagai ‘compound.’
Senyawa adalah hasil kombinasi kimiawi dari dua atau lebih unsur dalam proporsi tetap.

Sifat suatu senyawa berbeda dengan unsur penyusunnya, sedangkan sifat suatu campuran sama dengan unsur atau senyawanya.
pengantar
Sekitar 500 SM, seorang Filsuf India Maharishi Kanad, pertama kali mendalilkan konsep bagian materi yang tak terpisahkan dan menamakannya ‘pramanu.’
Pada 1808, John Dalton menggunakan istilah tersebut ‘atom’ dan mendalilkan atomic theory untuk mempelajari materi.

Teori Atom Dalton
Menurut teori atom Dalton, semua materi, baik unsur, senyawa, atau campuran terdiri dari partikel-partikel kecil yang disebut atom.
Menurut teori atom Dalton, semua materi, baik itu unsur, senyawa, atau campuran, tersusun dari partikel kecil yang disebut atom.
Fitur yang menonjol dari Teori Atom Dalton
Semua materi terbuat dari partikel yang sangat kecil yang disebut atom.
Atom adalah partikel yang tidak dapat dibagi, yang tidak dapat dibuat atau dihancurkan melalui reaksi kimia.
Semua atom suatu unsur identik dalam massa dan sifat kimianya sedangkan, atom dari unsur yang berbeda memiliki massa dan sifat kimia yang berbeda.
Untuk membentuk suatu senyawa, atom digabungkan dalam rasio bilangan bulat kecil.
Dalam suatu senyawa, jumlah relatif dan jenis atomnya konstan.
Massa atom
Massa atom suatu unsur kimia; itu dinyatakan dalam satuan massa atom (simbolnya adalah u ).
Massa atom kira-kira setara dengan jumlah proton dan neutron yang ada di atom.
Satu satuan massa atom adalah satuan massa yang sama dengan tepat seperdua belas (1/12) massa satu atom karbon-12 dan massa atom relatif dari semua unsur telah dihitung sehubungan dengan atom karbon-12.
Molekul
Partikel terkecil dari suatu unsur atau senyawa, yang mampu ada secara mandiri dan menunjukkan semua sifat dari masing-masing zat tersebut.

Sebuah molekul, biasanya, adalah sekelompok dua atau lebih atom yang secara kimiawi terikat bersama.
Atom dari unsur yang sama atau unsur yang berbeda dapat bergabung (dengan ikatan kimia) bersama untuk membentuk molekul.
Jumlah atom yang menyusun molekul disebut molekulnya atomicity.
Ion
Partikel bermuatan dikenal sebagai ion; bisa juganegative charge atau positive charge.
Ion bermuatan positif dikenal sebagai a ‘cation’.
Ion bermuatan negatif dikenal sebagai ‘anion.’
Rumus Kimia
Rumus kimia suatu senyawa menunjukkan unsur-unsur penyusunnya dan jumlah atom dari setiap unsur yang bergabung.

Rumus kimia suatu senyawa adalah representasi simbolis dari Komposisinya.
Kapasitas penggabungan suatu elemen dikenal sebagai miliknya ‘valency.’
Massa Molekuler
Massa molekul suatu zat dihitung dengan menjumlahkan massa atom dari semua atom dalam molekul dari masing-masing zat. Misalnya, massa molekul air dihitung sebagai -
Massa atom hidrogen = 1u
Massa atom oksigen = 16 u
Air mengandung dua atom hidrogen dan satu atom oksigen.
Massa Molekul Air adalah = 2 × 1+ 1 × 16 = 18 u ( u adalah lambang massa molekul).
Rumus Satuan Massa
Massa satuan rumus suatu zat dihitung dengan menjumlahkan massa atom semua atom dalam satuan rumus suatu senyawa.
Avogadro Constant atau Avogadro Number
Avogadro adalah seorang ilmuwan Italia yang memberikan konsep Bilangan Avogadro (juga dikenal sebagai Avogadro Constant).
Jumlah partikel (atom, molekul, atau ion) yang ada dalam 1 mol zat apa pun adalah tetap, dan nilainya selalu dihitung sebagai 6.022 × 1023.
Pada tahun 1896, Wilhelm Ostwald telah memperkenalkan konsep 'tahi lalat;' Namun, satuan mol diterima sebagai cara sederhana untuk melaporkan sejumlah besar pada tahun 1967.
Hukum Kekekalan Massa
Selama reaksi kimia, jumlah massa reaktan dan produk tetap tidak berubah, yang dikenal sebagai ‘Law of Conservation of Mass.’
Hukum Proporsi Pasti
Dalam senyawa kimia murni, unsur-unsurnya selalu ada dalam proporsi tertentu berdasarkan massa, yang dikenal sebagai the ‘Law of Definite Proportions.’
pengantar
Pada tahun 1900, ditemukan bahwa atom bukanlah partikel sederhana yang tidak dapat dibagi, melainkan mengandung partikel sub-atom.
J.J. Thomson menemukan partikel sub-atom yaitu ‘electron.’

JJ Thomson adalah orang pertama yang mengusulkan a model untuk struktur atom.
Pada tahun 1886, E. Goldstein menemukan adanya radiasi baru dalam pelepasan gas dan menamakannya canal rays.
Partikel sub-atom bermuatan positif lainnya ditemukan dengan eksperimen sinar kanal dan menamakannya proton.
Model Atom Thomson
Thomson mengusulkan bahwa atom terdiri dari bola bermuatan positif dan elektron (muatan negatif) tertanam di dalamnya (seperti yang ditunjukkan pada gambar di bawah).

Lebih lanjut, Thomson mengatakan bahwa muatan negatif dan positif sama besarnya. Jadi, atom secara keseluruhan netral secara elektrik.
Model Atom Rutherford
E. Rutherford populer sebagai 'Bapak' fisika nuklir.

Rutherford sebagian besar dikenal karena karyanya tentang radioaktivitas dan penemuan nucleus atom dengan percobaan foil emas (seperti yang ditunjukkan pada gambar yang diberikan di bawah ini.

Rutherford mengatakan bahwa dalam sebuah atom, terdapat pusat bermuatan positif yang dikenal sebagai nucleus.
Rutherford mengatakan bahwa hampir semua massa atom ada di dalam nukleus.
Menurut Rutherford, elektron berputar mengelilingi inti dalam orbit yang terdefinisi dengan baik.
Model Atom Bohr
Neils Bohr lebih jauh memperpanjang model Rutherford dan memperbaiki kekurangannya.

Menurut Bohr, hanya orbit khusus tertentu yang dikenal sebagai orbit diskrit elektron yang diperbolehkan berada di dalam atom.
Bohr mengatakan bahwa elektron tidak memancarkan energi saat berputar dalam orbit diskrit.
Bohr menamakan orbit atau kulit sebagai tingkat energi (seperti yang ditunjukkan pada gambar di bawah).

Bohr mewakili orbit atau kulit ini dengan huruf K, L, M, N,… atau angka, n = 1,2,3,4,….
Neutron
Pada tahun 1932, J. Chadwick menemukan partikel sub-atom baru yaitu neutron.
Neutron tidak memiliki muatan dan massa yang hampir sama dengan proton.
Neutron ada di inti semua atom, kecuali hidrogen.
Elektron Didistribusikan dalam Orbit Berbeda (Kulit)
Jumlah maksimum elektron yang dapat berada di kulit ditentukan oleh rumus 2n2.
‘n’ adalah nomor orbit atau indeks tingkat energi, yaitu 1, 2, 3,….
Menurut rumus yang diberikan -
Orbit pertama yaitu K-shellakan menjadi = 2 × 1 2 = 2
Orbit kedua yaitu L-shellakan menjadi = 2 × 2 2 = 8
Orbit ketiga yaitu M-shellakan menjadi = 2 × 3 2 = 18
Orbit keempat yaitu N-shellakan menjadi = 2 × 4 2 = 32
Begitu pula, jumlah elektron maksimum yang dapat ditampung di orbit terluar adalah 8.
Elektron tidak terisi pada kulit tertentu, kecuali kulit bagian dalam terisi. Artinya, cangkang diisi secara bertahap; mulai dari kulit dalam sampai kulit terluar.
Valensi
Elektron, yang ada di kulit terluar sebuah atom, dikenal sebagai valence elektron.
Menurut model Bohr-Bury, kulit terluar sebuah atom dapat memiliki maksimal 8 elektron.
Nomor atom
Jumlah total proton, yang ada dalam inti atom, disebut sebagai atomic number.
Jumlah proton sebuah atom menentukan nomor atomnya.
Nomor atom dilambangkan dengan ‘Z’.
Proton dan neutron secara kolektif dikenal sebagai nucleons.
Nomor Massa
Jumlah dari jumlah total proton dan neutron, yang ada dalam inti atom, disebut sebagai mass number.
Isotop
Atom dari unsur yang sama, memiliki nomor atom yang sama tetapi nomor massa yang berbeda, dikenal sebagai isotop. Misalnya atom Hidrogen memiliki tiga isotop yaitu protium, deuterium, dan tritium.
Sifat kimia isotop atom serupa tetapi sifat fisiknya berbeda.
Isobar
Atom dari unsur yang berbeda dengan nomor atom berbeda, yang memiliki nomor massa yang sama, disebut isobar. Misalnya nomor atom kalsium adalah 20 dan nomor atom argon adalah 18; Selanjutnya, jumlah elektron dalam atom-atom ini berbeda, tetapi jumlah massa kedua unsur ini adalah 40.
pengantar
Suatu proses di mana satu atau lebih zat kimia bereaksi dengan zat kimia lain dan diubah menjadi satu atau lebih zat berbeda dikenal sebagai reaksi kimia.
Persamaan kimia
Persamaan kimia adalah demonstrasi simbolis dari reaksi kimia; itu direpresentasikan melalui simbol dan rumus. Misalnya
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
Zat magnesium dan oksigen dikenal sebagai reaktan dan hasil reaksinya, yaitu magnesium oksida dikenal sebagai produk.
Ingat, massa total unsur-unsur yang ada dalam produk reaksi kimia harus sama dengan massa total unsur-unsur yang ada dalam reaktan.
Jumlah atom setiap unsur selalu sama, sebelum dan sesudah reaksi kimia.
Jenis Reaksi Kimia
Berikut adalah jenis utama dari reaksi kimia -
Combination Reaction
Decomposition Reaction
Displacement Reaction
Mari kita bahas masing-masing secara singkat -
Reaksi Kombinasi
Ketika dua atau lebih zat (yaitu unsur atau senyawa) bereaksi membentuk produk tunggal, reaksi tersebut dikenal sebagai combination reaction. Misalnya
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
Seperti yang diilustrasikan dalam reaksi di atas, kalsium oksida dan air bereaksi (atau digabungkan) untuk membentuk produk tunggal, yang dikenal sebagai kalsium hidroksida.
Reaksi kimia di mana panas juga dilepaskan seiring dengan pembentukan produk yang dikenal sebagai exothermic chemical reactions.
Reaksi Dekomposisi
Reaksi, di mana reaktan tunggal terurai menjadi produk yang lebih sederhana, dikenal sebagai reaksi dekomposisi. Misalnya

Dalam reaksi yang diberikan di atas, kristal besi sulfat (yaitu FeSO 4 , 7H 2 O), ketika dipanaskan, kehilangan air dan warna kristal berubah. Akhirnya, ia terurai menjadi oksida besi (Fe 2 O 3 ), sulfur dioksida (SO 2 ) dan sulfur trioksida (SO 3 ).
Reaksi Perpindahan
Reaksi, di mana suatu elemen menggeser atau menghilangkan elemen lain, dikenal sebagai reaksi perpindahan. Misalnya
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
Dalam reaksi yang diberikan di atas, besi menggantikan tembaga dari larutan tembaga sulfat dan membentuk besi sulfat.
Oksidasi dan Reduksi
Jika suatu zat memperoleh oksigen selama reaksi, itu dikenal sebagai oxidation. Di sisi lain, dalam reaksi, jika suatu zat kehilangan oksigen, itu disebutreduction. Misalnya

Dalam reaksi yang diberikan di atas, oksida tembaga kehilangan oksigen dan karenanya tereduksi (yaitu reduksi); di sisi lain, hidrogen memperoleh oksigen dan karenanya teroksidasi (yaitu oksidasi).
Korosi
Ketika logam diserang oleh zat yang ditemukan di lingkungan terdekat, seperti kelembaban, asam, dll., Itu dikenal sebagai corrosion. Misalnya lapisan hitam pada perak, lapisan hijau pada tembaga, dll.,

Bau tengik
Ketika lemak dan minyak teroksidasi, prosesnya disebut tengik. Bau, rasa, warna, dll. Juga berubah; Selain itu, membuat makanan menjadi tidak aman untuk dikonsumsi.
pengantar
Kita merasakan makanan asam dan pahit, itu hanya karena keberadaan asam dan basa masing-masing.
Solusi lakmus
Litmus yang diekstrak dari lumut berwarna ungu (lihat gambar di bawah), tetapi kondisinya tidak bersifat asam atau basa, yaitu netral.

Litmus pada dasarnya merupakan tumbuhan milik Thallophyta, dan dalam percobaan kimia biasanya digunakan sebagai indikator.
Zat yang menyebabkan perubahan bau pada media asam atau basa, disebut sebagai olfactory indikator.
Asam atau Basa dalam Larutan Air
Ion hidrogen dalam HCl dihasilkan karena adanya air. Kedua, pemisahan ion H + dari molekul HCl tidak dapat dilakukan tanpa adanya air. Rumus kimianya diilustrasikan di bawah ini
HCl + H2O → H3O+ + Cl–
Lebih jauh, ion hidrogen tidak bisa eksis sendiri, tetapi bisa eksis di hadapan molekul air. Oleh karena itu, ion hidrogen ditampilkan sebagai H + (aq) atau ion hidronium (H 3 O + ). Rumus kimianya adalah -
H+ + H2O → H3O+
Basa yang larut dalam air disebut sebagai alkalis. Tetapi semua basa tidak larut dalam air.
Jika air ditambahkan ke asam pekat, maka panas dihasilkan.
Pencampuran asam atau basa dengan air mengakibatkan penurunan konsentrasi ion (yaitu H 3 O + / OH–) per satuan volume dan proses ini dikenal sebagaidilution.
Skala pH
Skala, yang digunakan untuk mengukur konsentrasi ion hidrogen dalam suatu larutan, dikenal sebagai pH scale.
Itu ‘p’ dalam pH singkatan ‘potenz’, itu adalah istilah Jerman, yang artinya ‘power’.
Nilai pH diambil hanya sebagai angka, yang menunjukkan sifat asam atau basa suatu larutan. Jadi, jika konsentrasi ion hidronium semakin tinggi, maka nilai pH akan semakin rendah.
Nilai skala pH berkisar antara ‘0’ dan ’14;’ jadi, jika nilai pH diukur '0,' itu berarti - sangat acidic dan jika 14, maka itu berarti - sangat alkaline.
Nilai netral skala pH adalah ‘7’.
Pada skala pH, nilai kurang dari 7 mewakili larutan asam dan nilai lebih besar dari 7 mewakili larutan basa.
Biasanya, kertas yang diresapi dengan indikator umum digunakan untuk mengukur pH (lihat gambar di bawah) -
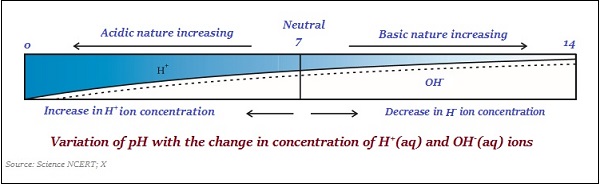
Demikian juga, kekuatan zat asam dan basa terutama bergantung pada jumlah ion H + dan ion OH - yang dihasilkan.
Gambar berikut menggambarkan secara kasar (variasi warna) nilai pH dari beberapa zat umum -

Pentingnya pH dalam Kehidupan Sehari-hari
Nilai pH tubuh manusia berkisar antara 7,0 dan 7,8.
Perut tubuh manusia menghasilkan asam klorida yang membantu pencernaan makanan; Anehnya, itu tidak membahayakan perut.
Namun, bila lambung menghasilkan terlalu banyak asam (dikenal sebagai gangguan pencernaan), hal itu menyebabkan rasa sakit dan iritasi. Untuk menghilangkan rasa sakit ini, dokter menyarankan penggunaan basa yang dikenal sebagai antasida.
Antasida ini menetralkan dan mengontrol peningkatan jumlah asam.
Gigi, yang terdiri dari kalsium fosfat, adalah zat yang paling keras di dalam tubuh. Namun, ketika pH di mulut menurun (di bawah 5,5), hal itu akan menimbulkan korosi pada gigi.
Garam biasanya dibentuk dengan kombinasi asam klorida dan larutan natrium hidroksida; dan, kombinasi tersebut dikenal sebagai natrium klorida.
Ketika nilai pH air hujan diukur kurang dari 5,6, itu dikenal sebagai acid rain.
Ketika hujan asam mengalir ke sungai, maka itu juga menurunkan pH air sungai
Air sungai yang asam merupakan ancaman bagi kelangsungan kehidupan akuatik.
Bubuk Pemutih
Bubuk pemutih diproduksi oleh aksi klorin pada kapur mati kering [Ca (OH) 2 ] dan direpresentasikan sebagai CaOCl 2 .
Bubuk pemutih biasanya digunakan di industri tekstil, pabrik kertas, industri kimia, dan desinfektan air minum.
Soda kue
Soda kue biasanya digunakan di dapur untuk memasak makanan renyah yang lezat. Ini juga memasak beberapa makanan lebih cepat.
Nama kimia dari soda kue adalah natrium hidrogenkarbonat dan rumusnya adalah NaHCO 3 .
Soda Cuci
Hasil rekristalisasi natrium karbonat menjadi soda cuci.
Rumus kimia dari soda cuci adalah Na 2 CO 3 .10H 2 O.
Soda cuci biasanya digunakan dalam industri kaca, sabun, dan kertas.
Plester Paris
Plaster of Paris adalah bubuk putih yang digunakan dokter sebagai plester untuk menopang tulang yang retak.
Nama kimia dari plester dari paris adalah kalsium sulfat hemihidrat dan rumus kimia adalah 2CaSO 4 .H 2 O.
pengantar
Logam dapat dibedakan dari non-logam berdasarkan sifat kimia dan fisiknya.
Sifat logam yang dapat digunakan untuk membuat lembaran tipis disebut sebagai malleability.
Properti logam yang dapat ditarik ke dalam kabel dikenal sebagai ductility.
Logam biasanya keras, mudah dibentuk, berkilau, ulet, nyaring, dan konduktor panas dan listrik yang baik. Misalnya besi, tembaga, kalsium, aluminium, magnesium, dll.

Bahan, yang tidak nyaring dan merupakan konduktor panas dan listrik yang buruk, disebut sebagai non-metals. Misalnya belerang, karbon, oksigen, fosfor, dll.
Beberapa logam, seperti sodium dan potassium lembut dan bisa dipotong dengan pisau.
Mercury adalah satu-satunya logam, yang tetap dalam keadaan cair pada suhu kamar.
Ketika sulfur dioksida dilarutkan dalam air, terbentuk asam sulfat. Ilustrasi - Sulfur dioksida (SO 2 ) + Air (H 2 O) → Asam sulfat (H 2 SO 3 ).
Oksida non-logam bersifat asam.
Asam belerang mengubah kertas lakmus biru menjadi merah.
Fosfor adalah non-logam yang sangat reaktif dan mudah terbakar setiap kali terkena udara.
Untuk mencegah kontak fosfor dengan oksigen atmosfer, Fosfor disimpan dalam air.
Pada pembakaran, logam mudah bereaksi dengan oksigen dan menghasilkan oksida logam, ini bersifat basa.
Non-logam bereaksi dengan oksigen dan menghasilkan oksida non-logam; ini bersifat asam.
Beberapa logam bereaksi dengan air dan menghasilkan logam hidroksida dan gas hidrogen.
Bukan logam biasanya tidak bereaksi dengan air.
Logam juga bereaksi dengan asam dan menghasilkan gas hidrogen dan garam logam.
Non-logam biasanya tidak bereaksi dengan asam.
Penggunaan Logam dan Bukan Logam
Logam digunakan dalam pembuatan mesin, pesawat terbang, mobil, kereta api, satelit, gadget industri, peralatan memasak, ketel air, dll.
Non-logam digunakan dalam pupuk untuk meningkatkan pertumbuhan tanaman.
Non-logam digunakan dalam pemurnian air.
Non-logam digunakan dalam cracker.
pengantar
Bahan padat, yang biasanya keras, mudah dibentuk, berkilau, melebur, dan ulet, dikenal sebagai logam. Misalnya besi, tembaga, aluminium, magnesium, natrium, timbal, seng, dll.
Biasanya, logam memiliki konduktivitas listrik dan termal yang baik.

Logam, dalam keadaan murni, memiliki permukaan yang bersinar, yang dikenal sebagai metallic luster.
Logam bisa dipukul menjadi lembaran tipis; properti ini dikenal sebagaimalleability.
Properti logam yang akan ditarik ke dalam kabel tipis dikenal sebagai ductility. Misal emas adalah logam yang paling ulet.
Perak dan tembaga adalah konduktor panas terbaik.
Bukan Logam
Non-logam biasanya ditemukan dalam bentuk padat atau gas. Namun, brom adalah pengecualian yang ditemukan dalam keadaan cair.
Beberapa contoh utama non-logam adalah karbon, belerang, yodium, oksigen, hidrogen, dll.

Fakta Logam dan Non-logam
Semua logam ada dalam bentuk padat pada suhu kamar, kecuali merkuri.
Gallium dan cesium memiliki titik leleh yang sangat rendah; kedua logam ini meleleh bahkan di telapak tangan.
Yodium adalah non-logam, tetapi berkilau (berkilau adalah properti logam).
Karbon adalah non-logam yang bisa ada dalam berbagai bentuk. Setiap bentuk disebut alotrop.
Intan adalah alotrop karbon dan merupakan zat alami terkeras yang diketahui.
Titik leleh dan titik didih intan sangat tinggi.
Grafit juga merupakan alotrop karbon; itu adalah konduktor listrik.
Logam alkali, seperti litium, kalium, natrium, adalah contoh logam lunak, karena dapat dipotong dengan pisau.
Hampir semua logam bila digabungkan dengan oksigen, membentuk oksida logam.
Logam yang berbeda memiliki frekuensi reaksi yang berbeda; beberapa bereaksi lambat, tetapi beberapa bereaksi sangat cepat. Misalnya kalium dan natrium sangat reaktif dan hanya terbakar jika disimpan di tempat terbuka.
Oleh karena itu, kalium dan natrium disimpan dalam minyak tanah agar tidak terbakar.
Namun, di antara semua logam, natrium (kemungkinan besar) adalah logam yang paling reaktif.
Anodisasi adalah proses pembentukan lapisan oksida pelindung tebal aluminium dan melindungi dari korosi.
Unsur atau senyawa yang terjadi secara alami di kerak bumi (lapisan atas) bumi disebut mineral.
Mineral dalam bentuk mentah dikenal sebagai ores. Misalnya emas, perak, besi dll. (Bijih besi ditunjukkan pada gambar di bawah) -

Bijih yang diekstraksi dari bumi biasanya terkontaminasi dengan sejumlah besar pengotor seperti bercampur dengan beberapa unsur, tanah, pasir, dll, yang dikenal sebagai ‘gangue’.
Berdasarkan sifat reaktif dan ekstraksi bijihnya, logam dapat dikategorikan sebagai -

pengantar
Karbon memainkan peran yang sangat penting bagi semua makhluk hidup.
Jumlah karbon di kerak bumi hanya 0,02% yang tersedia dalam bentuk mineral seperti karbonat, hidrogen-karbonat, batubara, dan minyak bumi.
Keberadaan karbon di atmosfer bumi sebesar 0,03% berupa karbondioksida.
Senyawa Karbon
Hampir semua senyawa karbon (kecuali beberapa) adalah konduktor listrik yang buruk.
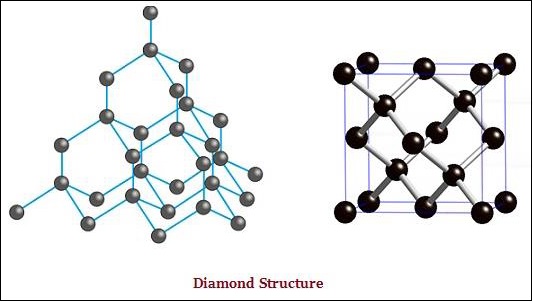
Intan dan grafit keduanya dibentuk oleh atom karbon; akan tetapi, perbedaannya terletak di antara keduanya pada cara atom karbon terikat satu sama lain.
Dalam intan, setiap atom karbon, terikat pada empat atom karbon lainnya dan membentuk struktur tiga dimensi yang kaku (lihat gambar di bawah).
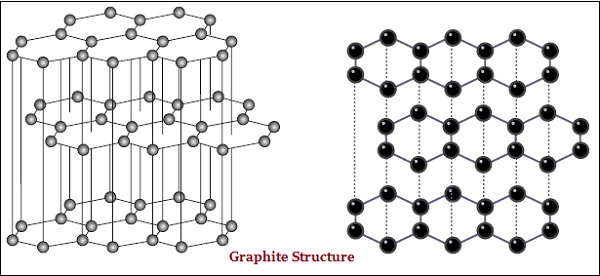
Dalam grafit, setiap atom karbon, terikat pada tiga atom karbon lainnya dalam bidang yang sama, yang menghasilkan susunan heksagonal (lihat gambar di bawah) -
Ada juga perbedaan dalam beberapa struktur fisik berlian dan grafit.
Intan adalah zat terkeras yang diketahui sedangkan grafit adalah zat halus dan licin.
Grafit adalah konduktor listrik yang baik sedangkan berlian bukan.
Tabel berikut menggambarkan struktur senyawa karbon dan hidrogen -
| Nama | Rumus | Struktur |
|---|---|---|
| Metana | BAGIAN 4 |

|
| Ethane | C 2 H 6 |

|
| Propana | C 3 H 8 |

|
| Butana | C 4 H 10 |

|
| Pentane | C 5 H 12 |

|
| Hexane | C 6 H 14 |

|
Senyawa tersebut, yang memiliki rumus molekul identik, tetapi strukturnya berbeda, disebut sebagai structural isomers (lihat struktur Butana yang diberikan di bawah).

Hidrokarbon jenuh dikenal sebagai alkanes.
Hidrokarbon tak jenuh, yang terdiri dari satu atau lebih ikatan rangkap, dikenal sebagai alkenes.
Hidrokarbon tak jenuh, yang terdiri dari satu atau lebih ikatan rangkap tiga, disebut sebagai alkynes.
Penggunaan Alkohol sebagai Bahan Bakar
Tanaman tebu sangat efisien mengubah sinar matahari menjadi energi kimia dan sarinya dapat digunakan untuk membuat molase.
Saat molase difermentasi, menghasilkan alkohol (etanol).
Beberapa negara sekarang menggunakan alkohol sebagai aditif dalam bensin, karena bahan bakar yang lebih bersih.
Alkohol ini, jika dibakar di udara yang cukup (oksigen), hanya menghasilkan karbon dioksida dan air.
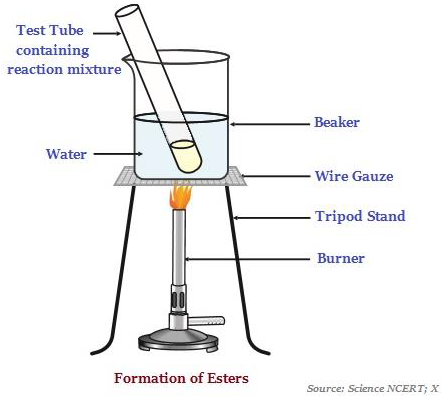
Ester
Ester adalah zat yang berbau harum, yang paling sering dibentuk oleh reaksi asam dan alkohol (lihat gambar di bawah - menggambarkan pembentukan ester).
Ketika ester bereaksi dengan adanya asam atau basa, ester mengembalikan alkohol dan asam karboksilat.
Reaksi ester dengan asam atau basa, dikenal sebagai saponification karena digunakan dalam pembuatan sabun.
Molekul sabun biasanya adalah garam natrium atau kalium dari asam karboksilat rantai panjang.
Menariknya, ujung ionik sabun larut dalam air sedangkan rantai karbon larut dalam minyak. Ciri-ciri khas dari molekul sabun membentuk struktur yang dikenal sebagaimicelles (lihat gambar yang diberikan di bawah)

Dalam misel, salah satu ujung molekul mengarah ke tetesan minyak sedangkan ujung ionik tetap berada di luar.
Misel sabun membantu melarutkan kotoran dalam air; begitu pula pakaiannya dibersihkan.
Di sisi lain, deterjen biasanya merupakan garam amonium atau sulfonat dari asam karboksilat rantai panjang, yang tetap efektif bahkan dalam air sadah.
Deterjen biasanya digunakan untuk membuat sampo dan beberapa produk lain untuk membersihkan pakaian.
pengantar
Ada sekitar 115 elemen yang telah kita ketahui hingga saat ini.
Berdasarkan propertinya, semua elemen tersusun secara berurutan yang disebut tabel periodik.
Johann Wolfgang Döbereiner, seorang ilmuwan Jerman, pertama kali mencoba menyusun elemen pada tahun 1817.
John Newlands, seorang ilmuwan Inggris, juga berusaha untuk menyusun unsur-unsur yang dikenal pada waktu itu (pada tahun 1866).
John Newlands mengikuti urutan peningkatan massa atom untuk menyusun unsur-unsurnya.
Newlands dimulai dengan unsur yang memiliki massa atom paling rendah (seperti hidrogen) dan berakhir di torium, yang merupakan unsur ke-56 (pada masanya).

Susunan unsur Newlands dikenal sebagai "Hukum Oktaf", karena dalam pengaturannya setiap delapan unsur memiliki sifat yang mirip dengan yang pertama. Misalnya, sifat litium dan natrium ditemukan sama.
| Sa (lakukan) | kembali | Ga (mi) | Ma (fa) | Pa (jadi) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H. | Li | Menjadi | B | C | N | HAI |
| F | Na | Mg | Al | Si | P. | S |
| Cl | K | Ca | Kr | Ti | M N | Fe |
| Co & Ni | Cu | Zn | Y | Di | Sebagai | Se |
| Br | Rb | Sr. | Ce & La | Zr |
Newlands juga membandingkannya dengan oktaf yang ditemukan dalam musik (lihat tabel yang diberikan di atas).
Dalam musik India, tujuh not musik adalah - sa, re, ga, ma, pa, da, ni; namun, di barat, not musik adalah - do, re, mi, fa, so, la, ti.
Selanjutnya, untuk memasukkan beberapa elemen ke dalam Tabelnya, Newlands meletakkan dua elemen dalam sel yang sama (lihat tabel yang diberikan di atas - kobalt & nikel disimpan dalam sel yang sama), tetapi teknik ini tidak berhasil, karena mereka memiliki sifat yang berbeda.
Namun, hukum oktaf memiliki batasan, seperti yang berlaku pada kalsium saja; dan, setelah kalsium, setiap unsur kedelapan tidak memiliki sifat yang sama dengan unsur pertama.
Tabel Periodik Mendeléev
Dmitri Ivanovich Mendeléev, seorang ahli kimia Rusia, yang berhasil menyusun unsur-unsurnya.
Mendeléev menyusun unsur-unsur berdasarkan sifat dasar (unsur), massa atom, serta kesamaan sifat kimianya.
Selama masa Mendeleev, hanya 63 elemen yang diketahui.
Tabel Periodik Mendeléev terdiri dari kolom vertikal yang dikenal sebagai ‘groups’ dan baris horizontal yang dikenal sebagai ‘periods.’

Hukum Berkala Mendeléev menyatakan bahwa
'Sifat-sifat unsur adalah fungsi periodik dari massa atomnya'.
Mendeléev mengatur urutannya dengan cara terbalik sehingga elemen-elemen dengan sifat yang mirip dapat dikelompokkan bersama.
Mendeléev menyisakan ruang untuk beberapa elemen, yang tidak ditemukan pada saat itu; dia dengan berani meramalkan tentang keberadaan elemen masa depan.
Salah satu batasan terbesar rumus periodik Mendeléev adalah - tidak ada posisi tetap yang ditetapkan untuk hidrogen dalam Tabel Periodik.
Tabel Periodik Modern
Pada tahun 1913, Henry Moseley, seorang fisikawan Inggris menemukan bahwa nomor atom suatu unsur adalah sifat yang lebih mendasar dibandingkan dengan massa atomnya.
Berdasarkan penemuan Moseley, Hukum Periodik Mendeléev diubah dan nomor atom diadopsi sebagai dasar Tabel Periodik Modern.
Hukum Periodik Modern menyatakan -
'Sifat-sifat unsur adalah fungsi periodik dari nomor atomnya.'
18 kolom vertikal yang dikenal sebagai 'groups'dan 7 baris horizontal yang dikenal sebagai 'periode' didefinisikan dalam Tabel Periodik Modern.
Dalam Tabel Periodik Modern, unsur-unsur disusun sedemikian rupa sehingga menunjukkan sifat-sifat periodik seperti ukuran atom, valensi, atau kapasitas gabungan dan karakteristik logam dan non-logam (unsur).
Dalam Tabel Periodik Modern, karakter logam menurun sepanjang periode dan meningkat ke bawah kelompok.
Di sisi lain, non-logam bersifat elektronegatif, karena cenderung membentuk ikatan dengan mendapatkan elektron.
Dalam Tabel Periodik Modern, non-logam ditempatkan di sisi kanan (dari atas).
pengantar
Pakaian yang kami kenakan terbuat dari kain dan kainnya terbuat dari serat, yang diperoleh dari sumber alami atau buatan.
Sumber serat alami adalah kapas, wol, sutra, dll., Yang diperoleh dari tumbuhan atau hewan.
Serat sintetis dibuat oleh manusia; oleh karena itu, ini disebut serat sintetis atau serat buatan.
Serat sintetis biasanya berupa rangkaian unit-unit kecil yang disatukan; setiap unit kecil adalah zat kimia.
Jenis Serat Sintetis
Sutra buatan biasanya dikenal sebagai Rayon.
Rayon (serat) diperoleh dengan perlakuan kimiawi dari pulp kayu.
Serat, yang dibuat dari batu bara, air dan udara, disebut sebagai Nylon.

Nylon adalah serat sintetis penuh pertama.
Polyesterjuga merupakan serat sintetis; itu adalah serat bebas kerut. Misalnya Terylene.
PET adalah salah satu bentuk poliester yang sudah dikenal dan digunakan untuk membuat perkakas, botol, film, kabel, dan banyak produk bermanfaat lainnya.
Poliester (Poli + ester) terdiri dari unit berulang dari bahan kimia yang dikenal sebagai ester.
Plastik juga merupakan sejenis polimer seperti serat sintetis.
Polythene (Poly + ethene) adalah contoh umum dari plastik.
Ada beberapa plastik, yang jika dicetak sekali, tidak dapat dilunakkan dengan pemanasan; oleh karena itu, ini dikenal sebagai plastik termoseting. Misal bakelite dan melamine.
Bakelite adalah konduktor panas dan listrik yang buruk; oleh karena itu, digunakan untuk membuat sakelar listrik, pegangan berbagai peralatan, dll.
Melamin tahan api dan dapat mentolerir panas lebih baik daripada plastik lainnya; oleh karena itu, digunakan untuk membuat ubin lantai, peralatan dapur, dan kain.
Bahan, yang terurai melalui proses alami, misalnya aksi oleh bakteri, dikenal sebagai biodegradable.
Bahan, yang tidak mudah terurai oleh proses alam, dikenal sebagai non-biodegradable.
Plastik tidak ramah lingkungan.
pengantar
Sumber daya, yang hadir dalam jumlah yang tidak terbatas di alam dan tidak mungkin habis oleh aktivitas manusia, dikenal sebagai Inexhaustible Natural Resources. Misal sinar matahari, udara.
Sumber daya, yang ada dalam jumlah terbatas di alam dan cenderung habis oleh aktivitas manusia, dikenal sebagai Exhaustible Natural Resources. Misalnya hutan, satwa liar, mineral, batu bara, minyak bumi, gas alam dll.
Sumber daya alam yang habis terbentuk dari sisa-sisa organisme hidup (fosil) yang mati; Oleh karena itu, sumber daya alam ini juga dikenal sebagaifossil fuels. Misal batubara, minyak bumi dan gas alam.
Batu bara
Batubara itu keras seperti batu dan berwarna hitam.
Batubara merupakan salah satu bahan bakar yang digunakan untuk memasak makanan.

Batubara digunakan di pembangkit listrik tenaga panas untuk menghasilkan listrik.
Di bawah tekanan tinggi dan suhu tinggi, tumbuhan mati yang terkubur di dalam bumi, perlahan diubah menjadi batu bara.
Batubara terutama mengandung karbon.
Proses lambatnya konversi vegetasi mati menjadi batu bara dikenal dengan istilah karbonisasi.
Batubara terbentuk dari sisa-sisa tumbuhan; oleh karena itu, ini juga dikenal sebagai bahan bakar fosil.
Saat terbakar, batubara menghasilkan gas karbon dioksida.
Ketika batubara diolah di industri, menghasilkan beberapa produk yang bermanfaat seperti kokas, tar batubara, dan gas batubara.
Coke adalah zat yang keras, keropos, dan hitam.
Coke adalah bentuk karbon murni.
Coke sebagian besar digunakan dalam pembuatan baja dan ekstraksi banyak logam.
Ter batubara adalah cairan hitam kental dengan bau tidak sedap.
Ter batubara adalah campuran dari sekitar 200 zat.
Produk yang diperoleh dari tar batubara digunakan sebagai bahan awal pembuatan berbagai zat yang digunakan dalam kehidupan sehari-hari dan industri. Misalnya bahan peledak, cat, bahan atap, pewarna sintetik, obat-obatan, parfum, plastik, bahan fotografi, dll.
Naphthalene balls, diperoleh dari tar batubara, digunakan untuk mengusir ngengat dan serangga lainnya.
Bitumen, diperoleh dari produk minyak bumi, digunakan sebagai pengganti tar batubara untuk logam jalan.
Selama pengolahan batubara untuk mendapatkan kokas, coal gas diperoleh.
Pada tahun 1810, untuk pertama kalinya di London, Inggris, gas batubara digunakan untuk penerangan jalan dan pada tahun 1820, di New York, AS.
Saat ini, gas batubara digunakan sebagai sumber panas.
Minyak bumi
Bensin dan solar diperoleh dari sumber daya alam yang disebut minyak bumi.
Minyak bumi terbentuk dari organisme yang hidup di laut.
Selama jutaan tahun (organisme mati terkubur di dalam bumi), dengan suhu tinggi, tekanan tinggi, dan tanpa udara, organisme mati berubah menjadi minyak bumi dan gas alam.
Pada tahun 1859, sumur minyak pertama di dunia dibor di Pennsylvania, AS.
Pada tahun 1867, minyak tertahan di Makum di Assam, India.
Di India, minyak bumi sebagian besar ditemukan di Assam, Gujarat, Mumbai High, Maharashtra, dan di lembah sungai Godavari dan Krishna.
Gambar berikut mengilustrasikan lapisan gas dan minyak -

Minyak bumi merupakan campuran dari berbagai macam konstituen seperti bensin, minyak bumi gas, solar, minyak pelumas, lilin parafin, dll.
Proses pemisahan berbagai unsur minyak bumi ini dikenal sebagai refining.
Zat bermanfaat yang berbeda, yang diperoleh dari minyak bumi dan gas alam, dikenal sebagai 'Petrokimia'.
Petrokimia digunakan dalam pembuatan deterjen, serat (poliester, nilon, akrilik, dll.), Plastik, dan plastik buatan lainnya.
Gas hidrogen, yang diperoleh dari gas alam, digunakan dalam produksi pupuk (urea).
Karena memiliki kepentingan komersial yang besar, minyak bumi juga dikenal sebagai ‘black gold.’
Gas alam biasanya disimpan di bawah tekanan tinggi dan karenanya dikenal sebagai Compressed Natural Gas (CNG).
CNG digunakan untuk pembangkit listrik dan bahan bakar untuk kendaraan.
The following table illustrates various constituents of petroleum and their uses −
| Konstituen minyak bumi | Kegunaan |
|---|---|
| Petroleum Gas in Liquid form (LPG) | Bahan bakar untuk rumah tangga dan industri |
| Bensin | Bahan bakar motor, bahan bakar penerbangan, pelarut untuk dry cleaning |
| Diesel | Bahan bakar untuk kendaraan bermotor berat, generator listrik |
| Minyak tanah | Bahan bakar untuk kompor, lampu dan pesawat jet |
| Pelumas | Pelumasan |
| Lemak Parafin | Salep, lilin, Vaseline, dll. |
| Aspal | Cat, permukaan jalan |
pengantar
Proses kimia di mana suatu zat bereaksi dengan oksigen dan mengeluarkan panas dikenal sebagai combustion.
Zat yang mengalami pembakaran disebut sebagai combustible atau fuel.
Bahan bakar bisa dalam bentuk padat, cair, atau gas.
Selama pembakaran, cahaya juga dilepaskan baik dalam bentuk a flame atau sebagai glow.

Zat yang menguap selama waktu pembakaran, menghasilkan nyala api.
Ada tiga zona berbeda yaitu zona api gelap, zona bercahaya dan zona non-bercahaya.

Zat yang berbeda terbakar pada suhu yang berbeda.
Suhu terendah di mana suatu zat terbakar disebut sebagai suhu ignition temperature.
Pertandingan mengandung antimon trisulfida dan kalium klorat.
Permukaan korek api berisi bubuk kaca dan sedikit fosfor merah.
Fosfor merah jauh lebih tidak berbahaya.
Saat batang korek api dipukul pada permukaan gosok, beberapa fosfor merah diubah menjadi fosfor putih; proses segera bereaksi dengan kalium klorat yang ada di kepala batang korek api dan menghasilkan panas yang cukup untuk menyalakan antimon trisulfida; demikian pula, pembakaran dimulai.
Zat yang memiliki suhu penyalaan sangat rendah dan dapat dengan mudah terbakar dengan nyala api, disebut sebagai inflammable substances. E. g. bensin, alkohol, Liquified Petroleum Gas (LPG), dll.
Pemadam Api
Water adalah alat pemadam kebakaran yang paling umum.
Air, sebagai alat pemadam kebakaran, hanya bekerja ketika benda-benda seperti kayu dan kertas terbakar.

Jika peralatan listrik terbakar, air dapat menghantarkan listrik dan merusak mereka yang mencoba memadamkan api.
Air juga bukan alat pemadam yang baik untuk kebakaran yang melibatkan minyak dan bensin.
Untuk kebakaran yang melibatkan peralatan listrik dan bahan yang mudah terbakar seperti bensin, Karbon Dioksida (CO2) adalah pemadam terbaik.

Salah satu cara mendapatkan CO2 adalah dengan melepaskan banyak bubuk kering bahan kimia seperti sodium bicarbonate (baking soda) atau potassium bicarbonate.
Fosfor terbakar di udara pada suhu kamar.
Jumlah energi panas yang dihasilkan pada pembakaran sempurna dari 1 kg bahan bakar disebut sebagai miliknya calorific value.
Nilai kalor bahan bakar diukur dalam satuan yang disebut kilojoule per kg (kJ / kg).
The following table illustrates the Calorific Values of Different Fuels −
| Bahan bakar | Nilai Kalor (kJ / kg) |
|---|---|
| Kue kotoran sapi | 6000-8000 |
| Kayu | 17000-22000 |
| Batu bara | 25000-33000 |
| Bensin | 45000 |
| Minyak tanah | 45000 |
| Diesel | 45000 |
| Metana | 50000 |
| CNG | 50000 |
| LPG | 55000 |
| Biogas | 35000-40000 |
| Hidrogen | 150000 |
Pembakaran sebagian besar pelepasan bahan bakar carbon dioxide di lingkungan.
Peningkatan konsentrasi karbon dioksida di udara kemungkinan besar merupakan penyebabnya global warming.
Kenaikan suhu atmosfer bumi dikenal sebagai Global Warming.
Pemanasan global menyebabkan mencairnya gletser kutub, yang menyebabkan naiknya permukaan laut yang pada akhirnya menyebabkan banjir di wilayah pesisir.
Oksida sulfur dan nitrogen larut dalam air hujan dan membentuk asam; jenis hujan seperti itu dikenal sebagaiacid rain.