Kimia Bagian 2 - Panduan Cepat
pengantar
Kimia adalah salah satu cabang Ilmu Pengetahuan Alam yang mempelajari tentang struktur, komposisi, dan sifat-sifat perubahan suatu benda.
Kimia mempelajari bagian terkecil dari suatu materi yaitu atom (beserta semua propertinya) ke bahan besar (misalnya emas, perak, besi, dll.) Dan sifat-sifatnya.
Kimia juga mempelajari gaya antarmolekul (yang memberikan materi sifat umum) dan interaksi antar zat melalui reaksi kimia.

Pada tahun 1998, Profesor Raymond Chang mendefinisikan Kimia sebagai -
"Kimia" berarti studi tentang materi dan perubahan yang dialaminya.
Dipercaya bahwa studi kimia dimulai dengan teori empat unsur yang dikemukakan oleh Aristoteles.
Empat teori unsur menyatakan bahwa "api, udara, tanah, dan air adalah unsur fundamental yang darinya segala sesuatu terbentuk sebagai kombinasi".
Karena karya klasiknya yaitu “The Sceptical Chymist,” Robert Boyle, dikenal sebagai bapak pendiri kimia.
Boyle merumuskan hukum, menjadi populer sebagai 'Hukum Boyle.'
Hukum Boyle adalah hukum gas eksperimental yang menganalisis hubungan antara tekanan gas dan volume masing-masing wadah.
Dengan mengadvokasi hukumnya, Boyle menolak teori 'empat elemen' klasik.
Ilmuwan Amerika Linus Pauling dan Gilbert N. Lewis secara kolektif mengemukakan teori elektronik tentang ikatan kimia dan orbital molekul.
Perserikatan Bangsa-Bangsa mendeklarasikan 2011 sebagai 'Tahun Kimia Internasional.'
Materi didefinisikan dalam kimia sebagai segala sesuatu yang memiliki massa dan volume diam dan juga membutuhkan ruang.
Itu matter terdiri dari partikel.
Itu atom adalah unit dasar kimia.
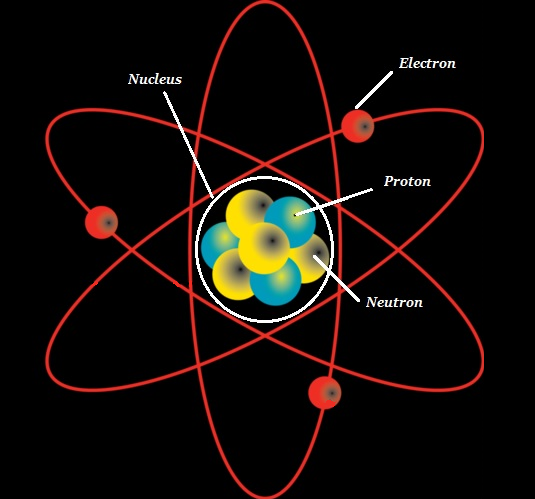
Atom terdiri dari inti padat yang disebut the atomic nucleus dan dikelilingi oleh ruang yang dikenal sebagai electron cloud.
Inti (atom) terdiri dari protons (+ve charged particles) dan neutrons (neutral or uncharged particles); secara kolektif, keduanya dikenal sebagainucleons (seperti yang ditunjukkan pada gambar di bawah).
Unsur kimia adalah bentuk murni dari suatu zat; itu terdiri dari satu jenis atom.
Tabel periodik adalah representasi standar dari semua unsur kimia yang tersedia.
Senyawa adalah bentuk murni dari suatu zat; itu terdiri dari lebih dari satu elemen.
Molekul adalah bagian terkecil yang tak terpisahkan dari zat kimia murni; molekul memiliki sifat kimia yang berbeda (lihat gambar di bawah).
Tabel berikut menggambarkan cabang-cabang kimia -
| Cabang | Cabang pembantu | Definisi |
|---|---|---|
| Physical Chemistry | Kimia Fisik | Studi tentang sifat fisik molekul |
| Kinetika Kimia | Studi tentang laju reaksi kimia | |
| Elektrokimia | Studi tentang interaksi atom, molekul, ion, dan arus listrik (yaitu transfer elektron antara elektroda dan elektrolit atau spesies) | |
| Kimia permukaan | studi tentang reaksi kimia pada permukaan (zat) | |
| Kimia panas | Pelajari hubungan antara aksi kimia dan jumlah panas yang diserap | |
| Kimia Kuantum | Studi penerapan mekanika kuantum dalam model fisik | |
| Spektroskopi | Studi spektrum cahaya atau radiasi | |
| Fotokimia | studi tentang efek kimiawi yang disebabkan oleh cahaya | |
| Organic Chemistry | Kimia organik | Studi struktur, sifat, dan preparasi senyawa kimia (karbon) (misalnya bahan bakar, plastik, bahan tambahan makanan, dan obat-obatan) |
| Stereokimia | Studi tentang pengaturan spasial relatif atom (dalam molekul) | |
| Kimia organik fisik | studi tentang struktur dan reaktivitas (keterkaitan) dalam molekul organik | |
| Kimia Polimer | Studi molekul polimer (komposisi dan kreasi) | |
| Kimia Organologam | Studi bahan kimia yang mengandung ikatan (terutama antara karbon dan logam) | |
| Kimia obat | Kajian perancangan, pengembangan, dan sintesis obat & obat | |
| Inorganic chemistry | Kimia anorganik | Mempelajari semua bahan yang tidak organik (seperti mineral, logam, katalis, struktur kristal, dll.) |
| Kimia Organologam | Studi senyawa kimia yang mengandung ikatan (terutama antara karbon dan logam) | |
| Kimia zat padat | Mempelajari senyawa kimia yang mengandung ikatan antara karbon dan logam | |
| Kimia Nuklir | Studi tentang zat radioaktif | |
| Geokimia | Studi komposisi kimia bumi (misalnya batuan, mineral & atmosfer) | |
| Kimia Bioinorganik | Studi interaksi antara ion logam dan jaringan hidup | |
| Kimia Koordinasi | ||
| Biochemistry | Biokimia | Studi tentang reaksi kimia (dan perubahan) pada makhluk hidup |
| Biokimia Molekuler | Mempelajari Biomolekul beserta fungsinya | |
| Biokimia Klinik | Studi tentang perubahan kimiawi pada makhluk hidup, yang disebabkan oleh berbagai penyakit | |
| Biologi Molekuler | Studi tentang berbagai jenis DNA, RNA, dan biosintesis protein (dan hubungannya) | |
| Biokimia pertanian | Studi kimia fauna (yaitu tumbuhan) | |
| Analytical Chemistry | Studi metode eksperimental standar dalam kimia (yaitu penentuan sifat kimiawi secara kuantitatif suatu zat) | |
| Astrochemistry | Studi tentang reaksi unsur dan molekul kimia yang ditemukan di alam semesta | |
| Cosmochemistry | Studi tentang komposisi kimia dari materi yang ditemukan di alam semesta | |
| Environmental chemistry | Studi tentang fenomena kimia dan biokimia yang terjadi di lingkungan |
pengantar
Proses emisi partikel dari inti karena ketidakstabilan inti; dikenal sebagai radioaktivitas.
Zat yang melepaskan energi / sinar tersebut dikenal sebagai zat radioaktif.
Sinar tak terlihat yang dilepaskan dari zat radioaktif tersebut dikenal sebagai sinar radioaktif.
Demikian juga radioaktivitas adalah fenomena nuklir yang terjadi (secara alamiah) karena ketidakstabilan inti atom.
Pada tahun 1896 Henri Becquerel pertama kali mengamati fenomena radioaktivitas, tetapi istilah 'radioaktivitas' diciptakan oleh Marie Curie.
Marie Curie menemukan unsur radioaktif yaitu Polonium dan Radium pada tahun 1898.
Untuk penemuannya, Marie Curie memenangkan Hadiah Nobel.
Sinar Radioaktif
Setelah bertahun-tahun bereksperimen, Ernest Rutherford bersama rekannya (Hans Geiger dan muridnya Ernest Marsden), menemukan sinar alfa, sinar beta, dan sinar gamma.
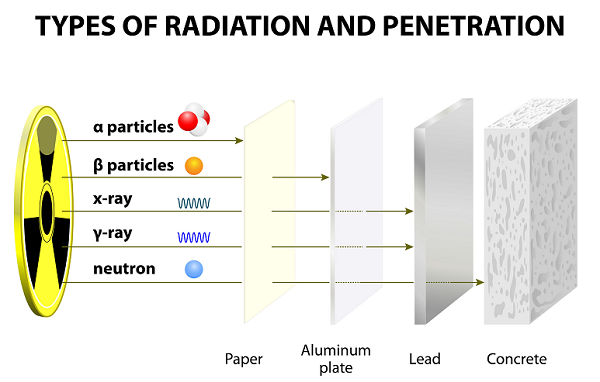
Sinar-sinar ini dipancarkan sebagai hasil disintegrasi atom.
Partikel Alfa (α)
Partikel alfa biasanya terdiri dari dua proton dan dua neutron, yang terikat erat.
Partikel alfa dilepaskan selama peluruhan radioaktif (atau peluruhan alfa) dari nuklida radio inti.
Partikel alfa identik dengan inti atom helium normal atau atom helium terionisasi ganda.
Dibandingkan dengan partikel lain (yaitu Gamma dan Beta), partikel alfa berat dan lambat. Oleh karena itu, partikel alfa memiliki jangkauan yang sangat kecil di udara.
Karena kecepatannya yang lambat, partikel Alfa memiliki daya tembus yang sangat lemah; partikel-partikel ini bahkan dihentikan oleh selembar kertas tipis (lihat gambar yang diberikan di atas).
Karena memiliki muatan positif ganda, partikel alfa sangat terionisasi.
Partikel Beta (β)
Partikel beta adalah elektron yang bergerak cepat yang dipancarkan oleh beberapa nuklida radio selama peluruhan radioaktif (juga dikenal sebagai peluruhan beta).
Partikel beta memiliki bobot yang jauh lebih ringan dan membawa satu muatan negatif.
Partikel beta jarang terionisasi daripada partikel alfa.
Karena memiliki bobot yang lebih ringan, partikel beta dapat bergerak lebih jauh daripada partikel alfa; Namun, partikel beta dapat dihentikan oleh beberapa lembar kertas atau satu lembar aluminium.
Partikel beta bermuatan negatif dan tertarik pada partikel bermuatan positif.
Partikel Gamma (ү)
Partikel gamma adalah kumpulan energi tinggi yaitu energi elektromagnetik (foton) yang dipancarkan oleh unsur radioaktif selama peluruhan radioaktif.
Di antara ketiga partikel (alfa, beta, dan gamma), partikel gamma adalah foton yang paling energik.
Partikel gamma, yang merupakan bentuk radiasi elektromagnetik (EMR), berasal dari nukleus.
Panjang gelombang gamma adalah yang terpendek di antara ketiganya.
Partikel gamma tidak memiliki muatan dan netral; oleh karena itu, mereka tidak terpengaruh oleh medan magnet dan listrik.
Penggunaan Unsur Radioaktif
Elemen radioaktif digunakan dalam -
Bidang medis (pengobatan banyak penyakit)
Proses industri
Produksi energi - reaktor nuklir
pengantar
Reaksi nuklir melepaskan sejumlah besar energi (dikenal sebagai energi nuklir), yang digunakan untuk menghasilkan listrik di pembangkit listrik tenaga nuklir.

Energi nuklir biasanya diproduksi oleh nuclear fission, nuclear fusion, dan nuclear decay.
Pada tahun 1938, ahli kimia Jerman Otto Hahn, Fritz Strassmann, dan fisikawan Austria Lise Meitner melakukan eksperimen di mana produk uranium yang dibombardir dengan neutron. Sebagai hasil dari percobaan ini, neutron yang relatif kecil membelah inti atom uranium masif menjadi dua bagian yang kira-kira sama dan melepaskan energi masif.
Eksperimen nuklir Otto Hahn dan rekan-rekannya populer sebagai fisi nuklir.
Fisi nuklir
Proses fisi nuklir menghasilkan neutron dan foton gamma bebas, sementara proses ini juga melepaskan sejumlah besar energi.
Fisi nuklir merupakan reaksi eksotermik, yang dapat melepaskan energi dalam jumlah besar dalam bentuk radiasi elektromagnetik serta energi kinetik.
Fisi nuklir, terkadang, dapat terjadi secara alami (tanpa bombardir neutron) sebagai jenis peluruhan radioaktif.
Jenis Fisi Nuklir
Berikut adalah jenis utama dari Fisi Nuklir -
Chain Reaction and
Fission Reaction
Mari kita bahas secara singkat -
Reaksi berantai
Ketika satu reaksi nuklir tunggal menyebabkan satu atau lebih reaksi nuklir berikutnya, ini dikenal sebagai reaksi berantai.
Reaksi berantai seperti itu meningkatkan kemungkinan rangkaian reaksi nuklir yang menyebar sendiri.
Reaksi berantai nuklir melepaskan energi jutaan kali lebih banyak per reaksi daripada reaksi kimia lainnya; oleh karena itu, ini juga dikenal sebagai reaksi berantai eksplosif atau tidak terkontrol.
Ketika sebuah atom berat mengalami fisi nuklir, biasanya atom tersebut pecah menjadi dua atau lebih fragmen fisi. Selama proses tersebut, beberapa neutron bebas, sinar gamma, dan neutrino dipancarkan, dan akhirnya sejumlah besar energi dilepaskan.
Berikut adalah dua contoh reaksi berantai -
235 U + → Fragmen fisi neutron + 2,4 neutron + 192,9 MeV
235 Pu + → Fragmen fisi neutron + 2,9 neutron + 198,9 MeV
Dalam bom atom, teknologi reaksi berantai digunakan karena membutuhkan sumber energi yang konsisten.
Reaksi Fisi
Reaksi fisi di mana neutron (dihasilkan oleh fisi atom bahan bakar) digunakan untuk menginduksi lebih banyak fisi untuk pelepasan energi berkelanjutan, yang dikenal sebagai reaksi fisi.
Reaksi seperti itu lambat dan terkendali; oleh karena itu, juga dikenal sebagai reaksi berantai terkontrol.
Tenaga (listrik) yang menghasilkan reaktor nuklir adalah contoh ideal dari reaksi berantai terkontrol.
Berdasarkan sifat dan jenis penggunaannya, reaksi berantai fisi / terkontrol diklasifikasikan sebagai -
Power reactors
Research reactors
Breeder reactors
Reaktor daya ini umumnya mengubah energi kinetik produk fisi menjadi panas; Selanjutnya, panas digunakan untuk memanaskan fluida kerja yang menggerakkan mesin panas, yang pada akhirnya menghasilkan tenaga mekanik atau listrik.
Komponen dasar Reaktor Nuklir
Berikut adalah komponen penting dari reaktor nuklir -
Nuclear fuels- Seperti Uranium ( 233 U, 235 U), thorium (Th 232 ), plutonium (Pu 239 ).
Moderators- Digunakan untuk mengontrol neutron yang dipancarkan. Misalnya air berat, berilium, grafit, dll.
Coolant- Digunakan untuk mendinginkan reaktor. Misalnya air, uap, helium, CO 2 , udara, logam cair, dll.
Control rods- Ini digunakan untuk menjalankan dan menghentikan reaksi fisi. Misalnya batang kadmium atau boron digunakan untuk tujuan tersebut.
Fusi nuklir
Proses peleburan dua inti ringan untuk membentuk inti yang berat dikenal sebagai fusi nuklir; selama proses ini, sejumlah besar energi dilepaskan yang dikenal sebagai energi nuklir.
Contoh terbaik dari fusi nuklir adalah - bom hidrogen.
Bom hidrogen sekitar 1.000 kali lebih kuat dari bom atom.
pengantar
Bahan (yang bisa berupa elemen, senyawa, atau paduan) yang memiliki karakteristik keras, berkilau, buram, dan memiliki sifat untuk menghantarkan panas dan listrik, disebut logam.
Logam secara alami ditemukan di kerak bumi dalam bentuk yang tidak murni yaitu bijih. Dan, itu diekstraksi melalui proses penambangan.
Di antara 118 unsur yang diketahui (dari tabel periodik), sekitar 91 unsur adalah logam.

Fitur Logam
Berikut ini adalah fitur-fitur penting logam -
Logam pada umumnya mudah dibentuk - artinya, bentuknya dapat diubah secara permanen tanpa pecah dan retak.
Logam bisa melebur - artinya; itu bisa menyatu atau meleleh dengan mudah.
Logam itu ulet - artinya; itu dapat diberikan bentuk apapun bahkan lembaran tipis atau kawat.
Logam adalah konduktor panas dan listrik yang baik; lebih berat, timbal adalah pengecualian, karena tidak membawa listrik.
Logam secara alami bereaksi dengan berbagai non-logam dan membentuk senyawa. Logam dapat bereaksi dengan basa dan asam. Misalnya 4 Na + O 2 → 2 Na 2 O (natrium oksida), dll.
Paduan
Paduan adalah produk dari campuran dua atau lebih elemen di mana logam mendominasi.
Untuk menghasilkan atau membuat produk yang diinginkan, logam yang berbeda (dalam rasio yang berbeda) dicampur (yaitu paduan). Misal paduan besi yaitu stainless steel, besi tuang, paduan lembaran, dll memberikan kontribusi yang besar baik dari segi kuantitas maupun nilai komersialnya.
Logam biasanya dibuat paduan dengan tujuan agar lebih tahan terhadap korosi, kurang rapuh, memberi warna yang menarik, dll.
Istilah Logam
Base Metal- Dalam ilmu kimia yang dimaksud logam dasar adalah - logam yang mudah teroksidasi atau terkorosi serta mudah bereaksi dengan HCl (encer asam klorida) dan membentuk hidrogen. Misalnya besi, nikel, seng, timbal, dll.
Ferrous Metal- "Ferrous" adalah kata Latin, yang berarti zat "mengandung besi". Misalnya baja, dll.
Heavy Metal- Logam yang lebih padat dari logam normal dikategorikan sebagai logam berat. Logam berat bersifat toksik atau beracun pada konsentrasi rendah. Misalnya merkuri (Hg), arsen (As), kromium (Cr), kadmium (Cd), talium (Tl), dan timbal (Pb).
Precious Metal- Unsur logam yang mempunyai unsur kimia logam langka yang bernilai ekonomis tinggi dikategorikan sebagai logam mulia. Misal platina, emas, perak, paladium, dll.
Noble Metal- Logam yang tahan terhadap korosi atau oksidasi. Misalnya ruthenium (Ru), rhodium (Rh), paladium (Pd), dll.
Penerapan Logam
Berikut adalah aplikasi signifikan dari logam -
Karena logam adalah konduktor panas dan listrik yang baik; oleh karena itu, ini digunakan sebagai kabel listrik dan di banyak peralatan listrik lainnya termasuk motor listrik, dll. Misalnya tembaga, perak, aluminium, dll.
Logam berat digunakan dalam konstruksi jembatan, kolam, dan untuk banyak tujuan semacam itu.
Banyak logam digunakan untuk membuat berbagai barang rumah tangga, seperti perkakas, panci, kompor, dll.
Logam sering digunakan untuk membuat berbagai jenis perkakas mulai dari obeng sederhana hingga roller batang berat.
Logam mulia memiliki tampilan yang indah dan menarik (misalnya emas, perak, dll.); oleh karena itu, mereka digunakan sebagai ornamen.
Beberapa logam tertentu digunakan untuk heat sink yang melindungi peralatan sensitif dari panas berlebih.
Logam radioaktif (misalnya uranium dan plutonium) digunakan dalam pembangkitan energi nuklir.
Merkuri adalah logam yang tetap dalam bentuk cair pada suhu kamar; itu digunakan dalam termometer.
Cabang ilmu pengetahuan dan teknologi yang mempelajari sifat-sifat logam serta produksi dan pemurniannya dikenal sebagai metallurgy.
Zat anorganik padat yang terbentuk secara alami dikenal sebagai a mineral.
Bahan padat alami dari mana mineral atau logam berharga dapat diekstraksi disebut sebagai ore.
Tabel berikut mengilustrasikan elemen utama dan bijihnya -
| Elemen | Bijih | Komposisi kimia |
|---|---|---|
| Aluminium | Bauksit | Al 2 O 3 2H 2 O |
| Korundum | Al 2 O 3 | |
| Kryolite | Na 3 AlF 6 | |
| Dyspore | Al 2 O 3 .H 2 O | |
| Tembaga | Tembaga Pyrite | CuFeS 2 |
| Malachite | 2CuCO 3 Cu (OH) 2 | |
| Besi | Bijih besi | Fe 2 O 3 |
| Magnetit | Fe 3 O 4 | |
| Siderite | FeCO 3 | |
| Sodium | Sodium karbonat | Na 2 CO 3 |
| Natrium klorida | NaCl | |
| Natrium Nitrat | NaNO 3 | |
| Natrium Sulfat | Na 2 SO 4 | |
| Kalium | Potasium klorida | KCl |
| Potasium Karbonat | K 2 CO 3 | |
| Potasium nitrat | KNO 3 | |
| Magnesium | Magnesit | MgCO 3 |
| Dolomit | CaMg (CO 3 ) 2 | |
| Garam Epsom | MgSO 4 | |
| Kalsium | Kalsium karbonat | CaCO 3 |
| Timah | Cassiterite | SnO 2 |
| Memimpin | Galena | PbS |
| Cerussite | PbCO 3 | |
| Anglesite | PbSO 4 | |
| Perak | Orang Argentina | Ag 2 S |
| Tetrahedrite | Sb 4 S 3 | |
| Seng | Seng Karbonat (dikenal sebagai calamine) | ZnCO 3 |
| Seng Sulfida | ZnS | |
| Air raksa | Cinnabar | HgS |
| Mangan | Pyrolusite | MnO 2 |
| Fosfor | Fosfotit | Ca 3 (PO 4 ) 2 |
| Fluorapatit | Ca 5 (PO 4 ) 3 F. | |
| Klorapatit | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Emas | Calaverite | AuTe 2 |
| Sylvanite | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| Antimony | Stibnite | Sb 2 S 3 |
| Stibiconite | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Kobalt | Cobaltite | CoAsS |
| Nikel | Pentlandite | ((Ni, Fe) S) |
| Chromium | Chromite | (FeCr 2 O 4 ) |
pengantar
Sodium adalah logam alkali yang lembut, berwarna keperakan, dan sangat reaktif.
Dalam tabel periodik, Natrium disimpan dalam golongan 1, karena ia memiliki elektron tunggal di kulit terluarnya.
Simbol natrium adalah 'Na,'yang sebenarnya diambil dari kata Latin ‘natrium.’
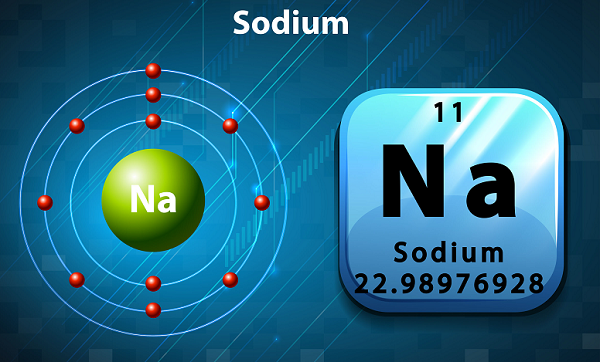
Dalam hal kelimpahan, natrium adalah unsur keenam yang ditemukan di kerak bumi.
Sodium ada di berbagai mineral termasuk feldspar, sodalite, dan garam batu (NaCl).
Pada 1807, Humphry Davy pertama kali mengisolasi natrium dengan elektrolisis natrium hidroksida.
Pada saat itu, 20 isotop natrium telah diketahui, tetapi hanya 23 Na yang stabil.
Fitur Penting Sodium
Berikut adalah fitur utama dari unsur natrium -
Logam natrium merupakan elemen lunak yang dapat dengan mudah dipotong dengan pisau.
Sodium adalah konduktor panas dan listrik yang baik.
Karena memiliki massa atom yang rendah dan jari-jari atom yang besar, natrium adalah salah satu unsur dengan massa jenis terkecil (unsur kerapatan terkecil ketiga - dua yang pertama adalah litium dan kalium).
Natrium bisa mengapung di atas air.
Natrium di sepanjang senyawanya bersinar kuning (lihat gambar di bawah).

Senyawa natrium memiliki kepentingan komersial yang sangat tinggi dan memiliki permintaan yang tinggi dalam industri kaca, kertas, sabun, dan tekstil.
Senyawa Natrium
Berikut adalah beberapa contoh penting senyawa natrium -
Garam meja - (NaCl)
Soda ash - (Na 2 CO 3 )
Soda kue - (NaHCO 3 )
Soda kaustik - (NaOH)
Natrium nitrat - (NaNO 3 )
Natrium tiosulfat - (Na 2 S 2 O 3 · 5H 2 O)
Boraks - (Na 2 B 4 O 7 · 10H 2 O)
Terjadinya Sodium
Kerak bumi mengandung sekitar 2,27% natrium.
Sodium adalah logam paling melimpah ke- 5 ; empat lainnya adalah aluminium, besi, kalsium, dan magnesium.
Di perairan samudra, sekitar 1,08 × 104 miligram natrium ditemukan dalam per liter.
Sodium tidak ditemukan sebagai unsur murni, karena sangat reaktif.
Kegunaan Sodium
Berikut ini adalah kegunaan utama natrium -
Sodium klorida sangat berguna untuk anti-icing dan de-icing serta pengawet.
Dalam memasak, natrium bikarbonat digunakan.
Sodium dan beberapa senyawanya digunakan dalam pengobatan.
Dibandingkan dengan kalium (yang merupakan ion yang lebih baik), natrium lebih sering digunakan karena harga dan berat atomnya yang lebih rendah.
Dalam kimia organik, natrium hidrida digunakan sebagai berbagai reaksi.
Natrium logam terutama digunakan untuk produksi natrium borohidrida, natrium trifenilfosfin, azida, nila, dll.
Pada beberapa reaktor cepat, natrium cair digunakan sebagai fluida perpindahan panas karena memiliki sifat konduktivitas panas yang baik.
Sodium juga merupakan mineral penting bagi kesehatan manusia, karena mengatur tekanan darah, volume darah, keseimbangan osmotik, dan nilai pH.
Jumlah minimum 500 miligram natrium diperlukan setiap hari untuk tubuh manusia yang sehat.
pengantar
Kalsium adalah unsur alkali berwarna kuning keabu-abuan lembut yang ditemukan sebagian besar di kerak bumi.
Simbol kalsium adalah “Ca” dan nomor atom adalah “20.”
Kalsium bebas hampir tidak ada di alam, karena sangat reaktif.
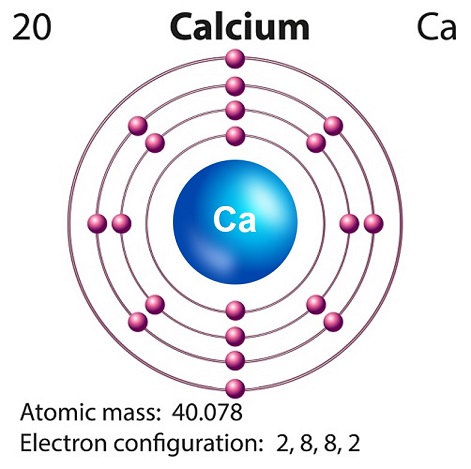
Kalsium biasanya diproduksi dalam nukleosintesis supernova.
Fitur Penting dari Kalsium
Kalsium adalah salah satu logam paling melimpah berdasarkan massa yang ditemukan di banyak hewan.
Kalsium merupakan unsur yang sangat penting dari gigi, tulang, dan cangkang.
Kalsium karbonat dan kalsium sitrat adalah suplemen makanan utama yang dibutuhkan untuk kesehatan yang baik.
Organisasi Kesehatan Dunia (WHO) mendaftarkan kalsium sebagai Obat Esensial.
Dibandingkan dengan logam lain, ion kalsium dan sebagian besar senyawa kalsium lainnya memiliki toksisitas rendah.
Jika kalsium bersentuhan dengan air atau asam, ia bereaksi dengannya dan menjadi berbahaya.
Jika kalsium bersentuhan dengan udara, ia bereaksi dengan cepat dan membentuk lapisan putih keabuan kalsium nitrida dan kalsium oksida.
Sebagian besar garam kalsium biasanya tidak berwarna.
Ketika kalsium terbakar, warna apinya tampak merah bata (lihat gambar di bawah).

Logam kalsium memiliki resistivitas listrik yang relatif lebih tinggi daripada aluminium atau tembaga.
Kejadian
Kalsium biasanya terjadi di batuan sedimen.
Mineral (sedimen) tempat kalsium ditemukan adalah kalsit, dolomit, dan gipsum.
Kalsium juga ditemukan pada batuan beku dan metamorf sebagian besar pada mineral silikat, seperti amfibol, plagioklas, piroksen, dan garnet.
Kalsium juga ditemukan di banyak produk makanan seperti produk susu, almond, hazelnut, kacang kedelai, brokoli, daun dandelion, buah ara, dan masih banyak lagi.
Senyawa Kalsium
Kalsium oksida - CaO
Kalsium hidroksida - Ca (OH) 2
Kalsium klorida - CaCl 2
Kalsium hipoklorit (Bubuk pemutih) - Ca (ClO) 2
Kalsium fosfat - Ca 3 (PO 4 ) 2
Kegunaan Kalsium
Kalsium memiliki kegunaan yang luas, yang terpenting adalah -
Kalsium karbonat (CaCO 3 ) digunakan dalam pembuatan semen.
Kalsium karbonat (CaCO 3 ) juga digunakan dalam pembuatan pasta gigi.
Dalam insektisida, kalsium arsenat (Ca 3 (AsO 4 ) 2 ) digunakan.
Kalsium klorida (CaCl 2 ) digunakan dalam penghilangan es serta pengendalian debu.
Kalsium sitrat (Ca 3 (C 6 H 5 O 7 ) 2 ) biasanya digunakan sebagai pengawet makanan.
Kalsium glukonat (Ca (C 6 H 11 O 7 ) 2 ) sering digunakan sebagai aditif makanan serta dalam pil vitamin.
Kalsium hipoklorit (Ca (OCl) 2 ) umumnya digunakan sebagai desinfektan kolam renang, sebagai zat pemutih.
pengantar
Logam yang memiliki sifat logam berwarna putih keperakan, lunak, nonmagnetik, dan ulet tersebut dikenal dengan istilah aluminium.
Simbol aluminium adalah ‘Al’ dan nomor atomnya adalah ‘13.’
Aluminium unsur kimia termasuk dalam kelompok boron.

- Bauksit adalah bijih utama aluminium.
Fitur Utama Aluminium
Logam aluminium adalah elemen yang reaktif secara kimiawi.
Aluminium berpotensi untuk menahan korosi dan proses resistivitas ini dikenal dengan passivasi.
Aluminium adalah logam yang relatif tahan lama, ringan, lembut, mudah dibentuk, dan ulet.
Aluminium bersifat nonmagnetik dan tidak mudah terbakar.
Film aluminium adalah reflektor yang sangat baik untuk cahaya tampak, karena memantulkan lebih dari 90 persen sinar yang masuk.
Aluminium biasanya bereaksi dengan air dan membentuk hidrogen.
Aluminium adalah logam dengan kepadatan rendah dan memiliki sifat tahan korosi.
Aluminium memiliki sifat konduktivitas panas dan listrik dan karenanya, merupakan konduktor yang baik.
Terjadinya Aluminium
Aluminium membentuk (sekitar) 8 persen kerak bumi.
Setelah oksigen dan silikon, aluminium adalah unsur paling melimpah ketiga; Namun, ini adalah logam paling melimpah di kerak bumi.
Ketika hidrogen menyatu dengan magnesium, itu menciptakan aluminium yang stabil.
Aluminium secara alami ditemukan dalam oksida atau silikat.
Senyawa Aluminium
Berikut ini adalah senyawa utama aluminium -
Alumina - Al 2 O 3
Aluminium klorida - AlCl 3
Aluminium sulfat - Al 2 (SO 4 ) 3
Aluminium hidroksida - Al (OH) 3
Aluminium karbida - Al 4 C 3
Penggunaan Aluminium
Aluminium memiliki berbagai macam penggunaan di industri maupun dalam kehidupan sehari-hari; signifikan dari mereka adalah -
Aluminium digunakan dalam industri transportasi, seperti kereta api, mobil, pesawat terbang, pesawat luar angkasa, truk, kapal laut, sepeda, dll.
Aluminium digunakan dalam kemasan beberapa bahan tertentu.
Aluminium digunakan dalam konstruksi pintu, jendela, kawat bangunan, selubung, atap, dll.
Aluminium banyak digunakan dalam pembuatan kawat listrik.
Aluminium digunakan dalam pembuatan peralatan rumah tangga dan banyak barang rumah tangga lainnya, seperti peralatan memasak.
Aluminium digunakan dalam pemukul bisbol, jam tangan, dan banyak lagi jenis barang semacam itu.
Aluminium digunakan dalam peralatan fotografi.
Aluminium digunakan pada peralatan elektronik.
Aluminium digunakan sebagai reflektor cahaya, karena merupakan reflektor cahaya yang baik; Pada dasarnya beberapa material dilapisi aluminium khusus untuk memantulkan cahaya.
Aluminium digunakan dalam produksi gas hidrogen melalui reaksi dengan asam klorida.
Aluminium digunakan dalam pembuatan alat musik.
pengantar
Magnesium adalah elemen padat abu-abu mengkilap.
Simbol magnesium adalah ‘Mg’ dan nomor atom adalah ‘12.’

Dengan sekitar 80% pangsa pasar dunia, China adalah pemasok magnesium terbesar.
Fitur Penting Magnesium
Massa jenis magnesium adalah dua pertiga massa jenis aluminium.
Di antara semua logam alkali di Bumi, magnesium memiliki titik leleh terendah (yaitu sekitar 1.202 0 F) dan titik didih terendah (sekitar 1.994 0 F).
Magnesium biasanya bereaksi dengan air pada suhu kamar.
Terkadang, magnesium juga digunakan sebagai penyala untuk termit.
Magnesium, ketika terbakar di udara, menghasilkan cahaya putih cemerlang, yang juga mencakup panjang gelombang ultraviolet yang kuat.

Magnesium, saat terbakar, menghasilkan cahaya putih dan terang yang intens (lihat gambar di atas).
Terjadinya Magnesium
Secara massa, magnesium adalah unsur paling melimpah kedelapan yang ditemukan di kerak bumi.
Magnesium biasanya ditemukan dalam deposit besar magnesit, dolomit, dan mineral sejenis lainnya.
Ion magnesium terlarut ditemukan dalam air mineral.
Setelah natrium dan klorin, magnesium adalah unsur paling melimpah ketiga yang terlarut dalam air laut.
Magnesium secara alami hanya terjadi dalam kombinasi dengan beberapa elemen lainnya.
Secara massa, magnesium adalah unsur paling melimpah ke- 11 dalam tubuh manusia dan sangat penting untuk semua sel dan enzim.
Ion magnesium sering berinteraksi dengan senyawa polifosfat termasuk ATP, DNA, dan RNA.
Senyawa Magnesium
Berikut ini adalah senyawa utama magnesium -
Magnesium karbonat - MgCO 3
Magnesium klorida - MgCl 2
Magnesium sitrat - C 6 H 6 MgO 7
Magnesium hidroksida - Mg (OH) 2
Magnesium oksida - MgO
Magnesium sulfat - MgSO 4
Magnesium sulfat heptahidrat - (MgSO 4 · 7H 2 O)
Magnesium sulfat heptahidrat umumnya dikenal sebagai Epsom salt.
Penggunaan Magnesium
Magnesium memiliki kegunaan yang luas dalam hidup kita; namun, beberapa penggunaan magnesium yang signifikan adalah -
Setelah besi dan aluminium, magnesium adalah elemen ketiga yang paling umum digunakan.
Magnesium terutama digunakan pada bahan paduan dan bahan super kuat yang ringan.
Magnesium juga digunakan sebagai bahan mesin di industri pesawat terbang.
Magnesium juga digunakan untuk memurnikan pelarut; seperti dalam pembuatan etanol super-kering.
Banyak merek otomotif besar termasuk Mercedes, Porsche, BMW, Volkswagen, Chevrolet, dll. Menggunakan magnesium dalam membuat mobil berkualitas tinggi mereka.
Karena memiliki bobot yang rendah dan sifat kelistrikan dan mekanik yang baik, magnesium biasanya digunakan dalam pembuatan laptop dan komputer tablet, ponsel, kamera, dan banyak komponen elektronik lainnya.
Magnesium sulfit biasanya digunakan dalam pembuatan kertas.
pengantar
Mangan adalah salah satu unsur kimia yang biasanya ditemukan dalam kombinasi dengan besi.
Simbol mangan adalah ‘Mn’ dan nomor atom adalah ’25.’
Mangan merupakan logam yang sangat penting untuk keperluan industri.

Pada tahun 1774, Johan Gottlieb Gahn, pertama kali mengisolasi sampel logam mangan yang tidak murni pada tahun 1774.
Fitur Mangan
Berikut ini adalah ciri dan ciri utama mangan -
Mirip dengan besi, mangan adalah logam abu-abu keperakan.
Mangan dapat dioksidasi dengan mudah, tetapi sangat sulit untuk memadukannya, karena sangat keras dan rapuh.
Di udara, mangan perlahan ternoda (oksidasi).
Mangan adalah salah satu unsur yang merupakan bagian dari golongan besi.
Terjadinya Mangan
Mangan adalah unsur paling melimpah ke- 12 di kerak bumi.
Tanah biasanya mengandung sekitar 7–9000 ppm mangan dengan rata-rata 440 ppm.
Air laut hanya mengandung sekitar 10 ppm mangan; Padahal, atmosfer mengandung sekitar 0,01 µg / m3.
Pyrolusite (MnO 2 ) adalah bijih mangan terpenting.
Senyawa Mangan
Berikut ini adalah senyawa utama mangan -
Mangan (II) oksida - MnO
Mangan (I) oksida - Mn 2 O 3
Mangan dioksida - MnO 2
Mangan klorida - MnCl 2
Kalium permanganat - KMnO 4
Mangan (II) sulfat - MnSO 4
Mangan (II) karbonat - MnCO 3
Mangan (II) sulfida - MnS
Mangan (II) nitrat - Mn (NO 3 ) 2
Mangan (II) bromida - MnBr 2
Mangan heptoksida - Mn 2 O 7
Dekarbonil dimangan - C 10 O 10 Mn 2
Mangan (II) iodida - MnI 2
Mangan (II) fluorida - MnF 2
Kegunaan Mangan
Berikut ini adalah kegunaan utama mangan -
Mangan adalah salah satu unsur terpenting dalam produksi baja.
Fosfat mangan biasanya digunakan untuk pencegahan karat dan korosi pada baja.
Dalam biologi, ion mangan (II) bertindak sebagai kofaktor untuk berbagai macam enzim.
Mangan juga penting dalam fenomena tanaman fotosintesis yang mengembangkan oksigen.
Mangan dioksida juga digunakan dalam pembuatan oksigen dan klorin dan untuk mengeringkan cat hitam.
pengantar
Besi adalah unsur yang paling umum ditemukan di sebagian besar bagian luar maupun dalam inti bumi.
Simbol dari besi adalah ‘Fe’ dan nomor atom adalah ‘26.’

Besi adalah salah satu elemen paling awal yang diketahui digunakan oleh manusia.
Fitur Penting Besi
Berikut ini adalah fitur utama besi -
Unsur besi murni bersifat lembut, ulet, dan mudah dibentuk.
Titik didih besi berkisar antara 1533 0 C dan 2450 0 C.
Besi dengan mudah tertarik pada magnet.
Di udara kering, besi tetap tidak aktif dan tidak bereaksi (dengan udara); Namun, di udara lembab, ia bereaksi dan membentuk karat.
Besi murni biasanya tidak bereaksi dengan air murni; Namun, ia bereaksi dengan mudah dengan air yang tercemar dan bentuk karat.
Besi bereaksi dengan halogen dan Sulfur untuk membentuk halida dan sulfida yang sesuai.
Terjadinya Besi
Inti dalam dan luar bumi sebagian besar terdiri dari besi dan nikel.
Kemungkinan besar, besi adalah unsur yang paling banyak tersedia di bumi; Namun, ini adalah elemen kerak keempat yang paling banyak tersedia.
Jenis Besi
Berikut ini adalah jenis-jenis utama besi -
Hematit - Fe 2 O 3
Magnetit - Fe 3 O 4
Siderit - FeCO 3
Senyawa Besi
Berikut ini adalah senyawa utama besi -
Besi (II) oksida - FeO
Besi (III) klorida - FeCl 3
Besi (III) oksida-hidroksida - Fe (OH) 3
Besi (II) sulfida - FeS
Besi (II) klorida - FeCl 2
Besi fosfat - FePO 4
Ferrate (VI) - (FeO 4 ) 2-
Besi (II) asetat - Fe (C 2 H 3 O 2 ) 2
Besi (III) sulfida - Fe 2 S 3
Besi (III) kromat - Fe 2 (CrO 4 ) 3
Besi (II) hidroksida - Fe (OH) 2
Besi (III) asetat - C 14 H 27 Fe 3 O
Besi (II) oksalat - FeC 2 O 4
Besi (II) flurida - FeF 2
Kegunaan Besi
Di antara semua logam, besi paling banyak digunakan (sekitar 90 persen dari total produksi logam dunia).
Di sebagian besar industri berat, besi adalah elemen terpenting.
Industri seperti kereta api, pembangunan kapal, mobil, konstruksi teknik, dll., Di mana pun, besi sangat dibutuhkan.
pengantar
Tembaga adalah logam yang lunak, ulet, dan mudah dibentuk.
Tembaga memiliki konduktivitas termal dan listrik yang sangat tinggi.
Simbol tembaga adalah ‘Cu’ dan nomor atom adalah ’29.’

Tembaga dikenal orang sejak (sekitar) c. 8000 SM.
Tembaga adalah logam pertama yang dilebur dari bijihnya sekitar c. 5000 SM.
Fitur-Fitur Penting Tembaga
Tembaga adalah logam pertama yang dicor menjadi suatu bentuk (dalam cetakan).
Tembaga adalah logam pertama yang berhasil dipadukan dengan logam lain, misalnya tembaga dengan timah dan dihasilkan perunggu. Itu dilakukan tentang c. 3500 SM.
Logam pertama yang sengaja dicampur dengan logam lain, timah, untuk membuat perunggu, c. 3500 SM.
Tembaga memiliki warna oranye kemerahan alami; itu terlihat setelah permukaannya terbuka.
Tembaga adalah konduktor listrik dan panas yang sangat baik.
Tembaga adalah unsur golongan 11 dari tabel periodik.
Tembaga biasanya tidak bereaksi dengan air; namun, ia bereaksi perlahan dengan oksigen atmosfer dan membentuk lapisan oksida tembaga hitam-coklat.
Tembaga oksida coklat-hitam biasanya melindungi logam yang mendasari dari korosi lebih lanjut seperti pasif.
Pasifasi adalah proses penggunaan lapisan tipis bahan pelindung, seperti oksida logam, yang digunakan untuk membuat selubung pelindung terhadap korosi.
Terjadinya Tembaga
Tembaga biasanya ditemukan di kerak bumi.
Pada tahun 1857, massa tembaga unsur terbesar (dengan berat sekitar 420 ton) ditemukan. Itu ditemukan di Semenanjung Keweenaw yang terletak di Michigan, AS.
Paduan Tembaga
Paduan logam, yang memiliki tembaga sebagai penyusun utamanya, dikenal sebagai paduan tembaga.
Paduan tembaga sangat tahan terhadap korosi.
Contoh terbaik dari paduan tembaga (tradisional) adalah perunggu (dibuat dengan mencampurkan timah dan kuningan).
Berikut ini adalah paduan utama tembaga -
Brass
Bronze
Auricupride
Perak Cina
Perunggu Korintus
Elektrum, Emas hijau
Emas abu-abu
Niello
Panchaloha
Emas mawar, merah, dan merah muda
Spangold
Shibuichi
Perak Tibet
emas putih
Senyawa Tembaga
Berikut ini adalah senyawa utama tembaga -
Cupric asetat - Cu (CH 3 COO) 2
Tembaga (I) oksida - Cu 2 O
Tembaga (II) oksida - CuO
Tembaga (II) klorida - CuCl 2
Dikopper klorida trihidroksida - Cu 2 (OH) 3 Cl
Tembaga (I) klorida - CuCl
Tembaga (II) nitrat - Cu (NO 3 ) 2
Tembaga Sianida - CuCN
Kegunaan Tembaga
Tembaga banyak digunakan dalam pembuatan kabel listrik.
Tembaga digunakan pada motor listrik.
Tembaga digunakan di atap, pipa ledeng, dan di banyak industri lainnya.
Cat tembaga digunakan untuk melukis perahu dan banyak bahan lainnya.
Banyak dari peralatan rumah tangga terbuat dari tembaga murni atau paduannya.
pengantar
Perak adalah logam transisi yang lembut, berkilau, dan putih.
Perak memiliki konduktivitas listrik dan termal tertinggi; dan, itu juga memiliki reflektifitas tertinggi dari semua logam.

Simbol perak adalah ‘Ag’ dan nomor atom adalah ’47.’
Fitur Penting Perak
Perak merupakan logam mulia yang digunakan sejak lama oleh manusia.
Perak adalah elemen golongan 11 dari tabel periodik.
Perak memiliki kilau logam putih yang sangat bagus yang biasa digunakan dalam cat tinggi.
Seperti perak tidak memiliki warna; Oleh karena itu, ia memiliki daya pantul (cahaya) yang tinggi.
Perak memiliki konduktivitas listrik dan termal yang sangat tinggi. Konduktivitas listriknya paling tinggi - lebih tinggi dari tembaga.
Di antara semua logam, perak juga memiliki resistansi kontak terendah.
Terjadinya Silver
Perak logam biasanya ditemukan di kerak bumi dalam bentuk murni.
Perak juga ditemukan sebagai paduan dengan emas dan beberapa logam lainnya.
Perak juga ditemukan di beberapa mineral, seperti argentit dan klorargirit.
Perak sebagian besar diproduksi sebagai produk sampingan dari emas, tembaga, seng, timbal, dll.
Paduan Perak
Berikut ini adalah paduan utama perak -
Perak sterling argentium
Perak Britannia
Doré bullion
Electrum
Goloid
Sterling platinum
Perak sterling
Perak Tibet
Senyawa Perak
Berikut ini adalah senyawa utama perak -
Perak klorida - AgCl
Perak iodida - Agl
Perak bromida - AgBr
Perak oksida - Ag 2 O
Perak sulfida - Ag 2 S
Perak fluorida - AgF
Perak sianida - AgCN
Perak karbonat - Ag 2 CO 3
Perak asetat - AgC 2 H 3 O 2
Perak sulfat - Ag 2 SO 4
Perak kromat - Ag 2 CrO 4
Perak oksalat - Ag 2 C 2 O 4
Perak klorat - AgClO 3
Kegunaan Perak
Berikut ini adalah kegunaan utama perak -
Sejak zaman kuno, perak digunakan dalam pembuatan koin.
Perak juga digunakan dalam pembuatan ornamen.
Banyak dari periuk rumah dan peralatan lainnya juga digunakan untuk dibuat dari perak.
Perak juga digunakan untuk pengobatan, karena digunakan sebagai lapisan antibiotik pada peralatan medis.
Karena memiliki daya hantar listrik yang sangat tinggi, perak umumnya digunakan pada beberapa perangkat elektronik.
Selain itu, perak memiliki banyak kegunaan lain, seperti dalam fotografi, peralatan kimia, partikel nano, dll.
pengantar
Emas adalah logam yang cerah, kuning kemerahan, lunak, padat, mudah dibentuk, dan ulet yang secara alami ditemukan di kerak bumi.
Simbol emas adalah ‘Au’ dan nomor atom adalah ‘79.’

Emas adalah (secara kimiawi) logam transisi dan termasuk golongan 11 dari tabel periodik.
Fitur Penting dari Emas
Emas, yang tetap dalam keadaan padat di bawah kondisi standar, adalah elemen yang paling tidak reaktif.
Emas tahan terhadap sebagian besar asam.
Emas larut dalam aqua regia; aqua regia adalah campuran asam nitrat dan asam klorida.
Namun, emas tidak larut dalam asam nitrat.
Emas biasanya larut dalam larutan alkali sianida.
Larutan sianida biasanya digunakan dalam penambangan dan pelapisan listrik.
Emas juga larut dalam merkuri dan bentuk ‘amalgam alloys.’
Emas tidak bereaksi dengan oksigen pada suhu apapun.
Terjadinya Emas
Emas biasanya muncul sebagai unsur bebas yaitu dalam bentuk alami.
Emas muncul sebagai nugget atau ditemukan di batuan, biji-bijian, di pembuluh darah, dan di beberapa endapan aluvial lainnya.
Emas juga terjadi dalam bentuk larutan padat dengan unsur aslinya seperti perak (sebagai elektrum).
Di beberapa tempat, emas juga secara alami dicampur dengan tembaga dan paladium.
Paduan Emas
Berikut ini adalah paduan utama emas -
Emas berwarna
Mahkota emas
Electrum
Mawar emas
Tumbaga
emas putih
Senyawa Emas
Berikut ini adalah senyawa utama emas -
Emas (III) klorida - AuCl 3
Emas (I) klorida - AuCl
Sianida - CN
Asam kloroaurat - HAuCl 4
Emas (III) oksida - Au 2 O 3
Emas bromida - AuBr
Aqua regia - HNO 3 + 3HCl
Emas bromida - AuBr 3
Emas (III) hidroksida - AuH 3 O 3
Emas fluorida - AuF 3
Emas (V) fluorida - AuF 5
Emas sulfida - Au 2 S
Emas penuh
Garam emas
Heptafluorida emas
Kegunaan Emas
Emas adalah salah satu elemen tertua yang digunakan manusia selama ribuan tahun.
Karena sangat berharga dan memberikan tampilan yang indah, maka digunakan secara khas dalam pembuatan ornamen.
Sesuai tren terkini (dunia), sekitar 50% emas digunakan dalam pembuatan perhiasan, 40% digunakan untuk investasi, dan 10% sisanya digunakan dalam industri.
pengantar
Platinum adalah unsur kimia yang mudah dibentuk, ulet, padat, dan sangat tidak reaktif.
Simbol dari platina adalah ‘Pt’ dan nomor atomnya adalah ‘78.’

Nama platina berasal dari istilah Spanyol yaitu 'platina', yang artinya "little silver. "
Platinum adalah logam (elemen) paling berharga dan paling langka di bumi.
Fitur Penting dari Platinum
Berikut adalah fitur penting dari platinum -
Platinum adalah logam putih perak.
Platinum adalah unsur golongan 10 dari tabel periodik.
Platina adalah salah satu elemen paling langka di kerak bumi.
Platinum adalah salah satu elemen yang paling tidak reaktif.
Platinum memiliki enam isotop alami.
Platinum adalah salah satu logam paling berharga dan berharga.
Platina memiliki karakteristik tahan korosi di semua kondisi. Karena alasan ini, ia dianggap sebagai logam mulia.
Platinum biasanya tidak larut dalam asam nitrat dan klorida, tetapi larut dalam aqua regia panas .
Setelah larut ke dalam aqua regia panas , platina menghasilkan asam kloroplatinat encer (lihat gambar di bawah).

Terjadinya Platinum
Platina umumnya ditemukan sebagai platina asli (alami) dan sebagai paduan dengan golongan platina lainnya.
Platina biasanya terdapat pada bijih nikel dan tembaga.
Platinum juga terjadi secara alami di pasir aluvial (umumnya ditemukan di sungai).
Platinum terjadi dengan konsentrasi hanya (sekitar) 0,005 ppm di kerak bumi.
Paduan Platinum
Platinum-iridium adalah salah satu paduan platina yang paling penting.
Senyawa Platinum
Berikut ini adalah senyawa utama platinum -
Platinum (II) klorida - Pt Cl 2
Platinum (IV) klorida - PtCl 4
Katalis Adam - PtO 2
Platinum hexafluoride - PtF 6
Kalium tetrakloropla - K 2 PtCl 4
Garam Krogmann - K 2 Pt (CN) 4 Br
Asam kloroplatinat - H 2 PtCl 6
Sodium hexachloropl - Na 2 PtCl 6
Aqua regia - HNO 3 + 3HCl
Kegunaan Platinum
Platinum digunakan sebagian besar untuk perangkat kontrol emisi kendaraan.
Platinum digunakan dalam penyulingan minyak bumi dan banyak produksi kimia lainnya.
Platinum digunakan pada perangkat elektronik, seperti pada hard disk (drive).
Platinum juga digunakan dalam perhiasan.
Terlepas dari semua penggunaan ini, platina juga digunakan dalam pengobatan (obat anti kanker), peralatan pembuatan kaca, elektroda, mesin turbin, investasi, dll.
pengantar
Dalam tabel periodik, seng adalah unsur pertama dari golongan 12.
Simbol seng adalah ‘Zn’ dan nomor atomnya adalah ‘30.’
Dalam hal ketersediaan, seng adalah unsur paling melimpah ke- 24 yang ditemukan di kerak bumi dan memiliki lima isotop stabil.

Bijih seng yang paling umum adalah sfalerit (zinc blende), yang merupakan mineral seng sulfida.
Andreas Sigismund Marggraf, ahli kimia Jerman, pertama kali menemukan seng logam murni pada tahun 1746.
Menariknya, alkemis membakar seng di udara dan membentuk sesuatu yang berbeda dan mereka menamakannya "philosopher's wool" atau "white snow. "
Fitur yang menonjol dari seng
Warna seng putih kebiruan dan logam berkilau dan diamagnetik.
Logam seng biasanya keras dan rapuh; namun, pada saat suhu meningkat dari 100 0 C, suhu menjadi lunak.
Ketika suhu meningkat 210 0 C, maka logam seng kembali menjadi rapuh dan mudah dihancurkan dengan pemukulan.
Seng adalah konduktor listrik.
Terjadinya Seng
Seng biasanya ditemukan terkait dengan beberapa logam dasar lain seperti tembaga dan timbal.
Sfalerit adalah salah satu bentuk seng sulfida dan merupakan bijih yang paling banyak ditambang.
Sfalerit mengandung sekitar 60 hingga 62% seng.
Paduan Seng
Berikut ini adalah paduan utama seng -
Brass
Perak nikel
Perak Jerman
Senyawa Seng
Berikut ini adalah senyawa utama seng -
Seng oksida - ZnO
Seng sulfida - ZnS
Seng halida - ZnF 2
Seng nitrat - Zn (NO 3 ) 2
Seng klorat - Zn (ClO 3 ) 2
Seng sulfat - ZnSO 4
Seng fosfat - Zn 3 (PO 4 ) 2
Seng molibdat - ZnMoO 4
Seng kromat - ZnCrO 4
Seng arsenit - Zn (AsO 2 ) 2
Seng asetat - Zn (O 2 CCH 3 ) 2
Kegunaan Seng
Seng merupakan salah satu unsur terpenting bagi kesehatan masyarakat.
Seng banyak digunakan sebagai agen anti korosi dan pelapis material besi dan baja.
Seng biasanya digunakan sebagai anoda atau bahan bakar baterai seng-udara.
Seng oksida banyak digunakan sebagai pigmen putih (lihat gambar di bawah) dalam cat.

Seng oksida juga digunakan sebagai katalis dalam pembuatan karet.
Seng pada dasarnya adalah elemen yang dibutuhkan untuk kesehatan kita; ini biasanya digunakan sebagai bahan tambahan dalam bentuk seng oksida, seng asetat, atau seng glukonat.
Seng biasanya merupakan bahan antioksidan.
Kekurangan seng dalam tubuh manusia dapat menyebabkan gangguan depresi berat.
Setelah cedera badan, seng digunakan untuk mempercepat proses penyembuhan.
Zinc pyrithione biasanya digunakan dalam sampo untuk mencegah ketombe.
Seng khelat biasanya digunakan dalam pasta gigi dan obat kumur (cair), karena mencegah bau mulut.
Seng juga melindungi kulit dari sengatan matahari, oleh karena itu digunakan dalam losion tubuh.
pengantar
Merkuri merupakan salah satu unsur kimia yang biasa disebut dengan 'quicksilver. '
Dahulu, merkuri dinamai 'hydrargyrum. '
Simbol merkuri adalah ‘Hg’ dan nomor atom adalah ‘80.’

Pigmen merah vermilion diekstraksi dengan menggiling cinnabar alami atau sulfida merkuri sintetis.
Fitur Penting Merkurius
Merkuri adalah logam berat dan putih keperakan.
Merkuri biasanya tersedia dalam bentuk cair; dalam kondisi normal, hanya sedikit unsur logam yang tetap dalam keadaan cair pada suhu kamar.
Merkuri adalah konduktor panas yang buruk, tetapi merupakan konduktor listrik yang baik.
Titik beku merkuri adalah −38,83 0 C dan titik didihnya 356,73 0 C.
Keracunan merkuri disebabkan karena menelan segala bentuk merkuri. Ini juga disebabkan oleh menghirup uap merkuri.
Merkuri melarutkan banyak logam termasuk emas dan perak untuk membentuk amalgam.
Terjadinya Merkurius
Merkuri adalah salah satu elemen paling langka di kerak bumi.
Bijih merkuri terkaya membawa sekitar 2,5 persen merkuri (dalam hal massa).
Merkuri ditemukan baik sebagai unsur asli (alami) atau dalam mineral corderoite, cinnabar, livingstonite, dll.
Merkuri ditemukan di wilayah sabuk pegunungan muda; sabuk yang terus memaksa batuan yang lebih padat ke kerak bumi. Misalnya daerah vulkanik atau bahkan daerah mata air panas.
Paduan Merkurius
Amalgam adalah paduan utama merkuri.
Senyawa Merkurius
Berikut adalah senyawa utama Merkurius -
Merkuri (II) klorida - HgCl 2
Merkuri (II) oksida - HgO
Merkuri sulfida - HgS
Merkuri (I) - klorida - Hg 2 Cl 2
Dimetilmer - C 2 H 6 Hg
Merkuri (II) nitrat - Hg (NO 3 ) 2
Merkuri (II) asetat - C 4 H 6 O 4 Hg
Merkuri (II) sulfat - HgSO 4
Merkuri (I) iodida - Hg 2 I 2
Mercury selenide - HgSe
Mercury (II) fulminate - Hg (CNO) 2
Merkuri (II) bromida - HgBr 2
Merkuri (II) iodida - HgI 2
Merkuri (I) oksida - Hg 2 O
Merkuri (I) fluorida - Hg 2 F 2
Mercuric amidochloride - ClH 2 HgN
Dietilmerkuri - C 4 H 10 Hg
Kegunaan Merkurius
Merkuri banyak digunakan dalam industri kimia.
Merkuri digunakan dalam aplikasi listrik dan elektronik.
Merkuri digunakan dalam termometer yang kami gunakan untuk mengukur suhu.
Merkuri bersama senyawanya biasa digunakan dalam berbagai obat-obatan.
pengantar
Plutonium pada dasarnya adalah logam aktinida dan tampak seperti abu-abu keperakan.
Unsur yang nomor atomnya berkisar antara 89 dan 103 ini dikenal sebagai unsur aktinida.
Simbol dari plutonium adalah ‘Pu’ dan nomor atom adalah ‘94.’

Plutonium biasanya memiliki enam alotrop.
Plutonium dinamai 'Pluto. '
Plutonium pertama kali ditemukan pada tahun 1940, oleh sekelompok ilmuwan yaitu Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan dan Arthur C. Wahl.
Fitur Penting dari Plutonium
Plutonium adalah unsur kimia radioaktif.
Plutonium ketika terkena udara akan ternoda dan ketika teroksidasi membentuk lapisan kusam.
Plutonium bereaksi dengan banyak unsur termasuk halogen, nitrogen, karbon, silikon, dan hidrogen.
Karena proses fisi, neutron terlepas dan mengubah inti uranium-238 menjadi plutonium-239.
Plutonium-239 dan plutonium-241 keduanya fisil, dan karenanya, mereka dapat mempertahankan reaksi berantai nuklir. Ini dapat diterapkan dengan sangat baik dalam senjata nuklir dan reaktor nuklir.
Titik leleh plutonium adalah 640 0 C dan titik didihnya 3.228 0 C.
Pelepasan inti helium (berenergi tinggi) adalah bentuk peluruhan radioaktif yang paling umum untuk plutonium.
Terjadinya Plutonium
Plutonium secara alami hanya ditemukan dalam jumlah kecil di dalam deposit uranium.
Plutonium juga diekstraksi dengan membakar uranium (sambil mengembangkan energi nuklir).
Paduan Plutonium
Berikut ini adalah paduan utama plutonium -
Plutonium-gallium adalah salah satu paduan penting dari plutonium dan juga galium.
Plutonium-galium digunakan di lubang senjata nuklir.
Plutonium-galium memiliki sifat muai panas yang sangat rendah.
Beberapa paduan plutonium lainnya adalah -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Senyawa Plutonium
Plutonium (IV) oksida - PuO 2
Plutonium (III) klorida - PuCl 3
Plutonium tetrafluorida - PuF 4
Kegunaan Plutonium
Isotop plutonium-239 merupakan salah satu elemen penting dalam pengembangan senjata nuklir.
Plutonium digunakan sebagai bahan bakar di pembangkit listrik tenaga nuklir.
pengantar
Uranium adalah logam dari deret aktinida dari tabel periodik.
Simbol uranium adalah ‘U’ dan nomor atom adalah ’92.’
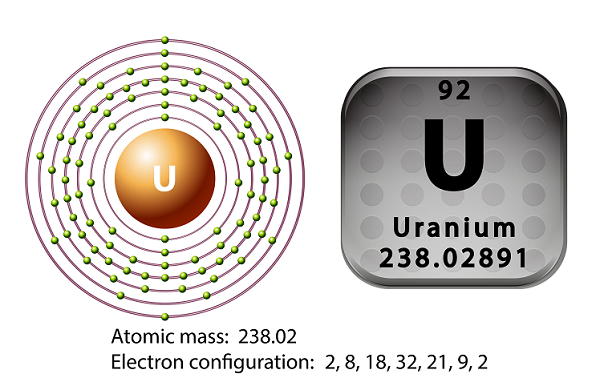
Pada tahun 1789, Martin Heinrich Klaproth telah menemukan unsur uranium dan menamakannya dengan nama Uranus.
Fitur Penting Uranium
Uranium adalah logam berwarna putih keperakan.
Sebuah atom uranium memiliki 92 elektron dan 92 proton, 6 di antaranya adalah elektron valensi.
Karena memiliki isotop yang tidak stabil, uranium merupakan unsur radioaktif yang lemah.
Uranium-238 adalah isotop uranium yang paling umum.
Uranium terjadi secara alami dalam konsentrasi yang sangat rendah yaitu beberapa bagian per juta di batuan, tanah, dan air.
Uranium membusuk secara bertahap (perlahan) dengan memancarkan partikel alfa-nya.
Uranium memiliki konduktivitas listrik yang buruk (konduktor listrik yang buruk).
Uranium mudah dibentuk, ulet, dan sedikit paramagnetik
Terjadinya Uranium
Uranium (secara alami) ditemukan sebagai uranium-238, uranium-235, dan uranium-234.
Waktu paruh uranium-238 sekitar 4,47 miliar tahun hampir seusia Bumi dan paruh uranium-235 sekitar 704 juta tahun.
Paduan Uranium
Berikut ini adalah paduan utama Uranium -
Staballoy
Uranium hidrida
Senyawa Uranium
Berikut ini adalah senyawa utama Uranium -
Uranium nitrida - U 2 N 3
Uranium pentafluoride - UF 5
Uranium karbida - UC
Uranyl fluoride - UO 2 F 2
Uranium dioksida - UO 2
Uranium hexafluoride - UF 6
Triuranium oxtoxide - U 3 O 8
Uranium tetrafluorida - UF 4
Uranium trioksida - UO 3
Uranium tetraklorida - Ucl 4
Uranyl nitrate - UO 2 (NO 3 ) 2
Kegunaan Uranium
Uranium digunakan sebagai sumber tenaga di kapal selam nuklir (terutama oleh militer).
Uranium digunakan dalam pembuatan senjata nuklir.
Uranium juga digunakan sebagai pemberat untuk kapal.
pengantar
Timbal adalah unsur kimia berat (logam) yang memiliki massa jenis tinggi.
Simbol timbal adalah ‘Pb’ dan nomor atom adalah ‘82.’

Timbal memiliki kecenderungan untuk mengikat dirinya sendiri; juga dapat membentuk rantai, ikatan, cincin, dan struktur polihedral.
Fitur Utama dari Timbal
Timbal adalah logam yang lunak dan mudah dibentuk; itu memiliki titik leleh yang relatif rendah.
Timbal merupakan unsur yang relatif tidak reaktif dan cenderung membentuk ikatan perjanjian.
Saat timbal dipotong, akan muncul warna putih kebiruan.
Saat terbakar, timbal menghasilkan nyala putih kebiruan (lihat gambar di bawah).

Senyawa timbal biasanya ditemukan dalam bilangan oksidasi +2.
Terjadinya Timbal
Timbal diketahui orang prasejarah di Asia Barat.
Timbal ditemukan di kerak bumi; itu jarang ditemukan jauh di dalam bumi.
Timbal biasanya ditemukan dalam kombinasi dengan belerang.
Galena adalah mineral pembawa timbal utama, sebagian besar ditemukan dengan bijih seng.
Paduan Timbal
Berikut adalah paduan utama timbal -
Molybdochalkos (tembaga)
Solder (timah)
Terne (timah)
Senyawa Timbal
Berikut adalah senyawa utama timbal -
Timbal monoksida - PbO
Timbal dioksida - PbO 2
Penggunaan Timbal
Timbal telah digunakan dalam pembuatan peluru selama ratusan tahun.
Timbal biasanya digunakan sebagai selubung pelindung untuk kabel bawah air (hanya karena memiliki sifat tahan korosi).
Lembaran timbal juga digunakan sebagai logam arsitektur terutama pada bahan atap.
Timbal juga digunakan dalam baterai asam.
Senyawa timbal umumnya sebagai zat pewarna dan semikonduktor.
Senyawa timbal juga digunakan dalam plastik, lilin, gelas, dll.
Timbal biasanya digunakan dalam polivinil klorida (yaitu digunakan untuk melapisi kabel listrik).
Pencegahan
Kehadiran timbal (dalam kualitas yang berlebihan) di dalam tubuh dapat menyebabkan kerusakan parah pada otak dan ginjal; bahkan bisa menyebabkan kematian pada akhirnya.
pengantar
Torium adalah salah satu logam aktinida radioaktif yang terjadi secara alami dalam jumlah besar.
Simbol dari torium adalah ‘Th’ dan nomor atom adalah ’90.’

Pada tahun 1829, seorang ahli mineralogi Norwegia Morten Thrane Esmark, pertama kali menemukan thorium.
Jöns Jacob Berzelius, ahli kimia Swedia, mengidentifikasi dan menamakannya 'thorium' setelah nama 'Thor', dewa petir Norse.
Fitur Penting dari Thorium
Torium adalah logam aktinida radioaktif paramagnetik dan lunak.
Warna logam thorium adalah keperakan; ketika terkena udara, ia menjadi hitam dan membentuk dioksida.
Semua isotop torium tidak stabil dan merupakan unsur radioaktif lemah.
Di antara semua unsur radioaktif yang signifikan, waktu paruh torium adalah yang paling lama, yaitu sekitar 14,05 miliar tahun.
Titik leleh torium sekitar 1750 0 C.
Terjadinya Thorium
Torium adalah unsur primordial yang sudah ada dalam bentuknya saat ini sejak sebelum Bumi terbentuk.
Thorium, ditemukan di kerak bumi, dimurnikan dari pasir monasit.
Monasit yang terjadi dalam jumlah besar di seluruh dunia merupakan sumber thorium yang paling penting.
Paduan dari Thorium
Mag-Thor dan thorium-aluminium adalah paduan paling signifikan dari thorium, Magnesium, dan aluminium.
Senyawa Thorium
Berikut ini adalah senyawa utama Thorium -
Thorium dioksida - Tho 2
Thorium (IV) sulfida - ThS 2
Thorium (IV) iodida - ThI 4
Thorium tetrafluorida - ThF 4
Thorium (IV klorida - ThCl 4
Thorium (IV) karbida - ThC
Beberapa lainnya adalah -
Thorite
Thorium (IV) nitrat
Thorium (IV) ortosilikat
Kegunaan Thorium
Torium biasanya digunakan dalam pengelasan busur tungsten gas (GTAW) karena (torium) meningkatkan kekuatan suhu tinggi elektroda tungsten dan karenanya meningkatkan stabilitas busur.
Pada peralatan elektronik, penerapan lapisan thorium pada kawat tungsten, meningkatkan emisi elektron katoda yang dipanaskan.
Dalam industri kimia, torium yaitu dioksida ‘thoria’ biasa digunakan.
pengantar
Dalam tabel periodik, hidrogen adalah unsur paling ringan, berat atomnya hanya 1,008.
Simbol hidrogen adalah ‘H’ dan nomor atomnya adalah ‘1.’

Pada awal abad ke - 16 , gas hidrogen pertama kali diproduksi secara artifisial oleh reaksi asam dan logam.
Henry Cavendish pertama kali mengenali gas hidrogen sebagai zat yang terpisah selama periode 1766-81, karena menghasilkan air saat dibakar.
Ciri-ciri Utama Hidrogen
Dalam keadaan plasma mereka, bintang non-sisa terutama terdiri dari hidrogen.
Pada suhu dan tekanan standar, hidrogen tampak tidak berwarna, tidak berasa, tidak berbau, bukan logam, tidak beracun, dan gas diatomik yang sangat mudah terbakar.
Rumus molekul hidrogen adalah H 2 .
Di bumi, hidrogen ada dalam bentuk molekul, misalnya air atau senyawa organik lainnya.
Hidrogen juga berperan penting dalam reaksi asam basa.
Gas hidrogen sangat mudah terbakar di udara.
Api hidrogen-oksigen murni memancarkan sinar ultraviolet; Selanjutnya, dengan campuran oksigen tinggi hampir tidak terlihat dengan mata telanjang.
Hidrogen dapat bereaksi dengan hampir semua unsur pengoksidasi.
Pada suhu kamar, Hidrogen biasanya bereaksi secara spontan dan kejam dengan klorin dan fluor dan membentuk hidrogen halida yang sesuai.
Terjadinya Hidrogen
Terdiri dari sekitar 75 persen dari semua massa baryonic, hidrogen adalah bahan kimia yang paling banyak ditemukan di alam semesta.
Di seluruh alam semesta, hidrogen biasanya ditemukan dalam keadaan atom dan plasma; akan tetapi, sifat-sifatnya sangat berbeda dari sifat molekul hidrogen.
Di bumi, hidrogen ada sebagai gas diatomik, yaitu H 2 .
Karena memiliki bobot yang ringan, hidrogen dengan mudah lepas dari atmosfer bumi.
Hidrogen adalah unsur paling melimpah ketiga yang ditemukan di permukaan bumi, tetapi sebagian besar ditemukan dalam bentuk hidrokarbon dan air.
Senyawa Hidrogen
Berikut adalah senyawa utama hidrogen -
Air - H 2 O
Amonia - NH 3
Hidrogen klorida - HCl
Hidrogen fluorida - HF
Hidrogen sulfida - H 2 S
Metana - CH 4
Hidroksida - OH -
Hidrogen bromida - HBr
Hidrogen iodida - HI
Hidrogen sianida - HCN
Fosfin - PH 3
Hidrogen selenida - H 2 Se
Metanol - CH 3 OH
Litium hidrida - LiH
Bikarbonat - HCO 3
Hidrogen telurida - H 2 Te
Hidrogen cair - H 2
Sianida - CN
Kalsium hidrida - CaH 2
Air deras - D 2 O
Diborane - B 2 H 6
Natrium hidrida - NaH
Potasium hidrida - KH
Kegunaan Hidrogen
Jumlah H 2 terbesar digunakan dalam pemrosesan bahan bakar fosil serta dalam produksi amonia.
Hidrogen (H 2 ) banyak digunakan dalam industri perminyakan dan kimia.
H 2 biasanya digunakan sebagai agen hidrogenasi, terutama dalam meningkatkan tingkat kejenuhan lemak dan minyak tak jenuh.
H 2 juga digunakan sebagai gas pelindung dalam prosedur pengelasan, seperti pengelasan atom hidrogen, dll.
pengantar
Helium adalah unsur paling ringan kedua (setelah hidrogen) dan unsur paling melimpah kedua di alam semesta.
Simbol dari Helium adalah ‘He’ dan nomor atom adalah ‘2.’

Dalam tabel periodik, Helium adalah yang pertama dalam golongan gas mulia.
Helium dinamai menurut nama dewa Matahari Yunani, 'Helios. '
Fitur Utama dari Helium
Helium adalah gas yang tidak berwarna, tidak berbau, tidak berasa, lembam, tidak beracun, dan monatomik.
Titik didih helium (-268,9 0 C) adalah yang paling rendah di antara semua unsur.
Helium biasanya terdiri dari dua elektron di orbital atom dan dikelilingi oleh inti, yang terdiri dari dua proton dan dua neutron.
Terjadinya Helium
Sebagian besar milik helium yang ditemukan di alam semesta helium-4, dan diyakini terbentuk selama Big Bang.
Bagian utama helium baru biasanya diciptakan oleh fusi nuklir hidrogen di bintang-bintang termasuk Matahari.
Meskipun ada penciptaan helium baru secara terus menerus; Namun, ketersediaan helium di bumi sangat rendah karena sebagai unsur yang ringan, helium dengan mudah lepas ke luar angkasa.
Di heterosfer (atmosfer luar) bumi, helium merupakan salah satu unsur (gas) yang paling banyak ditemukan.
Di kerak bumi, helium secara khas ditemukan dalam jumlah besar di mineral uranium dan thorium.
Senyawa Helium
Berikut adalah senyawa utama helium -
Disodium helida - Na 2 He
Cristobalite He II (Silikat) - SiO 2 He
Dihelium arsenolite - Sebagai 4 O 6 • 2He
Isotop Helium
Ada sekitar sembilan isotop helium yang diketahui, tetapi dua isotop berikut adalah yang paling stabil -
Helium-3 dan
Helium-4
Kegunaan Helium
Karena memiliki kerapatan rendah, titik didih rendah, kelarutan rendah, konduktivitas termal tinggi, helium merupakan elemen yang banyak digunakan; contoh paling populer adalah - penggunaan helium dalam balon.
Sebagian besar helium memiliki aplikasi kriogenik, seperti, mendinginkan magnet superkonduktor yang digunakan dalam pemindai MRI medis dan spektrometer NMR.
Helium juga digunakan sebagai gas pelindung dalam menumbuhkan kristal silikon dan germanium.
Helium juga digunakan dalam kromatografi gas dan produksi titanium dan zirkonium.
Helium digunakan di terowongan angin supersonik.
Helium juga digunakan sebagai gas pelindung dalam proses pengelasan busur.
pengantar
Oksigen adalah anggota golongan 16 pada tabel periodik; namun, seringkali, diperlakukan berbeda dari kelompoknya.
Simbol oksigen adalah ‘O’ dan nomor atom adalah ‘8.’

Oksigen memiliki sekitar sembilan alotrop dan alotrop yang paling umum adalah oksigen diatomik (yaitu O 2 ). Alotrop penting lainnya adalah Ozon yaitu O 3 .
Oksigen, pertama kali, diperhatikan oleh apoteker Swedia Carl Wilhelm Scheele.
Fitur Penting Oksigen
Oksigen secara khas dikategorikan sebagai anggota kelompok "chalcogen".
Kata "chalcogen" berasal dari kata Yunani “khalkόs, "Yang berarti" tembaga "dan kata Latin-Yunani"Genēs, ”Yang artinya lahir atau diproduksi.
Oksigen adalah gas yang sangat reaktif (atau elemen bukan logam); karenanya, ini adalah agen pengoksidasi yang dengan mudah membentuk oksida dengan sebagian besar unsur dan senyawanya.
Oksigen memiliki enam elektron valensi.
Titik leleh oksigen adalah -218,8 0 C dan titik didihnya -183 0 C.
Terjadinya Oksigen
Dengan sekitar 20,8 persen bagian (dalam total konstituen atmosfer bumi), oksigen adalah elemen peringkat kedua dari atmosfer bumi.
Oksigen terjadi hampir di seluruh bidang bumi yaitu atmosfer, hidrosfer, dan litosfer.
Selama proses fotosintesis, oksigen bebas diproduksi oleh semua tumbuhan hijau.
Oksigen terjadi sebagai penyusun bijih tembaga.
Tubuh manusia mengandung sekitar 65 persen oksigen.
Berdasarkan massanya, hampir setengah dari kerak bumi terdiri dari oksigen (yaitu oksidanya).
Berdasarkan massa, oksigen adalah unsur paling melimpah ketiga yang ditemukan di alam semesta; yang pertama dan kedua adalah hidrogen dan helium.
Oksigen (yaitu O 2 ) adalah gas diatomik yang tidak berwarna dan tidak berbau.
Oksigen sangat mudah larut dalam air; namun, kelarutan oksigen dalam air bergantung pada suhu.
Senyawa Oksigen
Berikut ini adalah senyawa utama oksigen -
Oxide
Peroxide
Karbon dioksida - CO 2
Hidroksida - OH -
Ozon - O 3
Merkuri (II) oksida - HgO
Klorat - ClO 3
Aluminium oksida - Al 2 O 3
Karbon monoksida - CO
Hipoklorit - ClO -
Silikon dioksida - SiO 2
Asam hipofluorous - HOF
Natrium peroksida - Na 2 O 2
Kalium klorat - KClO 3
Oxygen difluoride - OF 2
Natrium oksida - Na 2 O
Penggunaan Oksigen
Oksigen (O 2 ) adalah kebutuhan paling esensial untuk respirasi, tanpanya, kehidupan tidak dapat dibayangkan.
Oksigen digunakan dalam pengobatan.
Terapi oksigen biasanya digunakan untuk mengobati beberapa penyakit, seperti, emfisema, pneumonia, beberapa gangguan jantung, dll.
Beberapa aktivitas bawah laut seperti scuba diving, kapal selam, dll juga menggunakan oksigen buatan.

Pesawat udara, pendaki gunung, dll. Juga menggunakan oksigen buatan.
Oksigen juga digunakan di beberapa industri, misalnya peleburan bijih besi menjadi baja - dalam proses ini, sekitar 55% oksigen digunakan.
pengantar
Karbon adalah elemen non-logam dan tetravalen.
Alat tetravalen - karbon membuat empat elektron tersedia untuk membentuk ikatan kimia kovalen.
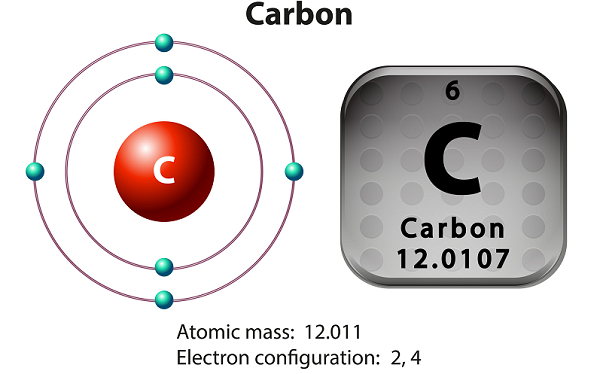
Karbon memiliki tiga isotop yang terjadi secara alami - yaitu 12 C, 13 C, dan 14 C.
Diantaranya, 12 C dan 13 C stabil, tetapi 14 C adalah isotop radioaktif. Waktu paruh 14 C adalah sekitar 5.730 tahun.
Fitur-Fitur Penting Karbon
Sifat fisik karbon sangat bergantung pada alotropnya.
Alotrop utama karbon adalah grafit, intan, dan karbon amorf.
Grafit berwarna buram, hitam, dan sangat lembut; karenanya, digunakan untuk membentuk coretan di atas kertas.
Berlian sangat keras (bahan alami terkeras) dan transparan.
Grafit adalah konduktor listrik yang baik.
Intan adalah konduktor listrik yang buruk.
Karbon kemungkinan besar memiliki titik sublimasi tertinggi di antara semua elemen.
Terjadinya Karbon
Dalam hal massa, karbon adalah unsur kimia paling melimpah keempat yang ditemukan di alam semesta (setelah hidrogen, helium, dan oksigen).
Karbon tersedia dalam jumlah melimpah di Matahari, bintang, komet, dan atmosfer di sebagian besar planet.
Karbon ditemukan di atmosfer bumi dan larut dalam air.
Hidrokarbon, seperti batubara, minyak bumi, dan gas alam, semuanya mengandung karbon.
Karbon juga ditemukan dalam hidrat metana, yang ditemukan di daerah kutub dan di bawah laut.
Beberapa batuan yang diperkaya karbon adalah batubara, batugamping, dolomit, dll.
Batubara sangat kaya akan karbon; karenanya, ini adalah sumber karbon mineral komersial terbesar.
Batubara berbagi sekitar 4.000 gigaton atau 80% dari total bahan bakar fosil.
Senyawa Karbon
Berikut adalah senyawa utama Karbon -
Sianogen - CN 2
Hidrogen sianida - HCN
Sianamida - CN 2 H 2
Asam isosianat - HNCO
Sianogen klorida - CNCl
Klorosulfonil isosianat - CNClO 3 S
Sianurat klorida - NCCl 3
Karbon disulfida - CS 2
Karbonil sulfida - OCS
Karbon monosulfida - CS
Kegunaan Karbon
Bergantung pada alotrop, karbon digunakan dalam berbagai aplikasi.
Karbon adalah salah satu elemen terpenting dalam kehidupan tanpanya, kita tidak dapat membayangkan kehidupan di bumi.
Bahan bakar fosil yaitu gas metana dan minyak mentah (minyak bumi), batu bara dll digunakan dalam kehidupan sehari-hari.
Grafit, dikombinasikan dengan tanah liat, digunakan dalam pembuatan 'timah' yang digunakan pada pensil.
Arang juga digunakan sebagai bahan gambar dalam karya seni, peleburan besi, pemanggang barbekyu, dll.
Berlian biasanya digunakan dalam perhiasan.
Berlian industri digunakan untuk memotong, mengebor, dan memoles alat untuk mengolah logam dan batu.
Hidrokarbon fosil, dan serat karbon digunakan dalam pembuatan plastik.
pengantar
Nitrogen adalah unsur kimia dari golongan 15 dalam tabel periodik; di antara semua elemen kelompok 15, itu adalah elemen paling ringan.
Simbol nitrogen adalah ‘N’ dan nomor atom adalah 7.

Pada 1772, dokter Skotlandia Daniel Rutherford, pertama kali menemukan dan mengisolasi karbon.
Namun, nama 'nitrogen' pertama kali diberikan oleh Jean-Antoine-Claude Chaptal pada tahun 1790.
Fitur Penting Nitrogen
Nitrogen memiliki dua isotop stabil yaitu 14 N dan 15 N.
Atom nitrogen bebas biasanya mudah bereaksi dengan sebagian besar elemen dan membentuk nitrida.
Molekul N 2 adalah gas tidak berwarna, tidak berbau, tidak berasa, dan diamagnetik pada kondisi standar.
Titik lebur N 2 adalah −210 0 C dan titik didihnya −196 0 C.
Senyawa nitrogen secara berulang-ulang bertukar antara atmosfer dan organisme hidup, membuat siklus nitrogen.
Terjadinya Nitrogen
Nitrogen merupakan unsur yang paling banyak ditemukan di bumi, karena merupakan 78,1% dari seluruh volume atmosfer bumi.
Gas nitrogen, yang merupakan gas industri, sebagian besar dihasilkan oleh distilasi fraksional udara cair.
Senyawa Nitrogen
Berikut ini adalah senyawa utama Nitrogen -
Amonium - NH 4+
Amonia - NH 3
Asam nitrat - HNO 3
Nitrit - NO 2-
Nitrogen dioksida - NO 2
Dinitrogen pentroksida - N 2 O 5
Hidrazin - N 2 H 4
Dinitrogen - N 2
Sianida - CN
Amonium nitrat - (NH 4 ) (NO 3 )
Nitrogen triklorida - NCl 3
Nitrogen trifluorida - NF 3
Nitrogen triiodida - NI 3
Piridin - C 5 H 5 N
Ion nitronium - NO 2+
Asam hidrazoat - HN 3
Amonium sulfat - (NH 4 ) 2 SO 4
Kegunaan Nitrogen
Senyawa nitrogen banyak digunakan di berbagai bidang dan industri.
Nitrogen murni digunakan sebagai aditif makanan.
Digunakan dalam sistem pemadaman kebakaran terutama untuk peralatan teknologi informasi.
Juga digunakan dalam pembuatan baja tahan karat.
Nitrogen juga digunakan untuk mengembang ban beberapa pesawat terbang dan mobil balap.
Nitrogen cair digunakan sebagai refrigeran.
Hukum alam yang berkaitan dengan kimia dikenal sebagai hukum kimia.
Reaksi kimia biasanya diatur oleh hukum-hukum tertentu, yang diamati dan dirumuskan dengan kata-kata menjadi konsep dasar dalam kimia.
Berikut adalah hukum kimia penting -
| Hukum | Penjelasan |
|---|---|
| Hukum Avogadro | "Volume yang sama dari semua gas, pada suhu dan tekanan yang sama, memiliki jumlah molekul yang sama" |
| Hukum Beer – Lambert, (atau hukum Beer atau hukum Lambert – Beer) | “Menjelaskan redaman cahaya pada sifat-sifat material yang dilaluinya (cahaya)” |
| Hukum Boyle | “Tekanan absolut yang diberikan oleh massa tertentu dari gas ideal berbanding terbalik dengan volume yang ditempati jika suhu dan jumlah gas tetap tidak berubah dalam sistem tertutup” |
| Hukum Charles (juga dikenal sebagai Hukum Volume) | "Ketika tekanan pada sampel gas kering dipertahankan konstan, suhu Kelvin dan volume akan berhubungan langsung" |
| Hukum Difusi Fick | Menjelaskan "difusi" (fluks) |
| Hukum Gay-Lussac | "Semua gas memiliki ekspansivitas termal rata-rata yang sama pada tekanan konstan pada kisaran suhu yang sama" |
| Prinsip Le Chatelier ("Hukum Ekuilibrium") | "Ketika sistem apa pun pada kesetimbangan mengalami perubahan konsentrasi, suhu, volume, atau tekanan, maka sistem tersebut menyesuaikan dirinya sendiri untuk melawan (sebagian) efek dari perubahan yang diterapkan dan kesetimbangan baru terbentuk" |
| Hukum Henry | "Hukum menghitung konsentrasi gas dalam larutan di bawah tekanan" |
| Hukum Hess | "Perubahan entalpi dalam reaksi kimia (artinya, panas reaksi pada tekanan konstan) tidak bergantung pada jalur antara keadaan awal dan akhir" |
| Hukum kekekalan energi | "Energi tidak dapat diciptakan atau dihancurkan" |
| Hukum Raoult | “Tekanan uap parsial tiap komponen campuran ideal cairan sama dengan tekanan uap komponen murni dikalikan dengan fraksi molnya dalam campuran” |
| Elektrolisis Hukum Faraday | "Jumlah zat yang diproduksi di elektroda berbanding lurus dengan jumlah listrik yang dilewatkan" |
| Teori Atom | “Materi terdiri dari unit berbeda yang disebut atom” |
| Teori Köhler | “Menjelaskan proses di mana uap air mengembun dan membentuk awan cair yang jatuh” |
| Persamaan Van 't Hoff | “Menjelaskan perubahan konstanta kesetimbangan reaksi kimia” |
| Teori Keadaan Transisi | “Laju reaksi reaksi kimia dasar” |
| Grotthuss – Hukum Draper | "Ini menjelaskan bahwa cahaya yang diserap oleh suatu sistem / permukaan dapat membawa perubahan fotokimia" |
| Teori Kinetik Gas | "Menjelaskan perilaku gas ideal hipotetis" |
| Prinsip Aufbau | “Menjelaskan bahwa elektron yang mengorbit atom pertama-tama mengisi tingkat energi terendah dan kemudian yang kedua lebih tinggi dan seterusnya dan seterusnya” |
| Aturan Hund | “Menjelaskan bahwa setiap orbital dalam sublevel ditempati tunggal sebelum orbital mana pun ditempati ganda” |
| Teori Tabrakan | “Berdasarkan teori kinetik gas, teori tumbukan menjelaskan bahwa reaksi kimia fase gas terjadi ketika molekul bertabrakan dengan energi kinetik yang cukup” |
pengantar
Tembaga kemungkinan besar adalah elemen pertama, yang ditambang dan digunakan oleh manusia.
Bukti penggunaan tembaga paling awal ditemukan di Anatolia, yang dimiliki oleh 6.000 SM.
Timbal kemungkinan besar adalah elemen kedua yang mulai digunakan manusia.
Artefak timah tertua yang diketahui adalah patung, yang ditemukan di sebuah kuil Osiris, Abydos, Mesir.
Patung kuil Osiris milik (sekitar) 3.800 SM.
Harta emas tertua yang diketahui ditemukan di Varna, Necropolis (Bulgaria).
Harta emas ini dimiliki (sekitar) 4.400 SM.
Penemuan perak hampir sama dengan emas; buktinya ditemukan di Asia Kecil.
Beberapa bukti mengatakan bahwa besi itu diketahui dari (sekitar) 5.000 SM.
Benda besi tertua yang diketahui, yang digunakan oleh manusia, ditemukan di Mesir (milik 4000 SM).
Tabel berikut mengilustrasikan elemen penting dengan tanggal penemuannya dan penemuannya -
| Elemen | Penemu | Tanggal Penemuan |
|---|---|---|
| Tembaga | Timur Tengah (Tempat) | Sekitar 9.000 SM |
| Memimpin | Mesir (Tempat) | Sekitar 7.000 SM |
| Emas | Bulgaria (Tempat) | Sekitar 6.000 SM |
| Perak | Asia Kecil (Tempat) | Sekitar 5.000 SM |
| Besi | Mesir (Tempat) | Sekitar 5.000 SM |
| Timah | Sekitar 3.500 SM | |
| Sulfur | Cina / India | Sekitar 2.000 SM |
| Air raksa | Mesir | 2.000 SM |
| Fosfor | H. Merek | 1669 |
| Kobalt | G. Brandt | 1735 |
| Platinum | A. de Ulloa | 1748 |
| Nikel | F. Cronstedt | 1751 |
| Bismut | CF Geoffroy | 1753 |
| Magnesium | J. Black | 1755 |
| Hidrogen | H. Cavendish | 1766 |
| Oksigen | W. Scheele | 1771 |
| Nitrogen | D. Rutherford | 1772 |
| Barium | W. Scheele | 1772 |
| Klorin | W. Scheele | 1774 |
| Mangan | W. Scheele | 1774 |
| Molibdenum | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirkonium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Berilium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Kalium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Kalsium | H. Davy | 1808 |
| Boron | L. Gay-Lussac dan LJ Thénard | 1808 |
| Fluor | AM Ampère | 1810 |
| Yodium | B. Courtois | 1811 |
| Litium | A. Arfwedson | 1817 |
| Kadmium | S.L Hermann, F. Stromeyer, dan JCH Roloff | 1817 |
| Selenium | J. Berzelius dan G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | HCØrsted | 1825 |
| Brom | J. Balard dan C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen dan GR Kirchhoff | 1861 |
| Talium | W. Crookes | 1861 |
| Indium | F. Reich dan T. Richter | 1863 |
| Helium | P. Janssen dan N. Lockyer | 1868 |
| Neon | W. Ramsay dan W. Travers | 1898 |
| Xenon | W. Ramsay dan W. Travers | 1898 |
| Fermium | A. Ghiorso dkk | 1952 |
| Nobelium | ED Donets, VA Shchegolev, dan VA Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris dan P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
Tabel berikut mengilustrasikan elemen signifikan dan valensinya -
| Elemen | Valensi | Simbol | Nomor atom |
|---|---|---|---|
| Hidrogen | -1, +1 | H. | 1 |
| Helium | 0 | Dia | 2 |
| Litium | 1 | Li | 3 |
| Berilium | 2 | Menjadi | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Karbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oksigen | -1, -2, 0, 2, 1, | HAI | 8 |
| Fluor | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminium | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Fosfor | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P. | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Klorin | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Kalium | -1, 1 | K | 19 |
| Kalsium | 2 | Ca | 20 |
| Skandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V. | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Kr | 24 |
| Mangan | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | M N | 25 |
| Besi | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Kobalt | -1, 0, 5, 4, 3, 2, 1 | Bersama | 27 |
| Nikel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Tembaga | 4, 3, 2, 1, 0 | Cu | 29 |
| Seng | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenik | -3, 5, 3, 2, | Sebagai | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Brom | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Stronsium | 2 | Sr. | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirkonium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molibdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |