化学-カーボン
前書き
炭素は非金属で4価の元素です。
4価の手段–炭素は4つの電子を利用可能にして共有化学結合を形成します。
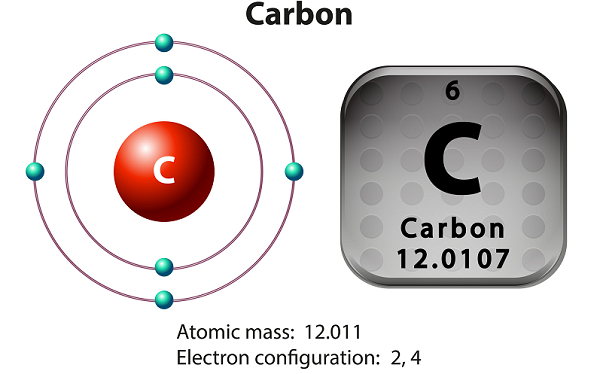
すなわち-炭素は、天然に存在する3つの同位体が有する12 C、13 C、および14 Cを
これらの中で、12 Cおよび13 Cは安定であるが、14 Cは放射性同位体です。半減期は14 Cは、5730年についてです。
カーボンの顕著な特徴
炭素の物理的性質は、その同素体に大きく依存します。
炭素の主な同素体は、グラファイト、ダイヤモンド、およびアモルファスカーボンです。
グラファイトは不透明で黒く、非常に柔らかいです。したがって、それは紙に縞を形成するために使用されました。
ダイヤモンドは非常に硬く(最も硬い天然素材)、透明です。
グラファイトは優れた電気伝導体です。
ダイヤモンドは電気の悪い導体です。
炭素は、すべての元素の中で最も昇華点が高い可能性があります。
炭素の発生
質量に関しては、炭素は宇宙で4番目に豊富な化学元素です(水素、ヘリウム、酸素に次ぐ)。
炭素は、太陽、星、彗星、そしてほとんどの惑星の大気中に豊富に存在します。
炭素は地球の大気中に存在し、水に溶けています。
石炭、石油、天然ガスなどの炭化水素には、すべて炭素が含まれています。
炭素は、極地や海底で見られるメタンハイドレートにも見られます。
炭素が豊富な岩石には、石炭、石灰岩、ドロマイトなどがあります。
石炭は炭素が非常に豊富です。したがって、それはミネラルカーボンの最大の商業的供給源です。
石炭は約4,000ギガトンまたは総化石燃料の80%を共有しています。
炭素化合物
以下は炭素の主な化合物です-
シアン- CN 2
シアン化水素- HCN
シアナミド- CN 2 H 2
イソシアン酸- HNCO
塩化シアン- CNCL
クロロスルホニルイソシアネート- CNClO 3 S
塩化シアヌル- NCCL 3
二硫化炭素- CS 2
硫化カルボニル- OCS
一硫化炭素- CS
カーボンの使用
同素体に応じて、炭素はさまざまな用途で使用されます。
炭素は、炭素がなければ生命の最も重要な要素の1つであり、地球上の生命を想像することはできません。
化石燃料であるメタンガスや原油(石油)、石炭などが日常生活で使われています。
鉛筆に使用される「鉛」の製造に使用される、粘土と組み合わせたグラファイト。
木炭は、アートワーク、製鉄、バーベキュー焼きなどの描画材料としても使用されます。
ダイヤモンドは通常、ジュエリーに使用されます。
工業用ダイヤモンドは、金属や石を機械加工するための切削、穴あけ、研磨ツールに使用されます。
プラスチックの製造には、化石炭化水素と炭素繊維が使用されます。