Chemia, część 1 - Krótki przewodnik
Wprowadzenie
Wszystko, co znajduje się w tym wszechświecie, składa się z pewnych materiałów, jak nazwali je naukowcy “matter.” Na przykład żywność, którą jemy, powietrze, którym oddychamy, kamienie, chmury, gwiazdy, rośliny, zwierzęta, woda, kurz, wszystko jest klasyfikowane jako materia.
Charakterystyka cząstek materii
Cząsteczki materii są bardzo małe, zwykle niewidoczne gołym okiem.

Cząsteczki materii poruszają się w sposób ciągły, co jest znane jako “kinetic energy.”
Energia kinetyczna cząstek zależy bezpośrednio od temperatury, wraz ze wzrostem temperatury wzrasta również prędkość ruchu.
Cząsteczki materii przyciągają siłę; dlatego przyciągają się wzajemnie.
Siła przyciągania cząstek utrzymuje je razem; jednak siła przyciągającej siły jest różna w zależności od rodzaju materii.
Stany materii
Materia ma trzy następujące stany -
Solid State
Liquid State
Gaseous State

Omówmy je w skrócie -
Stan stały
Wszystkie materiały bryłowe mają określony kształt, wyraźne granice i stałe objętości.
Większość materiałów stałych ma znikomą ściśliwość.
Wszystkie solidne materiały mają naturalną tendencję do utrzymywania kształtu pod wpływem siły zewnętrznej.
Całe materiały można złamać pod wpływem przyłożonej siły, ale bardzo trudno jest zmienić ich kształt, ponieważ są sztywne.
Stan ciekły
W przeciwieństwie do ciał stałych, ciecze nie mają ustalonego kształtu; jednak mają stałą głośność.
Płyny przybierają kształt pojemnika, w którym są przechowywane.
Ciecze mają właściwość płynięcia i zmiany kształtu.
Stan gazowy
Materia w postaci powietrza, która nie jest ani stała, ani ciekła, nazywana jest gazem. Na przykład tlen, azot, wodór itp.
W przeciwieństwie do ciała stałego gaz nie ma określonego rozmiaru i kształtu.
Gazy, np. Gaz płynny (LPG - używany do gotowania); sprężony gaz ziemny (CNG - używany jako paliwo w pojazdach) itp. ma wysoką ściśliwość; dlatego duża objętość gazu może być sprężona do małej butli i może być łatwo transportowana.
Gazy zwykle wykazują właściwość bardzo szybkiej dyfuzji do innych gazów. To jest powód, dla którego z daleka czujemy zapach (dobry lub zły).
Materia może zmienić swój stan
Woda może istnieć we wszystkich trzech stanach, np. Lód jako ciało stałe; woda (H2O) jako ciecz; i para wodna jako gaz. Poniższy diagram ilustruje przemiany wody w różnych stanach -

Temperatura, w której ciało stałe topi się i przekształca w ciecz (przy danym ciśnieniu atmosferycznym), jest określane jako “melting point.”
Temperatura topnienia ciała stałego jest wskaźnikiem siły przyciągania między jego cząstkami.
Temperatura topnienia lodu wynosi 273,16 K, czyli 0 0 C.
Proces topienia (czyli zmiana stanu stałego w stan ciekły) jest znany jako fusion.
Ilość energii cieplnej, która jest potrzebna do przemiany 1 kg materiału stałego w materiał ciekły przy danym ciśnieniu atmosferycznym, jest określana jako latent heat fuzji.
Temperatura, w której ciecz zaczyna wrzeć przy danym ciśnieniu atmosferycznym, nazywana jest “boiling point.”
Temperatura wrzenia wody wynosi 373 K, czyli 100 0 C.
Zmiana stanu materii bezpośrednio ze stanu stałego na gazowy bez przechodzenia w stan ciekły (lub odwrotnie) jest znana jako “sublimation.”
Zjawisko tj. Zamiana cieczy w pary w dowolnej temperaturze poniżej jej temperatury wrzenia jest znane jako “evaporation.”
Stały dwutlenek węgla (CO 2 ) jest przechowywany pod wysokim ciśnieniem.

Stały CO 2 przekształca się bezpośrednio w stan gazowy, gdy ciśnienie spadnie do 1 atmosfery.
Atmosphere(atm) jest jednostką pomiaru ciśnienia wywieranego przez gaz, a jednostką ciśnienia jest Pascal (Pa); 1 atmosfera = 1,01 × 105 Pa.
Czwarty stan materii
Plasma to stan, który składa się z superenergetycznych i super wzbudzonych cząstek.

Super wzbudzone cząstki występują w postaci zjonizowanych gazów. Np. Świetlówka (zawierająca hel) i żarówki neonowe (zawierające gaz neonowy) składają się z plazmy.
Wprowadzenie
Czysta substancja to taka, która składa się z jednego rodzaju cząstki lub cząstek.

Mieszaniny dwóch lub więcej czystych składników bez żadnych niepożądanych substancji są znane jako Mixturesna przykład woda, minerały, gleba itp.
Jednorodna mieszanina dwóch lub więcej substancji jest znana jako solution. Na przykład lemoniada, woda sodowa itp.
Roztwór może mieć dowolną postać, np. Płynną, stałą lub gazową.
Alloysto kolejny przykład mieszaniny, która zawiera jednorodne mieszaniny metali; nie można ich rozdzielić na części metodami fizycznymi. Np. Mosiądz jest mieszaniną cynku (około 30%) i miedzi (około 70%).
Istotne cechy rozwiązania
Roztwór jest zwykle jednorodną mieszaniną.
Cząsteczki roztworu mają nawet mniejszą niż 1 nm (10-9 metrów) średnicy, a zatem nie są widoczne gołym okiem.
Droga światła nie jest widoczna w roztworze.
Rozpuszczonych cząstek nie można oddzielić od mieszaniny w prostym procesie filtracji.
Rozpuszczone cząstki nie osiadają, gdy pozostawały niezakłócone.
W danej temperaturze, gdy w roztworze nie można już rozpuścić substancji rozpuszczonej, nazywa się to ‘saturated solution.’
W danej temperaturze ilość rozpuszczonych cząstek obecnych w nasyconym roztworze jest określana jako solubility.’
Zawieszenie
Zawiesina jest niejednorodną mieszaniną, w której cząstki substancji rozpuszczonej nie rozpuszczają się, ale raczej pozostają zawieszone w masie ośrodka. ‘suspension.’
Istotne cechy zawieszenia
Cząsteczki zawiesiny są dobrze widoczne gołym okiem.

Cząsteczki zawiesiny rozpraszają przechodzącą przez nią wiązkę światła i podobnie jej ścieżka jest widoczna.
Cząsteczki salutu można oddzielić od mieszaniny w prostym procesie filtracji.
Koloid
Niejednorodna mieszanina jest znana jako ‘colloid.’ Np. Mgiełka, mgła, dym, krem do twarzy itp.

Rozmiar cząstek koloidu jest zbyt mały, aby można je było zobaczyć gołym okiem.
Cząsteczki koloidu są wystarczająco duże, aby rozproszyć przechodzącą przez nie wiązkę światła i uczynić widoczną ścieżkę.
Cząstek koloidu nie można oddzielić od mieszaniny w prostym procesie filtracji.
Specjalna technika filtracji tj centrifugation, można użyć do oddzielenia cząstek koloidalnych.
Chromatografia
Proces rozdzielania składników mieszaniny nazywa się chromatography; zwykle jest używany do separacji kolorów.
Technika chromatograficzna jest stosowana do oddzielania tych substancji rozpuszczonych, które rozpuszczają się w tym samym rozpuszczalniku.
Destylacja
Proces oczyszczania cieczy przez ogrzewanie i chłodzenie nazywany jest destylacją.
Krystalizacja
Proces oddzielania czystego ciała stałego w postaci kryształów z roztworu jest znany jako ‘crystallization.’
Elementy
W 1661 roku Robert Boyle był pierwszym naukowcem, który użył tego terminu element; Antoine Laurent Lavoisier, francuski chemik, był pierwszym, który eksperymentalnie zdefiniował termin pierwiastek.
Pierwiastek jest podstawową formą materii, której nie można rozbić na prostsze substancje w wyniku reakcji chemicznej.
Elementy zwykle można podzielić na metals, non-metals, i metalloids.
Metal
Stały materiał, który zazwyczaj jest twardy, plastyczny, kowalny, błyszczący i topliwy o dobrej przewodności elektrycznej i cieplnej, jest znany jako metal. Np. Złoto, srebro, miedź, aluminium itp.

Mercury jest jedynym metalem, który pozostaje ciekły w temperaturze pokojowej.
Niemetalowe
Wszystkie pierwiastki lub substancje, które nie są metalami, są znane jako niemetale. Np. Wodór, tlen, jod, węgiel itp.
Niemetale mają różne kolory i są słabymi przewodnikami ciepła i elektryczności.
Niemetale nie są błyszczące, dźwięczne ani plastyczne.
Złożony
Substancja składająca się z dwóch lub więcej elementów jest znana jako ‘compound.’
Związek jest wynikiem chemicznej kombinacji dwóch lub więcej pierwiastków w ustalonej proporcji.

Właściwości związku różnią się w pewien sposób od jego elementów składowych, podczas gdy właściwości mieszaniny są takie same, jak właściwości elementów składowych lub związków.
Wprowadzenie
Około 500 roku pne indyjski filozof Maharishi Kanad po raz pierwszy postulował koncepcję niepodzielnej części materii i nazwał ją ‘pramanu.’
W 1808 roku John Dalton użył tego terminu ‘atom’ i postulował atomic theory do badania materii.

Teoria atomowa Daltona
Zgodnie z teorią atomową Daltona cała materia, czy to pierwiastek, związek czy mieszanina, składa się z małych cząstek zwanych atomami.
Zgodnie z teorią atomową Daltona wszystkie sprawy, czy to pierwiastki, związki czy mieszaniny, składają się z małych cząstek zwanych atomami.
Istotne cechy teorii atomowej Daltona
Cała materia składa się z bardzo malutkich cząstek zwanych atomami.
Atom to niepodzielna cząstka, której nie można wytworzyć ani zniszczyć w wyniku reakcji chemicznej.
Wszystkie atomy pierwiastka są identyczne pod względem masy i właściwości chemicznych, podczas gdy atomy różnych pierwiastków mają różne masy i właściwości chemiczne.
Aby utworzyć związek, atomy są łączone w stosunku małych liczb całkowitych.
W danym związku względna liczba i rodzaje atomów są stałe.
Masa atomowa
Masa atomu pierwiastka chemicznego; jest wyrażona w atomowych jednostkach masy (symbol to u ).
Masa atomowa jest z grubsza równa liczbie protonów i neutronów obecnych w atomie.
Jedna jednostka masy atomowej to jednostka masy równa dokładnie jednej dwunastej (1/12) masy jednego atomu węgla-12, a względne masy atomowe wszystkich pierwiastków zostały obliczone w odniesieniu do atomu węgla-12.
Cząsteczka
Najmniejsza cząsteczka pierwiastka lub związku, która może istnieć niezależnie i wykazuje wszystkie właściwości odpowiedniej substancji.

Cząsteczka to zwykle grupa dwóch lub więcej atomów, które są ze sobą połączone chemicznie.
Atomy tego samego pierwiastka lub różnych pierwiastków mogą łączyć się (wiązaniem chemicznym), tworząc cząsteczki.
Liczba atomów tworzących cząsteczkę jest określana jako jej atomicity.
Jon
Naładowana cząstka jest znana jako ion; to może byćnegative charge lub positive charge.
Dodatnio naładowany jon jest znany jako a ‘cation’.
Ujemnie naładowany jon jest znany jako ‘anion.’
Wzory chemiczne
Wzór chemiczny związku przedstawia jego elementy składowe i liczbę atomów każdego łączącego się pierwiastka.

Wzór chemiczny związku jest symbolicznym przedstawieniem jego składu.
Zdolność łączenia elementu nazywana jest jego ‘valency.’
Masa cząsteczkowa
Masę cząsteczkową substancji oblicza się, biorąc sumę mas atomowych wszystkich atomów w cząsteczce danej substancji. Na przykład masę cząsteczkową wody oblicza się jako -
Masa atomowa wodoru = 1u
Masa atomowa tlenu = 16 jednostek
Woda zawiera dwa atomy wodoru i jeden atom tlenu.
Masa cząsteczkowa wody wynosi = 2 × 1+ 1 × 16 = 18 u ( u jest symbolem masy cząsteczkowej).
Formuła Jednostka masy
Formułę masy jednostkowej substancji oblicza się, biorąc sumę mas atomowych wszystkich atomów we wzorze jednostki związku.
Avogadro Constant lub Avogadro Number
Avogadro był włoskim naukowcem, który przedstawił koncepcję liczby Avogadro (znanej również jako Avogadro Constant).
Liczba cząstek (atomów, cząsteczek lub jonów) obecnych w 1 molu dowolnej substancji jest stała, a jej wartość jest zawsze obliczana jako 6.022 × 1023.
W 1896 roku Wilhelm Ostwald wprowadził pojęcie „kreta”; jednak przyjęto, że jednostka mola zapewnia prosty sposób zgłaszania dużej liczby w 1967 roku.
Prawo zachowania masy
Podczas reakcji chemicznej suma mas reagentów i produktów pozostaje niezmieniona, co jest znane jako ‘Law of Conservation of Mass.’
Prawo określonych proporcji
W czystym związku chemicznym jego pierwiastki są zawsze obecne w określonej proporcji masowej, która jest znana jako ‘Law of Definite Proportions.’
Wprowadzenie
W 1900 roku odkryto, że atom nie jest prostą, niepodzielną cząstką, ale zawiera raczej cząstki subatomowe.
J.J. Thomson odkrył cząstkę subatomową mianowicie ‘electron.’

JJ Thomson był pierwszą osobą, która zaproponowała model dla struktury atomu.
W 1886 roku E. Goldstein odkrył obecność nowych promieniowań w wyładowaniu gazowym i nazwał je canal rays.
Inną dodatnio naładowaną cząstkę subatomową odkryto podczas eksperymentów z promieniami kanałowymi i nazwano ją proton.
Model atomu Thomsona
Thomson zaproponował, że atom składa się z dodatnio naładowanej kuli, w której osadzone są elektrony (ładunek ujemny) (jak pokazano na poniższym obrazku).

Ponadto Thomson powiedział, że ładunki ujemne i dodatnie są równe pod względem wielkości. Zatem atom jako całość jest elektrycznie obojętny.
Model atomu Rutherforda
E. Rutherford jest popularny jako „ojciec” fizyki jądrowej.

Rutherford jest w dużej mierze znany ze swojej pracy nad radioaktywnością i odkrycia nucleus atomu za pomocą eksperymentu ze złotą folią (jak pokazano na poniższym obrazku.

Rutherford powiedział, że w atomie znajduje się dodatnio naładowane centrum znane jako nucleus.
Rutherford powiedział, że prawie cała masa atomu znajduje się w jądrze.
Według Rutherforda elektrony krążą wokół jądra po dobrze określonych orbitach.
Model atomu Bohra
Neils Bohr dodatkowo rozszerzył model Rutherforda i poprawił jego wady.

Według Bohra tylko niektóre specjalne orbity znane jako dyskretne orbity elektronów są dozwolone wewnątrz atomu.
Bohr powiedział, że elektrony nie emitują energii podczas obracania się po dyskretnych orbitach.
Bohr nazwał orbity lub powłoki jako poziomy energii (jak pokazano na poniższym obrazku).

Bohr przedstawił te orbity lub powłoki za pomocą liter K, L, M, N,… lub liczb, n = 1,2,3,4,….
Neutron
W 1932 roku J. Chadwick odkrył nową cząstkę subatomową, tj. Neutron.
Neutron nie ma ładunku i ma masę prawie równą masie protonu.
Neutrony są obecne w jądrach wszystkich atomów z wyjątkiem wodoru.
Elektrony rozmieszczone na różnych orbitach (muszle)
Maksymalną liczbę elektronów, które mogą znajdować się w powłoce, podaje wzór 2n2.
‘n’ jest liczbą orbity lub wskaźnikiem poziomu energii, tj. 1, 2, 3,….
Zgodnie z podanym wzorem -
Pierwsza orbita tj K-shellbędzie = 2 × 1 2 = 2
Druga orbita tj L-shellbędzie = 2 × 2 2 = 8
Trzecia orbita tj M-shellbędzie = 2 × 3 2 = 18
Czwarta orbita tj N-shellbędzie = 2 × 4 2 = 32
Podobnie, maksymalna liczba elektronów, które można pomieścić na najbardziej zewnętrznej orbicie, wynosi 8.
Elektrony nie są wypełniane w danej powłoce, chyba że wewnętrzne powłoki są wypełnione. Oznacza to, że łuski są napełniane w sposób stopniowy; począwszy od skorupy wewnętrznej do skorupy zewnętrznej.
Wartościowość
Elektrony, które są obecne w najbardziej zewnętrznej powłoce atomu, są znane jako valence elektrony.
Zgodnie z modelem Bohra-Bury'ego, najbardziej zewnętrzna powłoka atomu może mieć maksymalnie 8 elektronów.
Liczba atomowa
Całkowita liczba protonów obecnych w jądrze atomu jest określana jako atomic number.
Liczba protonów w atomie określa liczbę atomową.
Liczba atomowa jest oznaczona przez ‘Z’.
Protony i neutrony są łącznie znane jako nucleons.
Liczba masowa
Suma całkowitej liczby protonów i neutronów obecnych w jądrze atomu jest określana jako mass number.
Izotopy
Atomy tego samego pierwiastka, mające tę samą liczbę atomową, ale różne liczby masowe, są znane jako izotopy. Np. Atom wodoru ma trzy izotopy, a mianowicie prot, deuter i tryt.
Właściwości chemiczne izotopów atomu są podobne, ale ich właściwości fizyczne są inne.
Isobary
Atomy różnych pierwiastków o różnych liczbach atomowych, które mają tę samą liczbę masową, nazywane są izobarami. Np. Liczba atomowa wapnia wynosi 20, a liczba atomowa argonu to 18; ponadto liczba elektronów w tych atomach jest różna, ale liczba masowa obu tych pierwiastków wynosi 40.
Wprowadzenie
Proces, w którym jedna lub więcej substancji chemicznych reaguje z inną substancją chemiczną i przekształca się w jedną lub więcej różnych substancji, nazywany jest reakcją chemiczną.
Równanie chemiczne
Równanie chemiczne to symboliczna demonstracja reakcji chemicznej; jest przedstawiany za pomocą symboli i formuł. Na przykład
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
Substancje magnez i tlen są znane jako reagenty, a wynik reakcji, tj. Tlenek magnezu jest znany jako produkt.
Pamiętaj, że całkowita masa pierwiastków obecnych w produktach reakcji chemicznej musi być równa całkowitej masie pierwiastków obecnych w reagentach.
Liczba atomów każdego pierwiastka zawsze pozostaje taka sama, przed i po reakcji chemicznej.
Rodzaje reakcji chemicznych
Poniżej przedstawiono główne typy reakcji chemicznych -
Combination Reaction
Decomposition Reaction
Displacement Reaction
Omówmy w skrócie każdy z nich -
Reakcja kombinowana
Gdy dwie lub więcej substancji (tj. Pierwiastków lub związków) reaguje, tworząc pojedynczy produkt, taka reakcja jest znana jako combination reaction. Na przykład
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
Jak zilustrowano w powyższej reakcji, tlenek wapnia i woda reagowały (lub łączyły się) tworząc pojedynczy produkt, znany jako wodorotlenek wapnia.
Reakcja chemiczna, w której uwalniane jest również ciepło wraz z tworzeniem się produktu, jest znana jako exothermic chemical reactions.
Reakcja rozkładu
Reakcja, w której pojedynczy reagent rozkłada się na prostsze produkty, jest znana jako reakcja rozkładu. Na przykład

W powyższej reakcji kryształy siarczanu żelazawego (tj. FeSO 4 , 7H 2 O) po podgrzaniu tracą wodę i zmienia się kolor kryształów. Ostatecznie rozkłada się na tlenek żelaza (Fe 2 O 3 ), dwutlenek siarki (SO 2 ) i trójtlenek siarki (SO 3 ).
Reakcja przemieszczenia
Reakcja, w której element przemieszcza lub usuwa inny pierwiastek, nazywana jest reakcją przemieszczenia. Na przykład
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
W powyższej reakcji miedź wyparta przez żelazo z roztworu siarczanu miedzi tworzy siarczan żelaza.
Utlenianie i redukcja
Jeśli substancja uzyskuje tlen podczas reakcji, nazywa się to oxidation. Z drugiej strony, w reakcji, jeśli substancja traci tlen, nazywa się toreduction. Na przykład

W podanej powyżej reakcji tlenek miedzi traci tlen, a zatem jest redukowany (tj. Redukcja); z drugiej strony wodór zyskuje tlen, a tym samym ulega utlenieniu (czyli utlenieniu).
Korozja
Kiedy metal zostaje zaatakowany przez substancje znajdujące się w bezpośrednim otoczeniu, takie jak wilgoć, kwasy itp., Nazywa się to corrosion. Np. Czarna powłoka na srebrze, zielona powłoka na miedzi itp.

Zjełczałość
Proces utleniania się tłuszczów i olejów nazywany jest jełczeniem. Zmienia się również ich zapach, smak, kolor itp .; podobnie sprawiało, że żywność była niebezpieczna do spożycia.
Wprowadzenie
Smakujemy kwaśno i gorzko, tylko z powodu obecności odpowiednio kwasów i zasad.
Lakmusowe rozwiązanie
Lakmus, który pozyskuje się z porostów, ma kolor purpurowy (patrz zdjęcie poniżej), ale występuje wtedy, gdy nie jest kwaśny ani zasadowy, czyli obojętny.

Lakmus to w zasadzie roślina należąca do Thallophyta, aw doświadczeniach chemicznych jest powszechnie używana jako wskaźnik.
Substancje, których zapach zmienia się w środowisku kwaśnym lub zasadowym, nazywane są olfactory wskaźniki.
Kwas lub zasada w roztworze wodnym
Jony wodoru w HCl są wytwarzane z powodu obecności wody. Po drugie, oddzielenie jonu H + od cząsteczek HCl nie może odbywać się bez wody. Poniżej przedstawiono wzór chemiczny
HCl + H2O → H3O+ + Cl–
Ponadto jony wodoru nie mogą istnieć same, ale mogą istnieć w obecności cząsteczek wody. Dlatego jony wodoru są pokazane jako H + (aq) lub jon hydroniowy (H 3 O + ). Wzór chemiczny to -
H+ + H2O → H3O+
Zasady rozpuszczalne w wodzie są znane jako alkalis. Ale wszystkie zasady nie są rozpuszczalne w wodzie.
Jeśli do stężonego kwasu dodaje się wodę, generowane jest ciepło.
Zmieszanie kwasu lub zasady z wodą powoduje zmniejszenie stężenia jonów (tj. H 3 O + / OH–) na jednostkę objętości i proces ten jest znany jakodilution.
Skala pH
Skala używana do pomiaru stężenia jonów wodorowych w roztworze jest znana jako pH scale.
Plik ‘p’ w pH oznacza ‘potenz’, jest to termin niemiecki, co oznacza ‘power’.
Wartość pH jest traktowana po prostu jako liczba, która wskazuje na kwaśny lub zasadowy charakter roztworu. Jeśli więc stężenie jonu hydroniowego jest wyższe, wówczas wartość pH byłaby niższa.
Wartość skali pH waha się między ‘0’ i ’14;’ więc jeśli zmierzona wartość pH wynosi „0”, to znaczy - jest bardzo acidic a jeśli jest 14, to znaczy - bardzo alkaline.
Neutralna wartość skali pH to ‘7’.
W skali pH wartości mniejsze niż 7 oznaczają roztwór kwaśny, a wartości większe niż 7 oznaczają roztwór zasadowy.
Zwykle do pomiaru pH stosuje się papier impregnowany zwykłym wskaźnikiem (patrz rysunek poniżej) -
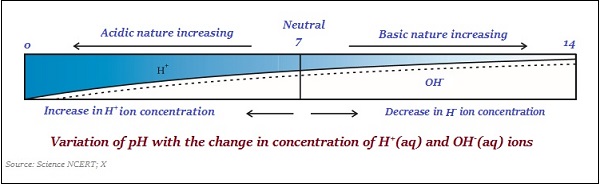
Podobnie siła kwasów i zasad zależy głównie od ilości wytworzonych jonów H + i OH - .
Poniższy obraz z grubsza ilustruje (różnice w kolorze) wartość pH niektórych powszechnie stosowanych substancji -

Znaczenie pH w życiu codziennym
Wartość pH ludzkiego ciała wynosi od 7,0 do 7,8.
Żołądek ludzkiego ciała wytwarza kwas solny, który pomaga w trawieniu pokarmu; o dziwo, i tak nie szkodzi żołądkowi.
Jednak gdy żołądek wytwarza zbyt dużo kwasu (znanego jako niestrawność), powoduje to ból i podrażnienie. Aby złagodzić ten ból, lekarze sugerują stosowanie środków zobojętniających sok żołądkowy.
Te środki zobojętniające sok żołądkowy neutralizują i kontrolują zwiększoną ilość kwasu.
Zęby, które są zbudowane z fosforanu wapnia, są najtwardszą substancją w organizmie. Jednak gdy pH w jamie ustnej spada (poniżej 5,5), powoduje to korozję zębów.
Sól zwykle powstaje przez połączenie kwasu solnego i roztworu wodorotlenku sodu; a połączenie to jest znane jako chlorek sodu.
Gdy zmierzona wartość pH wody deszczowej jest niższa niż 5,6, nazywa się to acid rain.
Kiedy kwaśne deszcze wpływają do rzek, obniżają również pH wody w rzece
Kwaśna woda rzeczna zagraża przetrwaniu organizmów wodnych.
Proszek wybielający
Proszek wybielający jest wytwarzany przez działanie chloru na suche wapno gaszone [Ca (OH) 2 ] i jest reprezentowany jako CaOCl 2 .
Proszek wybielający jest zwykle stosowany w przemyśle tekstylnym, papierniczym, chemicznym oraz do dezynfekcji wody pitnej.
Proszek do pieczenia
Soda oczyszczona jest powszechnie używana w kuchni do przyrządzania smacznych, chrupkich potraw. Również szybciej gotuje niektóre potrawy.
Chemiczna nazwa sody oczyszczonej to wodorowęglan sodu, a wzór to NaHCO 3 .
Soda do prania
Rekrystalizacja węglanu sodu prowadzi do powstania sody myjącej.
Wzór chemiczny sody myjącej to Na 2 CO 3 .10H 2 O.
Soda myjąca jest powszechnie stosowana w przemyśle szklarskim, mydlanym i papierniczym.
Gips modelarski
Plaster of Paris to biały proszek, który lekarze używają jako gips do podtrzymywania złamanych kości.
Nazwa chemiczna gipsu paryskiego to półwodzian siarczanu wapnia, a wzór chemiczny to 2CaSO 4 .H 2 O.
Wprowadzenie
Metale można odróżnić od niemetali na podstawie ich właściwości chemicznych i fizycznych.
Właściwość metali, dzięki której można je rozbijać na cienkie arkusze, jest znana jako malleability.
Właściwość metalu, dzięki której można go wciągnąć w druty, jest znana jako ductility.
Metale są zwykle twarde, plastyczne, błyszczące, plastyczne, dźwięczne i dobrze przewodzą ciepło i elektryczność. Np. Żelazo, miedź, wapń, aluminium, magnez itp.

Materiały, które nie są dźwięczne i są słabymi przewodnikami ciepła i elektryczności, nazywane są non-metals. Np. Siarka, węgiel, tlen, fosfor itp.
Niektóre metale, takie jak sodium i potassium są miękkie i można je ciąć nożem.
Mercury jest jedynym metalem, który pozostaje w stanie ciekłym w temperaturze pokojowej.
Gdy dwutlenek siarki jest rozpuszczany w wodzie, tworzy się kwas siarkowy. Ilustracja - Dwutlenek siarki (SO 2 ) + Woda (H 2 O) → Kwas siarkawy (H 2 SO 3 ).
Tlenki niemetali mają charakter kwaśny.
Kwas siarkowy zmienia niebieski papier lakmusowy na czerwony.
Fosfor jest bardzo reaktywnym niemetalem i zapala się pod wpływem powietrza.
Aby zapobiec kontaktowi fosforu z tlenem atmosferycznym, fosfor jest przechowywany w wodzie.
Podczas spalania metale łatwo reagują z tlenem i wytwarzają tlenki metali, które mają charakter zasadowy.
Niemetale reagują z tlenem i wytwarzają tlenki niemetali; te mają charakter kwaśny.
Niektóre metale reagują z wodą i wytwarzają wodorotlenki metali oraz wodór.
Niemetale zwykle nie reagują z wodą.
Metale reagują również z kwasami i wytwarzają wodór i sole metali.
Niemetale normalnie nie reagują z kwasami.
Zastosowania metali i niemetali
Metale są używane do produkcji maszyn, samolotów, samochodów, pociągów, satelitów, gadżetów przemysłowych, przyborów kuchennych, kotłów wodnych itp.
W nawozach stosowane są niemetale w celu poprawy wzrostu roślin.
Do oczyszczania wody stosuje się niemetale.
W krakersach stosuje się niemetale.
Wprowadzenie
Stały materiał, który jest zazwyczaj twardy, kowalny, błyszczący, topliwy i plastyczny, jest znany jako metale. Np. Żelazo, miedź, aluminium, magnez, sód, ołów, cynk itp.
Zwykle metale mają dobrą przewodność elektryczną i cieplną.

Metale w stanie czystym mają błyszczącą powierzchnię, znaną jako metallic luster.
Metale można bić na cienkie arkusze; ta właściwość jest znana jakomalleability.
Właściwość metali, które mają być wciągane do cienkich drutów, jest znana jako ductility. Np. Złoto jest najbardziej plastycznym metalem.
Srebro i miedź są najlepszymi przewodnikami ciepła.
Niemetale
Niemetale zwykle występują w stanie stałym lub gazowym. Jednak brom jest wyjątkiem, który występuje w stanie ciekłym.
Niektóre z głównych przykładów niemetali to węgiel, siarka, jod, tlen, wodór itp.

Fakty dotyczące metali i niemetali
Wszystkie metale występują w postaci stałej w temperaturze pokojowej, z wyjątkiem rtęci.
Gal i cez mają bardzo niskie temperatury topnienia; te dwa metale topią się nawet na dłoni.
Jod nie jest metalem, ale jest lśniący (połysk jest własnością metalu).
Węgiel to niemetal, który może występować w różnych formach. Każda forma nazywana jest alotropem.
Diament jest alotropem węgla i jest najtwardszą znaną naturalną substancją.
Diament ma bardzo wysoką temperaturę topnienia i wrzenia.
Grafit jest również alotropem węgla; jest przewodnikiem prądu.
Metale alkaliczne, takie jak lit, potas, sód, są przykładami metali miękkich, ponieważ można je ciąć nożem.
Prawie wszystkie metale w połączeniu z tlenem tworzą tlenki metali.
Różne metale mają różną częstotliwość reakcji; niektórzy reagują wolno, ale inni bardzo szybko. Np. Potas i sód są bardzo reaktywne i zapalają się tylko wtedy, gdy są trzymane na otwartej przestrzeni.
Dlatego potas i sód są zanurzone w oleju nafcie, aby nie mogły się zapalić.
Jednak spośród wszystkich metali najbardziej reaktywnym metalem jest sód (najprawdopodobniej).
Anodowanie to proces tworzenia grubej ochronnej warstwy tlenku aluminium, który chroni przed korozją.
Pierwiastki lub związki, które naturalnie występują w skorupie (górnej warstwie) ziemi, są znane jako minerały.
Minerały w postaci surowej są znane jako ores. Np. Złoto, srebro, żelazo itp. (Ruda żelaza pokazana na poniższym obrazku) -

Rudy wydobywane z ziemi są zwykle zanieczyszczone dużą ilością zanieczyszczeń, takich jak mieszanka z niektórymi pierwiastkami, ziemia, piasek itp., Znane jako ‘gangue’.
Na podstawie reaktywnego charakteru i ekstrakcji z rud metale można podzielić na -

Wprowadzenie
Węgiel odgrywa bardzo ważną rolę dla wszystkich żywych istot.
Zawartość węgla w skorupie ziemskiej wynosi zaledwie 0,02%, który jest dostępny w postaci minerałów, takich jak węglany, wodorowęglany, węgiel i ropa naftowa.
Obecność węgla w atmosferze ziemskiej wynosi 0,03% w postaci dwutlenku węgla.
Związki węgla
Prawie wszystkie związki węgla (z wyjątkiem kilku) są słabymi przewodnikami elektryczności.
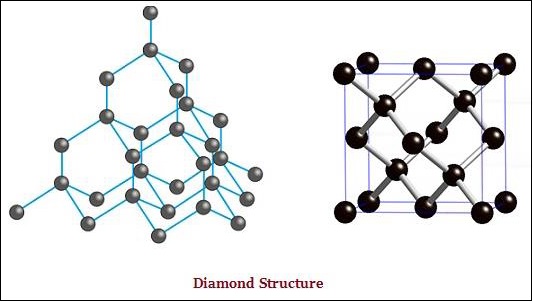
Diament i grafit są utworzone przez atomy węgla; jednak różnica leży między nimi w sposobie, w jaki atomy węgla są ze sobą połączone.
W diamencie każdy atom węgla jest związany z czterema innymi atomami węgla i tworzy sztywną trójwymiarową strukturę (patrz rysunek poniżej).
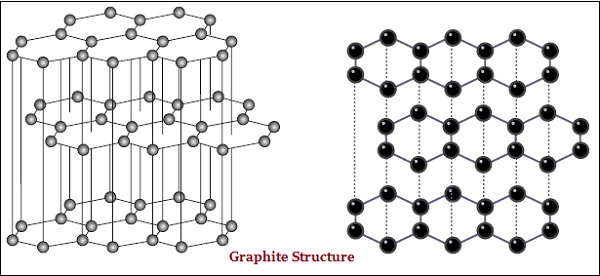
W graficie każdy atom węgla jest związany z trzema innymi atomami węgla w tej samej płaszczyźnie, co daje układ heksagonalny (patrz rysunek poniżej) -
Istnieje również różnica w niektórych strukturach fizycznych diamentu i grafitu.
Diament jest najtwardszą znaną substancją, podczas gdy grafit to gładka i śliska substancja.
Grafit jest dobrym przewodnikiem elektryczności, podczas gdy diament nie.
Poniższa tabela ilustruje strukturę związków węgla i wodoru -
| Nazwa | Formuła | Struktura |
|---|---|---|
| Metan | CH 4 |

|
| Etan | C 2 H 6 |

|
| Propan | C 3 H 8 |

|
| Butan | C 4 H 10 |

|
| Pentan | C 5 H 12 |

|
| Heksan | C 6 H 14 |

|
Związki, które mają identyczny wzór cząsteczkowy, ale inną strukturę, są znane jako structural isomers (patrz struktura butanu podana poniżej).

Węglowodory nasycone są znane jako alkanes.
Węglowodory nienasycone, które zawierają jedno lub więcej wiązań podwójnych, są znane jako alkenes.
Węglowodory nienasycone, które zawierają jedno lub więcej wiązań potrójnych, są znane jako alkynes.
Stosowanie alkoholu jako paliwa
Rośliny trzciny cukrowej bardzo wydajnie przetwarzają światło słoneczne w energię chemiczną, a jej sok można wykorzystać do przygotowania melasy.
Podczas fermentacji melasa wytwarza alkohol (etanol).
Niektóre kraje używają obecnie alkoholu jako dodatku do benzyny, ponieważ jest to czystsze paliwo.
Alkohol ten, spalając się w wystarczającej ilości powietrza (tlenu), daje jedynie dwutlenek węgla i wodę.
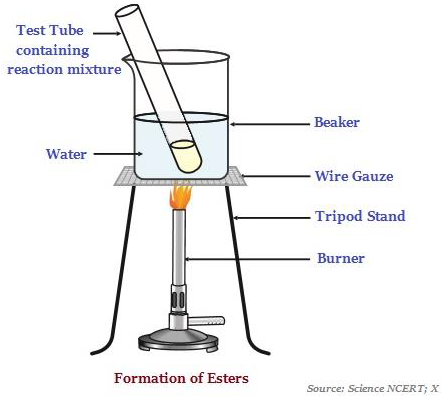
Estry
Estry to substancje o słodkim zapachu, które najczęściej powstają w wyniku reakcji kwasu i alkoholu (patrz rysunek poniżej - ilustrujący powstawanie estrów).
Kiedy estry reagują w obecności kwasu lub zasady, oddają alkohol i kwas karboksylowy.
Reakcja estrów z kwasem lub zasadą jest znana jako saponification ponieważ jest używany do przygotowania mydła.
Cząsteczki mydła są zwykle solami sodowymi lub potasowymi długołańcuchowych kwasów karboksylowych.
Co ciekawe, koniec jonowy mydła rozpuszcza się w wodzie, podczas gdy łańcuch węglowy rozpuszcza się w oleju. Te typowe cechy cząsteczek mydła tworzą struktury znane jakomicelles (patrz zdjęcie podane poniżej)

W micelach jeden koniec cząsteczek jest skierowany w stronę kropli oleju, podczas gdy koniec jonowy pozostaje na zewnątrz.
Micela mydlana pomaga w rozpuszczaniu brudu w wodzie; podobnie ubrania są czyszczone.
Z drugiej strony detergentami są zwykle sole amonowe lub sulfonianowe długołańcuchowych kwasów karboksylowych, które pozostają skuteczne nawet w twardej wodzie.
Detergenty są zwykle używane do produkcji szamponów i innych produktów do czyszczenia odzieży.
Wprowadzenie
Do dziś znanych jest nam około 115 elementów.
Na podstawie ich właściwości wszystkie elementy są uporządkowane w kolejności, zwanej układem okresowym.
Johann Wolfgang Döbereiner, niemiecki naukowiec, po raz pierwszy próbował uporządkować elementy w 1817 roku.
John Newlands, angielski naukowiec, również próbował uporządkować znane wówczas elementy (w 1866).
John Newlands postępował zgodnie z kolejnością rosnących mas atomowych, aby uporządkować elementy.
Newlands zaczynał od pierwiastka o najniższej masie atomowej (np. Wodór), a kończył na torze, który był 56 pierwiastkiem (w jego czasach).

Układ elementów Newlands jest znany jako „Prawo Oktaw”, ponieważ w jego układzie każdy osiem elementów miał właściwości podobne do właściwości pierwszego. Np. Stwierdzono, że właściwości litu i sodu są takie same.
| Sa (do) | ponownie | Ga (mi) | Ma (fa) | Pa (tak) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H. | Li | Być | b | do | N | O |
| fa | Na | Mg | Glin | Si | P. | S |
| Cl | K. | Ca | Cr | Ti | Mn | Fe |
| Co & Ni | Cu | Zn | Y | W | Tak jak | Se |
| Br | Rb | Sr | Ce & La | Zr |
Newlands porównał go również z oktawami występującymi w muzyce (patrz tabela podana powyżej).
W muzyce indyjskiej siedem nut to - sa, re, ga, ma, pa, da, ni; jednak na zachodzie nuty to - do, re, mi, fa, so, la, ti.
Ponadto, aby dopasować niektóre elementy do swojej tabeli, Newlands umieścił dwa elementy w tej samej komórce (patrz tabela podana powyżej - kobalt i nikiel przechowywane w tej samej komórce), ale ta technika nie zadziałała, ponieważ mają różne właściwości.
Jednak prawo oktawy miało ograniczenia, które dotyczyło tylko wapnia; a po wapniu każdy ósmy pierwiastek nie miał właściwości podobnych do właściwości pierwszego.
Układ okresowy Mendelejewa
Dmitri Ivanovich Mendeléev, rosyjski chemik, któremu udało się uporządkować elementy.
Mendeléev uporządkował pierwiastki na podstawie ich podstawowych właściwości (pierwiastków), masy atomowej, a także podobieństwa właściwości chemicznych.
W czasach Mendelejewa znane były tylko 63 elementy.
Układ okresowy Mendeléeva składa się z pionowych kolumn znanych jako ‘groups’ i poziome rzędy znane jako ‘periods.’

Prawo okresowe Mendelejewa tak stwierdza
„Właściwości pierwiastków są okresową funkcją ich mas atomowych”.
Mendeléev ułożył sekwencję w sposób odwrócony, aby elementy o podobnych właściwościach mogły być grupowane razem.
Mendeléev zostawił miejsce dla pewnych pierwiastków, które nie zostały wówczas odkryte; śmiało przewidział istnienie przyszłych elementów.
Jednym z największych ograniczeń wzoru okresowego Mendelejewa jest - nie przypisano wodoru żadnej stałej pozycji w układzie okresowym.
Nowoczesny układ okresowy
W 1913 roku Henry Moseley, angielski fizyk, odkrył, że liczba atomowa pierwiastka jest bardziej podstawową właściwością w porównaniu z jego masą atomową.
Opierając się na odkryciu Moseleya, prawo okresowe Mendelejewa zostało zmodyfikowane, a liczba atomowa została przyjęta jako podstawa nowoczesnego układu okresowego.
Współczesne prawo okresowe stanowi:
„Właściwości pierwiastków są okresową funkcją ich liczby atomowej”.
18 pionowe kolumny znane jako „groups' i 7 poziome rzędy znane jako „okresy” są zdefiniowane we współczesnym układzie okresowym.
We współczesnym układzie okresowym pierwiastki są ułożone w taki sposób, że wykazuje cykliczność właściwości, takich jak wielkość atomu, wartościowość lub łączenie pojemności i właściwości metalicznych i niemetalicznych (pierwiastków).
We współczesnym układzie okresowym metaliczny charakter maleje w okresie i zwiększa się w grupie.
Z drugiej strony niemetale są elektroujemne, ponieważ mają tendencję do tworzenia wiązań poprzez pozyskiwanie elektronów.
We współczesnym układzie okresowym niemetale są umieszczone po prawej stronie (od góry).
Wprowadzenie
Odzież, którą nosimy, wykonana jest z tkanin, a tkaniny są wykonane z włókien, które są pozyskiwane ze źródeł naturalnych lub sztucznych.
Naturalnym źródłem włókien jest bawełna, wełna, jedwab itp., Które są pozyskiwane z roślin lub zwierząt.
Włókna syntetyczne są wytwarzane przez ludzi; dlatego nazywa się je włóknami syntetycznymi lub sztucznymi.
Włókno syntetyczne jest zwykle łańcuchem małych jednostek połączonych razem; każda mała jednostka jest substancją chemiczną.
Rodzaje włókien syntetycznych
Sztuczny jedwab jest zwykle znany jako Rayon.
Sztuczny jedwab (włókno) uzyskano poprzez obróbkę chemiczną ścieru drzewnego.
Włókno, przygotowane z węgla, wody i powietrza, jest znane jako Nylon.

Nylon był pierwszym w pełni syntetycznym włóknem.
Polyesterjest również włóknem syntetycznym; jest to włókno bez zmarszczek. Np. Terylene.
PET jest jedną ze znanych form poliestrów i jest używany do produkcji przyborów kuchennych, butelek, folii, drutów i wielu innych przydatnych produktów.
Poliester (Poly + ester) składa się z powtarzających się jednostek substancji chemicznej znanej jako ester.
Plastik jest również rodzajem polimeru, podobnie jak włókno syntetyczne.
Polietylen (poli + eten) jest typowym przykładem tworzywa sztucznego.
Istnieją tworzywa sztuczne, których raz uformowane nie można zmiękczyć przez ogrzewanie; dlatego są one znane jako tworzywa termoutwardzalne. Np. Bakelit i melamina.
Bakelit jest słabym przewodnikiem ciepła i elektryczności; dlatego służy do wykonywania włączników elektrycznych, uchwytów różnych przyborów kuchennych itp.
Melamina jest odporna na ogień i toleruje ciepło lepiej niż inne tworzywa sztuczne; dlatego jest używany do produkcji płytek podłogowych, naczyń kuchennych i tkanin.
Materiał, który ulega rozkładowi w naturalnych procesach, np. Przez bakterie, jest znany jako biodegradowalny.
Materiał, którego nie można łatwo rozłożyć w naturalnych procesach, jest znany jako nieulegający biodegradacji.
Plastik nie jest przyjazny dla środowiska.
Wprowadzenie
Zasoby, które występują w naturze w nieograniczonych ilościach i prawdopodobnie nie zostaną wyczerpane przez działalność człowieka, nazywane są Inexhaustible Natural Resources. Np. Światło słoneczne, powietrze.
Zasoby, które występują w przyrodzie w ograniczonej ilości i mogą zostać wyczerpane przez działalność człowieka, są znane jako Exhaustible Natural Resources. Np. Lasy, dzika przyroda, minerały, węgiel, ropa naftowa, gaz ziemny itp.
Wyczerpane zasoby naturalne powstały z martwych szczątków organizmów żywych (skamieniałości); dlatego te zasoby naturalne są również znane jakofossil fuels. Np. Węgiel, ropa naftowa i gaz ziemny.
Węgiel
Węgiel jest twardy jak kamień i ma czarny kolor.
Węgiel jest jednym z paliw używanych do gotowania żywności.

Węgiel jest wykorzystywany w elektrowniach cieplnych do produkcji energii elektrycznej.
Pod wpływem wysokiego ciśnienia i wysokiej temperatury martwe rośliny, które zostały zakopane w ziemi, powoli przekształcały się w węgiel.
Węgiel zawiera głównie węgiel.
Powolny proces przekształcania martwej roślinności w węgiel jest znany jako karbonizacja.
Węgiel powstaje z resztek roślinności; dlatego jest również znany jako paliwo kopalne.
Podczas spalania węgla wytwarza głównie dwutlenek węgla.
Kiedy węgiel jest przetwarzany w przemyśle, wytwarza pewne użyteczne produkty, takie jak koks, smoła węglowa i gaz węglowy.
Coke jest twardą, porowatą i czarną substancją.
Koks to czysta forma węgla.
Koks jest szeroko stosowany do produkcji stali oraz do wydobywania wielu metali.
Smoła węglowa to czarny, gęsty płyn o nieprzyjemnym zapachu.
Smoła węglowa jest mieszaniną około 200 substancji.
Produkty otrzymywane ze smoły węglowej są wykorzystywane jako materiał wyjściowy do produkcji różnorodnych substancji używanych w życiu codziennym i przemyśle. Np. Materiały wybuchowe, farby, pokrycia dachowe, barwniki syntetyczne, narkotyki, perfumy, tworzywa sztuczne, materiały fotograficzne itp.
Naphthalene ballspozyskiwane ze smoły węglowej służą do odstraszania moli i innych owadów.
Bitumen, otrzymywany z produktów ropopochodnych, jest stosowany zamiast smoły węglowej do metalowania dróg.
Podczas przeróbki węgla na koks, coal gas jest uzyskiwane.
W 1810 r. Po raz pierwszy w Londynie w Wielkiej Brytanii wykorzystano gaz węglowy do oświetlenia ulic, aw 1820 r. W Nowym Jorku w USA.
Obecnie źródłem ciepła jest gaz węglowy.
Ropa naftowa
Benzyna i olej napędowy są pozyskiwane z naturalnego surowca znanego jako ropa naftowa.
Ropa naftowa powstała z organizmów żyjących w morzu.
Przez miliony lat (martwe organizmy zakopane w ziemi), w obecności wysokiej temperatury, wysokiego ciśnienia i przy braku powietrza, martwe organizmy przekształciły się w ropę i gaz ziemny.
W 1859 r. W Pensylwanii w USA wykonano pierwszy na świecie odwiert naftowy.
W 1867 r. Ropa utknęła w Makum w Assam w Indiach.
W Indiach ropa naftowa występuje głównie w Assam, Gujarat, Mumbai High, Maharashtra oraz w dorzeczach Godawari i Kryszny.
Poniższy obraz przedstawia warstwę gazu i ropy -

Ropa naftowa to mieszanka różnych składników, takich jak benzyna, gaz ropopochodny, olej napędowy, olej smarowy, wosk parafinowy itp.
Proces oddzielania różnych składników ropy naftowej jest znany jako refining.
Różne przydatne substancje, które są otrzymywane z ropy naftowej i gazu ziemnego, nazywane są „produktami petrochemicznymi”.
Produkty petrochemiczne są wykorzystywane do produkcji detergentów, włókien (poliester, nylon, akryl itp.), Polietylenu i innych sztucznych tworzyw sztucznych.
Wodór, który jest pozyskiwany z gazu ziemnego, jest wykorzystywany do produkcji nawozów (mocznik).
Ze względu na duże znaczenie handlowe ropa naftowa jest również znana jako ‘black gold.’
Gaz ziemny jest zwykle przechowywany pod wysokim ciśnieniem i stąd znany jako Compressed Natural Gas (CNG).
CNG służy do wytwarzania energii i paliwa do pojazdów.
The following table illustrates various constituents of petroleum and their uses −
| Składniki ropy naftowej | Używa |
|---|---|
| Gaz z ropy naftowej w postaci płynnej (LPG) | Paliwo dla domu i przemysłu |
| Benzyna | Paliwo silnikowe, paliwo lotnicze, rozpuszczalnik do czyszczenia na sucho |
| Diesel | Paliwo do ciężkich pojazdów mechanicznych, prądnice elektryczne |
| Nafta oczyszczona | Paliwo do pieców, lamp i do samolotów odrzutowych |
| Smar | Smarowanie |
| Parafina | Maści, świece, wazelina itp. |
| Bitum | Farby, nawierzchnie drogowe |
Wprowadzenie
Proces chemiczny, w którym substancja reaguje z tlenem i oddaje ciepło, jest znany jako combustion.
Substancja, która ulega spalaniu, nazywana jest as combustible lub fuel.
Paliwo może mieć postać stałą, płynną lub gazową.
Podczas spalania światło wydziela się również w postaci a flame lub jako glow.

Substancje, które odparowują w czasie spalania, dają płomienie.
Istnieją trzy różne strefy: strefa ciemna płomienia, strefa świetlna i strefa nieświecąca.

Różne substancje zapalają się w różnych temperaturach.
Najniższa temperatura, w której substancja zapala się, nazywana jest jej ignition temperature.
Zapałka zawiera trisiarczek antymonu i chloran potasu.
Ścierająca się powierzchnia zapałki zawiera sproszkowane szkło i trochę czerwonego fosforu.
Fosfor czerwony jest znacznie mniej niebezpieczny.
Kiedy pałeczka jest uderzana o ocierającą się powierzchnię, część czerwonego fosforu przekształca się w biały fosfor; proces natychmiast reaguje z chloranem potasu obecnym w główce zapałki i wytwarza ciepło wystarczające do zapalenia trisiarczku antymonu; podobnie rozpoczyna się spalanie.
Substancje, które mają bardzo niską temperaturę zapłonu i mogą łatwo zapalić się płomieniem, nazywane są inflammable substances. Np. benzyna, alkohol, skroplony gaz ropopochodny (LPG) itp.
Gaśnica
Water jest najczęściej używaną gaśnicą.
Woda, jako gaśnica, działa tylko wtedy, gdy pali się drewno i papier.

Jeśli sprzęt elektryczny się pali, woda może przewodzić prąd i uszkodzić osoby próbujące ugasić pożar.
Woda nie jest również dobrym środkiem gaśniczym w przypadku pożarów związanych z olejem i benzyną.
W przypadku pożarów obejmujących sprzęt elektryczny i materiały łatwopalne, takie jak benzyna, najlepszym środkiem gaśniczym jest dwutlenek węgla (CO2).

Jednym ze sposobów uzyskania CO2 jest uwolnienie dużej ilości suchego proszku chemikaliów, takich jak wodorowęglan sodu (soda oczyszczona) lub wodorowęglan potasu.
Fosfor spala się w powietrzu w temperaturze pokojowej.
Ilość energii cieplnej powstającej przy całkowitym spaleniu 1 kg paliwa nazywana jest jego calorific value.
Wartość opałową paliwa mierzy się w jednostce zwanej kilodżulem na kg (kJ / kg).
The following table illustrates the Calorific Values of Different Fuels −
| Paliwo | Wartość opałowa (kJ / kg) |
|---|---|
| Ciasto z krowiego łajna | 6000-8000 |
| Drewno | 17000-22000 |
| Węgiel | 25000-33000 |
| Benzyna | 45000 |
| Nafta oczyszczona | 45000 |
| Diesel | 45000 |
| Metan | 50000 |
| CNG | 50000 |
| LPG | 55000 |
| Biogaz | 35000-40000 |
| Wodór | 150000 |
Spalanie większości paliw uwalnia carbon dioxide w otoczeniu.
Najprawdopodobniej przyczyną jest zwiększone stężenie dwutlenku węgla w powietrzu global warming.
Wzrost temperatury atmosfery ziemskiej jest znany jako Global Warming.
Globalne ocieplenie powoduje topnienie lodowców polarnych, co prowadzi do podniesienia się poziomu morza, co ostatecznie powoduje powodzie w regionach przybrzeżnych.
Tlenki siarki i azotu rozpuszczają się w wodzie deszczowej i tworzą kwasy; taki rodzaj deszczu jest znany jakoacid rain.