อิเล็กทรอนิกส์พื้นฐาน - วัสดุ
สสารประกอบด้วยโมเลกุลซึ่งประกอบด้วยอะตอม ตามทฤษฎีของบอร์“ อะตอมประกอบด้วยนิวเคลียสที่มีประจุบวกและอิเล็กตรอนที่มีประจุลบจำนวนหนึ่งซึ่งหมุนรอบนิวเคลียสในวงโคจรต่างๆ” เมื่ออิเล็กตรอนถูกยกระดับจากสถานะที่ต่ำกว่าไปสู่สถานะที่สูงกว่าจะมีการกล่าวถึงexcited. ในขณะที่น่าตื่นเต้นถ้าอิเล็กตรอนถูกกำจัดออกจากนิวเคลียสอย่างสมบูรณ์อะตอมก็จะแตกตัวเป็นไอออน ดังนั้นกระบวนการเพิ่มอะตอมจากสถานะปกติเป็นสถานะแตกตัวเป็นไอออนนี้เรียกว่าionization.
รูปต่อไปนี้แสดงโครงสร้างของอะตอม
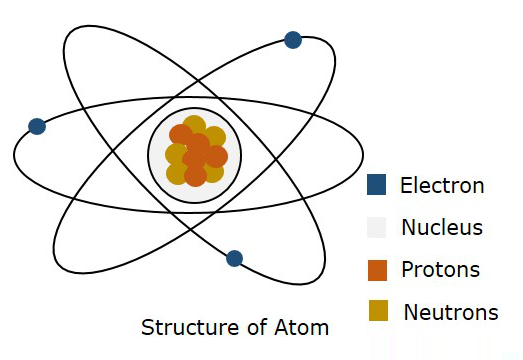
ตามแบบจำลองของบอร์กล่าวว่าอิเล็กตรอนถูกเคลื่อนย้ายโดยเฉพาะ Orbitในขณะที่ตามกลศาสตร์ควอนตัมกล่าวว่าอิเล็กตรอนอยู่ที่ไหนสักแห่งในพื้นที่ว่างของอะตอมเรียกว่า Orbital. ทฤษฎีกลศาสตร์ควอนตัมนี้ได้รับการพิสูจน์แล้วว่าถูกต้อง ดังนั้นขอบเขตสามมิติที่มีโอกาสพบอิเล็กตรอนจึงถูกเรียกว่าAtomic Orbital.
ตัวเลขควอนตัม
แต่ละออร์บิทัลที่อิเล็กตรอนเคลื่อนที่มีพลังงานและรูปร่างแตกต่างกัน ระดับพลังงานของออร์บิทัลสามารถแสดงโดยใช้ชุดปริพันธ์ที่ไม่ต่อเนื่องและปริพันธ์ครึ่งหนึ่งที่เรียกว่าเลขควอนตัม มีตัวเลขควอนตัมสี่ตัวที่ใช้กำหนดฟังก์ชันคลื่น
จำนวนควอนตัมหลัก
เลขควอนตัมแรกที่อธิบายอิเล็กตรอนคือ Principal quantum number. สัญลักษณ์ของมันคือn. ระบุขนาดหรือลำดับ (ระดับพลังงาน) ของตัวเลข เมื่อค่าของ n เพิ่มขึ้นระยะห่างเฉลี่ยจากอิเล็กตรอนถึงนิวเคลียสก็เพิ่มขึ้นเช่นกันพลังงานของอิเล็กตรอนก็เพิ่มขึ้นเช่นกัน ระดับพลังงานหลักสามารถเข้าใจได้ว่าเป็นเปลือกหอย
จำนวนควอนตัมโมเมนตัมเชิงมุม
เลขควอนตัมนี้มี lเป็นสัญลักษณ์ของมัน l นี้บ่งบอกถึงรูปร่างของออร์บิทัล มีตั้งแต่ 0 ถึง n-1
l = 0, 1, 2 … n-1
สำหรับเชลล์แรก n = 1
กล่าวคือสำหรับ n-1 l = 0 เป็นค่าเดียวที่เป็นไปได้ของ l เป็น n = 1
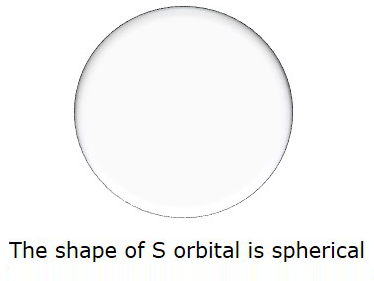
ดังนั้นเมื่อ l = 0 มันถูกเรียกว่าเป็น Sวงโคจร. รูปร่างของ S เป็นทรงกลม รูปต่อไปนี้แสดงถึงรูปร่างของ S.
ถ้า n = 2 ดังนั้น l = 0, 1 เนื่องจากเป็นค่าที่เป็นไปได้สองค่าสำหรับ n = 2
เรารู้ว่ามันคือ S ออร์บิทัลสำหรับ l = 0 แต่ถ้า l = 1 มันคือ P วงโคจร.
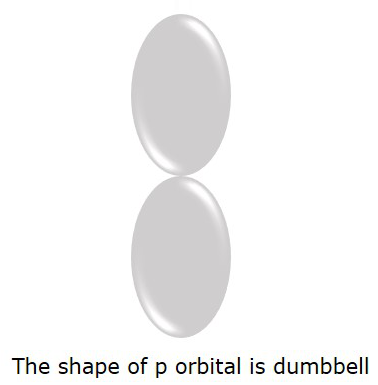
P ออร์บิทัลที่มีโอกาสพบอิเล็กตรอนมากขึ้น dumbbellรูปร่าง. ดังแสดงในรูปต่อไปนี้
จำนวนควอนตัมแม่เหล็ก
จำนวนควอนตัมนี้แสดงด้วย mlซึ่งแสดงถึงการวางแนวของออร์บิทัลรอบนิวเคลียส ค่าของ m lขึ้นอยู่กับ l
$$ m_ {l} = \ int (-l \: \: ถึง \: + l) $$
สำหรับ l = 0, m l = 0 สิ่งนี้แสดงถึง S ออร์บิทัล
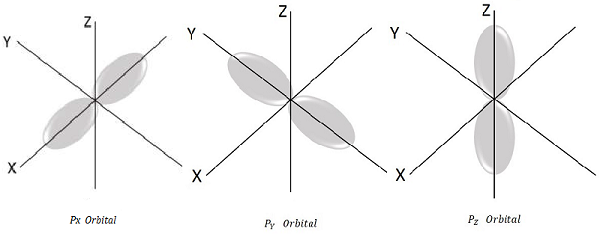
สำหรับ l = 1, m l = -1, 0, +1 นี่คือค่าที่เป็นไปได้สามค่าและนี่แสดงถึง P ออร์บิทัล
ดังนั้นเราจึงมีวงโคจร P สามวงดังแสดงในรูปต่อไปนี้
หมุนหมายเลข Quantum
สิ่งนี้แสดงโดย msและอิเล็กตรอนที่นี่หมุนบนแกน การเคลื่อนที่ของการหมุนของอิเล็กตรอนอาจเป็นได้ทั้งตามเข็มนาฬิกาหรือทวนเข็มนาฬิกาตามที่แสดงไว้ด้านล่าง
ค่าที่เป็นไปได้สำหรับจำนวนควอนตัมสปินนี้จะเป็นดังนี้
$$ m_ {s} = + \ frac {1} {2} \: \: ขึ้น $$
สำหรับการเคลื่อนไหวที่เรียกว่าหมุนขึ้นผลลัพธ์คือครึ่งบวก
$$ m_ {s} = - \ frac {1} {2} \: \: down $$
สำหรับการเคลื่อนไหวที่เรียกว่าหมุนลงผลลัพธ์จะเป็นลบครึ่งหนึ่ง
นี่คือตัวเลขควอนตัมสี่ตัว
หลักการกีดกัน Pauli
ตามหลักการกีดกัน Pauli no two electrons in an atom can have the same set of four identical quantum numbers. หมายความว่าถ้าอิเล็กตรอนสองตัวใดมีค่า n, s, ml เท่ากัน (ดังที่เราเพิ่งกล่าวไปข้างต้น) ค่า l ก็จะแตกต่างกันอย่างแน่นอน ดังนั้นจึงไม่มีอิเล็กตรอนสองตัวที่จะมีพลังงานเท่ากัน
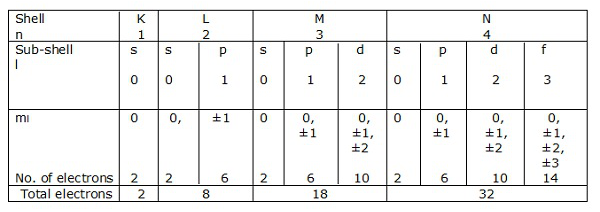
เปลือกหอยอิเล็กทรอนิกส์
ถ้า n = 1 เป็นเชลล์ดังนั้น l = 0 คือเชลล์ย่อย
ในทำนองเดียวกัน n = 2 คือเชลล์และ l = 0, 1 คือเชลล์ย่อย
เปลือกของอิเล็กตรอนที่สอดคล้องกับ n = 1, 2, 3 … .. แสดงด้วย K, L, M, N ตามลำดับ เปลือกย่อยหรือวงโคจรที่สอดคล้องกับ l = 0, 1, 2, 3 ฯลฯ แสดงด้วย s, p, d, f เป็นต้นตามลำดับ
ให้เราดูการกำหนดค่าทางอิเล็กทรอนิกส์ของคาร์บอนซิลิกอนและเจอร์เมเนียม (กลุ่ม IV - A)

เป็นที่สังเกตว่าเปลือกย่อย p นอกสุดในแต่ละกรณีมีอิเล็กตรอนเพียงสองตัว แต่จำนวนอิเล็กตรอนที่เป็นไปได้คือหก ดังนั้นมีสี่valence electronsในแต่ละเปลือกนอกส่วนใหญ่ ดังนั้นอิเล็กตรอนแต่ละตัวในอะตอมจึงมีพลังงานจำเพาะ การจัดเรียงอะตอมภายในโมเลกุลของสารทุกประเภทเกือบจะเป็นแบบนี้ แต่ระยะห่างระหว่างอะตอมนั้นแตกต่างกันไปในแต่ละวัสดุ