Kimya - Asitler, Bazlar ve Tuzlar
Giriş
Yiyecekleri ekşi ve acı tadı alıyoruz, sadece sırasıyla asit ve bazların varlığından kaynaklanıyor.
Litmus Çözümü
Likenden ekstrakte edilen Litmus mor renge sahiptir (aşağıdaki resme bakınız), ancak durum ne asidik ne de bazik, yani nötr olduğu zamandır.

Litmus temelde Thallophyta'ya ait bir bitkidir ve kimyasal deneyde genellikle bir gösterge olarak kullanılır.
Asidik veya bazik ortamda koku değişikliğine neden olan maddeler, olfactory göstergeler.
Su Çözeltisinde Asit veya Baz
HCl'deki hidrojen iyonları su varlığından dolayı üretilir. İkinci olarak, H + iyonunun HCl moleküllerinden ayrılması su yokken yapılamaz. Kimyasal formül aşağıda gösterilmiştir
HCl + H2O → H3O+ + Cl–
Dahası, hidrojen iyonları tek başına var olamaz, ancak su moleküllerinin varlığında var olabilirler. Bu nedenle, hidrojen iyonları H + (aq) veya hidronyum iyonu (H 3 O + ) olarak gösterilir. Kimyasal formül -
H+ + H2O → H3O+
Suda çözünen bazlar şu şekilde bilinir: alkalis. Ancak tüm bazlar suda çözünmez.
Konsantre bir aside su eklenirse, ısı üretilir.
Bir asit veya bazın suyla karıştırılması, birim hacim başına iyon konsantrasyonunun (yani H 3 O + / OH–) azalmasına neden olur ve işlem olarak bilinir.dilution.
PH cetveli
Bir çözeltideki hidrojen iyonu konsantrasyonunu ölçmek için kullanılan bir ölçek, pH scale.
‘p’ pH değerinde ‘potenz’, Alman bir terimdir, yani ‘power’.
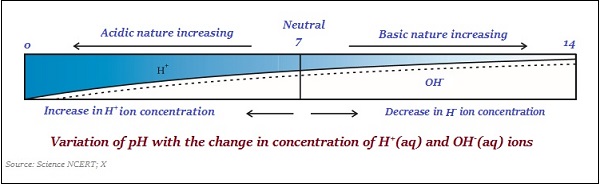
pH değeri, bir çözeltinin asidik veya bazik yapısını gösteren bir sayı olarak alınır. Bu nedenle, hidronyum iyonu konsantrasyonu daha yüksekse, pH değeri daha düşük olacaktır.
PH ölçeğinin değeri arasında değişir ‘0’ ve ’14;’ yani, pH değeri '0' olarak ölçülürse, bu çok acidic ve eğer 14 ise, o zaman - çok alkaline.
PH ölçeğinin nötr değeri ‘7’.
Bir pH ölçeğinde, 7'den küçük değerler asidik bir çözeltiyi temsil eder ve 7'den büyük değerler temel bir çözeltiyi temsil eder.
Genellikle, pH'ı ölçmek için ortak indikatörle emprenye edilmiş kağıt kullanılır (aşağıda verilen resme bakın) -
Benzer şekilde, asitlerin ve baz maddelerinin gücü , sırasıyla üretilen H + iyonlarının ve OH - iyonlarının sayısına bağlıdır .
Aşağıdaki görüntü, yaygın olarak kullanılan bazı maddelerin pH değerini kabaca göstermektedir (renkteki farklılıklar) -

Günlük Yaşamda pH'ın Önemi
Bir insan vücudunun pH değeri 7.0 ile 7.8 arasında değişmektedir.
İnsan vücudunun midesi, gıdanın sindirilmesine yardımcı olan hidroklorik asit üretir; şaşırtıcı bir şekilde mideye zarar vermez.
Ancak mide çok fazla asit ürettiğinde (hazımsızlık olarak bilinir) ağrıya ve tahrişe neden olur. Bu ağrıdan kurtulmak için doktorlar antasitler olarak bilinen bazların kullanılmasını önermektedir.
Bu antasitler artan asit miktarını nötralize eder ve kontrol eder.
Kalsiyum fosfattan oluşan dişler vücuttaki en sert maddedir. Ancak ağızdaki pH düştüğünde (5.5'in altına) dişleri aşındırır.
Tuz, normal olarak, hidroklorik asit ve sodyum hidroksit çözeltisinin kombinasyonundan oluşur; ve kombinasyon sodyum klorür olarak bilinir.
Yağmur suyunun pH değeri 5,6'nın altında ölçüldüğünde, acid rain.
Nehirlere asit yağmuru aktığında nehir suyunun pH'ını da düşürür.
Asidik nehir suyu, sucul yaşamın hayatta kalması için bir tehdittir.
Beyazlatıcı pudra
Ağartma tozu, klorun kuru sönmüş kireç [Ca (OH) 2 ] üzerindeki etkisiyle üretilir ve CaOCl 2 olarak temsil edilir .
Ağartma tozu normalde tekstil endüstrisinde, kağıt fabrikasında, kimya endüstrisinde ve içme suyunun dezenfekte edilmesinde kullanılır.
Karbonat
Kabartma tozu mutfakta lezzetli çıtır yiyecekler pişirmek için yaygın olarak kullanılır. Ayrıca bazı yiyecekleri daha hızlı pişirir.
Kabartma tozu kimyasal adı sodyum hidrojenkarbonattır ve formülü NaHCO 3'tür .
Çamaşır sodası
Sodyum karbonatın yeniden kristalleşmesi, yıkama sodasına neden olur.
Çamaşır sodası kimyasal formülü Na 2 CO 3 .10H 2 O
Yıkama soda genellikle cam, sabun ve kağıt endüstrilerinde kullanılır.
Paris ALÇISI
Alçı, doktorların kırık kemikleri desteklemek için alçı olarak kullandıkları beyaz bir tozdur.
Paris sıvasının kimyasal adı kalsiyum sülfat hemihidrat ve kimyasal formülü 2CaSO 4 .H 2 O.