Kimya Bölüm 1 - Hızlı Kılavuz
Giriş
Bu evrende bulunan her şey bazı malzemelerden oluşmuştur, bilim adamları bunları şöyle adlandırmıştır: “matter.” Örneğin yediğimiz yiyecekler, soluduğumuz hava, taşlar, bulutlar, yıldızlar, bitkiler, hayvanlar, su, toz, her şey madde kategorisine giriyor.
Madde Parçacıklarının Özellikleri
Madde parçacıkları çok küçüktür, normalde çıplak gözle görülmez.

Maddenin parçacıkları sürekli olarak hareket etmeye devam eder, bu da “kinetic energy.”
Parçacıkların kinetik enerjisi doğrudan sıcaklığa bağlıdır, sıcaklık arttıkça hareketin hızı da artar.
Madde parçacıkları çekme kuvvetine sahiptir; bu nedenle birbirlerini çekerler.
Parçacıkların çekme kuvveti parçacıkları bir arada tutar; ancak, çeken kuvvetin gücü bir tür maddeden diğerine değişir.
Maddenin halleri
Maddenin şu üç durumu vardır:
Solid State
Liquid State
Gaseous State

Bunları kısaca tartışalım -
Katı hal
Tüm katı malzemelerin belirli bir şekli, farklı sınırları ve sabit hacimleri vardır.
Katı malzemelerin çoğu ihmal edilebilir sıkıştırılabilirliğe sahiptir.
Tüm katı malzemeler, dış kuvvete maruz kaldıklarında şekillerini korumak için doğal bir eğilime sahiptir.
Katı malzemeler uygulanan kuvvet altında kırılabilir, ancak sert oldukları için şekillerini değiştirmek çok zordur.
Sıvı hal
Katıların aksine, sıvıların sabit bir şekli yoktur; ancak sabit hacimleri vardır.
Sıvılar, tutulduğu kabın şeklini alır.
Sıvılar, akma ve şekil değiştirme özelliğine sahiptir.
Gaz Hali
Katı veya sıvı olmayan hava şeklindeki madde gaz olarak bilinir. Örneğin oksijen, nitrojen, hidrojen vb.
Katıdan farklı olarak, gazın belirli bir boyutu ve şekli yoktur.
Sıvılaştırılmış petrol gazı (LPG - pişirmede kullanılır) gibi gazlar; sıkıştırılmış doğal gaz (CNG - araçlarda yakıt olarak kullanılır) vb. yüksek sıkıştırılabilirliğe sahiptir; bu nedenle, büyük hacimli bir gaz, küçük bir silindire sıkıştırılabilir ve kolaylıkla taşınabilir.
Normalde gazlar diğer gazlara çok hızlı yayılma özelliği gösterir. Uzaktan (iyi ya da kötü) koklayabilmemizin nedeni budur.
Madde Durumunu Değiştirebilir
Su her üç durumda da bulunabilir, örneğin Buz katı olarak; sıvı olarak su (H2O); ve gaz olarak su buharı. Aşağıdaki diyagram, suyun farklı durumlarda dönüşümünü göstermektedir -

Katının eriyip sıvıya dönüştüğü sıcaklık (belirli atmosfer basıncında), “melting point.”
Bir katının erime noktası, parçacıkları arasındaki çekim kuvvetinin bir göstergesidir.
Buzun erime noktası 273.16 K, yani 0 0 C'dir.
Erime süreci (yani katı halin sıvı hale dönüşmesi) olarak bilinir. fusion.
Belirli bir atmosfer basıncında 1 kg katı malzemeyi sıvı malzemeye dönüştürmek için gerekli olan ısı enerjisi miktarı, latent heat füzyon.
Bir sıvının belirli atmosferik basınçta kaynamaya başladığı sıcaklık, “boiling point.”
Suyun kaynama noktası 373 K yani 100 0 C'dir.
Bir maddenin halinin sıvı hale geçmeden doğrudan katıdan gaza dönüşmesi (veya tersi) olarak bilinir. “sublimation.”
Bir sıvının kaynama noktasının altındaki herhangi bir sıcaklıkta buhara dönüşmesi fenomeni olarak bilinir. “evaporation.”
Katı karbondioksit (CO 2 ) yüksek basınç altında depolanır.

Katı CO 2 basıncı 1 atmosfere azalır kez gaz halinde doğrudan dönüştürülmüş olur.
Atmosphere(atm), gazın uyguladığı basınç ölçüm birimidir ve basınç birimi Pascal (Pa); 1 atmosfer = 1.01 × 105 Pa.
Maddenin Dördüncü Hali
Plasma süper enerjik ve süper heyecanlı parçacıklardan oluşan durumdur.

Süper uyarılmış parçacıklar iyonize gazlar şeklinde bulunur. Örneğin, flüoresan tüp (helyum gazı içerir) ve neon işaret ampulleri (neon gazı içeren) plazmadan oluşur.
Giriş
Saf bir madde, tek tip partikül veya partiküllerden oluşan maddedir.

İstenmeyen herhangi bir madde içermeyen iki veya daha fazla saf bileşenin karışımları, Mixturesörneğin su, mineraller, toprak vb.
İki veya daha fazla maddenin homojen bir karışımı olarak bilinir solution. Örneğin limonata, soda vb.
Çözüm sıvı, katı veya gaz gibi herhangi bir biçimde olabilir.
Alloyshomojen metal karışımları içeren başka bir karışım örneğidir; fiziksel yöntemlerle bileşenlerine ayrılamazlar. Örneğin, pirinç, çinko (yaklaşık% 30) ve bakır (yaklaşık% 70) karışımıdır.
Çözümün Önemli Özellikleri
Çözelti normalde homojen bir karışımdır.
Bir çözeltinin parçacıkları 1 nm'den (10-9 metre) bile daha küçüktür ve bu nedenle bunlar çıplak gözle görülemez.
Çözümde ışığın yolu görünmez.
Çözünen parçacıklar, basit filtreleme işlemiyle karışımdan ayrılamaz.
Çözünen parçacıklar, rahatsız edilmeden bırakıldığında çökmez.
Belirli bir sıcaklıkta, bir çözelti içinde artık çözünen madde çözülemediğinde, ‘saturated solution.’
Belirli bir sıcaklıkta doymuş çözelti içinde bulunan çözünmüş parçacıkların miktarı şu şekilde bilinir: solubility.’
Süspansiyon
Bir süspansiyon, çözünen partiküllerin çözünmediği, bunun yerine ortamın hacmi boyunca asılı kaldığı heterojen bir karışımdır. ‘suspension.’
Süspansiyonun önemli özellikleri
Bir süspansiyon parçacıkları çıplak gözle açıkça görülebilir.

Bir süspansiyonun parçacıkları, içinden geçen bir ışık demeti saçar ve aynı şekilde yolu görünür hale gelir.
Selam tanecikleri, basit filtreleme işlemiyle karışımdan ayrılabilir.
Kolloid
Heterojen bir karışım olarak bilinir ‘colloid.’ Örneğin sis, sis, duman, yüz kremi vb.

Kolloid parçacıkların boyutu çıplak gözle görülemeyecek kadar küçüktür.
Kolloid parçacıkları, içinden geçen bir ışık demetini saçacak ve yolu görünür kılacak kadar büyüktür.
Kolloid partikülleri, basit filtreleme işlemiyle karışımdan ayrılamaz.
Özel filtrasyon tekniği yani centrifugation, koloidal partikülleri ayırmak için kullanılabilir.
Kromatografi
Bir karışımın bileşenlerini ayırma işlemine chromatography; normalde renk ayrımı için kullanılır.
Aynı çözücü içinde çözünen bu çözünenlerin ayrılması için kromatografi tekniği kullanılır.
Damıtma
Bir sıvının ısıtma ve soğutma yoluyla saflaştırılması işlemi damıtma olarak bilinir.
Kristalleşme
Saf bir katıyı kristalleri şeklinde bir çözeltiden ayıran işlem olarak bilinir. ‘crystallization.’
Elementler
1661'de Robert Boyle, bu terimi kullanan ilk bilim adamıydı. element; Fransız kimyager Antoine Laurent Lavoisier, element terimini deneysel olarak tanımlayan ilk kişiydi.
Element, kimyasal reaksiyonla daha basit maddelere ayrılamayan temel bir madde biçimidir.
Öğeler normalde şu şekilde kategorize edilebilir: metals, non-metals, ve metalloids.
Metal
Tipik olarak sert, sünek, dövülebilir, parlak ve iyi elektriksel ve termal iletkenliğe sahip eriyebilir bir katı malzeme olarak bilinir. metal. Örneğin altın, gümüş, bakır, alüminyum vb.

Mercury oda sıcaklığında sıvı kalan tek metaldir.
Metal olmayan
Metal olmayan tüm elementler veya maddeler metal olmayanlar olarak bilinir. Örneğin hidrojen, oksijen, iyot, karbon vb.
Metal olmayanlar çeşitli renklere sahiptir ve zayıf ısı ve elektrik iletkenleridir.
Metal olmayanlar parlak, dolgun veya dövülebilir değildir.
Bileşik
İki veya daha fazla elementten oluşan bir madde, ‘compound.’
Bileşik, iki veya daha fazla elementin sabit bir oranda kimyasal olarak kombinasyonunun sonucudur.

Bir bileşiğin özellikleri, bileşen elementlerinden bir şekilde farklıdır, oysa bir karışımın özellikleri, onu oluşturan elementler veya bileşikler ile aynıdır.
Giriş
MÖ 500 civarında Hintli filozof Maharishi Kanad, maddenin bölünmez kısmı kavramını ilk kez varsaydı ve ona isim verdi. ‘pramanu.’
1808'de, John Dalton terimi kullandı ‘atom’ ve varsaydı atomic theory madde çalışmasına.

Dalton'un Atom Teorisi
Dalton'un atom teorisine göre, bir element, bir bileşik veya bir karışım olsun, tüm madde, atom adı verilen küçük parçacıklardan oluşur.
Dalton'un atom teorisine göre, elementler, bileşikler veya karışımlar olsun, tüm maddeler atom olarak bilinen küçük parçacıklardan oluşur.
Dalton'un Atom Teorisinin göze çarpan özellikleri
Tüm madde, atom olarak bilinen çok küçük parçacıklardan yapılmıştır.
Atom, kimyasal reaksiyonla yaratılamayan veya yok edilemeyen bölünmez bir parçacıktır.
Bir elementin tüm atomları kütle ve kimyasal özellikler bakımından aynı iken, farklı elementlerin atomları farklı kütlelere ve kimyasal özelliklere sahiptir.
Bir bileşik oluşturmak için atomlar, küçük tam sayılar oranında birleştirilir.
Belirli bir bileşikte, göreceli atom sayısı ve türü sabittir.
Atomik Kütle
Kimyasal bir elementin atomunun kütlesi; atomik kütle birimleriyle ifade edilir (sembol u'dur ).
Atom kütlesi kabaca atomda bulunan proton ve nötron sayısına eşittir.
Bir atomik kütle birimi, bir karbon-12 atomunun kütlesinin tam on ikide birine (1/12) eşit bir kütle birimidir ve tüm elementlerin bağıl atomik kütleleri, bir karbon-12 atomuna göre hesaplanmıştır.
Molekül
Bağımsız olarak var olabilen ve ilgili maddenin tüm özelliklerini gösteren bir elementin veya bir bileşiğin en küçük parçacığı.

Normalde bir molekül, kimyasal olarak birbirine bağlanmış iki veya daha fazla atomdan oluşan bir gruptur.
Aynı elementin veya farklı elementlerin atomları, moleküller oluşturmak için (kimyasal bağ ile) birleşebilir.
Bir molekülü oluşturan atomların sayısı onun atomicity.
İyon
Yüklü bir parçacık olarak bilinir ion; her ikisi de olabilirnegative charge veya positive charge.
Pozitif yüklü iyon, ‘cation’.
Negatif yüklü iyon, bir ‘anion.’
Kimyasal Formüller
Bir bileşiğin kimyasal formülü, onu oluşturan unsurları ve her bir birleşen elementin atom sayısını gösterir.

Bir bileşiğin kimyasal formülü, Bileşiminin sembolik temsilidir.
Bir elemanın birleştirme kapasitesi, ‘valency.’
Moleküler kütle
Bir maddenin moleküler kütlesi, ilgili maddenin bir molekülündeki tüm atomların atom kütlelerinin toplamı alınarak hesaplanır. Örneğin, suyun moleküler kütlesi şu şekilde hesaplanır -
Hidrojenin atom kütlesi = 1u
Atomik oksijen kütlesi = 16 u
Su, iki hidrojen atomu ve bir oksijen atomu içerir.
Suyun Moleküler Kütlesi = 2 × 1+ 1 × 16 = 18 u ( u , moleküler kütlenin sembolüdür).
Formül Birim Kütle
Bir maddenin formül birim kütlesi, bir bileşiğin formül birimindeki tüm atomların atomik kütlelerinin toplamı alınarak hesaplanır.
Avogadro Sabiti veya Avogadro Numarası
Avogadro, Avogadro Numarası (Avogadro Sabiti olarak da bilinir) kavramını vermiş olan bir İtalyan bilim adamıydı.
Herhangi bir maddenin 1 molünde bulunan parçacıkların (atomlar, moleküller veya iyonlar) sayısı sabittir ve değeri her zaman şu şekilde hesaplanır: 6.022 × 1023.
1896'da Wilhelm Ostwald 'köstebek' kavramını tanıtmıştı; ancak, 1967'de mol biriminin çok sayıda bildirmenin basit bir yolunu sağladığı kabul edildi.
Kütlenin Korunması Kanunu
Kimyasal bir reaksiyon sırasında, reaktanların ve ürünlerin kütlelerinin toplamı değişmeden kalır; ‘Law of Conservation of Mass.’
Kesin Oranlar Hukuku
Saf bir kimyasal bileşikte, elementleri her zaman kütlece belirli bir oranda bulunur; ‘Law of Definite Proportions.’
Giriş
1900'e gelindiğinde, atomun basit, bölünemez bir parçacık olmadığı, daha ziyade atom altı parçacıkları içerdiği keşfedildi.
J.J. Thomson yani atom altı parçacığı keşfetti ‘electron.’

JJ Thomson, bir model bir atomun yapısı için.
1886'da E. Goldstein, bir gaz deşarjında yeni radyasyonların varlığını keşfetti ve onları adlandırdı canal rays.
Başka bir pozitif yüklü atom altı parçacık, kanal ışınları deneyleriyle keşfedildi ve adını verdi. proton.
Thomson'ın Atom Modeli
Thomson, bir atomun pozitif yüklü bir küreden oluştuğunu ve elektronların (negatif yük) içine gömülü olduğunu öne sürdü (aşağıda verilen resimde gösterildiği gibi).

Ayrıca Thomson, negatif ve pozitif yüklerin büyüklük olarak eşit olduğunu söyledi. Böylece, atom bir bütün olarak elektriksel olarak nötrdür.
Rutherford'un Atom Modeli
E. Rutherford, nükleer fiziğin 'Babası' olarak popülerdir.

Rutherford, büyük ölçüde radyoaktivite konusundaki çalışmaları ve nucleus altın folyo deneyi ile bir atomun (aşağıda verilen görüntüde gösterildiği gibi.

Rutherford, bir atomda, pozitif yüklü bir merkez olduğunu söyledi. nucleus.
Rutherford, bir atomun neredeyse tüm kütlesinin çekirdekte bulunduğunu söyledi.
Rutherford'a göre, elektronlar çekirdeğin etrafında iyi tanımlanmış yörüngelerde dönüyor.
Bohr'un Atom Modeli
Neils Bohr, Rutherford'un modelini daha da genişletti ve dezavantajlarını iyileştirdi.

Bohr'a göre, atomun içinde yalnızca elektronların ayrık yörüngeleri olarak bilinen belirli özel yörüngelere izin verilir.
Bohr, elektronların ayrı yörüngelerde dönerken enerji yaymadığını söyledi.
Bohr yörüngeleri veya mermileri enerji seviyeleri olarak adlandırdı (aşağıda verilen resimde gösterildiği gibi).

Bohr bu yörüngeleri veya mermileri temsil eden K, L, M, N,… harfleriyle veya n = 1,2,3,4,… sayılarıyla.
Nötron
1932'de J. Chadwick yeni bir atom altı parçacık, yani nötron keşfetti.
Nötronun yükü yoktur ve neredeyse bir protonun kütlesine eşittir.
Nötronlar, hidrojen hariç tüm atomların çekirdeğinde bulunur.
Farklı Yörüngelerde Dağıtılan Elektronlar (Kabuklar)
Bir kabukta bulunabilecek maksimum elektron sayısı formülle verilir. 2n2.
‘n’ yörünge numarası veya enerji seviyesi endeksidir, yani 1, 2, 3,….
Verilen formüle göre -
İlk yörünge yani K-shell= 2 × 1 2 = 2 olacak
İkinci yörünge yani L-shell= 2 × 2 2 = 8 olacak
Üçüncü yörünge yani M-shell= 2 × 3 2 = 18 olacak
Dördüncü yörünge yani N-shell= 2 × 4 2 = 32 olacak
Aynı şekilde, en dış yörüngede barındırılabilecek maksimum elektron sayısı 8'dir.
İç kabuklar doldurulmadıkça, elektronlar belirli bir kabukta doldurulmaz. Bu, kabukların adım adım doldurulduğu anlamına gelir; iç kabuktan başlayarak dış kabuğa.
Değerlik
Bir atomun en dıştaki kabuğunda bulunan elektronlar, valence elektronlar.
Bohr-Bury modeline göre, bir atomun en dıştaki kabuğu en fazla 8 elektrona sahip olabilir.
Atomik numara
Bir atomun çekirdeğinde bulunan toplam proton sayısı şu şekilde bilinir: atomic number.
Bir atomun proton sayısı atom numarasını belirler.
Atom numarası şu şekilde gösterilir: ‘Z’.
Protonlar ve nötronlar toplu olarak şu şekilde bilinir: nucleons.
Kütle Numarası
Bir atomun çekirdeğinde bulunan toplam proton ve nötron sayısının toplamı şu şekilde bilinir: mass number.
İzotoplar
Aynı atom numarasına ancak farklı kütle numaralarına sahip aynı elementin atomları izotoplar olarak bilinir. Örneğin Hidrojen atomunun protium, döteryum ve trityum olmak üzere üç izotopu vardır.
Bir atomun izotoplarının kimyasal özellikleri benzerdir ancak fiziksel özellikleri farklıdır.
İzobarlar
Aynı kütle numarasına sahip farklı atom numaralarına sahip farklı elementlerin atomları izobarlar olarak bilinir. Örneğin, kalsiyumun atom numarası 20'dir ve argonun atom numarası 18'dir; ayrıca, bu atomlardaki elektron sayısı farklıdır, ancak bu iki elementin kütle sayısı 40'tır.
Giriş
Bir veya daha fazla kimyasal maddenin diğer kimyasal maddelerle reaksiyona girdiği ve bir veya daha fazla farklı maddeye dönüştürüldüğü bir süreç, kimyasal reaksiyon olarak bilinir.
Kimyasal Denklem
Kimyasal bir denklem, bir kimyasal reaksiyonun sembolik gösterimidir; semboller ve formüllerle temsil edilir. Örneğin
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
Magnezyum ve oksijen maddeleri reaktan olarak bilinir ve reaksiyonun sonucu yani magnezyum oksit ürün olarak bilinir.
Unutmayın bir kimyasal reaksiyon ürünlerinde bulunan elementlerin toplam kütlesi elemanları reaktanlarda mevcut toplam kütlesine eşit olmak zorundadır.
Kimyasal reaksiyondan önce ve sonra her elementin atom sayısı her zaman aynı kalır.
Kimyasal Reaksiyon Türleri
Aşağıdakiler başlıca kimyasal reaksiyon türleridir -
Combination Reaction
Decomposition Reaction
Displacement Reaction
Her birini kısaca tartışalım -
Kombinasyon Reaksiyonu
İki veya daha fazla madde (yani elementler veya bileşikler) tek bir ürün oluşturmak için reaksiyona girdiğinde, böyle bir reaksiyon olarak bilinir combination reaction. Örneğin
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
Yukarıdaki reaksiyonda gösterildiği gibi, kalsiyum oksit ve su, kalsiyum hidroksit olarak bilinen tek bir ürün oluşturmak için reaksiyona girdi (veya birleştirildi).
Ürün oluşumu ile birlikte ısının da açığa çıktığı kimyasal reaksiyon, exothermic chemical reactions.
Ayrışma reaksiyonu
Tek bir reaktantın daha basit ürünlere ayrıldığı reaksiyon, ayrışma reaksiyonu olarak bilinir. Örneğin

Yukarıda verilen reaksiyonda Demir sülfat kristalleri (yani FeSO 4 , 7H 2 O) ısıtıldıklarında su kaybeder ve kristallerin rengi değişir. Son olarak, demir oksit (Fe haline parçalanır 2 O 3 ), kükürt dioksit (SO 2 ) ve kükürt trioksit (SO 3 ).
Deplasman Reaksiyonu
Bir elementin başka bir elementi yerinden ettiği veya uzaklaştırdığı reaksiyon, yer değiştirme reaksiyonu olarak bilinir. Örneğin
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
Yukarıda verilen reaksiyonda demir, bakırın bakır sülfat çözeltisinden yerini değiştirmiş ve Demir sülfat oluşturmuştur.
Yükseltgenme ve İndirgenme
Bir reaksiyon sırasında bir madde oksijen kazanırsa, buna oxidation. Öte yandan, bir reaksiyonda, bir madde oksijen kaybederse,reduction. Örneğin

Yukarıda verilen reaksiyonda, bakır oksit oksijen kaybeder ve dolayısıyla azalır (yani indirgeme); Öte yandan, hidrojen oksijen kazanır ve dolayısıyla oksitlenir (yani oksidasyon).
Aşınma
Bir metale yakın çevrede bulunan nem, asitler vb. Gibi maddeler tarafından saldırıya uğradığında, corrosion. Örneğin gümüş üzeri siyah kaplama, bakır üzeri yeşil kaplama vb.

Acı
Katı ve sıvı yağlar oksitlendiğinde, süreç ekşimişlik olarak bilinir. Kokusu, tadı, rengi vb. De değişir; aynı şekilde, yiyecekleri tüketim için güvensiz hale getirdi.
Giriş
Yiyecekleri ekşi ve acı tadı alıyoruz, sadece sırasıyla asit ve bazların varlığından kaynaklanıyor.
Litmus Çözümü
Likenden ekstrakte edilen Litmus mor renge sahiptir (aşağıdaki resme bakın), ancak durum ne asidik ne de bazik, yani nötr olduğu zamandır.

Litmus temelde Thallophyta'ya ait bir bitkidir ve kimyasal deneyde genellikle bir gösterge olarak kullanılır.
Asidik veya bazik ortamda koku değişikliğine neden olan maddeler, olfactory göstergeler.
Su Çözeltisinde Asit veya Baz
HCl'deki hidrojen iyonları, su varlığı nedeniyle üretilir. İkinci olarak, H + iyonunun HCl moleküllerinden ayrılması su olmadan yapılamaz. Kimyasal formül aşağıda gösterilmiştir
HCl + H2O → H3O+ + Cl–
Dahası, hidrojen iyonları tek başına var olamaz, ancak su moleküllerinin varlığında var olabilirler. Bu nedenle, hidrojen iyonları H + (aq) veya hidronyum iyonu (H 3 O + ) olarak gösterilir. Kimyasal formül -
H+ + H2O → H3O+
Suda çözünen bazlar şu şekilde bilinir: alkalis. Ancak tüm bazlar suda çözünmez.
Konsantre bir aside su eklenirse, ısı üretilir.
Bir asit veya bazın suyla karıştırılması, birim hacim başına iyon konsantrasyonunun (yani H 3 O + / OH–) azalmasına neden olur ve işlem olarak bilinir.dilution.
PH cetveli
Bir çözeltideki hidrojen iyonu konsantrasyonunu ölçmek için kullanılan bir ölçek, pH scale.
‘p’ pH değerinde ‘potenz’, Alman bir terimdir, yani ‘power’.
pH değeri, bir çözeltinin asidik veya bazik yapısını gösteren bir sayı olarak alınır. Dolayısıyla, hidronyum iyonunun konsantrasyonu daha yüksekse, pH değeri daha düşük olacaktır.
PH ölçeğinin değeri arasında değişir ‘0’ ve ’14;’ yani, pH değeri '0' olarak ölçülürse, bu çok acidic ve eğer 14 ise, o zaman - çok alkaline.
PH ölçeğinin nötr değeri ‘7’.
Bir pH ölçeğinde, 7'den küçük değerler asidik bir çözeltiyi temsil eder ve 7'den büyük değerler temel bir çözeltiyi temsil eder.
Genellikle, pH'ı ölçmek için ortak indikatörle emprenye edilmiş kağıt kullanılır (aşağıda verilen resme bakın) -
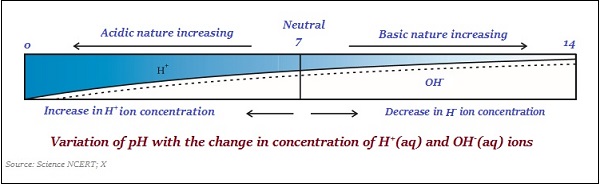
Aynı şekilde, asitlerin ve baz maddelerinin gücü , sırasıyla üretilen H + iyonlarının ve OH - iyonlarının sayısına bağlıdır .
Aşağıdaki resim, yaygın olarak kullanılan bazı maddelerin pH değerini kabaca göstermektedir (renkteki farklılıklar) -

Günlük Yaşamda pH'ın Önemi
İnsan vücudunun pH değeri 7.0 ile 7.8 arasında değişmektedir.
İnsan vücudunun midesi, gıdanın sindirilmesine yardımcı olan hidroklorik asit üretir; şaşırtıcı bir şekilde mideye zarar vermez.
Ancak mide çok fazla asit ürettiğinde (hazımsızlık olarak bilinir) ağrıya ve tahrişe neden olur. Bu acıdan kurtulmak için doktorlar antasitler olarak bilinen bazların kullanılmasını önermektedir.
Bu antasitler artan asit miktarını nötralize eder ve kontrol eder.
Kalsiyum fosfattan oluşan dişler vücuttaki en sert maddedir. Ancak ağızdaki pH düştüğünde (5.5'in altına) dişleri aşındırır.
Tuz, normal olarak, hidroklorik asit ve sodyum hidroksit çözeltisinin kombinasyonundan oluşur; ve kombinasyon sodyum klorür olarak bilinir.
Yağmur suyunun pH değeri 5,6'nın altında ölçüldüğünde, acid rain.
Nehirlere asit yağmuru aktığında nehir suyunun pH'ını da düşürür.
Asidik nehir suyu, sucul yaşamın hayatta kalması için bir tehdittir.
Beyazlatıcı pudra
Ağartma tozu, klorun kuru sönmüş kireç [Ca (OH) 2 ] üzerindeki etkisiyle üretilir ve CaOCl 2 olarak temsil edilir .
Ağartma tozu normalde tekstil endüstrisinde, kağıt fabrikasında, kimya endüstrisinde ve içme suyunun dezenfekte edilmesinde kullanılır.
Karbonat
Kabartma tozu mutfakta lezzetli çıtır yiyecekler pişirmek için yaygın olarak kullanılır. Ayrıca bazı yiyecekleri daha hızlı pişirir.
Kabartma tozu kimyasal adı sodyum hidrojenkarbonattır ve formülü NaHCO 3'tür .
Çamaşır sodası
Sodyum karbonatın yeniden kristalleşmesi yıkama sodasına neden olur.
Çamaşır sodası kimyasal formülü Na 2 CO 3 .10H 2 O
Washing soda is commonly used in glass, soap, and paper industries.
Plaster of Paris
Plaster of Paris is a white powder that doctors use as plaster for supporting fractured bones.
The chemical name of plaster of paris is calcium sulphate hemihydrate and chemical formula is 2CaSO4.H2O.
Introduction
The metals can be distinguished from the non-metals on the basis of their chemical and physical properties.
The property of metals by which they can be beaten into thin sheets is known as malleability.
The property of metal by which it can be drawn into wires is known as ductility.
The metals are normally hard, malleable, lustrous, ductile, sonorous, and good conductors of heat and electricity. E.g. iron, copper, calcium, aluminum, magnesium, etc.

The materials, which are not sonorous and are poor conductors of heat and electricity, are known as non-metals. E.g. sulphur, carbon, oxygen, phosphorus, etc.
Some metals, such as sodium and potassium are soft and can be cut with a knife.
Mercury is the only metal, which remains in liquid state at room temperature.
When sulphur dioxide is dissolved in water, sulphurous acid is formed. Illustration - Sulphur dioxide (SO2) + Water (H2O) → Sulphurous acid (H2SO3).
Oxides of non-metals are acidic in nature.
The sulphurous acid changes blue litmus paper red.
Phosphorus is a very reactive non-metal and it catches fire whenever exposed to air.
To prevent the contact of phosphorus with atmospheric oxygen, Phosphorus is stored in water.
On burning, metals easily react with oxygen and produce metal oxides, these are basic in nature.
Non-metals react with oxygen and produce non- metallic oxides; these are acidic in nature.
Some metals react with water and produce metal hydroxides and hydrogen gas.
Nonmetals normally do not react with water.
Metals also react with acids and produce hydrogen gas and metal salts.
Non-metals normally do not react with acids.
Uses of Metals and Nonmetals
Metals are used in making machinery, airplanes, automobiles, trains, satellites, industrial gadgets, cooking utensils, water boilers, etc.
Non-metals are used in fertilizers to improve the growth of plants.
Non-metal are used in water purification.
Non-metals are used in crackers.
Introduction
A solid material, which is typically hard, malleable, shiny, fusible, and ductile, is known as metals. E.g. iron, copper, aluminum, magnesium, sodium, lead, zinc, etc.
Normally, metals have good electrical and thermal conductivity.

Metals, in their pure state, have a shining surface, known as metallic luster.
Metals can be beaten into thin sheets; this property is known as malleability.
The property of metals to be drawn into the thin wires is known as ductility. E.g. gold is the most ductile metal.
Silver and copper are the best heat conductor.
Non-Metals
The non-metals are normally found in either solids or gases states. However, bromine is an exception that found in liquid state.
Some of the major examples of non-metals are carbon, sulphur, iodine, oxygen, hydrogen, etc.

Facts of Metals and Non-metals
All metals exist in the solid form at room temperature, except mercury.
Gallium and caesium have very low melting points; these two metals get melt even on palm.
Iodine is a non-metal, but it is lustrous (lustrous is the property of metal).
Carbon is a non-metal that can exist in different forms. Each form is called an allotrope.
Diamond is an allotrope of carbon and it is the hardest natural substance known.
The melting and boiling point of diamond is very high.
Graphite is also allotrope of carbon; it is a conductor of electricity.
Alkali metals, such as lithium, potassium, sodium, are the examples of soft metals, as they can be cut with a knife.
Nearly all metals when combined with oxygen, it forms metal oxides.
Different metals have different frequency of reaction; some react slow, but some react very fast. E.g. potassium and sodium are very reactive and they catch fire only if kept in the open.
Therefore, potassium and sodium are kept immersed in kerosene oil so that they cannot catch fire.
However, among all metals, sodium (most likely), is the most reactive metal.
Anodizing is a process of forming a thick protective oxide layer of aluminum and it protects from corrosion.
The elements or compounds that occur naturally in the crust (upper layer) of the earth, are known as minerals.
The minerals in raw form is known as ores. E.g. gold, silver, iron etc. (iron ore shown in the image given below) −

The ores, which are extracted from the earth, are usually contaminated with large amounts of impurities such as mix with some elements, soil, sand, etc., known as ‘gangue’.
Based on the reactive nature and extraction from the ores, metals can be categorized as −

Introduction
Carbon plays very important roles for all living beings.
The amount of carbon in the earth’s crust is merely 0.02%, which is available in the form of minerals such as carbonates, hydrogen-carbonates, coal, and petroleum.
The presence of carbon in the atmosphere of the earth is 0.03%, in the form of carbon dioxide.
Compounds of Carbon
Almost all carbon compounds (except a few) are poor conductors of the electricity.
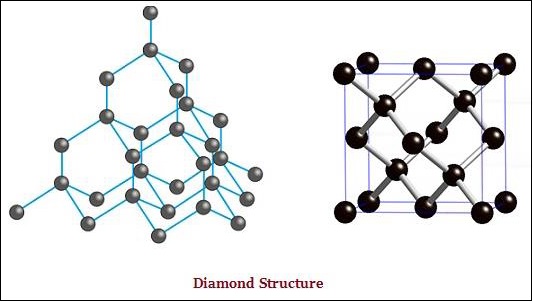
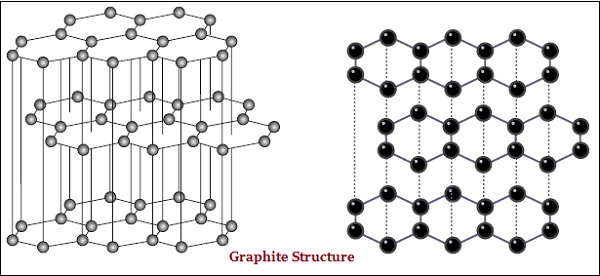
The diamond and graphite both are formed by carbon atoms; however, the difference lies between them in the manner in which the carbon atoms are bonded to one another.
In diamond, each atom of the carbon, is bonded to four other carbon atoms and form a rigid three-dimensional structure (see the image given below).
In graphite, each atom of the carbon, is bonded to three other carbon atoms in the same plane, which gives a hexagonal array (see the image given below) −
There is also difference in some physical structure of diamond and graphite.
Diamond is the hardest substance known whereas graphite is smooth and slippery substance.
Graphite is good conductor of electricity whereas diamond is not.
Following table illustrates the structures of compounds of carbon and hydrogen −
| Name | Formula | Structure |
|---|---|---|
| Methane | CH4 |

|
| Ethane | C2H6 |

|
| Propane | C3H8 |

|
| Butane | C4H10 |

|
| Pentane | C5H12 |

|
| Hexane | C6H14 |

|
The compounds, which has identical molecular formula, but different structures, are known as structural isomers (see the structure Butane given below).

The saturated hydrocarbons are known as alkanes.
The unsaturated hydrocarbons, which comprise of one or more double bonds, are known as alkenes.
The unsaturated hydrocarbons, which comprise of one or more triple bonds, are known as alkynes.
Use of Alcohol as Fuel
Sugarcane plants very efficient convert sunlight into chemical energy and its juice can be used to prepare molasses.
When molasses is fermented, it produces alcohol (ethanol).
Some of the countries now using alcohol as an additive in petrol, as it is a cleaner fuel.
These alcohol, on burning in sufficient air (oxygen), gives rise to only carbon dioxide and water.
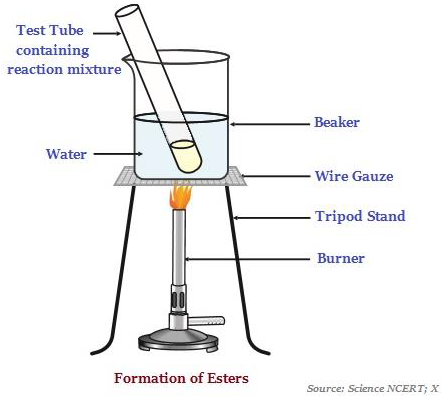
Esters
Esters are sweet-smelling substances, which are most commonly formed by reaction of an acid and an alcohol (see the image below – illustrating the formation of esters).
When esters react in the presence of an acid or a base, it gives back the alcohol and carboxylic acid.
The reaction of esters with an acid or a base, is known as saponification because it is used in the preparation of soap.
The molecules of soap normally are sodium or potassium salts of long-chain carboxylic acids.
Interestingly, the ionic-end of soap dissolves in water whereas the carbon chain dissolves in oil. This typical features of the soap molecules forms structures known as micelles (see the image given below)

In micelles, one end of the molecules is towards the oil droplet whereas the ionic-end remains outside.
The soap micelle helps in dissolving the dirt in water; likewise, the clothes get cleaned.
On the other hand, detergents are usually ammonium or sulphonate salts of long chain carboxylic acids, which remain effective even in hard water.
Detergents are customarily used to make shampoos and some other products for cleaning clothes.
Introduction
There are about 115 elements have been known to us till today.
Based on their properties, all the elements are arranged in order, known as periodic table.
Johann Wolfgang Döbereiner, a German scientist, first attempted to arrange the elements in 1817.
John Newlands, an English scientist, also attempted to arrange the then known elements (in 1866).
John Newlands had followed the order of increasing atomic masses to arrange the elements.
Newlands started with the element having the lowest atomic mass (such as hydrogen) and ended at thorium, which was the 56th element (at his time).

Newlands’ arrangement of elements is known as “Law of Octaves,” as in his arrangement every eight element had the properties similar to that of the first. E.g. the properties of lithium and sodium were found to be the same.
| Sa (do) | re (re) | Ga (mi) | Ma (fa) | Pa (so) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
| Co & Ni | Cu | Zn | Y | In | As | Se |
| Br | Rb | Sr | Ce & La | Zr |
Newlands also compared it with the octaves that found in music (see the table given above).
In the Indian music, the seven musical notes are – sa, re, ga, ma, pa, da, ni; however, in the west, the musical notes are – do, re, mi, fa, so, la, ti.
Further, in order to fit some elements into his Table, Newlands put two elements in the same cell (see the table given above – cobalt & nickel kept in same cell), but this technique did not work, as they have different properties.
However, the law of octave had limitation, as was applicable up to calcium only; and, after calcium every eighth element had not the properties similar to that of the first.
Mendeléev’s Periodic Table
Dmitri Ivanovich Mendeléev, a Russian chemist, who successfully attempted to arrange the elements.
Mendeléev arranged the elements based on their (elements) fundamental property, the atomic mass, as well as on the similarity of chemical properties.
During the Mendeleev’s time, only 63 elements were known.
Mendeléev’s Periodic Table consists of vertical columns known as ‘groups’ and horizontal rows known as ‘periods.’

Mendeléev’s Periodic Law states that
‘The properties of elements are the periodic function of their atomic masses’.
Mendeléev arranged the sequence in inverted fashion so that elements with similar properties could be grouped together.
Mendeléev left space for some elements, which were not discovered at that time; he boldly predicted about the existence of future elements.
One of the biggest limitation of Mendeléev’s Periodic formula is - no fixed position has been assigned to hydrogen in the Periodic Table.
Modern Periodic Table
In 1913, Henry Moseley, an English physicist discovered that the atomic number of an element is a more fundamental property in comparison to its atomic mass.
Based on Moseley’s discovery, Mendeléev’s Periodic Law was modified and atomic number was adopted as the basis of Modern Periodic Table.
The Modern Periodic Law states −
‘Properties of elements are a periodic function of their atomic number.’
18 vertical columns known as ‘groups’ and 7 horizontal rows known as ‘periods’ are defined in the Modern Periodic Table.
In Modern Periodic Table, the elements are arranged in such a way that it shows periodicity of properties such as atomic size, valency, or combining capacity and metallic and non-metallic characteristics (of elements).
In Modern Periodic Table, the metallic character decreases across a period and increases down the group.
On the other hand, non-metals are electronegative, as they tend to form bonds by gaining electrons.
In Modern Periodic Table, the non-metals are placed on the right-hand side (from the top).
Introduction
The clothes that we wear are made up of fabrics and the fabrics are made from fibers, which is obtained from natural or artificial sources.
The natural source of fibers is cotton, wool, silk, etc., which are obtained from plants or animals.
The synthetic fibers are made by human beings; therefore, these are called synthetic or man-made fibers.
A synthetic fiber is usually a chain of small units those joined together; each small unit is a chemical substance.
Types of Synthetic Fibers
The artificial silk is usually known as Rayon.
Rayon (fiber) was obtained by chemical treatment of wood pulp.
The fiber, prepared from coal, water and air, is known as Nylon.

Nylon was the first fully synthetic fiber.
Polyester is also a synthetic fiber; it is wrinkle free fiber. E.g. Terylene.
PET is one of the familiar form of polyesters and it is used for making utensils, bottles, films, wires, and many other useful products.
Polyester (Poly + ester) is made up of the repeating units of a chemical known as an ester.
Plastic is also a sort of polymer like the synthetic fiber.
Polythene (Poly + ethene) is a common example of a plastic.
There are some plastics, which when molded once, cannot be softened by heating; therefore, these are known as thermosetting plastics. E.g. Bakelite and melamine.
Bakelite is a poor conductor of heat and electricity; therefore, it is used in making electrical switches, handles of various utensils, etc.
Melamine resists fire and can tolerate heat better than other plastics; therefore, it is used for making floor tiles, kitchenware, and fabrics.
A material, which gets decomposed through the natural processes, e.g. action by bacteria, is known as biodegradable.
A material, which cannot be easily decomposed by natural processes, is known as non-biodegradable.
Plastic is not an environment friendly.
Introduction
The resources, which are present in unlimited quantity in nature and are not likely to be exhausted by human activities, are known as Inexhaustible Natural Resources. E.g. sunlight, air.
The resources, which are present in limited quantity in nature and are likely to be exhausted by human activities, are known as Exhaustible Natural Resources. E.g. forests, wildlife, minerals, coal, petroleum, natural gas etc.
Exhaustible natural resources were formed from the dead remains of living organisms (fossils); therefore, these natural resources are also known as fossil fuels. E.g. coal, petroleum and natural gas.
Coal
Coal is hard as stone and black in color.
Coal is one of the fuels used to cook food.

Coal is used in thermal power plants to produce electricity.
Under high pressure and high temperature, the dead plants those got buried inside the Earth, got slowly converted into coal.
Coal contains mainly carbon.
The slow process of conversion of dead vegetation into coal is known as carbonization.
Coal is formed from the remains of vegetation; therefore, it is also known as fossil fuel.
When coal burns, it produces mainly carbon dioxide gas.
When coal is processed in industry, it produces some useful products such as coke, coal tar, and coal gas.
Coke is a hard, porous, and black substance.
Coke is pure form of carbon.
Coke is largely used in the manufacturing of steel and in the extraction of many metals.
Coal tar is a black, thick liquid with unpleasant smell.
Coal tar is mixture of about 200 substances.
The products, those are obtained from coal tar, are used as starting materials for manufacturing various substances used in everyday life and in industry. E.g. explosives, paints, roofing materials, synthetic dyes, drugs, perfumes, plastics, photographic materials, etc.
Naphthalene balls, obtained from coal tar, are used to repel moths and other insects.
Bitumen, obtained from petroleum product, is used in place of coal-tar for metalling the roads.
During the processing of coal to get coke, coal gas is obtained.
In 1810, for the first time in London, UK, coal gas was used for street lighting and in 1820, in New York, USA.
At present, coal gas is used as a source of heat.
Petroleum
Petrol and diesel are obtained from a natural resource known as petroleum.
Petroleum was formed from the organisms living in the sea.
Over millions of years (the dead organisms buried inside the earth), in the presence high temperature, high pressure, and in the absence of air, the dead organisms transformed into petroleum and natural gas.
In 1859, the world’s first oil well was drilled in Pennsylvania, USA.
In 1867, oil was stuck at Makum in Assam, India.
In India, petroleum is largely found in Assam, Gujarat, Mumbai High, Maharashtra, and in the river basins of Godavari and Krishna.
The following image illustrates the layer of gas and oil −

Petroleum is a mixture of various constituents such as petrol, petroleum gas, diesel, lubricating oil, paraffin wax, etc.
The process of separating the various constituents of petroleum is known as refining.
The different useful substances, which are obtained from the petroleum and natural gas, are known as ‘Petrochemicals.’
Petrochemicals are used in the manufacturing of detergents, fibers (polyester, nylon, acrylic etc.), polythene and other man-made plastics.
Hydrogen gas, which is obtained from natural gas, is used in the production of fertilizers (urea).
Because of having the great commercial importance, petroleum is also known as ‘black gold.’
Natural gas is normally stored under high pressure and hence known as Compressed Natural Gas (CNG).
CNG is used for power generation and fuel for vehicles.
The following table illustrates various constituents of petroleum and their uses −
| Petrol bileşenleri | Kullanımlar |
|---|---|
| Sıvı haldeki Petrol Gazı (LPG) | Ev ve endüstri için yakıt |
| Benzin | Motor yakıtı, uçak yakıtı, kuru temizleme için çözücü |
| Dizel | Ağır motorlu araçlar için yakıt, elektrik jeneratörleri |
| Gazyağı | Sobalar, lambalar ve jet uçakları için yakıt |
| Kayganlaştırıcı yağ | Yağlama |
| Parafin mumu | Merhemler, mumlar, vazelin vb. |
| Zift | Boyalar, yol kaplaması |
Giriş
Bir maddenin oksijenle reaksiyona girdiği ve ısı yaydığı kimyasal bir süreç olarak bilinir. combustion.
Yanmaya uğrayan maddeye combustible veya fuel.
Yakıt katı, sıvı veya gaz formunda olabilir.
Yanma sırasında ışık da ya bir flame veya olarak glow.

Yanma süresinde buharlaşan maddeler alev verir.
Bir alev karanlık bölgesi, ışıklı bölge ve ışıksız bölgenin üç farklı bölgesi vardır.

Farklı maddeler farklı sıcaklıklarda tutuşur.
Bir maddenin alev aldığı en düşük sıcaklık, ignition temperature.
Bir kibrit, antimon trisülfür ve potasyum klorat içerir.
Kibritin sürtünme yüzeyi, toz cam ve biraz kırmızı fosfor içerir.
Kırmızı fosfor çok daha az tehlikelidir.
Kibrit çubuğu sürtünme yüzeyine vurulduğunda, bir miktar kırmızı fosfor beyaz fosfora dönüşür; işlem hemen kibrit çöpü kafasında bulunan potasyum klorat ile reaksiyona girer ve antimon trisülfidi tutuşturmak için yeterli ısı üretir; aynı şekilde yanma başlar.
Tutuşma sıcaklığı çok düşük olan ve alevle kolayca alev alabilen maddeler olarak bilinir. inflammable substances. Örneğin. benzin, alkol, Sıvılaştırılmış Petrol Gazı (LPG) vb.
Yangın söndürücü
Water en yaygın yangın söndürücüdür.
Yangın söndürücü olarak su, yalnızca tahta ve kağıt gibi şeyler yandığında çalışır.

Elektrikli ekipman yanıyorsa, su elektriği iletebilir ve yangını söndürmeye çalışanlara zarar verebilir.
Su aynı zamanda petrol ve petrol içeren yangınlar için iyi bir söndürücü değildir.
Elektrikli ekipman ve benzin gibi yanıcı maddeler içeren yangınlar için Karbon Dioksit (CO2) en iyi söndürücüdür.

CO2 elde etmenin yollarından biri, sodyum bikarbonat (kabartma tozu) veya potasyum bikarbonat gibi bol miktarda kuru kimyasal toz salmaktır.
Fosfor, oda sıcaklığında havada yanar.
1 kg yakıtın tamamen yanması üzerine üretilen ısı enerjisi miktarı, calorific value.
Bir yakıtın kalorifik değeri kilojoule / kg (kJ / kg) olarak adlandırılan bir birimle ölçülür.
The following table illustrates the Calorific Values of Different Fuels −
| Yakıt | Kalori Değeri (kJ / kg) |
|---|---|
| İnek gübresi keki | 6000-8000 |
| Odun | 17000-22000 |
| Kömür | 25000-33000 |
| Benzin | 45.000 |
| Gazyağı | 45.000 |
| Dizel | 45.000 |
| Metan | 50000 |
| CNG | 50000 |
| LPG | 55.000 |
| Biyogaz | 35000-40000 |
| Hidrojen | 150000 |
Çoğu yakıt salınımının yanması carbon dioxide çevrede.
Havadaki karbondioksit konsantrasyonunun artması büyük olasılıkla nedenidir global warming.
Dünya atmosferinin sıcaklığındaki artış Global Warming.
Küresel ısınma, kutup buzullarının erimesine neden olur ve bu da deniz seviyesinde bir yükselmeye yol açar ve sonuçta kıyı bölgelerinde sellere neden olur.
Kükürt ve nitrojen oksitleri yağmur suyunda çözünür ve asit oluşturur; bu tür yağmur şu şekilde biliniracid rain.