Grundlegende Elektronik - Materialien
Materie besteht aus Molekülen, die aus Atomen bestehen. Nach Bohrs Theorie besteht das Atom aus einem positiv geladenen Kern und einer Reihe negativ geladener Elektronen, die sich in verschiedenen Bahnen um den Kern drehen. Wenn ein Elektron von einem niedrigeren in einen höheren Zustand gebracht wird, spricht man von einem niedrigeren Zustandexcited. Während der Anregung wird das Atom ionisiert, wenn das Elektron vollständig aus dem Kern entfernt ist. Der Prozess des Anhebens des Atoms vom Normalzustand in diesen ionisierten Zustand wird also als bezeichnetionization.
Die folgende Abbildung zeigt die Struktur eines Atoms.
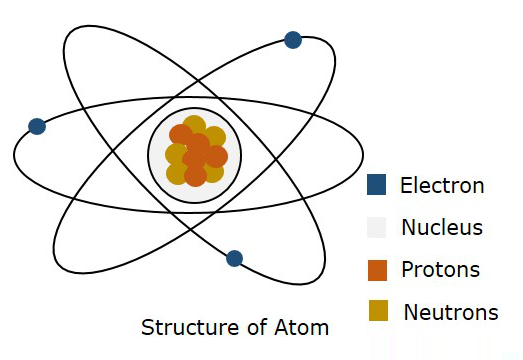
Nach Bohrs Modell soll ein Elektron in einem bestimmten bewegt werden OrbitWährend nach der Quantenmechanik ein Elektron irgendwo im freien Raum des Atoms sein soll, heißt Orbital. Diese Theorie der Quantenmechanik hat sich als richtig erwiesen. Daher wird eine dreidimensionale Grenze, an der sich wahrscheinlich ein Elektron befindet, als bezeichnetAtomic Orbital.
Quantenzahlen
Jedes Orbital, in dem sich ein Elektron bewegt, unterscheidet sich in seiner Energie und Form. Die Energieniveaus von Orbitalen können unter Verwendung eines diskreten Satzes von Integralen und Halbintegralen dargestellt werden, die als Quantenzahlen bekannt sind. Es gibt vier Quantenzahlen, die zum Definieren einer Wellenfunktion verwendet werden.
Hauptquantenzahl
Die erste Quantenzahl, die ein Elektron beschreibt, ist die Principal quantum number. Sein Symbol istn. Es gibt die Größe oder Reihenfolge (Energieniveau) der Zahl an. Wenn der Wert von n zunimmt, nimmt auch der durchschnittliche Abstand vom Elektron zum Kern zu, und auch die Energie des Elektrons nimmt zu. Das Hauptenergieniveau kann als Hülle verstanden werden.
Drehimpuls Quantenzahl
Diese Quantenzahl hat lals sein Symbol. Dieses l gibt die Form des Orbitals an. Sie reicht von 0 bis n-1.
l = 0, 1, 2… n-1
Für die erste Schale ist n = 1.
dh für n-1 ist l = 0 der einzig mögliche Wert von l als n = 1.
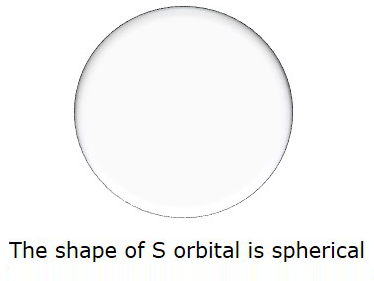
Wenn also l = 0 ist, heißt es als SOrbital. Die Form von S ist kugelförmig. Die folgende Abbildung zeigt die Form von S.
Wenn n = 2, dann ist l = 0, 1, da dies die zwei möglichen Werte für n = 2 sind.
Wir wissen, dass es S-Orbital für l = 0 ist, aber wenn l = 1 ist, ist es P Orbital.
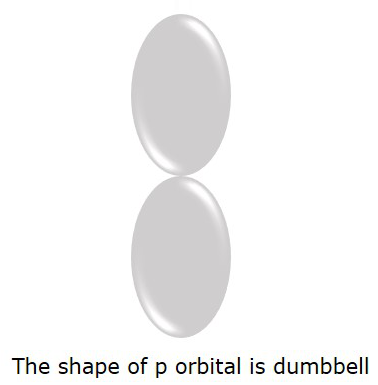
Das P-Orbital, in dem sich die Elektronen mit größerer Wahrscheinlichkeit befinden, befindet sich in dumbbellgestalten. Dies ist in der folgenden Abbildung dargestellt.
Magnetische Quantenzahl
Diese Quantenzahl wird mit bezeichnet mlDies repräsentiert die Ausrichtung eines Orbitals um den Kern. Die Werte von m l hängen von l ab.
$$ m_ {l} = \ int (-l \: \: bis \: + l) $$
Für l = 0, m l = 0 repräsentiert dies das S-Orbital.
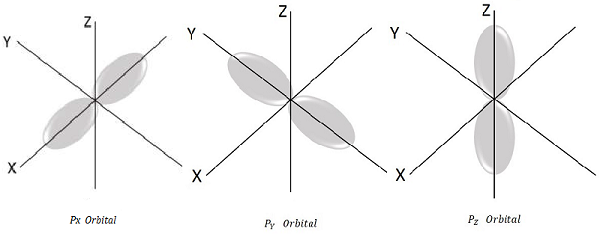
Für l = 1, m l = -1, 0, +1 sind dies die drei möglichen Werte und dies repräsentiert das P-Orbital.
Daher haben wir drei P-Orbitale, wie in der folgenden Abbildung gezeigt.
Spin Quantenzahl
Dies wird dargestellt durch msund das Elektron dreht sich hier um die Achse. Die Bewegung des Elektronenspinnens kann entweder im Uhrzeigersinn oder gegen den Uhrzeigersinn erfolgen, wie hier unten gezeigt.
Die möglichen Werte für diese Spinquantenzahl sind wie folgt:
$$ m_ {s} = + \ frac {1} {2} \: \: up $$
Für eine Bewegung namens Spin-up ist das Ergebnis die positive Hälfte.
$$ m_ {s} = - \ frac {1} {2} \: \: down $$
Für eine Bewegung namens Spin-Down ist das Ergebnis eine negative Hälfte.
Dies sind die vier Quantenzahlen.
Pauli-Ausschlussprinzip
Nach dem Pauli-Ausschlussprinzip no two electrons in an atom can have the same set of four identical quantum numbers. Das heißt, wenn zwei Elektronen die gleichen Werte von n, s, ml haben (wie wir gerade oben besprochen haben), dann wäre der l-Wert in ihnen definitiv unterschiedlich. Daher haben keine zwei Elektronen die gleiche Energie.
Elektronische Schalen
Wenn n = 1 eine Shell ist, dann ist l = 0 eine Sub-Shell.
Ebenso ist n = 2 eine Schale und l = 0, 1 ist eine Unterschale.
Elektronenschalen, die n = 1, 2, 3 ... entsprechen, werden jeweils durch K, L, M, N dargestellt. Die Unterschalen oder die Orbitale, die l = 0, 1, 2, 3 usw. entsprechen, werden jeweils mit s, p, d, f usw. bezeichnet.
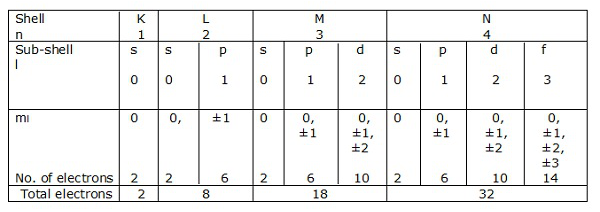
Betrachten wir die elektronischen Konfigurationen von Kohlenstoff, Silizium und Germanium (Gruppe IV - A).

Es wird beobachtet, dass die äußerste p-Unterschale jeweils nur zwei Elektronen enthält. Die mögliche Anzahl von Elektronen beträgt jedoch sechs. Daher gibt es viervalence electronsin jeder äußersten Schale. Jedes Elektron in einem Atom hat also eine spezifische Energie. Die atomare Anordnung innerhalb der Moleküle in jeder Art von Substanz ist fast so. Der Abstand zwischen den Atomen unterscheidet sich jedoch von Material zu Material.