Chimica Parte 1 - Guida rapida
introduzione
Tutto ciò che si trova in questo universo è costituito da alcuni materiali, gli scienziati li hanno chiamati come “matter.” Ad esempio, il cibo che mangiamo, l'aria che respiriamo, pietre, nuvole, stelle, piante, animali, acqua, polvere, tutto è classificato come materia.
Caratteristiche delle particelle di materia
Le particelle di materia sono molto piccole, normalmente, non visibili ad occhio nudo.

Le particelle di materia continuano a muoversi continuamente, che è noto come “kinetic energy.”
L'energia cinetica delle particelle dipende direttamente dalla temperatura, all'aumentare della temperatura, aumenta anche la velocità del movimento.
Le particelle di materia hanno una forza di attrazione; quindi, si attraggono.
La forza di attrazione delle particelle tiene insieme le particelle; tuttavia, la forza della forza di attrazione varia da un tipo di materia a un altro.
Stati della materia
La materia ha tre stati seguenti:
Solid State
Liquid State
Gaseous State

Discutiamoli in breve -
Stato solido
Tutti i materiali solidi hanno una forma definita, confini distinti e volumi fissi.
La maggior parte dei materiali solidi ha una comprimibilità trascurabile.
Tutti i materiali solidi hanno una naturale tendenza a mantenere la loro forma se sottoposti a forze esterne.
I materiali solidi possono rompersi sotto la forza applicata, ma è molto difficile cambiare la loro forma, poiché sono rigidi.
Stato liquido
A differenza dei solidi, i liquidi non hanno una forma fissa; tuttavia, hanno un volume fisso.
I liquidi assumono la forma del contenitore in cui vengono conservati.
I liquidi hanno la proprietà di fluire e cambiare forma.
Stato gassoso
La materia sotto forma di aria, che non è né solida né liquida, è nota come gas. Ad esempio, ossigeno, azoto, idrogeno, ecc.
A differenza del solido, il gas non ha dimensioni e forma definite.
I gas, come il gas di petrolio liquefatto (GPL - utilizzato in cucina); il gas naturale compresso (CNG - utilizzato come carburante nei veicoli), ecc. hanno un'elevata compressibilità; pertanto, un grande volume di gas può essere compresso in una piccola bombola e può essere trasportato facilmente.
I gas, normalmente, mostrano la proprietà di diffondersi molto velocemente in altri gas. Questo è il motivo per cui possiamo annusare (buono o cattivo) da lontano.
La materia può cambiare il suo stato
L'acqua può esistere in tutti e tre gli stati, ad esempio il ghiaccio come solido; acqua (H2O) come liquido; e vapore acqueo come gas. Il diagramma seguente illustra la trasformazione dell'acqua in diversi stati:

La temperatura, alla quale il solido si scioglie e si trasforma nel liquido (alla data pressione atmosferica), è nota come “melting point.”
Il punto di fusione di un solido è un'indicazione della forza della forza di attrazione tra le sue particelle.
Il punto di fusione del ghiaccio è 273,16 K, ovvero 0 0 C.
Il processo di fusione (cioè cambiamento dello stato solido in stato liquido) è noto come fusion.
La quantità di energia termica necessaria per trasformare 1 kg di un materiale solido in un materiale liquido a una data pressione atmosferica è nota come latent heat di fusione.
La temperatura alla quale un liquido inizia a bollire alla data pressione atmosferica è nota come “boiling point.”
Il punto di ebollizione dell'acqua è 373 K, ovvero 100 0 C.
Un cambiamento di stato di una materia direttamente da solido a gas senza passare allo stato liquido (o viceversa) è noto come “sublimation.”
Il fenomeno, ovvero la trasformazione di un liquido in vapori a qualsiasi temperatura inferiore al suo punto di ebollizione, è noto come “evaporation.”
L'anidride carbonica solida (CO 2 ) viene immagazzinata ad alta pressione.

La CO 2 solida viene convertita direttamente allo stato gassoso quando la pressione scende a 1 atmosfera.
Atmosphere(atm) è un'unità di misura della pressione esercitata dal gas e l'unità di pressione è Pascal (Pa); 1 atmosfera = 1,01 × 105 Pa.
Il quarto stato della materia
Plasma è lo stato che consiste di particelle super energetiche e super eccitate.

Le particelle super eccitate si trovano sotto forma di gas ionizzati. Ad esempio, il tubo fluorescente (che contiene gas elio) e le lampadine per insegne al neon (che contengono gas neon) sono costituiti da plasma.
introduzione
Una sostanza pura è quella costituita da un singolo tipo di particella o particelle.

Sono note miscele di due o più componenti puri senza alcuna sostanza indesiderabile Mixtures, ad esempio, acqua, minerali, suolo ecc.
Una miscela omogenea di due o più sostanze è nota come solution. Ad esempio, limonata, acqua gassata ecc.
La soluzione potrebbe essere in qualsiasi forma come: potrebbe essere liquida, solida o gassosa.
Alloyssono un altro esempio di miscela che contengono miscele omogenee di metalli; non possono essere separati nei loro componenti con metodi fisici. Ad esempio, l'ottone è una miscela di zinco (circa il 30%) e rame (circa il 70%).
Caratteristiche significative della soluzione
La soluzione è normalmente una miscela omogenea.
Le particelle di una soluzione sono anche più piccole di 1 nm (10-9 metri) di diametro e quindi non sono visibili ad occhio nudo.
Il percorso della luce non è visibile in una soluzione.
Le particelle disciolte non possono essere separate dalla miscela mediante il semplice processo di filtrazione.
Le particelle disciolte non si depositano quando vengono lasciate indisturbate.
A una data temperatura, quando non è più possibile dissolvere in una soluzione soluto, è noto come ‘saturated solution.’
Ad una data temperatura, la quantità delle particelle disciolte presenti nella soluzione satura è nota come solubility.’
Sospensione
Una sospensione è una miscela eterogenea in cui le particelle di soluto non si dissolvono, ma rimangono piuttosto sospese per tutta la maggior parte del mezzo, è nota come ‘suspension.’
Caratteristiche significative della sospensione
Le particelle di una sospensione sono chiaramente visibili ad occhio nudo.

Le particelle di una sospensione diffondono un raggio di luce che la attraversa e allo stesso modo è visibile il suo percorso.
Le particelle di saluto possono essere separate dalla miscela mediante il semplice processo di filtrazione.
Colloide
Una miscela eterogenea è nota come ‘colloid.’ Ad esempio nebbia, nebbia, fumo, crema per il viso, ecc.

La dimensione delle particelle colloidali è troppo piccola per essere vista ad occhio nudo.
Le particelle colloidali sono abbastanza grandi da disperdere un raggio di luce che le attraversa e rendere visibile il percorso.
Le particelle colloidali non possono essere separate dalla miscela mediante il semplice processo di filtrazione.
La speciale tecnica di filtrazione es centrifugation, può essere utilizzato per separare le particelle colloidali.
Cromatografia
Il processo di separazione dei componenti di una miscela è chiamato come chromatography; normalmente viene utilizzato per la separazione dei colori.
La tecnica cromatografica viene utilizzata per la separazione di quei soluti che si dissolvono nello stesso solvente.
Distillazione
Il processo di purificazione di un liquido mediante mezzi di riscaldamento e raffreddamento è noto come distillazione.
Cristallizzazione
Il processo che separa un solido puro sotto forma dei suoi cristalli da una soluzione è noto come ‘crystallization.’
Elementi
Nel 1661, Robert Boyle fu il primo scienziato che usò il termine element; Antoine Laurent Lavoisier, un chimico francese, è stato il primo a definire sperimentalmente il termine elemento.
L'elemento è una forma base di materia che non può essere scomposta in sostanze più semplici da una reazione chimica.
Gli elementi normalmente possono essere classificati come metals, non-metals, e metalloids.
Metallo
Un materiale solido, che in genere è duro, duttile, malleabile, lucido e fusibile con una buona conduttività elettrica e termica, è noto come metal. Ad esempio oro, argento, rame, alluminio, ecc.

Mercury è l'unico metallo che rimane liquido a temperatura ambiente.
Metalloide
Tutti gli elementi o le sostanze, che non sono metalli, sono noti come non metalli. Ad esempio idrogeno, ossigeno, iodio, carbonio, ecc.
I non metalli hanno una varietà di colori e sono cattivi conduttori di calore ed elettricità.
I non metalli non sono lucenti, sonori o malleabili.
Composto
Una sostanza, composta da due o più elementi, è nota come ‘compound.’
Il composto è il risultato della combinazione chimica di due o più elementi in una proporzione fissa.

Le proprietà di un composto sono in qualche modo diverse dai suoi elementi costitutivi, mentre le proprietà di una miscela sono le stesse dei suoi elementi o composti costituenti.
introduzione
Intorno al 500 a.C., un filosofo indiano Maharishi Kanad, postulò per la prima volta il concetto di parte indivisibile della materia e lo chiamò ‘pramanu.’
Nel 1808, John Dalton ha usato il termine ‘atom’ e postulato il atomic theory allo studio della materia.

Teoria atomica di Dalton
Secondo la teoria atomica di Dalton, tutta la materia, sia essa un elemento, un composto o una miscela, è composta da piccole particelle chiamate atomi.
Secondo la teoria atomica di Dalton, tutte le materie, siano esse elementi, composti o miscele, sono composte da piccole particelle note come atomi.
Caratteristiche salienti della teoria atomica di Dalton
Tutta la materia è composta da particelle molto minuscole note come atomi.
L'atomo è una particella indivisibile, che non può essere creata o distrutta attraverso la reazione chimica.
Tutti gli atomi di un elemento sono identici in massa e proprietà chimiche mentre gli atomi di elementi diversi hanno masse e proprietà chimiche diverse.
Per formare un composto, gli atomi vengono combinati nel rapporto di piccoli numeri interi.
In un dato composto, il numero relativo e il tipo di atomi sono costanti.
Massa atomica
La massa di un atomo di un elemento chimico; è espresso in unità di massa atomica (il simbolo è u ).
La massa atomica è più o meno equivalente al numero di protoni e neutroni presenti nell'atomo.
Un'unità di massa atomica è un'unità di massa uguale esattamente a un dodicesimo (1/12) della massa di un atomo di carbonio-12 e le masse atomiche relative di tutti gli elementi sono state calcolate rispetto a un atomo di carbonio-12.
Molecola
La particella più piccola di un elemento o di un composto, che è in grado di esistere indipendentemente e mostra tutte le proprietà della rispettiva sostanza.

Una molecola, normalmente, è un gruppo di due o più atomi che sono legati chimicamente insieme.
Atomi dello stesso elemento o di elementi diversi possono unirsi (con legame chimico) insieme per formare molecole.
Il numero di atomi che costituiscono una molecola è noto come suo atomicity.
Ion
Una particella carica è nota come ion; potrebbe essere l'uno o l'altronegative charge o positive charge.
Lo ione caricato positivamente è noto come a ‘cation’.
Lo ione caricato negativamente è noto come ‘anion.’
Formule chimiche
Una formula chimica di un composto dimostra i suoi elementi costitutivi e il numero di atomi di ciascun elemento che combina.

La formula chimica di un composto è la rappresentazione simbolica della sua Composizione.
La capacità di combinazione di un elemento è nota come sua ‘valency.’
Massa molecolare
La massa molecolare di una sostanza viene calcolata prendendo la somma delle masse atomiche di tutti gli atomi in una molecola della rispettiva sostanza. Ad esempio, la massa molecolare dell'acqua viene calcolata come:
Massa atomica dell'idrogeno = 1u
Massa atomica di ossigeno = 16 u
L'acqua contiene due atomi di idrogeno e un atomo di ossigeno.
La massa molecolare dell'acqua è = 2 × 1+ 1 × 16 = 18 u ( u è il simbolo della massa molecolare).
Formula Unit Mass
La formula unitaria di massa di una sostanza viene calcolata prendendo la somma delle masse atomiche di tutti gli atomi in una formula unit di un composto.
Costante Avogadro o Numero Avogadro
Avogadro era uno scienziato italiano che aveva dato il concetto di Numero di Avogadro (noto anche come Costante di Avogadro).
Il numero di particelle (atomi, molecole o ioni) presenti in 1 mole di qualsiasi sostanza è fisso e il suo valore viene sempre calcolato come 6.022 × 1023.
Nel 1896 Wilhelm Ostwald aveva introdotto il concetto di "talpa"; tuttavia, l'unità mole è stata accettata per fornire un modo semplice per segnalare un numero elevato nel 1967.
Legge di conservazione della massa
Durante una reazione chimica, la somma delle masse dei reagenti e dei prodotti rimane invariata, nota come ‘Law of Conservation of Mass.’
Legge delle proporzioni definite
In un composto chimico puro, i suoi elementi sono sempre presenti in una proporzione definita in massa, nota come ‘Law of Definite Proportions.’
introduzione
Nel 1900 si scoprì che l'atomo non era una particella semplice e indivisibile, ma piuttosto contiene particelle subatomiche.
J.J. Thomson ha scoperto la particella subatomica cioè ‘electron.’

JJ Thomson è stata la prima persona a proporre un file model per la struttura di un atomo.
Nel 1886, E. Goldstein scoprì la presenza di nuove radiazioni in una scarica di gas e le nominò canal rays.
Un'altra particella subatomica caricata positivamente è stata scoperta con esperimenti sui raggi del canale e l'ha chiamata proton.
Thomson's Model of Atom
Thomson ha proposto che un atomo sia costituito da una sfera caricata positivamente e gli elettroni (carica negativa) siano incorporati in essa (come mostrato nell'immagine sotto).

Inoltre, Thomson ha affermato che le cariche negative e positive sono uguali in grandezza. Pertanto, l'atomo nel suo insieme è elettricamente neutro.
Rutherford's Model of Atom
E. Rutherford è popolare come il "padre" della fisica nucleare.

Rutherford è ampiamente noto per il suo lavoro sulla radioattività e per la scoperta del nucleus di un atomo con l'esperimento della lamina d'oro (come mostrato nell'immagine sotto.

Rutherford ha detto che in un atomo c'è un centro caricato positivamente noto come nucleus.
Rutherford ha detto che quasi tutta la massa di un atomo esiste nel nucleo.
Secondo Rutherford, gli elettroni ruotano attorno al nucleo in orbite ben definite.
Modello di Atomo di Bohr
Neils Bohr ha ulteriormente ampliato il modello di Rutherford e migliorato i suoi svantaggi.

Secondo Bohr, solo alcune orbite speciali note come orbite discrete degli elettroni sono consentite all'interno dell'atomo.
Bohr ha detto che gli elettroni non irradiano energia mentre ruotano su orbite discrete.
Bohr ha chiamato orbite o conchiglie come livelli di energia (come mostrato nell'immagine sotto).

Bohr ha rappresentato queste orbite o conchiglie con le lettere K, L, M, N,… o con i numeri, n = 1,2,3,4,….
Neutron
Nel 1932 J. Chadwick scoprì una nuova particella subatomica, cioè il neutrone.
Il neutrone non ha carica e ha una massa quasi uguale a quella di un protone.
I neutroni sono presenti nel nucleo di tutti gli atomi, tranne l'idrogeno.
Elettroni distribuiti in diverse orbite (conchiglie)
Il numero massimo di elettroni che possono essere presenti in un guscio è dato dalla formula 2n2.
‘n’ è il numero dell'orbita o l'indice del livello di energia, cioè 1, 2, 3,….
Secondo la formula data -
Prima orbita cioè K-shellsarà = 2 × 1 2 = 2
Seconda orbita cioè L-shellsarà = 2 × 2 2 = 8
Terza orbita cioè M-shellsarà = 2 × 3 2 = 18
Quarta orbita cioè N-shellsarà = 2 × 4 2 = 32
Allo stesso modo, il numero massimo di elettroni che possono essere ospitati nell'orbita più esterna è 8.
Gli elettroni non sono riempiti in un dato guscio, a meno che i gusci interni non siano riempiti. Significa che i gusci vengono riempiti in modo graduale; partendo dalla calotta interna alla calotta esterna.
Valenza
Gli elettroni, quelli presenti nel guscio più esterno di un atomo, sono noti come valence elettroni.
Secondo il modello di Bohr-Bury, il guscio più esterno di un atomo può avere un massimo di 8 elettroni.
Numero atomico
Il numero totale di protoni, presenti nel nucleo di un atomo, è noto come atomic number.
Il numero di protoni di un atomo determina il numero atomico.
Il numero atomico è indicato da ‘Z’.
Protoni e neutroni sono noti collettivamente come nucleons.
Numero di Massa
La somma del numero totale di protoni e neutroni, presenti nel nucleo di un atomo, è nota come mass number.
Isotopi
Gli atomi dello stesso elemento, aventi lo stesso numero atomico ma diversi numeri di massa, sono noti come isotopi. Ad esempio, l'atomo di idrogeno ha tre isotopi: protio, deuterio e trizio.
Le proprietà chimiche degli isotopi di un atomo sono simili ma le loro proprietà fisiche sono diverse.
Isobar
Gli atomi di elementi diversi con numeri atomici diversi, che hanno lo stesso numero di massa, sono noti come isobari. Ad esempio, il numero atomico del calcio è 20 e il numero atomico dell'argon è 18; inoltre, il numero di elettroni in questi atomi è diverso, ma il numero di massa di entrambi questi elementi è 40.
introduzione
Un processo in cui una o più sostanze chimiche reagiscono con un'altra sostanza chimica e vengono convertite in una o più sostanze diverse è noto come reazione chimica.
Equazione chimica
Un'equazione chimica è la dimostrazione simbolica di una reazione chimica; è rappresentato attraverso simboli e formule. Per esempio
Magnesium + Oxygen = Magnesium Oxide
Mg + O2 = MgO
Le sostanze magnesio e ossigeno sono note come reagenti e il risultato della reazione, cioè l'ossido di magnesio è noto come prodotto.
Ricorda, la massa totale degli elementi presenti nei prodotti di una reazione chimica deve essere uguale alla massa totale degli elementi presenti nei reagenti.
Il numero di atomi di ogni elemento rimane sempre lo stesso, prima e dopo la reazione chimica.
Tipi di reazione chimica
Di seguito sono riportati i principali tipi di reazione chimica:
Combination Reaction
Decomposition Reaction
Displacement Reaction
Parliamo di ciascuno di loro in breve:
Reazione di combinazione
Quando due o più sostanze (cioè elementi o composti) reagiscono per formare un singolo prodotto, tale reazione è nota come combination reaction. Per esempio
CaO(s) +H2O(1)→Ca(OH)2(aq)
(Quick lime) (Slaked lime)
Come illustrato nella reazione di cui sopra, l'ossido di calcio e l'acqua hanno reagito (o combinati) per formare un singolo prodotto, noto come idrossido di calcio.
La reazione chimica in cui viene rilasciato anche calore insieme alla formazione del prodotto è nota come exothermic chemical reactions.
Reazione di decomposizione
La reazione, in cui un singolo reagente si scompone in prodotti più semplici, è nota come reazione di decomposizione. Per esempio

Nella reazione sopra data, i cristalli di solfato ferroso (cioè FeSO 4 , 7H 2 O), quando riscaldati, perdono acqua e il colore dei cristalli cambia. Infine, si decompone in ossido ferrico (Fe 2 O 3 ), anidride solforosa (SO 2 ) e anidride solforosa (SO 3 ).
Reazione di spostamento
La reazione, in cui un elemento sposta o rimuove un altro elemento, è nota come reazione di spostamento. Per esempio
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(Copper sulphate)(Iron sulphate)
Nella reazione sopra indicata, il ferro ha sostituito il rame dalla soluzione di solfato di rame e forma il solfato di ferro.
Ossidazione e riduzione
Se una sostanza guadagna ossigeno durante una reazione, è nota come oxidation. D'altra parte, in una reazione, se una sostanza perde ossigeno, è nota comereduction. Per esempio

Nella reazione sopra indicata, l'ossido di rame perde ossigeno e quindi si riduce (cioè riduzione); d'altra parte, l'idrogeno guadagna ossigeno e quindi si ossida (cioè ossidazione).
Corrosione
Quando un metallo viene attaccato da sostanze che si trovano nell'ambiente circostante, come umidità, acidi, ecc., È noto come corrosion. Ad esempio, il rivestimento nero su argento, il rivestimento verde su rame, ecc.,

Rancidità
Quando i grassi e gli oli si ossidano, il processo è noto come irrancidimento. Anche il loro odore, sapore, colore, ecc. Cambiano; allo stesso modo, rendeva il cibo insicuro per il consumo.
introduzione
Assaggiamo cibi aspri e amari, è solo per la presenza rispettivamente di acidi e basi.
Tornasole
Il tornasole, che viene estratto dal lichene, ha un colore viola (vedi l'immagine sotto riportata), ma la condizione è quando non è né acido né basico, cioè neutro.

Tornasole è fondamentalmente una pianta che appartiene a Thallophyta, e negli esperimenti chimici, è comunemente usata come indicatore.
Le sostanze, il cui odore cambia in mezzi acidi o basici, sono note come olfactory indicatori.
Acido o base in una soluzione acquosa
Gli ioni idrogeno in HCl vengono prodotti a causa della presenza di acqua. In secondo luogo, la separazione dello ione H + dalle molecole di HCl non può essere eseguita in assenza di acqua. La formula chimica è illustrata di seguito
HCl + H2O → H3O+ + Cl–
Inoltre, gli ioni idrogeno non possono esistere da soli, ma possono esistere in presenza di molecole d'acqua. Pertanto, gli ioni idrogeno sono indicati come H + (aq) o ione idronio (H 3 O + ). La formula chimica è -
H+ + H2O → H3O+
Le basi che sono solubili in acqua sono note come alkalis. Ma tutte le basi non sono solubili in acqua.
Se l'acqua viene aggiunta a un acido concentrato, viene generato il calore.
Mescolando un acido o una base con l'acqua si ottiene una diminuzione della concentrazione di ioni (cioè H 3 O + / OH–) per unità di volume e il processo è noto comedilution.
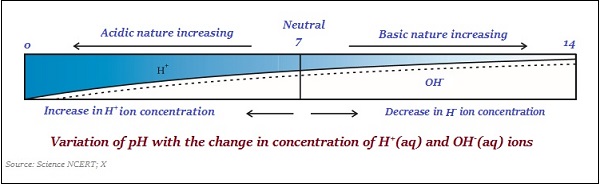
Scala del pH
Una scala, utilizzata per misurare la concentrazione di ioni idrogeno in una soluzione, è nota come pH scale.
Il ‘p’ in pH sta per ‘potenz’, è un termine tedesco, il che significa ‘power’.
Il valore del pH è preso semplicemente come un numero, che indica la natura acida o basica di una soluzione. Quindi, se la concentrazione di ione idronio è maggiore, il valore del pH sarebbe inferiore.
Il valore della scala del pH varia tra ‘0’ e ’14;’ quindi, se il valore del pH è misurato "0", significa che è molto acidic e se è 14, significa - molto alkaline.
Il valore neutro della scala del pH è ‘7’.
Su una scala di pH, valori inferiori a 7 rappresentano una soluzione acida e valori superiori a 7 rappresentano una soluzione basica.
Di solito, la carta impregnata con l'indicatore comune viene utilizzata per misurare il pH (vedere l'immagine sotto riportata) -
Allo stesso modo, la forza della sostanza di acidi e basi dipende principalmente dal numero di ioni H + e ioni OH - prodotti, rispettivamente.
L'immagine seguente illustra approssimativamente (variazioni di colore) il valore di pH di alcune delle sostanze comuni -

Importanza del pH nella vita quotidiana
Il valore del pH di un corpo umano varia tra 7,0 e 7,8.
Lo stomaco di un corpo umano produce acido cloridrico che aiuta nella digestione del cibo; sorprendentemente, comunque, non danneggia lo stomaco.
Tuttavia, quando lo stomaco produce troppo acido (noto come indigestione), provoca dolore e irritazione. Per ottenere sollievo da questo dolore, i medici suggeriscono l'uso di basi note come antiacidi.
Questi antiacidi neutralizzano e controllano la maggiore quantità di acido.
I denti, che sono costituiti da fosfato di calcio, è la sostanza più dura del corpo. Tuttavia, quando il pH nella bocca diminuisce (inferiore a 5,5), corrode i denti.
Il sale, normalmente, è formato dalla combinazione di acido cloridrico e soluzione di idrossido di sodio; e la combinazione è nota come cloruro di sodio.
Quando il valore del pH dell'acqua piovana viene misurato come inferiore a 5,6, è noto come acid rain.
Quando la pioggia acida scorre nei fiumi, abbassa anche il pH dell'acqua del fiume
L'acqua acida del fiume è una minaccia per la sopravvivenza della vita acquatica.
Polvere decolorante
La polvere decolorante è prodotta dall'azione del cloro sulla calce spenta secca [Ca (OH) 2 ] ed è rappresentata come CaOCl 2 .
La polvere sbiancante viene normalmente utilizzata nell'industria tessile, nella cartiera, nell'industria chimica e nella disinfezione dell'acqua potabile.
Bicarbonato di sodio
Il bicarbonato di sodio è comunemente usato in cucina per cucinare cibi gustosi e croccanti. Cuoce anche alcuni alimenti più velocemente.
Il nome chimico del bicarbonato di sodio è idrogenocarbonato di sodio e la formula è NaHCO 3 .
Soda di lavaggio
La ricristallizzazione del carbonato di sodio si traduce in soda di lavaggio.
La formula chimica del bicarbonato di sodio è Na 2 CO 3 .10H 2 O.
Il bicarbonato di sodio è comunemente usato nell'industria del vetro, del sapone e della carta.
Gesso
Plaster of Paris è una polvere bianca che i medici usano come cerotto per sostenere le ossa fratturate.
Il nome chimico dell'intonaco di Parigi è solfato di calcio emiidrato e la formula chimica è 2CaSO 4 .H 2 O.
introduzione
I metalli possono essere distinti dai non metalli in base alle loro proprietà chimiche e fisiche.
La proprietà dei metalli con cui possono essere battuti in fogli sottili è nota come malleability.
La proprietà del metallo con cui può essere attirato nei fili è nota come ductility.
I metalli sono normalmente duri, malleabili, lucenti, duttili, sonori e buoni conduttori di calore ed elettricità. Ad esempio ferro, rame, calcio, alluminio, magnesio, ecc.

I materiali, che non sono sonori e sono cattivi conduttori di calore ed elettricità, sono noti come non-metals. Ad esempio zolfo, carbonio, ossigeno, fosforo, ecc.
Alcuni metalli, come sodium e potassium sono morbidi e si possono tagliare con un coltello.
Mercury è l'unico metallo che rimane allo stato liquido a temperatura ambiente.
Quando l'anidride solforosa viene sciolta in acqua, si forma acido solforoso. Illustrazione - Anidride solforosa (SO 2 ) + Acqua (H 2 O) → Acido solforoso (H 2 SO 3 ).
Gli ossidi di non metalli sono di natura acida.
L'acido solforoso cambia rosso blu cartina tornasole.
Il fosforo è un non metallo molto reattivo e prende fuoco quando esposto all'aria.
Per prevenire il contatto del fosforo con l'ossigeno atmosferico, il fosforo viene immagazzinato nell'acqua.
Quando bruciano, i metalli reagiscono facilmente con l'ossigeno e producono ossidi metallici, questi sono di base in natura.
I non metalli reagiscono con l'ossigeno e producono ossidi non metallici; questi sono di natura acida.
Alcuni metalli reagiscono con l'acqua e producono idrossidi metallici e idrogeno gassoso.
I materiali non metallici normalmente non reagiscono con l'acqua.
I metalli reagiscono anche con gli acidi e producono gas idrogeno e sali metallici.
I non metalli normalmente non reagiscono con gli acidi.
Usi di metalli e non metalli
I metalli sono utilizzati nella fabbricazione di macchinari, aeroplani, automobili, treni, satelliti, gadget industriali, utensili da cucina, caldaie per l'acqua, ecc.
I non metalli sono usati nei fertilizzanti per migliorare la crescita delle piante.
Non metalli vengono utilizzati nella purificazione dell'acqua.
I non metalli sono usati nei cracker.
introduzione
Un materiale solido, che è tipicamente duro, malleabile, lucido, fusibile e duttile, è noto come metalli. Ad esempio ferro, rame, alluminio, magnesio, sodio, piombo, zinco, ecc.
Normalmente, i metalli hanno una buona conduttività elettrica e termica.

I metalli, allo stato puro, hanno una superficie brillante, nota come metallic luster.
I metalli possono essere battuti in fogli sottili; questa proprietà è nota comemalleability.
La proprietà dei metalli da trascinare nei fili sottili è nota come ductility. Ad esempio, l'oro è il metallo più duttile.
L'argento e il rame sono il miglior conduttore di calore.
Non metalli
I non metalli si trovano normalmente negli stati solidi o gassosi. Tuttavia, il bromo è un'eccezione che si trova allo stato liquido.
Alcuni dei principali esempi di non metalli sono carbonio, zolfo, iodio, ossigeno, idrogeno, ecc.

Fatti di metalli e non metalli
Tutti i metalli esistono in forma solida a temperatura ambiente, tranne il mercurio.
Il gallio e il cesio hanno punti di fusione molto bassi; questi due metalli si sciolgono anche sul palmo.
Lo iodio non è un metallo, ma è brillante (la brillantezza è la proprietà del metallo).
Il carbonio è un non metallo che può esistere in diverse forme. Ogni forma è chiamata allotropo.
Il diamante è un allotropo del carbonio ed è la sostanza naturale più dura conosciuta.
Il punto di fusione e di ebollizione del diamante è molto alto.
La grafite è anche allotropo del carbonio; è un conduttore di elettricità.
I metalli alcalini, come litio, potassio, sodio, sono gli esempi di metalli teneri, poiché possono essere tagliati con un coltello.
Quasi tutti i metalli quando combinato con l'ossigeno, forma ossidi metallici.
Metalli diversi hanno diverse frequenze di reazione; alcuni reagiscono lentamente, ma alcuni reagiscono molto velocemente. Ad esempio il potassio e il sodio sono molto reattivi e prendono fuoco solo se tenuti all'aperto.
Pertanto, il potassio e il sodio vengono tenuti immersi nell'olio di cherosene in modo che non possano prendere fuoco.
Tuttavia, tra tutti i metalli, il sodio (molto probabilmente), è il metallo più reattivo.
L'anodizzazione è un processo di formazione di uno spesso strato protettivo di ossido di alluminio e protegge dalla corrosione.
Gli elementi o composti che si trovano naturalmente nella crosta (strato superiore) della terra, sono noti come minerali.
I minerali in forma grezza sono noti come ores. Ad esempio oro, argento, ferro ecc. (Minerale di ferro mostrato nell'immagine sotto) -

I minerali, che vengono estratti dalla terra, sono solitamente contaminati da grandi quantità di impurità come miscele con alcuni elementi, terra, sabbia, ecc., Note come ‘gangue’.
In base alla natura reattiva e all'estrazione dai minerali, i metalli possono essere classificati come:

introduzione
Il carbonio gioca un ruolo molto importante per tutti gli esseri viventi.
La quantità di carbonio nella crosta terrestre è solo dello 0,02%, disponibile sotto forma di minerali come carbonati, carbonati di idrogeno, carbone e petrolio.
La presenza di carbonio nell'atmosfera terrestre è dello 0,03%, sotto forma di anidride carbonica.
Composti di carbonio
Quasi tutti i composti di carbonio (tranne alcuni) sono cattivi conduttori dell'elettricità.
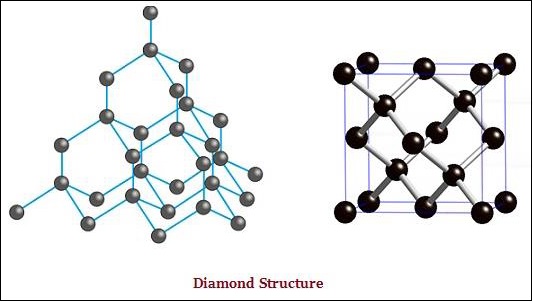
Il diamante e la grafite sono entrambi formati da atomi di carbonio; tuttavia, la differenza sta tra loro nel modo in cui gli atomi di carbonio sono legati l'uno all'altro.
Nel diamante, ogni atomo di carbonio, è legato ad altri quattro atomi di carbonio e forma una rigida struttura tridimensionale (vedi l'immagine sotto riportata).
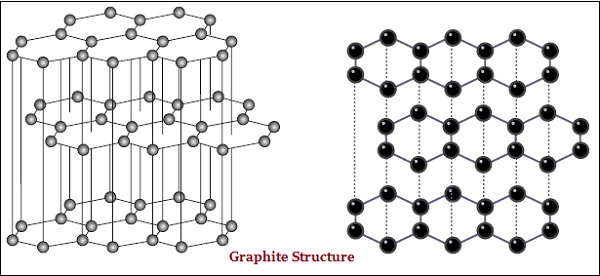
Nella grafite, ogni atomo di carbonio è legato ad altri tre atomi di carbonio sullo stesso piano, il che dà una matrice esagonale (vedi l'immagine sotto) -
C'è anche una differenza in alcune strutture fisiche del diamante e della grafite.
Il diamante è la sostanza più dura conosciuta mentre la grafite è una sostanza liscia e scivolosa.
La grafite è un buon conduttore di elettricità mentre il diamante non lo è.
La tabella seguente illustra le strutture dei composti di carbonio e idrogeno -
| Nome | Formula | Struttura |
|---|---|---|
| Metano | CH 4 |

|
| Etano | C 2 H 6 |

|
| Propano | C 3 H 8 |

|
| Butano | C 4 H 10 |

|
| Pentano | C 5 H 12 |

|
| Esano | C 6 H 14 |

|
I composti, che hanno una formula molecolare identica, ma strutture differenti, sono noti come structural isomers (vedere la struttura Butano riportata di seguito).

Gli idrocarburi saturi sono noti come alkanes.
Gli idrocarburi insaturi, che comprendono uno o più doppi legami, sono noti come alkenes.
Gli idrocarburi insaturi, che comprendono uno o più tripli legami, sono noti come alkynes.
Uso di alcol come carburante
Le piante di canna da zucchero convertono molto efficientemente la luce solare in energia chimica e il suo succo può essere utilizzato per preparare la melassa.
Quando la melassa viene fermentata, produce alcol (etanolo).
Alcuni paesi ora usano l'alcol come additivo nella benzina, poiché è un carburante più pulito.
Questi alcol, bruciando in aria sufficiente (ossigeno), danno origine solo a anidride carbonica e acqua.
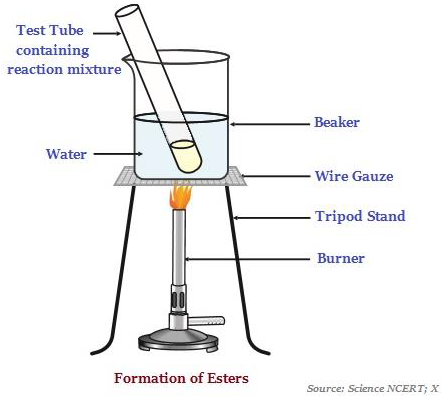
Esteri
Gli esteri sono sostanze dall'odore dolce, che più comunemente si formano per reazione di un acido e un alcol (vedere l'immagine sotto - che illustra la formazione di esteri).
Quando gli esteri reagiscono in presenza di un acido o di una base, restituiscono l'alcol e l'acido carbossilico.
La reazione degli esteri con un acido o una base è nota come saponification perché viene utilizzato nella preparazione del sapone.
Le molecole di sapone normalmente sono sali di sodio o di potassio di acidi carbossilici a catena lunga.
È interessante notare che l'estremità ionica del sapone si dissolve in acqua mentre la catena di carbonio si dissolve nell'olio. Questa caratteristica tipica delle molecole di sapone forma strutture note comemicelles (vedi l'immagine sotto riportata)

Nelle micelle, un'estremità delle molecole è verso la goccia d'olio mentre l'estremità ionica rimane all'esterno.
La micella di sapone aiuta a sciogliere lo sporco nell'acqua; allo stesso modo, i vestiti vengono puliti.
D'altra parte, i detergenti sono solitamente sali di ammonio o solfonato di acidi carbossilici a catena lunga, che rimangono efficaci anche in acque dure.
I detersivi sono abitualmente usati per fare shampoo e alcuni altri prodotti per la pulizia dei vestiti.
introduzione
Ci sono circa 115 elementi a noi noti fino ad oggi.
In base alle loro proprietà, tutti gli elementi sono disposti in ordine, noto come tavola periodica.
Johann Wolfgang Döbereiner, uno scienziato tedesco, tentò per la prima volta di disporre gli elementi nel 1817.
John Newlands, uno scienziato inglese, tentò anche di organizzare gli elementi allora noti (nel 1866).
John Newlands aveva seguito l'ordine di aumentare le masse atomiche per disporre gli elementi.
Newlands iniziò con l'elemento con la massa atomica più bassa (come l'idrogeno) e terminò con il torio, che era il 56 ° elemento (ai suoi tempi).

La disposizione degli elementi di Newlands è nota come "Legge delle Ottave", poiché nella sua disposizione ogni otto elementi aveva proprietà simili a quella del primo. Ad esempio, le proprietà del litio e del sodio sono risultate le stesse.
| Sa (fare) | re (ri) | Ga (mi) | Ma (fa) | Pa (così) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H | Li | Essere | B | C | N | O |
| F | N / A | Mg | Al | Si | P | S |
| Cl | K | Circa | Cr | Ti | Mn | Fe |
| Co & Ni | Cu | Zn | Y | In | Come | Se |
| Br | Rb | Sr | Ce & La | Zr |
Newlands lo ha anche confrontato con le ottave che si trovano nella musica (vedi la tabella sopra).
Nella musica indiana, le sette note musicali sono: sa, re, ga, ma, pa, da, ni; tuttavia, in occidente, le note musicali sono: do, re, mi, fa, so, la, ti.
Inoltre, per inserire alcuni elementi nella sua tabella, Newlands mise due elementi nella stessa cella (vedi la tabella sopra - cobalto e nichel tenuti nella stessa cella), ma questa tecnica non ha funzionato, poiché hanno proprietà diverse.
Tuttavia, la legge dell'ottava aveva delle limitazioni, poiché era applicabile solo al calcio; e, dopo il calcio, ogni otto elementi non avevano proprietà simili a quelle del primo.
Tavola periodica di Mendeléev
Dmitri Ivanovich Mendeléev, un chimico russo, che ha tentato con successo di organizzare gli elementi.
Mendeléev ha organizzato gli elementi in base alla loro proprietà fondamentale (elementi), la massa atomica, nonché alla somiglianza delle proprietà chimiche.
All'epoca di Mendeleev si conoscevano solo 63 elementi.
La tavola periodica di Mendeléev è composta da colonne verticali note come ‘groups’ e righe orizzontali note come ‘periods.’

La legge periodica di Mendeléev lo afferma
"Le proprietà degli elementi sono la funzione periodica delle loro masse atomiche".
Mendeléev ha organizzato la sequenza in modo invertito in modo che gli elementi con proprietà simili potessero essere raggruppati insieme.
Mendeléev lasciò spazio ad alcuni elementi, che allora non furono scoperti; predisse coraggiosamente l'esistenza di elementi futuri.
Uno dei maggiori limiti della formula periodica di Mendeléev è: nessuna posizione fissa è stata assegnata all'idrogeno nella tavola periodica.
Tavola periodica moderna
Nel 1913, Henry Moseley, un fisico inglese scoprì che il numero atomico di un elemento è una proprietà più fondamentale rispetto alla sua massa atomica.
Sulla base della scoperta di Moseley, la legge periodica di Mendeléev fu modificata e il numero atomico fu adottato come base della tavola periodica moderna.
La legge periodica moderna afferma:
"Le proprietà degli elementi sono una funzione periodica del loro numero atomico."
18 colonne verticali note come "groups' e 7 le righe orizzontali note come "periodi" sono definite nella tavola periodica moderna.
Nella tavola periodica moderna, gli elementi sono disposti in modo tale da mostrare la periodicità di proprietà come la dimensione atomica, la valenza o la capacità di combinazione e le caratteristiche metalliche e non metalliche (degli elementi).
Nella tavola periodica moderna, il carattere metallico diminuisce in un periodo e aumenta nel gruppo.
D'altra parte, i non metalli sono elettronegativi, poiché tendono a formare legami guadagnando elettroni.
Nella tavola periodica moderna, i non metalli sono posizionati sul lato destro (dall'alto).
introduzione
Gli abiti che indossiamo sono costituiti da tessuti e i tessuti sono realizzati con fibre, ottenute da fonti naturali o artificiali.
La fonte naturale di fibre è cotone, lana, seta, ecc., Che si ottengono da piante o animali.
Le fibre sintetiche sono prodotte da esseri umani; pertanto, queste sono chiamate fibre sintetiche o artificiali.
Una fibra sintetica è solitamente una catena di piccole unità quelle unite insieme; ogni piccola unità è una sostanza chimica.
Tipi di fibre sintetiche
La seta artificiale è solitamente conosciuta come Rayon.
Il rayon (fibra) è stato ottenuto mediante trattamento chimico della pasta di legno.
La fibra, preparata da carbone, acqua e aria, è nota come Nylon.

Il nylon è stata la prima fibra completamente sintetica.
Polyesterè anche una fibra sintetica; è fibra senza rughe. Ad esempio, Terylene.
Il PET è una delle forme familiari di poliesteri ed è utilizzato per realizzare utensili, bottiglie, pellicole, fili e molti altri prodotti utili.
Il poliestere (poli + estere) è costituito dalle unità ripetitive di una sostanza chimica nota come estere.
La plastica è anche una sorta di polimero come la fibra sintetica.
Il politene (Poly + ethene) è un esempio comune di plastica.
Ci sono alcune materie plastiche che, una volta stampate una volta, non possono essere ammorbidite dal riscaldamento; pertanto, questi sono noti come plastiche termoindurenti. Ad esempio bachelite e melammina.
La bachelite è un cattivo conduttore di calore ed elettricità; pertanto, viene utilizzato nella realizzazione di interruttori elettrici, maniglie di vari utensili, ecc.
La melammina resiste al fuoco e può tollerare il calore meglio di altre plastiche; pertanto, viene utilizzato per la produzione di piastrelle per pavimenti, stoviglie e tessuti.
Un materiale che si decompone attraverso i processi naturali, ad esempio l'azione dei batteri, è noto come biodegradabile.
Un materiale, che non può essere facilmente decomposto da processi naturali, è noto come non biodegradabile.
La plastica non è rispettosa dell'ambiente.
introduzione
Le risorse, che sono presenti in natura in quantità illimitata e non rischiano di essere esaurite dalle attività umane, sono denominate Inexhaustible Natural Resources. Ad esempio, luce solare, aria.
Le risorse, che sono presenti in quantità limitata in natura e rischiano di essere esaurite dalle attività umane, sono note come Exhaustible Natural Resources. Ad esempio foreste, fauna selvatica, minerali, carbone, petrolio, gas naturale ecc.
Risorse naturali esauribili si sono formate dai resti morti di organismi viventi (fossili); pertanto, queste risorse naturali sono anche conosciute comefossil fuels. Ad esempio carbone, petrolio e gas naturale.
Carbone
Il carbone è duro come la pietra e di colore nero.
Il carbone è uno dei combustibili usati per cucinare il cibo.

Il carbone viene utilizzato nelle centrali termiche per produrre elettricità.
Sotto l'alta pressione e l'alta temperatura, le piante morte che sono state sepolte all'interno della Terra, si sono lentamente convertite in carbone.
Il carbone contiene principalmente carbonio.
Il lento processo di conversione della vegetazione morta in carbone è noto come carbonizzazione.
Il carbone è formato dai resti della vegetazione; pertanto, è anche noto come combustibile fossile.
Quando il carbone brucia, produce principalmente anidride carbonica.
Quando il carbone viene lavorato nell'industria, produce alcuni prodotti utili come coke, catrame di carbone e gas di carbone.
Coke è una sostanza dura, porosa e nera.
La coca cola è una forma pura di carbonio.
Il coke è ampiamente utilizzato nella produzione di acciaio e nell'estrazione di molti metalli.
Il catrame di carbone è un liquido nero e denso con un odore sgradevole.
Il catrame di carbone è una miscela di circa 200 sostanze.
I prodotti, quelli ottenuti dal catrame di carbone, sono utilizzati come materie prime per la fabbricazione di varie sostanze utilizzate nella vita quotidiana e nell'industria. Ad esempio esplosivi, vernici, materiali per tetti, coloranti sintetici, droghe, profumi, plastica, materiali fotografici, ecc.
Naphthalene balls, ottenuti dal catrame di carbone, sono usati per respingere le tarme e altri insetti.
Bitumen, ottenuto da prodotti petroliferi, viene utilizzato al posto del catrame di carbone per la metallizzazione delle strade.
Durante la lavorazione del carbone per ottenere il coke, coal gas è ottenuto.
Nel 1810, per la prima volta a Londra, nel Regno Unito, il gas di carbone fu utilizzato per l'illuminazione stradale e nel 1820 a New York, negli Stati Uniti.
Attualmente, il gas di carbone viene utilizzato come fonte di calore.
Petrolio
La benzina e il diesel sono ottenuti da una risorsa naturale nota come petrolio.
Il petrolio si è formato dagli organismi che vivono nel mare.
Nel corso di milioni di anni (gli organismi morti seppelliti nella terra), in presenza di alte temperature, alta pressione e in assenza di aria, gli organismi morti si sono trasformati in petrolio e gas naturale.
Nel 1859, il primo pozzo petrolifero del mondo fu perforato in Pennsylvania, USA.
Nel 1867, il petrolio fu bloccato a Makum nell'Assam, in India.
In India, il petrolio si trova in gran parte ad Assam, Gujarat, Mumbai High, Maharashtra e nei bacini fluviali di Godavari e Krishna.
L'immagine seguente mostra lo strato di gas e petrolio:

Il petrolio è una miscela di vari componenti come benzina, gas di petrolio, gasolio, olio lubrificante, cera di paraffina, ecc.
Il processo di separazione dei vari componenti del petrolio è noto come refining.
Le diverse sostanze utili, ottenute dal petrolio e dal gas naturale, sono note come "prodotti petrolchimici".
I prodotti petrolchimici sono utilizzati nella produzione di detergenti, fibre (poliestere, nylon, acrilico, ecc.), Politene e altre plastiche artificiali.
L'idrogeno gassoso, che si ottiene dal gas naturale, viene utilizzato nella produzione di fertilizzanti (urea).
A causa della grande importanza commerciale, il petrolio è anche conosciuto come ‘black gold.’
Il gas naturale è normalmente immagazzinato ad alta pressione e quindi noto come Compressed Natural Gas (CNG).
Il metano viene utilizzato per la generazione di energia e il carburante per i veicoli.
The following table illustrates various constituents of petroleum and their uses −
| Costituenti del petrolio | Utilizza |
|---|---|
| Gas di petrolio in forma liquida (GPL) | Carburante per la casa e l'industria |
| Benzina | Carburante per motori, carburante per aviazione, solvente per lavaggio a secco |
| diesel | Carburante per autoveicoli pesanti, gruppi elettrogeni |
| Cherosene | Carburante per stufe, lampade e per aerei a reazione |
| Olio lubrificante | Lubrificazione |
| Paraffina | Unguenti, candele, vaselina, ecc. |
| Bitume | Vernici, pavimentazioni stradali |
introduzione
Un processo chimico in cui una sostanza reagisce con l'ossigeno ed emette calore è noto come combustion.
La sostanza che subisce la combustione è chiamata come combustible o fuel.
Il carburante può essere sotto forma di solido, liquido o gas.
Durante la combustione, la luce viene anche emessa sotto forma di a flame o come file glow.

Le sostanze che vaporizzano durante il tempo di combustione, danno fiamme.
Ci sono tre diverse zone di una zona scura fiamma, zona luminosa e zona non luminosa.

Diverse sostanze prendono fuoco a diverse temperature.
La temperatura più bassa alla quale una sostanza prende fuoco è nota come sua ignition temperature.
Un fiammifero contiene trisolfuro di antimonio e clorato di potassio.
La superficie di sfregamento del fiammifero contiene polvere di vetro e un po 'di fosforo rosso.
Il fosforo rosso è molto meno pericoloso.
Quando il bastoncino di fiammifero viene urtato contro la superficie di sfregamento, un po 'di fosforo rosso viene convertito in fosforo bianco; il processo reagisce immediatamente con il clorato di potassio presente nella testa del fiammifero e produce abbastanza calore per accendere il trisolfuro di antimonio; allo stesso modo inizia la combustione.
Le sostanze, che hanno una temperatura di accensione molto bassa e possono facilmente prendere fuoco con una fiamma, sono note come inflammable substances. Per esempio. benzina, alcool, gas di petrolio liquefatto (GPL), ecc.
Estintore
Water è l'estintore più comune.
L'acqua, come estintore, funziona solo quando cose come legno e carta sono in fiamme.

Se le apparecchiature elettriche sono in fiamme, l'acqua può condurre elettricità e danneggiare coloro che cercano di spegnere il fuoco.
Anche l'acqua non è un buon estintore per gli incendi che coinvolgono petrolio e benzina.
Per gli incendi che coinvolgono apparecchiature elettriche e materiali infiammabili come la benzina, l'anidride carbonica (CO2) è il miglior estintore.

Uno dei modi per ottenere CO2 è rilasciare molta polvere secca di sostanze chimiche come il bicarbonato di sodio (bicarbonato di sodio) o il bicarbonato di potassio.
Il fosforo brucia nell'aria a temperatura ambiente.
La quantità di energia termica prodotta con la combustione completa di 1 kg di un combustibile è nota come sua calorific value.
Il potere calorifico di un carburante è misurato in un'unità chiamata kilojoule per kg (kJ / kg).
The following table illustrates the Calorific Values of Different Fuels −
| Carburante | Potere calorifico (kJ / kg) |
|---|---|
| Torta di sterco di vacca | 6000-8000 |
| Legna | 17000-22000 |
| Carbone | 25000-33000 |
| Benzina | 45000 |
| Cherosene | 45000 |
| diesel | 45000 |
| Metano | 50000 |
| CNG | 50000 |
| GPL | 55000 |
| Biogas | 35000-40000 |
| Idrogeno | 150000 |
Combustione della maggior parte delle emissioni di combustibili carbon dioxide nell'ambiente.
La causa più probabile è l'aumento della concentrazione di anidride carbonica nell'aria global warming.
L'aumento della temperatura dell'atmosfera terrestre è noto come Global Warming.
Il riscaldamento globale provoca lo scioglimento dei ghiacciai polari, che porta a un innalzamento del livello del mare che alla fine causa inondazioni nelle regioni costiere.
Gli ossidi di zolfo e azoto si dissolvono nell'acqua piovana e formano acidi; questo tipo di pioggia è noto comeacid rain.