화학-칼슘
소개
칼슘은 지각에서 주로 발견되는 부드러운 회 황색 알칼리 원소입니다.
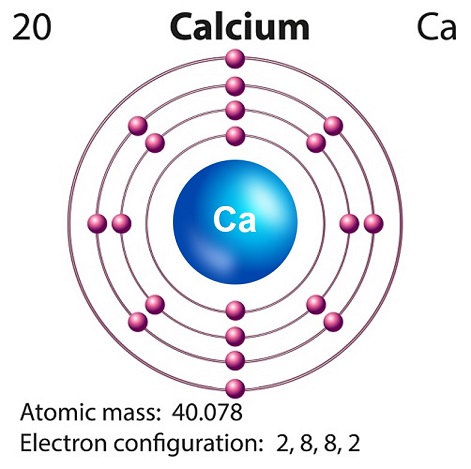
칼슘의 상징은 “Ca” 원자 번호는 “20.”
유리 칼슘은 반응성이 높기 때문에 자연에는 거의 존재하지 않습니다.
칼슘은 일반적으로 초신성 핵 합성에서 생성됩니다.
칼슘의 두드러진 특징
칼슘은 많은 동물에서 발견되는 질량 기준으로 가장 풍부한 금속 중 하나입니다.
칼슘은 치아, 뼈 및 껍질의 매우 중요한 구성 요소입니다.
탄산 칼슘과 구연산 칼슘은 건강에 필요한 주요식이 보충제입니다.
세계 보건기구 (WHO)는 칼슘을 필수 의약품으로 지정했습니다.
다른 금속에 비해 칼슘 이온 및 대부분의 다른 칼슘 화합물은 독성이 낮습니다.
칼슘이 물이나 산과 접촉하면 칼슘과 반응하여 위험 해집니다.
칼슘이 공기와 접촉하면 빠르게 반응하여 질화 칼슘과 산화 칼슘의 회백색 코팅을 형성합니다.
대부분의 칼슘 염은 일반적으로 무색입니다.
칼슘이 타면 화염의 색이 벽돌색으로 나타납니다 (아래 이미지 참조).

칼슘 금속은 알루미늄이나 구리보다 전기 저항이 비교적 높습니다.
발생
칼슘은 일반적으로 퇴적암에서 발생합니다.
칼슘이 발견되는 미네랄 (퇴적물)은 방해석, 백운석 및 석고입니다.
칼슘은 또한 각섬석, 사장석, 피 록센 및 석류석과 같은 규산염 광물에서 주로 화성암 및 변성암에서 발견됩니다.
칼슘은 유제품, 아몬드, 헤이즐넛, 콩, 브로콜리, 민들레 잎, 무화과 등 많은 식품에서 발견됩니다.
칼슘 화합물
산화 칼슘 - 의 CaO
수산화칼슘 - 캐나다 (OH) 2
염화칼슘 - 염화칼슘 2
차아 염소산 칼슘 (표백제) - 캐나다 (C10의) 2
인산 칼슘 - 칼슘 3 (PO 4 ) 2
칼슘의 용도
칼슘은 다양한 용도로 사용되며 그 중 중요한 것은-
탄산 칼슘 (CaCO 3 )은 시멘트 제조에 사용됩니다.
탄산 칼슘 (CaCO 3 )은 치약 제조에도 사용됩니다.
살충제에는 비산 칼슘 (Ca 3 (AsO 4 ) 2 )이 사용됩니다.
염화칼슘 (CaCl 2 )은 제빙 및 먼지 제어에 사용됩니다.
구연산 칼슘 (Ca 3 (C 6 H 5 O 7 ) 2 )은 일반적으로 식품 방부제로 사용됩니다.
칼슘 글루코 네이트 (Ca (C 6 H 11 O 7 ) 2 )는 비타민 알약뿐만 아니라 식품 첨가물로 자주 사용됩니다.
차아 염소산 칼슘 (Ca (OCl) 2 )은 일반적으로 표백제로 수영장 소독제로 사용됩니다.