화학 파트 2-퀵 가이드
소개
화학은 물질의 구조, 구성 및 변화하는 특성에 대해 연구하는 자연 과학의 한 분야입니다.
화학은 물질의 가장 작은 부분, 즉 원자 (모든 속성과 함께)에서 큰 물질 (예 : 금,은, 철 등)과 그 속성을 연구합니다.
화학은 또한 분자간 힘 (일반적인 특성을 제공하는 물질)과 화학 반응을 통한 물질 간의 상호 작용을 연구합니다.

1998 년에 Raymond Chang 교수는 화학을 다음과 같이 정의했습니다.
"화학"은 물질에 대한 연구와 물질이 겪는 변화를 의미합니다.
화학 연구는 아리스토텔레스가 주장한 네 가지 요소 이론에서 시작되었다고 믿어집니다.
네 가지 원소 이론은 “불, 공기, 흙, 물은 모든 것이 결합되어 형성되는 기본 요소”라고 말합니다.
그의 고전적인 작업 즉 “The Sceptical Chymist,” Robert Boyle은 화학의 창시자로 알려져 있습니다.
보일은 법을 제정하고 '보일의 법칙'으로 유명해졌습니다.
보일의 법칙은 가스의 압력과 각 용기의 부피 사이의 관계를 분석하는 실험적인 가스 법칙입니다.
그의 법칙을 옹호함으로써 보일은 고전적인 '4 가지 요소'이론을 거부했다.
미국 과학자 인 Linus Pauling과 Gilbert N. Lewis는 화학 결합과 분자 궤도에 대한 전자 이론을 총체적으로 제안했습니다.
유엔은 2011 년을 '국제 화학의 해'로 선언했습니다.
물질은 화학에서 나머지 질량과 부피가 있고 공간을 차지하는 모든 것으로 정의됩니다.
그만큼 matter 입자로 구성되어 있습니다.
그만큼 atom 화학의 기본 단위입니다.
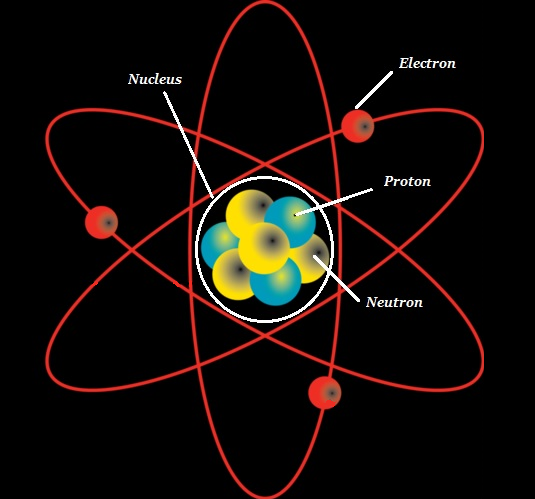
원자는 atomic nucleus 그리고 그것은 알려진 공간으로 둘러싸여 있습니다. electron cloud.
(원자의) 핵은 다음과 같이 구성됩니다. protons (+ve charged particles) 및 neutrons (neutral or uncharged particles); 총체적으로이 두 가지는nucleons (아래 이미지 참조).
화학 원소는 순수한 형태의 물질입니다. 단일 유형의 원자로 구성됩니다.
주기율표는 사용 가능한 모든 화학 원소의 표준화 된 표현입니다.
화합물은 순수한 형태의 물질입니다. 하나 이상의 요소로 구성됩니다.
분자는 순수한 화학 물질에서 분할 할 수없는 가장 작은 부분입니다. 분자는 독특한 화학적 특성을 가지고 있습니다 (아래 이미지 참조).
다음 표는 화학의 가지를 보여줍니다-
| 분기 | 하위 지점 | 정의 |
|---|---|---|
| Physical Chemistry | 물리 화학 | 분자의 물리적 특성 연구 |
| 화학 역학 | 화학 반응 속도 연구 | |
| 전기 화학 | 원자, 분자, 이온 및 전류의 상호 작용 연구 (즉, 전극과 전해질 또는 종 사이의 전자 이동) | |
| 표면 화학 | 표면 (물질)에서의 화학 반응 연구 | |
| 열화학 | 화학적 작용과 흡수 된 열량과의 관계 연구 | |
| 양자 화학 | 물리 모델에서의 양자 역학 적용 연구 | |
| 분광학 | 빛 또는 방사선의 스펙트럼 연구 | |
| 광화학 | 빛에 의한 화학적 영향 연구 | |
| Organic Chemistry | 유기 화학 | 화학 (탄소) 화합물 (예 : 연료, 플라스틱, 식품 첨가물 및 약물)의 구조, 특성 및 제조에 대한 연구 |
| 입체 화학 | 원자의 상대적 공간 배열 연구 (분자) | |
| 물리적 유기 화학 | 유기 분자의 구조 및 반응성 (상호 관계) 연구 | |
| 고분자 화학 | 고분자 분자 연구 (구성 및 생성) | |
| 유기 금속 화학 | 결합을 포함하는 화학 물질 연구 (특히 탄소와 금속 사이) | |
| 약용 화학 | 약품 및 의약품의 설계, 개발 및 합성 연구 | |
| Inorganic chemistry | 무기 화학 | 유기가 아닌 모든 재료 (예 : 광물, 금속, 촉매, 결정 구조 등) 연구 |
| 유기 금속 화학 | 결합을 포함하는 화합물 연구 (특히 탄소와 금속 사이) | |
| 고체 화학 | 탄소와 금속의 결합을 포함하는 화합물 연구 | |
| 핵 화학 | 방사성 물질 연구 | |
| 지구 화학 | 지구 (예 : 암석, 광물 및 대기)의 화학 성분 연구 | |
| 생물 무기 화학 | 금속 이온과 생체 조직의 상호 작용 연구 | |
| 배위 화학 | ||
| Biochemistry | 생화학 | 생명체의 화학 반응 (및 변화) 연구 |
| 분자 생화학 | 기능과 함께 생체 분자의 연구 | |
| 임상 생화학 | 다양한 질병으로 인한 생명체의 화학적 변화 연구 | |
| 분자 생물학 | 다양한 유형의 DNA, RNA 및 단백질 생합성 (및 그 관계)에 대한 연구 | |
| 농업 생화학 | 동물 군 (예 : 식물)의 화학 연구 | |
| Analytical Chemistry | 화학에서 표준화 된 실험 방법 연구 (즉, 물질의 화학적 특성의 정량적 결정) | |
| Astrochemistry | 우주에서 발견되는 화학 원소와 분자의 반응 연구 | |
| Cosmochemistry | 우주에서 발견되는 물질의 화학적 조성 연구 | |
| Environmental chemistry | 환경에서 발생하는 화학 및 생화학 적 현상 연구 |
소개
핵 불안정성으로 인해 핵에서 입자가 방출되는 과정; 방사능이라고합니다.
이러한 에너지 / 선을 방출하는 물질을 방사성 물질이라고합니다.
이러한 방사성 물질에서 방출되는 보이지 않는 광선을 방사성 광선이라고합니다.
마찬가지로 방사능은 원자의 핵 불안정성으로 인해 (자연적으로) 발생하는 핵 현상입니다.
1896 년 Henri Becquerel은 처음으로 방사능 현상을 관찰했지만 '방사능'이라는 용어는 Marie Curie에 의해 만들어졌습니다.
Marie Curie는 1898 년에 방사성 원소 인 폴로늄과 라듐을 발견했습니다.
그녀의 발견으로 Marie Curie는 노벨상을 수상했습니다.
방사성 광선
오랜 실험 끝에 Ernest Rutherford는 동료 (Hans Geiger와 그의 학생 Ernest Marsden)와 함께 알파선, 베타선 및 감마선을 발견했습니다.
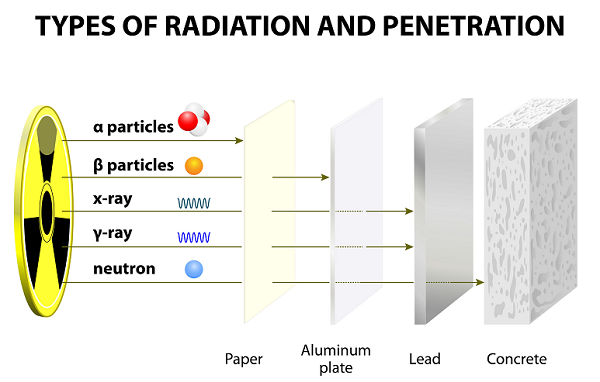
이 광선은 원자 분해의 결과로 방출되었습니다.
알파 (α) 입자
알파 입자는 일반적으로 두 개의 양성자와 두 개의 중성자로 구성되며 서로 단단히 결합되어 있습니다.
알파 입자는 핵 방사성 핵종에서 방사성 붕괴 (또는 알파 붕괴) 중에 방출됩니다.
알파 입자는 정상 헬륨 원자 또는 이중 이온화 된 헬륨 원자의 핵과 동일합니다.
다른 입자 (예 : 감마 및 베타)에 비해 알파 입자는 무겁고 느립니다. 따라서 알파 입자는 공기 중에 매우 작은 범위를 갖습니다.
느린 속도로 인해 알파 입자는 침투력이 매우 약합니다. 이러한 입자는 얇은 종이 시트로도 차단됩니다 (위의 이미지 참조).
이중 양전하를 갖기 때문에 알파 입자는 고도로 이온화됩니다.
베타 (β) 입자
베타 입자는 방사성 붕괴 (베타 붕괴라고도 함) 동안 일부 방사성 핵종에 의해 방출되는 빠르게 움직이는 전자입니다.
베타 입자는 훨씬 가볍고 단일 음전하를 운반합니다.
베타 입자는 알파 입자보다 이온화되는 경우가 거의 없습니다.
무게가 가볍기 때문에 베타 입자는 알파 입자보다 훨씬 더 멀리 이동할 수 있습니다. 그러나 베타 입자는 여러 장의 종이 또는 한 장의 알루미늄으로 막을 수 있습니다.
베타 입자는 음전하를 띠고 양전하를 띤 입자쪽으로 끌립니다.
감마 (ү) 입자
감마 입자는 방사성 붕괴 동안 방사성 요소에 의해 방출되는 전자기 에너지 (광자)와 같은 고 에너지의 묶음입니다.
세 가지 입자 (알파, 베타 및 감마) 중에서 감마 입자는 가장 에너지가 많은 광자입니다.
전자기 복사 (EMR)의 형태 인 감마 입자는 핵에서 발생합니다.
감마의 파장은 세 가지 모두 중에서 가장 짧습니다.
감마 입자는 전하가 없으며 중성입니다. 따라서 자기장과 전기장의 영향을받지 않습니다.
방사성 원소의 사용
방사성 원소는-
의료 분야 (다양한 질병의 치료)
산업 공정
에너지 생산 – 원자로
소개
핵 반응은 원자력 발전소에서 전기를 생산하는 데 사용되는 엄청난 양의 에너지 (핵 에너지라고 함)를 방출합니다.

일반적으로 생산되는 원자력 nuclear fission, nuclear fusion, 과 nuclear decay.
1938 년 독일의 화학자 오토 한, 프리츠 스트 라스 만, 오스트리아의 물리학 자 리세 마이트 너는 중성자에 의해 우라늄을 폭격하는 실험을 수행했습니다. 이 실험의 결과, 상대적으로 작은 중성자는 거대한 우라늄 원자의 핵을 대략 동일한 두 조각으로 나누고 거대한 에너지를 방출했습니다.
오토 한과 그의 동료들의 핵 실험은 핵분열로 인기가 있습니다.
핵분열
핵분열 과정은 자유 중성자와 감마 광자를 생성하는 동시에 매우 많은 양의 에너지를 방출합니다.
핵분열은 발열 반응으로, 운동 에너지뿐만 아니라 전자기 복사 형태로 많은 양의 에너지를 방출 할 수 있습니다.
때때로 핵분열은 방사성 붕괴의 일종으로 자연적으로 (즉, 중성자 폭격없이) 발생할 수 있습니다.
핵분열의 유형
다음은 핵분열의 주요 유형입니다-
Chain Reaction and
Fission Reaction
간단히 논의 해 봅시다.
연쇄 반응
하나의 단일 핵 반응이 하나 이상의 후속 핵 반응을 일으키는 경우 연쇄 반응이라고합니다.
이러한 연쇄 반응은 일련의 자체 전파 핵 반응의 가능성을 증가시킵니다.
핵 연쇄 반응은 다른 어떤 화학 반응보다 반응 당 백만 배 더 많은 에너지를 방출합니다. 따라서 폭발성 또는 통제되지 않은 연쇄 반응이라고도합니다.
중원자가 핵분열을 경험하면 일반적으로 두 개 이상의 핵분열 조각으로 분해됩니다. 이 과정에서 여러 자유 중성자, 감마선 및 중성미자가 방출되고 궁극적으로 많은 양의 에너지가 방출됩니다.
다음은 연쇄 반응의 두 가지 예입니다.
235 U + → 중성자 분열 조각 + 2.4 중성자 + 192.9 MeV
235 Pu + → 중성자 분열 조각 + 2.9 중성자 + 198.9 MeV
원자 폭탄에는 일관된 에너지 원이 필요하기 때문에 연쇄 반응 기술이 사용됩니다.
핵분열 반응
중성자 (연료 원자의 핵분열에 의해 생성됨)가 지속 가능한 에너지의 방출을 위해 더 많은 핵분열을 유도하는 데 사용되는 핵분열 반응은 핵분열 반응으로 알려져 있습니다.
이러한 반응은 느리고 제어 가능합니다. 따라서 제어 된 연쇄 반응이라고도합니다.
원자로를 생산하는 전력 (전기)은 제어 된 연쇄 반응의 이상적인 예입니다.
특성 및 사용 유형에 따라 핵분열 / 제어 연쇄 반응은 다음과 같이 분류됩니다.
Power reactors
Research reactors
Breeder reactors
이러한 동력로들은 일반적으로 핵분열 생성물의 운동 에너지를 열로 변환합니다. 또한 열은 열 엔진을 구동하는 작동 유체를 가열하는 데 사용되어 궁극적으로 기계적 또는 전력을 생성합니다.
원자로의 기본 구성 요소
다음은 원자로의 필수 구성 요소입니다-
Nuclear fuels- 우라늄 AS ( 233 U, 235 U), 토륨 (토륨 232 ), 플루토늄 (우레탄 239 ).
Moderators− 방출되는 중성자를 제어하는 데 사용됩니다. 예 : 중수, 베릴륨, 흑연 등
Coolant− 반응기 냉각에 사용됩니다. 예 : 물, 증기, 헬륨, CO 2 , 공기, 용융 금속 등
Control rods− 핵분열 반응을 실행하고 중지하는 데 사용됩니다. 예를 들어 카드뮴 또는 붕소 막대가 이러한 목적으로 사용됩니다.
핵융합
두 개의 가벼운 핵이 융합되어 무거운 핵을 형성하는 과정을 핵융합이라고합니다. 이 과정에서 핵 에너지로 알려진 엄청난 양의 에너지가 방출됩니다.
핵융합의 가장 좋은 예는 수소 폭탄입니다.
수소 폭탄은 원자 폭탄보다 약 1,000 배 더 강력합니다.
소개
특징적으로 단단하고 광택이 있고 불투명하며 열과 전기를 전도하는 특성을 가진 재료 (원소, 화합물 또는 합금 일 수 있음)를 금속이라고합니다.
금속은 지각에서 광석과 같은 불순한 형태로 자연적으로 발견됩니다. 그리고 채굴 과정을 통해 추출됩니다.
알려진 모든 118 개의 원소 (주기율표) 중에서 약 91 개의 원소가 금속입니다.

금속의 특징
다음은 금속의 중요한 특징입니다-
금속은 일반적으로 가단성이 있습니다. 즉, 깨지거나 깨지지 않고 모양이 영구적으로 변경 될 수 있습니다.
금속은 가용성입니다. 그것은 쉽게 융합되거나 녹을 수 있습니다.
금속은 연성입니다. 얇은 시트 나 와이어로도 어떤 모양이든 지정할 수 있습니다.
금속은 열과 전기의 좋은 전도체입니다. heaver, 납은 전기를 운반하지 않기 때문에 예외입니다.
금속은 자연적으로 다양한 비금속과 반응하여 화합물을 형성합니다. 금속은 염기 및 산과 반응 할 수 있습니다. 예 : 4 Na + O 2 → 2 Na 2 O (산화 나트륨) 등
합금
합금은 금속이 지배하는 두 개 이상의 원소의 혼합물의 산물입니다.
원하는 제품을 생산하거나 제조하기 위해 다른 금속 (다른 비율)이 혼합됩니다 (즉, 합금). 예를 들어 철의 합금, 즉 스테인리스 강, 주철, 합금 시트 등은 수량 및 상업적 가치 측면에서 많은 부분을 차지합니다.
금속은 일반적으로 부식에 더 강하고, 덜 부서지며, 매력적인 색상 등을 제공하기 위해 합금으로 만들어집니다.
금속 용어
Base Metal− 화학에서 비금속의 의미는 – 쉽게 산화되거나 부식 될 수있을뿐만 아니라 HCl (희염산)과 쉽게 반응하여 수소를 형성하는 금속입니다. 예 : 철, 니켈, 아연, 납 등
Ferrous Metal− "철 (Ferrous)"은 "철을 함유 한"물질을 의미하는 라틴어입니다. 예 : 강철 등
Heavy Metal− 일반 금속보다 밀도가 훨씬 높은 금속은 중금속으로 분류됩니다. 중금속은 저농도에서 유독하거나 유독합니다. 예 : 수은 (Hg), 비소 (As), 크롬 (Cr), 카드뮴 (Cd), 탈륨 (Tl) 및 납 (Pb).
Precious Metal− 경제적 가치가 높은 희귀 한 금속 화학 원소를 가진 금속 원소는 귀금속으로 분류됩니다. 예 : 백금, 금,은, 팔라듐 등
Noble Metal− 부식 또는 산화에 강한 금속. 예 : 루테늄 (Ru), 로듐 (Rh), 팔라듐 (Pd) 등
금속의 응용
다음은 금속의 중요한 응용 프로그램입니다-
금속은 열과 전기의 좋은 전도체이기 때문에; 따라서 전선 및 전기 모터 등을 포함한 다른 많은 전기 제품 (예 : 구리,은, 알루미늄 등)으로 사용됩니다.
중금속은 교량, 수영장 및 이러한 많은 용도로 사용됩니다.
많은 금속은 식기, 냄비, 스토브 등과 같은 다양한 가정 용품을 제조하는 데 사용됩니다.
금속은 간단한 스크류 드라이버에서 무거운로드 롤러에 이르기까지 다양한 유형의 도구를 제조하는 데 자주 사용됩니다.
귀금속은 외관이 아름답고 매력적입니다 (예 : 금,은 등). 따라서 그들은 장식품으로 사용됩니다.
과열로부터 민감한 장비를 보호하는 방열판에 일부 특정 금속이 사용됩니다.
방사성 금속 (예 : 우라늄 및 플루토늄)은 원자력 발전에 사용됩니다.
수은은 실온에서 액체 상태로 남아있는 금속입니다. 온도계에 사용됩니다.
금속의 특성과 생산 및 정제를 연구하는 과학 기술 분야는 다음과 같이 알려져 있습니다. metallurgy.
자연적으로 발생하는 고체 무기 물질은 mineral.
귀중한 광물이나 금속을 추출 할 수있는 자연 발생 고체 물질은 다음과 같이 알려져 있습니다. ore.
다음 표는 주요 원소와 광석을 보여줍니다.
| 요소 | 광석 | 화학적 구성 요소 |
|---|---|---|
| 알류미늄 | 보크 사이트 | 알 2 O 3 2H 2 O |
| 커런덤 | Al 2 O 3 | |
| Kryolite | Na 3 AlF 6 | |
| Dyspore | Al 2 O 3 .H 2 O | |
| 구리 | 구리 황철석 | CuFeS 2 |
| 공작석 | 2CuCO 3 Cu (OH) 2 | |
| 철 | 적철광 | Fe 2 O 3 |
| 자철광 | 의 Fe 3 O 4 | |
| Siderite | FeCO 3 | |
| 나트륨 | 탄산나트륨 | Na 2 CO 3 |
| 염화나트륨 | NaCl | |
| 질산 나트륨 | NaNO 3 | |
| 황산나트륨 | Na 2 SO 4 | |
| 칼륨 | 염화칼륨 | KCl |
| 탄산 칼륨 | K 2 CO 3 | |
| 질산 칼륨 | KNO 3 | |
| 마그네슘 | 마그네사이트 | MgCO 3 |
| 백운석 | CaMg (CO 3 ) 2 | |
| 엡솜 솔트 | MgSO 4 | |
| 칼슘 | 탄산 칼슘 | CaCO 3 |
| 주석 | Cassiterite | SnO 2 |
| 리드 | 방연광 | PbS |
| Cerussite | PbCO 3 | |
| Anglesite | PbSO 4 | |
| 은 | Argentite | Ag 2 S |
| 사면체 | Sb 4 S 3 | |
| 아연 | 아연 탄산염 (칼라 민으로 알려짐) | ZnCO 3 |
| 아연 황화물 | ZnS | |
| 수은 | 단사 | HgS |
| 망간 | Pyrolusite | MnO 2 |
| 인의 | 인산염 | Ca 3 (PO 4 ) 2 |
| Fluorapatite | Ca 5 (PO 4 ) 3 F | |
| 클로 라파 타이트 | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| 금 | Calaverite | AuTe 2 |
| 실바 나이트 | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| 안티몬 | Stibnite | Sb 2 S 3 |
| Stibiconite | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| 코발트 | 코발 타이트 | CoAsS |
| 니켈 | Pentlandite | ((Ni, Fe) S) |
| 크롬 | 크로 마이트 | (FeCr 2 O 4 ) |
소개
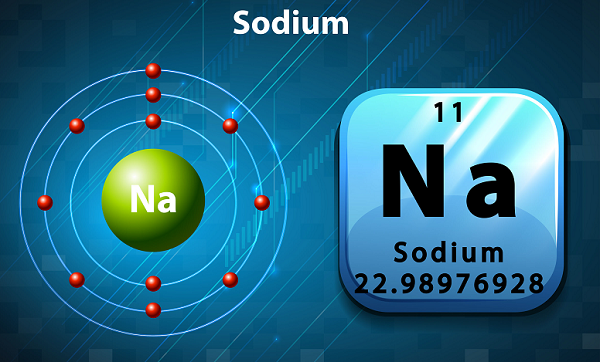
나트륨은 부드럽고 은색이며 반응성이 높은 알칼리 금속입니다.
주기율표에서 나트륨은 외부 껍질에 단일 전자가 있기 때문에 그룹 1로 유지됩니다.
나트륨의 상징은 'Na,'실제로 라틴어에서 가져온 것입니다. ‘natrium.’
풍부함 측면에서 나트륨은 지각에서 발견되는 여섯 번째 원소입니다.
나트륨은 장석, 소달 라이트, 암염 (NaCl) 등 다양한 미네랄에 존재합니다.
1807 년 Humphry Davy는 수산화 나트륨을 전기 분해하여 나트륨을 처음으로 분리했습니다.
당시에는 20 개의 나트륨 동위 원소가 알려져 있지만 그중에서도 23 개의 Na 만이 안정적입니다.
나트륨의 두드러진 특징
다음은 나트륨 원소의 주요 특징입니다-
나트륨 금속은 칼로 쉽게자를 수있는 부드러운 원소입니다.
나트륨은 열과 전기의 좋은 전도체입니다.
원자 질량이 낮고 원자 반경이 크기 때문에 나트륨은 밀도가 가장 낮은 원소 중 하나입니다 (세 번째로 밀도가 가장 낮은 원소 – 처음 두 개는 리튬과 칼륨 임).
나트륨은 물에 뜰 수 있습니다.
화합물의 나트륨은 노란색으로 빛납니다 (아래 이미지 참조).

나트륨 화합물은 상업적 중요성이 매우 높으며 유리, 종이, 비누 및 직물 산업에서 수요가 높습니다.
나트륨 화합물
다음은 나트륨 화합물의 중요한 예입니다.
식염 - (NaCl)
소다회 - (Na 2 CO 3 )
베이킹 소다 - (NaHCO 3 )
가성 소다 - (NaOH)
질산 나트륨 - (NaNO 3 )
Sodium thiosulfate -(Na2S2O3·5H2O)
Borax -(Na2B4O7·10H2O)
Occurrence of Sodium
The crust of Earth contains about 2.27% sodium.
Sodium is the 5th most abundant metal; other four are aluminum, iron, calcium, and magnesium.
In the oceanic water, about 1.08 × 104 milligrams sodium found in per liter.
Sodium does not found as a pure element, as it is highly reactive.
Uses of Sodium
Following are the major uses of sodium −
Sodium chloride is highly useful for anti-icing and de-icing as well as a preservative.
In cooking, sodium bicarbonate is used.
Sodium and some of its compounds are used in medicines.
In comparison to potassium (which is a better ion), sodium is more frequently used because of its lower price and atomic weight.
In organic chemistry, sodium hydride is used as various reactions.
Metallic sodium is principally used for the production of sodium borohydride, sodium triphenylphosphine, azide, indigo, etc.
In some fast reactors, liquid sodium is used as a heat transfer fluid because of having the property of good heat conductivity.
Sodium is also an essential mineral for the human health, as it regulates blood pressure, blood volume, osmotic equilibrium, and pH value.
The minimum amount of 500 milligrams sodium is required every day for a healthy human body.
Introduction
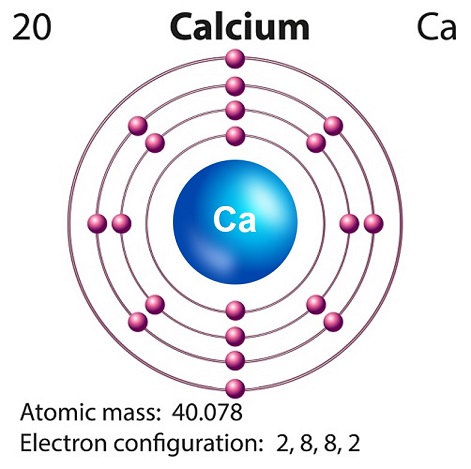
Calcium is a soft grayish-yellow alkaline element found largely in the Earth’s crust.
Calcium’s symbol is “Ca” and atomic number is “20.”
Free calcium hardly exists in nature, as it is highly reactive.
Calcium is produced usually in supernova nucleosynthesis.
Salient Features of Calcium
Calcium is one of the most abundant metals by mass found in many animals.
Calcium is a very important constituent of teeth, bone, and shells.
Calcium carbonate and calcium citrate are the major dietary supplements required for a good health.
World Health Organization (WHO) listed calcium as the Essential Medicines.
In comparison to other metals, the calcium ion and most of the other calcium compounds have low toxicity.
If calcium comes in contact with water or acid, it reacts with them and becomes hazardous.
If calcium comes in contact with air, it reacts swiftly and forms a gray-white coating of calcium nitride and calcium oxide.
Most of the calcium salts are normally colorless.
When calcium burnt, the color of its flame appears brick red (see the image given below).

Calcium metal has comparatively a higher electrical resistivity than aluminum or copper.
Occurrence
Calcium occurs usually in sedimentary rocks.
The minerals (sedimentary) in which calcium found are calcite, dolomite, and gypsum.
Calcium also found in igneous and metamorphic rocks mostly in the silicate minerals, such as amphiboles, plagioclases, pyroxenes, and garnets.
Calcium also found in many of the food products namely dairy products, almonds, hazelnuts, soy beans, broccoli, dandelion leaves, figs, and in many more.
Compounds of Calcium
Calcium oxide - CaO
Calcium hydroxide - Ca(OH)2
Calcium chloride - CaCl2
Calcium hypochlorite (Bleaching powder) - Ca(ClO)2
Calcium phosphate - Ca3(PO4)2
Uses of Calcium
Calcium has wide range of usage, significant of them are −
Calcium carbonate (CaCO3) is used in manufacturing cement.
Calcium carbonate (CaCO3) is also used in making toothpaste.
In insecticides, calcium arsenate (Ca3(AsO4)2) is used.
Calcium chloride (CaCl2) is used in ice removal as well as in dust control.
Calcium citrate (Ca3(C6H5O7)2) is commonly used as food preservative.
Calcium gluconate (Ca(C6H11O7)2) is used frequently as a food additive as well as in vitamin pills.
Calcium hypochlorite (Ca(OCl)2) is generally used as a swimming pool disinfectant, as a bleaching agent.
Introduction
The metal with color silvery-white, soft, nonmagnetic, and ductile metal property, is known as aluminum.
The symbol of aluminum is ‘Al’ and its atomic number is ‘13.’
The Chemical element aluminum belongs to the boron group.

- Bauxite is the chief ore of the aluminum.
Salient Features of Aluminum
Aluminum metal is a chemically reactive element.
Aluminum has the potential to resist corrosion and the process of this resistivity is known as passivation.
Aluminum is a comparatively durable, lightweight, soft, malleable, and ductile, metal.
Aluminum is nonmagnetic and does not get ignite easily.
An aluminum film is a very good reflector of visible light, as it reflects more than 90 percent of incoming rays.
Aluminum commonly reacts with water and forms hydrogen.
Aluminum is the metal of low density and it has the property to resist corrosion.
Aluminum has the property of heat and electricity conductivity and hence, it is a good conductor.
Occurrence of Aluminum
Aluminum makes up (about) 8 percent of the Earth's crust.
After oxygen and silicon, aluminum is the third most abundant element; however, it is the most abundant metal in the crust.
When hydrogen fuses with magnesium, it creates stable aluminum.
Aluminum naturally found in oxides or silicates states.
Compounds of Aluminum
Following are the major compounds of aluminum −
Alumina - Al2O3
Aluminum chloride - AlCl3
Aluminum sulphate - Al2(SO4)3
Aluminum hydroxide - Al(OH)3
Aluminum carbide - Al4C3
Usage of Aluminum
Aluminum has wide range of usages in the industries as well as in everyday life; significant of them are −
Aluminum is used in transportation industries, such as railway, automobiles, aircraft, spacecraft, trucks, marine vessels, bicycles, etc.
Aluminum is used in packaging some specific materials.
Aluminum is used in the constructions of doors, windows, building wire, sheathing, roofing, etc.
Aluminum is largely used in making electric wire.
Aluminum is used in making home appliances and many other household items, such as cooking utensils.
Aluminum is used in baseball bats, watches, and many more such kind of stuffs.
Aluminum is used in photographic equipment.
Aluminum is used in electronic appliances.
Aluminum is used as light reflector, as it is a good light reflector; basically, some of the materials are aluminum coated specially to reflect light.
Aluminum is used in production of hydrogen gas by reaction with hydrochloric acid.
Aluminum is used in manufacturing musical instruments.
Introduction
Magnesium is a shiny gray solid element.
The symbol of magnesium is ‘Mg’ and atomic number is ‘12.’

With approximately 80% of the world market share, China is the largest supplier of magnesium.
Salient Features of Magnesium
The density of magnesium is two-thirds the density of aluminum.
Among all the alkali metals of the Earth, magnesium has lowest melting point (i.e. about 1,2020F) and lowest boiling point (about 1,9940F).
Magnesium usually reacts with water at room temperature.
Sometimes, magnesium is also used as an igniter for thermite.
Magnesium, when burns in air, produces a brilliant-white light, which also includes strong ultraviolet wavelengths.

Magnesium, when burns, it produces intense bright and white light (see image given above).
Occurrence of Magnesium
By mass, magnesium is the eighth-most-abundant element found in the Earth's crust.
Magnesium is found usually in large deposits of magnesite, dolomite, and other such minerals.
The soluble magnesium ion is found in the mineral water.
After sodium and chlorine, magnesium is the third most abundant element dissolved in seawater.
Magnesium naturally occurs only in combination with some other elements.
By mass, magnesium is the 11th most abundant element in the human body and it is essential to all cells and enzymes.
Magnesium ions frequently interact with polyphosphate compounds including ATP, DNA, and RNA.
Compounds of Magnesium
Following are the major compounds of magnesium −
Magnesium carbonate - MgCO3
Magnesium chloride - MgCl2
Magnesium citrate - C6H6MgO7
Magnesium hydroxide - Mg(OH)2
Magnesium oxide - MgO
Magnesium sulfate - MgSO4
Magnesium sulfate heptahydrate - (MgSO4·7H2O)
Magnesium sulfate heptahydrate is commonly known as Epsom salt.
Usages of Magnesium
Magnesium has wide range of usage in our lives; however, some significant usages of magnesium are −
After iron and aluminum, magnesium is third most commonly used element.
Magnesium is especially used in super-strong, lightweight materials, and alloys.
Magnesium is also used as engine materials in the aircraft industry.
Magnesium is also used to purify the solvents; such as in preparing the super-dry ethanol.
Many of the automotive big brands including Mercedes, Porsche, BMW, Volkswagen, Chevrolet, etc. use magnesium in making their highly quality cars.
Because of having low weight and good electrical and mechanical properties, magnesium is commonly used in manufacturing laptops and tablet computers, mobile phones, cameras, and many other electronic components.
Magnesium sulfite is usually used in manufacturing paper.
Introduction
Manganese is a chemical element that usually found in combination with the iron.
The symbol of manganese is ‘Mn’ and atomic number is ’25.’
Manganese is a metal very important for the industrial use.

In 1774, Johan Gottlieb Gahn, first time isolated an impure sample of manganese metal in 1774.
Features of Manganese
Following are the major features and characteristics of manganese −
Similar to iron, manganese is silvery-gray metal.
Manganese can be oxidized easily, but very difficult to fuse it, as it is very hard and brittle.
In air, manganese gets tarnished slowly (oxidization).
Manganese is an element, which is part of the iron group.
Occurrence of Manganese
Manganese is the 12th most abundant element of the earth’s crust.
Soil usually contains about 7–9000 ppm of manganese with an average of 440 ppm.
Seawater has only about 10 ppm manganese; whereas, the atmosphere contains about 0.01 µg/m3.
Pyrolusite (MnO2) is the most important ore of manganese.
Compounds of Manganese
Following are the major compounds of manganese −
Manganese (II) oxide - MnO
Manganese (I) oxide - Mn2O3
Manganese dioxide - MnO2
Manganese chloride - MnCl2
Potassium permanganate - KMnO4
Manganese (II) sulfate - MnSO4
Manganese (II) carbonate - MnCO3
Manganese (II) sulfide - MnS
Manganese (II) nitrate - Mn(NO3)2
Manganese (II) bromide - MnBr2
Manganese heptoxide - Mn2O7
Dimanganese decacarbonyl - C10O10Mn2
Manganese (II) iodide - MnI2
Manganese (II) fluoride - MnF2
Uses of Manganese
Following are the major uses of manganese −
Manganese is one of the most essential constituents of steel production.
Manganese phosphating is commonly used for the rust and corrosion prevention on steel.
In biology, manganese(II) ions act as cofactors for the large variety of enzymes.
Manganese is also important in the oxygen-evolving phenomenon of photosynthetic plants.
Manganese dioxide is also used in the manufacture of oxygen and chlorine and in drying black paints.
Introduction
Iron is the most common element found in largely in outer as well inner core of the earth.
The symbol of iron is ‘Fe’ and atomic number is ‘26.’

Iron is one of the earliest known elements that is being used by human beings.
Salient Features of Iron
Following are the major features of iron −
Pure iron element is soft, ductile, and malleable.
The boiling point of iron ranges between 15330C and 24500C.
Iron easily gets attracted towards magnet.
In dry air, iron remains inactive and does not react (with air); however, in moist air, it reacts and forms rust.
Pure iron normally does not react with pure water; however, it reacts easily with ordinary of polluted water and rust forms.
Iron reacts with halogen and Sulphur to form halide and sulphide accordingly.
Occurrence of Iron
The inner and outer cores of the earth are largely made up of iron and nickel.
Most likely, iron is the most abundantly available element of the earth; however, it is the fourth most abundantly available element of the crust.
Types of Iron
Following are the major types iron −
Hematite - Fe2O3
Magnetite - Fe3O4
Siderite - FeCO3
Compounds of Iron
Following are the major compounds of iron −
Iron (II) oxide - FeO
Iron (III) chloride - FeCl3
Iron (III) oxide-hydroxide - Fe(OH)3
Iron (II) sulfide - FeS
Iron (II) chloride - FeCl2
Iron phosphate - FePO4
Ferrate (VI) - (FeO4)2-
Iron (II) acetate - Fe(C2H3O2)2
Iron (III) sulfide - Fe2S3
Iron (III) chromate - Fe2(CrO4)3
Iron (II) hydroxide - Fe(OH)2
Iron (III) acetate - C14H27Fe3O
Iron (II) oxalate - FeC2O4
Iron (II) fluride - FeF2
Uses of Iron
Among all the metals, iron is most widely used (about 90 percent of world’s total metal production).
In most of the heavy industries, iron is the most essential element.
Industries like railway, ship building, automobile, engineering construction, etc., everywhere, iron is essentially required.
Introduction
Copper is a soft, ductile, and malleable metal.
Copper has very high thermal and electrical conductivity.
The symbol of copper is ‘Cu’ and atomic number is ’29.’

Copper is known to people since (about) c. 8000 BC.
Copper is the first metal, which was smelted from its ore around c. 5000 BC.
Salient Features of Copper
Copper was the first metal that cast into a shape (in a mold).
Copper was the first metal that successful alloyed with another metal, e.g. copper alloyed with tin and resultantly bronze is prepared. It is done about c. 3500 BC.
First metal to be purposefully alloyed with another metal, tin, to create bronze, c. 3500 BC.
Copper has a natural reddish-orange color; it is visible once the its surface is exposed.
Copper is a very good conductor of electricity and heat.
Copper is an element of group 11 of the periodic table.
Copper normally does not react with water; however, it does react slowly with atmospheric oxygen and form a layer of brown-black copper oxide.
The brown-black copper oxide usually protects the underlying metal from further corrosion just like passivation.
Passivation is a process of use of a light coat of a protective material, such as metal oxide, which is used to create a protective shell against the corrosion.
Occurrence of Copper
Copper is commonly found in the earth’s crust.
In 1857, the largest mass of elemental copper (weighing about 420 tones) discovered. It was found on the Keweenaw Peninsula located in Michigan, US.
Alloys of Copper
The metal alloys, which have the copper as their major constituent, is known as copper alloys.
Copper alloys are highly resistant to corrosion.
The best (traditional) example of copper alloy is bronze (made by mixing tin and brass).
Following are the major alloys of copper −
Brass
Bronze
Auricupride
Chinese silver
Corinthian bronze
Electrum, Green gold
Grey gold
Niello
Panchaloha
Rose, red, and pink gold
Spangold
Shibuichi
Tibetan silver
White gold
Compounds of Copper
Following are the major compounds of the copper −
Cupric acetate - Cu(CH3COO)2
Copper(I) oxide - Cu2O
Copper(II) oxide - CuO
Copper(II) chloride - CuCl2
Dicopper chloride trihydroxide - Cu2(OH)3Cl
Copper(I) chloride - CuCl
Copper(II) nitrate - Cu(NO3)2
Copper Cyanide - CuCN
Uses of Copper
Copper is largely used in making electric wires.
Copper is used in electric motors.
Copper is used in roofing, plumbing, and in many other industries.
Copper paint is used in painting boats and many other materials.
Many of the home appliances are made up of either pure copper or its alloys.
Introduction
Silver is a soft, lustrous transition, and white metal.
Silver has the highest electrical and thermal conductivity; and, it has also the highest reflectivity of any metal.

The symbol of silver is ‘Ag’ and atomic number is ’47.’
Salient Features of Silver
Silver is a precious metal used since long time by human beings.
Silver is an element of group 11 of the periodic table.
Silver has an excellent white metallic luster commonly used in a high polish.
As silver has no color; therefore, it has high reflectivity (of light).
Silver has very high electrical and thermal conductivity. Its electric conductivity is the highest – higher than copper.
Among all the metals, silver also has the lowest contact resistance.
Occurrence of Silver
The metal silver is usually found in the Earth's crust in the pure form.
Silver also found as an alloy with the gold and some other metals.
Silver is also found in some minerals, such as argentite and chlorargyrite.
Silver is largely produced as a byproduct of gold, copper, zinc, lead, etc.
Alloys of Silver
Following are the major alloys of silver −
Argentium sterling silver
Britannia silver
Doré bullion
Electrum
Goloid
Platinum sterling
Sterling silver
Tibetan silver
Compounds of Silver
Following are the major compound of silver −
Silver chloride - AgCl
Silver iodide - Agl
Silver bromide - AgBr
Silver oxide - Ag2O
Silver sulfide - Ag2S
Silver fluoride - AgF
Silver cyanide - AgCN
Silver carbonate - Ag2CO3
Silver acetate - AgC2H3O2
Silver sulfate - Ag2SO4
Silver chromate - Ag2CrO4
Silver oxalate - Ag2C2O4
Silver chlorate - AgClO3
Uses of Silver
Following are the major uses of silver −
From the ancient period, silver is being used in making coins.
Silver is also used in making ornaments.
Many of the home pots and other utensils were also used to be made by silver.
Silver has also medicinal use, as it is used as an antibiotic coating in medical devices.
Because of having very high electric conductivity, silver is commonly used in some electronic devices.
Besides, silver has many other uses, such as in photography, in chemical equipment, nanoparticles, etc.
Introduction
Gold is a bright, reddish yellow, soft, dense, malleable, and ductile metal naturally found in the earth’s crust.
The symbol of gold is ‘Au’ and atomic number is ‘79.’

Gold is (chemically) a transition metal and belongs to group 11 of the periodic table.
Salient Features of Gold
Gold, which remains in a solid state under standard conditions, is the least reactive element.
Gold is resistant to most of the acids.
Gold does dissolve in aqua regia; aqua regia is a mixture of nitric acid and hydrochloric acid.
However, gold is insoluble in nitric acid.
Gold usually dissolves in alkaline solutions of cyanide.
Cyanide solutions are commonly used in mining and electroplating.
Gold also dissolves in mercury and forms ‘amalgam alloys.’
Gold does not react with oxygen at any temperature.
Occurrence of Gold
Gold commonly occurs as a free element i.e. in the natural form.
Gold occurs as nuggets or else found in in rocks, grains, in veins, and in some other alluvial deposits.
Gold also occurs in a solid solution forms with the native element such as silver (as electrum).
At some places, gold also naturally alloyed with copper and palladium.
Alloys of Gold
Following are the major alloys of gold −
Colored gold
Crown gold
Electrum
Rose gold
Tumbaga
White gold
Compounds of Gold
Following are the major compounds of the gold −
Gold (III) chloride - AuCl3
Gold (I) chloride - AuCl
Cyanide - CN
Chloroauric acid - HAuCl4
Gold (III) oxide - Au2O3
Gold bromide - AuBr
Aqua regia - HNO3+3HCl
Gold bromide - AuBr3
Gold (III) hydroxide - AuH3O3
Gold fluoride - AuF3
Gold (V) fluoride - AuF5
Gold sulfide - Au2S
Fulminating gold
Gold salts
Gold heptafluoride
Uses of Gold
Gold is one of the oldest elements that human being have been using for thousands of years.
As it is highly precious and provides a beautiful look, hence it is characteristically used in making ornaments.
As per the recent trend (of the world), about 50% gold is used in making jewelry, 40% used in investments, and remaining 10% is used in industry.
Introduction
Platinum is a malleable, ductile, dense, and highly unreactive chemical element.
The symbol of platinum is ‘Pt’ and its atomic number is ‘78.’

The name of platinum is derived from a Spanish term i.e. ‘platina,’ which means "little silver."
Platinum is the most precious and the rarest metal (element) on the earth.
Salient Features of Platinum
Following are the important features of the platinum −
Platinum is a silver white metal.
Platinum is an element of group 10 of the periodic table.
Platinum is one of the rarest elements in the crust of the earth.
Platinum is one of the least reactive elements.
Platinum has six natural isotopes.
Platinum is one of the most highly valuable and precious metals.
Platinum is characteristically resists corrosion in all conditions. Because of this reason, it is considered as noble metal.
Platinum is normally insoluble in nitric and hydrochloric acid, but dissolves in hot aqua regia.
After dissolving into the hot aqua regia, platinum gives aqueous chloroplatinic acid (see the image given below).

Occurrence of Platinum
Platinum is commonly found as the native (natural) platinum and as alloy with the other platinum-group.
Platinum usually occurs in the ores of nickel and copper.
Platinum also occurs naturally in the alluvial sands (commonly found in rivers).
Platinum occurs with the concentration of only (about) 0.005 ppm in the Earth's crust.
Alloys of Platinum
Platinum-iridium is one of the most significant alloys of platinum.
Compounds of Platinum
Following are the major compounds of platinum −
Platinum (II) chloride - Pt Cl2
Platinum (IV) chloride - PtCl4
Adam’s catalyst - PtO2
Platinum hexafluoride - PtF6
Potassium tetrachloropla - K2PtCl4
Krogmann’s salt - K2Pt(CN)4Br
Chloroplatinic acid - H2PtCl6
Sodium hexachloropl - Na2PtCl6
Aqua regia - HNO3+3HCl
Uses of Platinum
Platinum is used largely for vehicle emissions control devices.
Platinum is used in petroleum refining and many other chemical productions.
Platinum is used in electronic devices, such as in hard disk (drives).
Platinum is also used in jewelry.
Apart from all these usages, platinum is also used in medicine (anti-cancer drugs), glassmaking equipment, electrodes, turbine engines, investment, etc.
소개
주기율표에서 아연은 그룹 12의 첫 번째 원소입니다.
아연의 상징은 ‘Zn’ 그리고 원자 번호는 ‘30.’
가용성 측면에서 아연은 지각에서 발견 되는 24 번째로 가장 풍부한 원소이며 5 개의 안정한 동위 원소를 가지고 있습니다.

가장 일반적인 아연 광석은 황화 아연 광물 인 sphalerite (아연 블렌드)입니다.
독일의 화학자 인 Andreas Sigismund Marggraf는 1746 년에 처음으로 순수한 금속 아연을 발견했습니다.
흥미롭게도 연금술사들은 공기 중에 아연을 태워서 다른 것을 형성했고 "philosopher's wool" 또는 "white snow. "
아연의 두드러진 특징
아연의 색은 청백색이며 광택이 나는 반자성 금속입니다.
아연 금속은 일반적으로 단단하고 부서지기 쉽습니다. 그러나, 온도가 증가 할 때 (100)에서 0 C, 이는 연성된다.
온도가 증가하면 210 0 C를 다음 아연 금속은 다시 취화 및 고해함으로써 용이하게 분쇄 할 수있다.
아연은 전기 전도체입니다.
아연의 발생
아연은 일반적으로 구리 및 납과 같은 다른 비금속과 관련하여 발견됩니다.
Sphalerite는 황화 아연의 한 형태이며 가장 많이 채굴 된 광석입니다.
Sphalerite는 약 60 ~ 62 %의 아연을 포함합니다.
아연 합금
다음은 아연의 주요 합금입니다-
Brass
양은
양은
아연 화합물
다음은 아연의 주요 화합물입니다-
산화 아연 - ZnO의
황화 아연 - 은 ZnS
아연 할로겐 - ZnF 2
질산 아연 - 아연 (NO 3 ) 2
아연 염소산 - 아연 (C10의 3 ) (2)
황산 아연 - ZnSO 4
인산 아연 - 아연 3 (PO 4 ) 2
아연 몰리브덴 - ZnMoO 4
아연 크롬 - ZnCrO 4
아연 아비 산염 - 아연 (아소 2 ) 2
아세트산 아연 - 아연 (O 2 CCH 3 ) (2)
아연의 용도
아연은 공중 보건에 가장 중요한 요소 중 하나입니다.
아연은 주로 철 및 강재의 부식 방지제 및 코팅제로 사용됩니다.
아연은 일반적으로 아연-공기 배터리의 양극 또는 연료로 사용됩니다.
산화 아연은 페인트에서 백색 안료로 광범위하게 사용됩니다 (아래 이미지 참조).

산화 아연은 고무 제조시 촉매로도 사용됩니다.
아연은 우리 건강에 필수적인 요소입니다. 일반적으로 산화 아연, 아세트산 아연 또는 글루 콘산 아연과 같은 형태의 보충 재료로 사용됩니다.
아연은 일반적으로 항산화 물질입니다.
인체의 아연 결핍은 주요 우울 장애를 일으킬 수 있습니다.
신체 부상 후 아연은 치유 과정을 가속화하는 데 사용됩니다.
아연 피리 티온은 일반적으로 비듬을 예방하기 위해 샴푸에 사용됩니다.
킬레이트 아연은 구취를 예방하기 때문에 일반적으로 치약과 구강 세정제 (액체)에 사용됩니다.
아연은 또한 햇볕으로부터 피부를 보호하므로 바디 로션에 사용됩니다.
소개
수은은 일반적으로 'quicksilver. '
이전에 수은은 'hydrargyrum. '
수은의 상징은 ‘Hg’ 원자 번호는 ‘80.’

붉은 색 안료 주홍은 천연 진사 또는 합성 황화 수은을 갈아서 추출합니다.
수은의 두드러진 특징
수은은 무겁고 은백색 금속입니다.
수은은 일반적으로 액체 상태로 제공됩니다. 정상적인 상태에서 상온에서 액체 상태로 남아있는 것은 금속 원소가 거의 없습니다.
수은은 열 전도체가 좋지 않지만 전기 전도체가 좋습니다.
수은의 빙점은 -38.83이며 0 C 및 비점 356.73이고 0 C.
모든 형태의 수은 섭취로 인해 발생하는 수은 중독. 또한 수은 증기의 흡입으로 인해 발생합니다.
수은은 금과은을 포함한 많은 금속을 용해시켜 아말감을 형성합니다.
수은의 발생
수은은 지각에서 가장 희귀 한 원소 중 하나입니다.
가장 풍부한 수은 광석은 약 2.5 %의 수은 (질량 기준)을 운반합니다.
수은은 천연 (천연) 원소 또는 코데 로이트, 진사, 리빙 스토 나이트 등 광물에서 발견됩니다.
수은은 젊은 산지 지역에서 발견됩니다. 더 조밀 한 암석을 계속해서 지구의 지각으로 밀어 붙이는 벨트. 예를 들어 화산 지역 또는 온천 지역.
수은 합금
아말감은 수은의 주요 합금입니다.
수은 화합물
다음은 수은의 주요 화합물입니다-
수은 (II) 클로라이드 - HgCl 2
수은 (II) 산화물 - HGO
황화 수은 - HGS
머큐리 (I) - 클로라이드 - 수은 (2) CL (2)
Dimethylmer - C 2 H 6 수은
수은 (II), 질산 - 수은 (NO 3 ) 2
수은 (II) 아세테이트 - C 4 H 6 O 4 수은
수은 (II), 황산 - HgSO 4
수은 (I), 요오드화 - 수은 이 I 2
수은 셀렌 - HgSe
수은 (II) 뇌 산염 - 수은 (CNO) 2
수은 (II) 브로마이드 - HgBr 2
수은 (II) 요오드 - HGI 2
산화 수은 - 수은 이 O
수은 (I) 불소 - 수은 이 F 2
수은 amidochloride - CLH 2 HGN
Diethylmercury - C 4 H 10 수은
수은의 사용
수은은 화학 산업에서 주로 사용됩니다.
수은은 전기 및 전자 응용 분야에 사용됩니다.
수은은 우리가 온도를 측정하는 데 사용하는 온도계에 사용됩니다.
수은은 화합물과 함께 일반적으로 다양한 의약품에 사용됩니다.
소개
플루토늄은 기본적으로 악티늄 족 금속이며 은회색처럼 보입니다.
원자 번호가 89에서 103 사이 인 원소는 악티 나이드 원소로 알려져 있습니다.
플루토늄의 상징은 ‘Pu’ 원자 번호는 ‘94.’

플루토늄은 일반적으로 6 개의 동소체를 가지고 있습니다.
플루토늄은 'Pluto. '
플루토늄은 1940 년 Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan 및 Arthur C. Wahl이라는 과학자 그룹에 의해 처음 발견되었습니다.
플루토늄의 두드러진 특징
플루토늄은 방사성 화학 원소입니다.
플루토늄은 공기에 노출되면 변색되고 산화되면 무딘 코팅을 형성합니다.
플루토늄은 할로겐, 질소, 탄소, 실리콘 및 수소를 포함한 많은 원소와 반응합니다.
핵분열 과정으로 인해 중성자가 방출되어 우라늄 -238 핵을 플루토늄 -239로 변환합니다.
플루토늄 -239와 플루토늄 -241은 모두 핵분열 성이므로 핵 연쇄 반응을 유지할 수 있습니다. 그것은 핵무기와 원자로에 매우 잘 적용됩니다.
플루토늄 융점 640 0 C 및 비점이 3,228이고 0 C.
헬륨 핵 (고 에너지)의 방출은 플루토늄에 대한 가장 일반적인 방사성 붕괴 형태입니다.
플루토늄의 발생
우라늄 매장지 내에서 미량에서만 자연적으로 발견되는 플루토늄.
플루토늄은 또한 우라늄을 태워서 추출합니다 (핵 에너지를 개발하는 동안).
플루토늄 합금
다음은 플루토늄의 주요 합금입니다-
플루토늄-갈륨은 갈륨뿐만 아니라 플루토늄의 중요한 합금 중 하나입니다.
플루토늄-갈륨은 핵무기 구덩이에 사용됩니다.
플루토늄-갈륨은 열팽창이 매우 낮습니다.
다른 플루토늄 합금은 다음과 같습니다.
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
플루토늄 화합물
이산화 플루토늄 - PuO 2
플루토늄 (III) 클로라이드 - PuCl 3
플루토늄 테트라 플루오 라이드 - PUF 4
플루토늄의 용도
동위 원소 플루토늄 -239는 핵무기 개발에있어 중요한 요소 중 하나입니다.
플루토늄은 원자력 발전소에서 연료로 사용됩니다.
소개
우라늄은 주기율표의 악티늄 족 계열의 금속입니다.
우라늄의 상징은 ‘U’ 원자 번호는 ’92.’
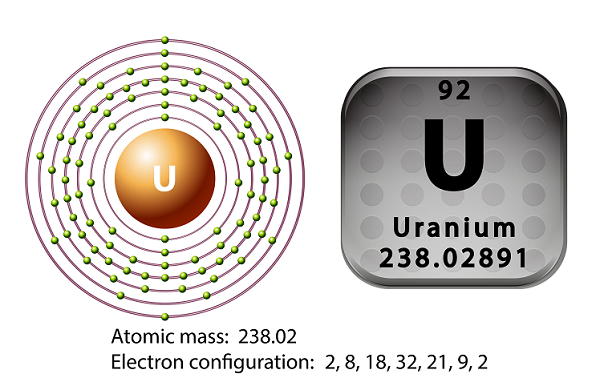
1789 년에 Martin Heinrich Klaproth는 우라늄 원소를 발견하고 천왕성의 이름을 따서 명명했습니다.
우라늄의 두드러진 특징
우라늄은 은백색 금속입니다.
우라늄 원자는 92 개의 전자와 92 개의 양성자를 가지고 있으며, 그중 6 개는 원자가 전자입니다.
불안정한 동위 원소를 가지고 있기 때문에 우라늄은 약한 방사성 원소입니다.
우라늄 -238은 우라늄의 가장 흔한 동위 원소입니다.
우라늄은 자연적으로 매우 낮은 농도, 즉 암석, 토양 및 물에서 수 백만 분율로 발생합니다.
우라늄은 알파 입자를 방출하여 서서히 (천천히) 붕괴됩니다.
우라늄은 전기 전도도가 좋지 않습니다 (전기 전도도가 좋지 않음).
우라늄은 가단성, 연성 및 약간의 상자성입니다.
우라늄의 발생
우라늄은 (자연적으로) 우라늄 -238, 우라늄 -235 및 우라늄 -234로 발견됩니다.
우라늄 -238의 반감기는 지구 나이의 거의 44 억 7 천만년이고 우라늄 -235의 반감기는 약 7 억 4 천만년입니다.
우라늄 합금
다음은 우라늄의 주요 합금입니다-
Staballoy
수소화 우라늄
우라늄 화합물
다음은 우라늄의 주요 화합물입니다-
우라늄 질화물 - U 2 N 3
우라늄 불화 - UF (5)
우라늄 카바이드 - UC
우라 닐 불화 - UO 2 F 2
이산화 우라늄 - UO 2
우라늄 헥사 플루오 라이드 - UF 6
Triuranium oxtoxide - U 3 O 8
우라늄 테트라 플루오 라이드 - UF 4
우라늄 삼산화 - UO 3
우라늄 테트라 - UCL 4
질산 우라 닐 - UO 2 (NO 3 ) 2
우라늄의 용도
우라늄은 핵 잠수함 (특히 군용)의 전원으로 사용됩니다.
우라늄은 핵무기 제조에 사용됩니다.
우라늄은 선박의 밸러스트로도 사용됩니다.
소개
납은 중화학 원소 (금속)로 밀도가 높습니다.
납의 상징은 ‘Pb’ 원자 번호는 ‘82.’

납은 스스로를 결합하는 경향이 있습니다. 마찬가지로 사슬, 결합, 고리 및 다면체 구조를 형성 할 수 있습니다.
납의 두드러진 특징
납은 부드럽고 가단성이있는 금속입니다. 녹는 점이 비교적 낮습니다.
납은 상대적으로 반응이없는 원소이며 언약 적 유대를 형성하는 경향이 있습니다.
납을 자르면 청백색으로 나타납니다.
타는 동안 납은 청백색 불꽃을냅니다 (아래 이미지 참조).

납 화합물은 일반적으로 +2 산화 상태에서 발견됩니다.
납의 발생
납은 서아시아의 선사 시대 사람들에게 알려져 있습니다.
납은 지각에서 발견됩니다. 지구 깊은 곳에서는 거의 발견되지 않습니다.
납은 일반적으로 황과 함께 발견됩니다.
Galena는 주로 아연 광석에서 발견되는 주요 납 함유 광물입니다.
납 합금
다음은 납의 주요 합금입니다-
몰 리브 도찰 코스 (구리)
솔더 (주석)
Terne (주석)
납 화합물
다음은 납의 주요 화합물입니다-
리드 일산화탄소 - PbO를
이산화 납 - PbO를 2
납의 사용
납은 수백 년 동안 총알을 만드는 데 사용되었습니다.
납은 일반적으로 수중 케이블의 보호 덮개로 사용됩니다 (내식성이 있기 때문에).
납 시트는 특히 지붕 재료의 건축용 금속으로도 사용됩니다.
납은 산성 배터리에도 사용됩니다.
납 화합물은 일반적으로 착색제 및 반도체로 사용됩니다.
납 화합물은 플라스틱, 양초, 유리 등에 사용됩니다.
납은 일반적으로 폴리 염화 비닐에 사용됩니다 (즉, 전기 코드 코팅에 사용됨).
예방법
신체에 납의 존재 (과도한 품질)는 뇌와 신장에 심각한 손상을 줄 수 있습니다. 마지막으로 죽음을 초래할 수도 있습니다.
소개
토륨은 자연적으로 대량으로 발생하는 방사성 액티 나이드 금속 중 하나입니다.
토륨의 상징은 ‘Th’ 원자 번호는 ’90.’

1829 년 노르웨이 광물 학자 Morten Thrane Esmark가 처음으로 토륨을 발견했습니다.
스웨덴 화학자 인 Jöns Jacob Berzelius는 북유럽 천둥의 신인 '토르'의 이름을 따서 '토륨'이라는 이름을 붙였습니다.
토륨의 두드러진 특징
토륨은 상자성이며 부드러운 방사성 액티 나이드 금속입니다.
토륨 금속의 색상은 은빛입니다. 공기에 노출되면 검게 변색되어 이산화물을 형성합니다.
토륨의 모든 동위 원소는 불안정하고 약한 방사성 원소입니다.
모든 중요한 방사성 원소 중에서 토륨의 반감기가 가장 길다. 즉 약 140 억 5 천만년이다.
토륨의 융점은 1750에 관한 것입니다 0 C.
토륨의 발생
토륨은 지구가 형성되기 전부터 현재의 형태로 존재했던 원시 원소입니다.
지각에서 발견되는 토륨은 모나자이트 모래에서 정제됩니다.
전 세계적으로 대량으로 발생하는 모나자이트는 토륨의 가장 중요한 공급원입니다.
토륨 합금
Mag-Thor 및 thorium-aluminum은 토륨, 마그네슘 및 알루미늄의 가장 중요한 합금입니다.
토륨 화합물
다음은 토륨의 주요 화합물입니다-
토륨 이산화 - 상점 2
토륨 (IV) 설파이드 - THS 2
토륨 (IV) 요오드 - 티 4
토륨 테트라 플루오 라이드 - THF 4
토륨 (IV 클로라이드 - ThCl 4
토륨 (IV) 탄화물 - THC
다른 일부는-
Thorite
질산 토륨 (IV)
토륨 (IV) 오르토 실리케이트
토륨의 용도
토륨은 일반적으로 가스 텅스텐 아크 용접 (GTAW)에 사용됩니다. 그 이유는 토륨 (토륨)이 텅스텐 전극의 고온 강도를 높여 아크 안정성을 향상시키기 때문입니다.
전자 장비에서 텅스텐 와이어에 토륨 코팅을 적용하면 가열 된 음극의 전자 방출이 증가합니다.
화학 산업에서 토륨의 이산화물 즉 ‘thoria’ 일반적으로 사용됩니다.
소개
주기율표에서 수소는 가장 가벼운 원소이며 원자량은 1.008에 불과합니다.
수소의 상징은 ‘H’ 그리고 원자 번호는 ‘1.’

초기 16 일 세기, 수소 가스는 제 인위적 산과 금속의 반응에 의해 제조 하였다.
Henry Cavendish는 1766-81 년에 수소 가스가 불에 타면 물을 생성하기 때문에 불연속 물질로 처음 인식했습니다.
수소의 두드러진 특징
플라즈마 상태에서 잔존하지 않는 별은 주로 수소로 구성됩니다.
표준 온도 및 압력에서 수소는 무색, 무미, 무취, 비금속, 무독성, 고 가연성 이원자 가스로 나타납니다.
수소의 분자식은 H 2 입니다.
지구상에서 수소는 물 또는 기타 유기 화합물과 같은 분자 형태로 존재합니다.
수소는 또한 산-염기 반응에서 중요한 역할을합니다.
수소 가스는 공기 중에 가연성이 높습니다.
순수한 수소-산소 불꽃은 자외선을 방출합니다. 또한 높은 산소 혼합으로 육안으로는 거의 보이지 않습니다.
수소는 거의 모든 산화 요소와 반응 할 수 있습니다.
실온에서 수소는 일반적으로 염소 및 불소와 자발적이고 악의적으로 반응하여 상응하는 할로겐화 수소를 형성합니다.
수소 발생
모든 baryonic 질량의 약 75 %로 구성된 수소는 우주에서 가장 풍부하게 발견되는 화학적 존재입니다.
우주 전체에서 수소는 일반적으로 원자 및 플라즈마 상태에서 발견됩니다. 그러나 분자 수소의 특성과는 매우 다릅니다.
지구상에서 수소는 이원자 가스, 즉 H 2 로 존재합니다 .
무게가 가볍기 때문에 수소는 지구 대기에서 쉽게 빠져 나갑니다.
수소는 지구 표면에서 세 번째로 가장 풍부한 원소이지만, 주로 탄화수소와 물의 형태로 발견됩니다.
수소 화합물
다음은 수소의 주요 화합물입니다-
물 - H 2 O
암모니아 - NH 3
염화수소 - 염산
불화 수소 - HF
황화수소 - H 2 S
메탄 - CH 4
수산화 - OH -
브롬화 수소 - HBr로
요오드화 수소 - HI
시안화 수소 - HCN
포스 - PH 3
셀렌 화수소 - H 2 괜찮다
메탄올 - CH 3 OH
리튬 수소 - LiH에
중탄산염 - HCO 3
수소 텔루 라이드 - H 2 테
액체 수소 - H 2
시안 - CN
칼슘 수소 - CAH 2
중수 - D 2 O
디보 란 - B 2 H 6
나트륨 수소 - 에 NaH
칼륨 수소 - KH
수소의 용도
가장 많은 양의 H 2 는 암모니아 생산뿐만 아니라 화석 연료 가공에도 사용됩니다.
수소 (H 2 )는 석유 및 화학 산업에서 광범위하게 사용됩니다.
H 2 는 일반적으로 특히 불포화 지방과 오일의 포화 수준을 높이는 데 수소화 제로 사용됩니다.
H 2 는 원자 수소 용접 등과 같은 용접 절차에서 차폐 가스로도 사용됩니다.
소개
헬륨은 우주에서 두 번째로 가볍고 (수소 다음으로) 두 번째로 풍부한 원소입니다.
헬륨의 상징은 ‘He’ 원자 번호는 ‘2.’

주기율표에서 헬륨은 희가스 그룹에서 첫 번째입니다.
헬륨은 그리스 태양신의 이름을 따서 명명되었습니다.Helios. '
헬륨의 두드러진 특징
헬륨은 무색, 무취, 무미, 불활성, 무독성, 단원 자 가스입니다.
헬륨 의 비등점 (-268.9 0 C)은 모든 원소 중에서 가장 낮습니다.
헬륨은 일반적으로 원자 궤도에서 두 개의 전자로 구성되며 두 개의 양성자와 두 개의 중성자로 구성된 핵으로 둘러싸여 있습니다.
헬륨의 발생
우주에서 발견되는 대부분의 헬륨은 helium-4, 그리고 그것은 빅뱅 동안 형성된 것으로 믿어집니다.
새로운 헬륨의 주요 부분은 일반적으로 태양을 포함한 별에서 수소의 핵융합에 의해 생성됩니다.
새로운 헬륨이 지속적으로 생성되지만 그럼에도 불구하고 지구상에서 헬륨의 가용성은 매우 낮습니다. 왜냐하면 경량 요소이기 때문에 쉽게 우주로 빠져 나가기 때문입니다.
지구의 이종권 (외부 대기)에서 헬륨은 가장 많이 발견되는 원소 (가스) 중 하나입니다.
지각에서 헬륨은 우라늄과 토륨의 광물에서 다량으로 발견되는 특징이 있습니다.
헬륨 화합물
다음은 헬륨의 주요 화합물입니다-
나트륨 helide - 나 둘 그는
크리스토 그는 II (규산염) - 그런가 2 그는
Dihelium arsenolite - As 4 O 6 • 2He
헬륨의 동위 원소
약 9 개의 알려진 헬륨 동위 원소가 있지만 다음 두 개가 가장 안정적인 동위 원소입니다.
헬륨 -3 및
Helium-4
헬륨의 용도
낮은 밀도, 낮은 끓는점, 낮은 용해도, 높은 열전도율 때문에 헬륨은 널리 사용되는 요소입니다. 가장 인기있는 예는 – 풍선에 헬륨을 사용하는 것입니다.
주요 헬륨 덩어리에는 의료용 MRI 스캐너 및 NMR 분광계에 사용되는 초전도 자석 냉각과 같은 극저온 응용 분야가 있습니다.
헬륨은 성장하는 실리콘 및 게르마늄 결정의 보호 가스로도 사용됩니다.
헬륨은 가스 크로마토 그래피와 티타늄 및 지르코늄 생산에도 사용됩니다.
헬륨은 초음속 풍동에서 사용됩니다.
헬륨은 아크 용접 공정에서 차폐 가스로도 적용됩니다.
소개
산소는 주기율표에서 그룹 16의 구성원입니다. 그러나 대부분의 경우 그룹과 다르게 취급됩니다.
산소의 상징은 ‘O’ 원자 번호는 ‘8.’

산소에는 약 9 개의 동소체가 있으며 가장 일반적인 동소체는 이원자 산소 (즉, O 2 )입니다. 다른 중요한 동소체는 오존 즉 O 3 입니다.
스웨덴 약사 Carl Wilhelm Scheele이 처음으로 산소를 발견했습니다.
산소의 두드러진 특징
산소는 "칼 코겐"그룹의 구성원으로 특징적으로 분류됩니다.
"chalcogen"이라는 단어는 그리스어 "khalkόs, "는"구리 "를 의미하고 라틴 그리스어 단어"Genēs, "는 태어나거나 생산됨을 의미합니다.
산소는 반응성이 높은 가스 (또는 비금속 원소)입니다. 따라서 대부분의 원소 및 화합물과 함께 산화물을 쉽게 형성하는 산화제입니다.
산소에는 6 개의 원자가 전자가 있습니다.
산소의 녹는 점은 -218.8 인 0 C 및 비점이 -183이고 0 C.
산소 발생
약 20.8 % (지구의 전체 대기 구성 요소 중)를 차지하는 산소는 지구 대기의 두 번째 요소입니다.
산소는 대기, 수권 및 암석권과 같은 지구의 거의 영역에서 발생합니다.
광합성 과정에서 모든 녹색 식물은 자유 산소를 생성합니다.
산소는 구성 구리 광석으로 발생합니다.
인체에는 약 65 %의 산소가 포함되어 있습니다.
질량으로 볼 때 지각의 거의 절반은 산소 (즉, 산화물)로 구성되어 있습니다.
질량으로 볼 때 산소는 우주에서 발견 된 세 번째로 풍부한 원소입니다. 첫 번째와 두 번째는 수소와 헬륨입니다.
산소 (즉, O 2 )는 무색 무취의 이원자 가스입니다.
산소는 물에 아주 쉽게 용해됩니다. 그러나 물에서 산소의 용해도는 온도에 따라 다릅니다.
산소 화합물
다음은 산소의 주요 화합물입니다-
Oxide
Peroxide
이산화탄소 - CO 2
수산화 - OH -
오존 - O 3
수은 (II) 산화물 - HGO
염소 산염 - C10의 3
알루미늄 산화물 - 알 2 O 3
일산화탄소 - CO
하이포 아 염소산 - C10의 -
이산화 규소 - 그런가 2
하이포 플루오로 산 - HOF
나트륨 과산화 - 나 2 O 2
염소산 칼륨 - KClO 3
산소 디 플루오 라이드 - 의 2
산화 나트륨 - 나 2 O
산소의 사용
산소 (O 2 )는 호흡을위한 가장 필수적인 요구 사항입니다. 산소 가 없으면 생명을 상상할 수 없습니다.
산소는 의학에 사용됩니다.
산소 요법은 일반적으로 폐기종, 폐렴, 일부 심장 질환 등과 같은 일부 질병을 치료하는 데 사용됩니다.
스쿠버 다이빙, 잠수함 등과 같은 수중 활동 중 일부는 인공 산소를 사용합니다.

항공기, 등산가 등도 인공 산소를 사용합니다.
산소는 또한 철광석을 철강으로 제련하는 등 일부 산업에서 사용됩니다.이 공정에서는 약 55 %의 산소가 사용됩니다.
소개
탄소는 비금속 및 4가 원소입니다.
4가 수단 – 탄소는 공유 화학 결합을 형성하기 위해 4 개의 전자를 사용할 수 있도록합니다.
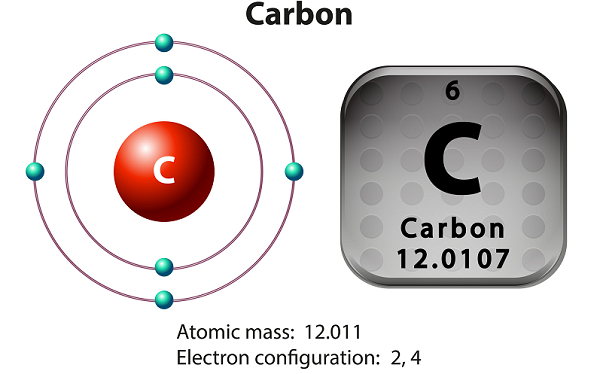
즉 - 탄소 자연적 세 동위 갖는다 12 C, 13 C 및 14 C.을
그 중에서도, 12 C 및 13 C는 안정하지만 14 C는 방사성 동위 원소이다. 의 반감기 (14) C는 5천7백30년에 관한 것입니다.
탄소의 두드러진 특징
탄소의 물리적 특성은 동소체에 크게 의존합니다.
탄소의 주요 동소체는 흑연, 다이아몬드 및 비정질 탄소입니다.
흑연은 불투명하고 검은 색이며 매우 부드럽습니다. 따라서 종이에 줄무늬를 형성하는 데 사용되었습니다.
다이아몬드는 매우 단단하고 (자연적으로 발생하는 가장 단단한 물질) 투명합니다.
흑연은 좋은 전기 전도체입니다.
다이아몬드는 나쁜 전기 전도체입니다.
탄소는 모든 원소 중에서 가장 높은 승화 점을 가지고 있습니다.
탄소 발생
질량 측면에서 탄소는 (수소, 헬륨 및 산소 다음으로) 우주에서 발견되는 네 번째로 풍부한 화학 원소입니다.
탄소는 태양, 별, 혜성 및 대부분의 행성 대기에서 풍부하게 이용할 수 있습니다.
탄소는 지구 대기에서 발견되며 물에 용해됩니다.
석탄, 석유 및 천연 가스와 같은 탄화수소에는 모두 탄소가 포함되어 있습니다.
탄소는 극지방과 해저에서 발견되는 메탄 수화물에서도 발견됩니다.
탄소가 풍부한 암석 중 일부는 석탄, 석회암, 백운석 등입니다.
석탄은 탄소가 매우 풍부합니다. 따라서 미네랄 탄소의 가장 큰 상업적 공급원입니다.
석탄은 총 화석 연료의 약 4,000 기가 톤 또는 80 %를 공유합니다.
탄소 화합물
다음은 탄소의 주요 화합물입니다-
시안 - CN 2
시안화 수소 - HCN
시안 아미드 - CN 2 H 2
사이 안산 - HNCO
시안 염화 - CNCL
클로로 술 포닐 이소시아네이트 - CNClO 3 S
염화 시아 누르 - NCCl 3
이황화 탄소 - CS 2
황화 카르 보닐 - OCS
Carbon monosulfide - CS
Uses of Carbon
Depending upon the allotrops, carbon is used in range of applications.
Carbon is one of the most essential elements of life without it, we cannot imagine life on the earth.
The fossil fuel namely methane gas and crude oil (petroleum), coal etc. are used in everyday life.
Graphite, combining with clay, used in making 'lead' used in pencils.
Charcoal is also used as a drawing material in artwork, iron smelting, barbecue grilling, etc.
Diamond is usually used in jewelry.
Industrial diamonds are used in cutting, drilling, and polishing tools for machining the metals and stone.
Fossil hydrocarbons, and carbon fiber are used in making plastic.
Introduction
Nitrogen is a chemical element of group of 15 of the periodic table; among all the elements of group 15, it is the lightest element.
The symbol of nitrogen is ‘N’ and atomic number is 7.

In 1772, Scottish physician Daniel Rutherford, first discovered and isolated carbon.
However, the name ‘nitrogen’ was first given by Jean-Antoine-Claude Chaptal in 1790.
Salient Features of Nitrogen
Nitrogen has two stable isotopes namely 14N and 15N.
Free nitrogen atoms normally easily react with most of the elements and form nitrides.
The molecules of N2 is colorless, odorless, tasteless, and diamagnetic gas at standard conditions.
The melting point of N2 is −2100C and the boiling point is −1960C.
Nitrogen compounds repetitively interchange between the atmosphere and living organisms, making a nitrogen cycle.
Occurrence of Nitrogen
Nitrogen is most abundantly found element on the earth, as it constitutes about 78.1% of the entire volume of the earth’s atmosphere.
Nitrogen gas, which is an industrial gas, largely produced by the fractional distillation of liquid air.
Compounds of Nitrogen
Following are the major compounds of Nitrogen −
Ammonium - NH4+
Ammonia - NH3
Nitric acid - HNO3
Nitrite - NO2-
Nitrogen dioxide - NO2
Dinitrogen pentroxide - N2O5
Hydrazine - N2H4
Dinitrogen - N2
Cyanide - CN
Ammonium nitrate - (NH4)(NO3)
Nitrogen trichloride - NCl3
Nitrogen trifluoride - NF3
Nitrogen triiodide - NI3
Pyridine - C5H5N
Nitronium ion - NO2+
Hydrazoic acid - HN3
Ammonium sulfate - (NH4)2SO4
Uses of Nitrogen
Nitrogen compounds are extensively used in wide range of fields and industries.
Pure nitrogen is used as food additive.
Used in fire suppression systems especially for the information technology equipment.
Also used in manufacturing stainless steel.
Nitrogen is also used to inflate the tires of some of the aircraft and race cars.
Liquid nitrogen is used as a refrigerant.
The laws of nature related to chemistry is known as chemical laws.
Chemical reactions, normally, are administrated by certain laws, which are observed and formulated in words become fundamental concepts in chemistry.
Following are the significant chemical laws −
| Laws | Explanation |
|---|---|
| Avogadro's Law | “Equal volumes of all gases, at the same temperature and pressure, have the same number of molecules” |
| Beer–Lambert law, (or simply Beer's law or Lambert–Beer law) | “Explains the attenuation of light to the properties of the material through which it (light) passes” |
| Boyle's Law | “The absolute pressure exerted by a given mass of an ideal gas is inversely proportional to the volume it occupies if the temperature and amount of gas remain unchanged within a closed system” |
| Charles' Law (also known as Law of Volume) | “When the pressure on a sample of a dry gas is held constant, the Kelvin temperature and the volume will be directly related” |
| Fick's Laws of Diffusion | Describes “diffusion” (of flux) |
| Gay-Lussac's Law | "All gases have the same mean thermal expansivity at constant pressure over the same range of temperature" |
| Le Chatelier's Principle ("The Equilibrium Law") | “When any system at equilibrium is subjected to change in concentration, temperature, volume, or pressure, then the system readjusts itself to counteract (partially) the effect of the applied change and a new equilibrium is established” |
| Henry's Law | “The law calculates the concentration of gas in the solution under pressure” |
| Hess's Law | “The change of enthalpy in a chemical reaction (it means, the heat of reaction at constant pressure) is independent of the pathway between the initial and final states” |
| Law of conservation of energy | “Energy can neither be created nor be destroyed” |
| Raoult's Law | “The partial vapor pressure of each component of an ideal mixture of liquids is equal to the vapor pressure of the pure component multiplied by its mole fraction in the mixture” |
| Faraday's Law Electrolysis | “The amount of substance produced at an electrode is directly proportional to the quantity of electricity passed” |
| Atomic Theory | “Matter is composed of distinct units known as atoms” |
| Köhler Theory | “Explains the process in which water vapor condenses and forms the liquid cloud drops” |
| Van 't Hoff Equation | “Describes change in the equilibrium constant of a chemical reaction” |
| Transition State Theory | “The reaction rates of elementary chemical reactions” |
| Grotthuss–Draper Law | “It describes that the light which is absorbed by a system/surface can bring a photochemical change” |
| Kinetic Theory of Gases | “Describes the behavior of a hypothetical ideal gas” |
| Aufbau Principle | “Explains that the electrons orbiting the atoms first fill the lowest energy levels and then second higher levels and so on and so forth” |
| Hund's Rule | “ Explains that every orbital in a sublevel is singly occupied before any orbital is doubly occupied” |
| Collision Theory | “Based on the kinetic theory of gases, collision theory describes that the gas-phase chemical reactions occur when molecules collide with sufficient kinetic energy” |
Introduction
Most likely copper was the first element, which was mined and used by humans.
The evidence of earliest use of copper was found in Anatolia, which belongs to 6,000 BCE.
The lead was most likely the second element that humans start using.
The oldest known artifact of lead is statuette, which was found in a temple of Osiris, Abydos, Egypt.
The statuette of Osiris temple belongs to (about) 3,800 BCE.
The oldest known gold treasure was discovered in Varna, Necropolis (Bulgaria).
This gold treasure belongs to (about) 4,400 BCE.
Discovery of silver is almost same as of gold; its evidence was found in Asia Minor.
Some evidence say that the iron was known from (about) 5,000 BCE.
The oldest known iron objects, which was used by the humans, were found in Egypt (belongs to 4000 BCE).
The following table illustrates the significant elements with their discovery date and discovers −
| Element | Discoverer | Discovery Date |
|---|---|---|
| Copper | Middle East (Place) | About 9,000 BCE |
| Lead | Egypt (Place) | About 7,000 BCE |
| Gold | Bulgaria (Place) | About 6,000 BCE |
| Silver | Asia Minor (Place) | About 5,000 BCE |
| Iron | Egypt (Place) | About 5,000 BCE |
| Tin | About 3,500 BCE | |
| Sulfur | Chinese/India | About 2,000 BCE |
| Mercury | Egypt | 2,000 BCE |
| Phosphorus | H. Brand | 1669 |
| Cobalt | G. Brandt | 1735 |
| Platinum | A. de Ulloa | 1748 |
| Nickel | F. Cronstedt | 1751 |
| Bismuth | C.F. Geoffroy | 1753 |
| Magnesium | J. Black | 1755 |
| Hydrogen | H. Cavendish | 1766 |
| Oxygen | W. Scheele | 1771 |
| Nitrogen | D. Rutherford | 1772 |
| Barium | W. Scheele | 1772 |
| Chlorine | W. Scheele | 1774 |
| Manganese | W. Scheele | 1774 |
| Molybdenum | W. Scheele | 1781 |
| Tungsten | W. Scheele | 1781 |
| Zirconium | H. Klaproth | 1789 |
| Uranium | H. Klaproth | 1789 |
| Titanium | W. Gregor | 1791 |
| Chromium | N. Vauquelin | 1797 |
| Beryllium | N. Vauquelin | 1798 |
| Vanadium | M. del Río | 1801 |
| Potassium | H. Davy | 1807 |
| Sodium | H. Davy | 1807 |
| Calcium | H. Davy | 1808 |
| Boron | L. Gay-Lussac and L.J. Thénard | 1808 |
| Fluorine | A. M. Ampère | 1810 |
| Iodine | B. Courtois | 1811 |
| Lithium | A. Arfwedson | 1817 |
| Cadmium | S. L Hermann, F. Stromeyer, and J.C.H. Roloff | 1817 |
| Selenium | J. Berzelius and G. Gahn | 1817 |
| Silicon | J. Berzelius | 1823 |
| Aluminium | H.C.Ørsted | 1825 |
| Bromine | J. Balard and C. Löwig | 1825 |
| Thorium | J. Berzelius | 1829 |
| Lanthanum | G. Mosander | 1838 |
| Rubidium | R. Bunsen and G. R. Kirchhoff | 1861 |
| Thallium | W. Crookes | 1861 |
| Indium | F. Reich and T. Richter | 1863 |
| Helium | P. Janssen and N. Lockyer | 1868 |
| Neon | W. Ramsay and W. Travers | 1898 |
| Xenon | W. Ramsay and W. Travers | 1898 |
| Fermium | A. Ghiorso et al | 1952 |
| Nobelium | E. D. Donets, V. A. Shchegolev and V. A. Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris and P. Eskola | 1970 |
| Tennessine | Y. Oganessian et al | 2010 |
The following table illustrates significant elements and their valence −
| Element | Valence | Symbol | Atomic No. |
|---|---|---|---|
| Hydrogen | -1, +1 | H | 1 |
| Helium | 0 | He | 2 |
| Lithium | 1 | Li | 3 |
| Beryllium | 2 | Be | 4 |
| Boron | 3, 2, 1 | B | 5 |
| Carbon | -1, -2, -4, 4, 3, 2, 1, | C | 6 |
| Nitrogen | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Oxygen | -1, -2, 0, 2, 1, | O | 8 |
| Fluorine | -1, 0 | F | 9 |
| Neon | 0 | Ne | 10 |
| Sodium | -1, 1 | Na | 11 |
| Magnesium | 2 | Mg | 12 |
| Aluminum | 3, 1 | Al | 13 |
| Silicon | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Phosphorus | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P | 15 |
| Sulfur | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlorine | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potassium | -1, 1 | K | 19 |
| Calcium | 2 | Ca | 20 |
| Scandium | 3, 2, 1 | Sc | 21 |
| Titanium | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Vanadium | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chromium | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Manganese | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Iron | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Cobalt | -1, 0, 5, 4, 3, 2, 1 | Co | 27 |
| Nickel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Copper | 4, 3, 2, 1, 0 | Cu | 29 |
| Zinc | 2, 1, 0 | Zn | 30 |
| Gallium | 3, 2, 1 | Ga | 31 |
| Germanium | 4, 3, 2, 1 | Ge | 32 |
| Arsenic | -3, 5, 3, 2, | As | 33 |
| Selenium | -2, 6, 4, 2, 1 | Se | 34 |
| Bromine | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubidium | -1, 1 | Rb | 37 |
| Strontium | 2 | Sr | 38 |
| Yttrium | 3, 2 | Y | 39 |
| Zirconium | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niobium | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molybdenum | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technetium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruthenium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rhodium | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Palladium | 4, 2, 0 | Pd | 46 |
| Silver | 3, 2, 1, 0 | Ag | 47 |
| Cadmium | 2, 1 | Cd | 48 |
| Indium | 3, 2, 1 | In | 49 |
| Tin | -4, 4, 2 | Sn | 50 |
| Antimony | -3, 5, 3 | Sb | 51 |
| Tellurium | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Iodine | -1, 0, 7, 5, 3, 1 | I | 53 |
| Xenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cesium | -1, 1 | Cs | 55 |
| Barium | 2 | Ba | 56 |
| Lanthanum | 3, 2 | La | 57 |
| Cerium | 4, 3, 2 | Ce | 58 |
| Praseodymium | 4, 3, 2 | Pr | 59 |
| Neodymium | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Pm | 61 |
| Samarium | 3, 2 | Sm | 62 |
| Europium | 3, 2 | Eu | 63 |
| Gadolinium | 3, 2, 1 | Gd | 64 |
| Terbium | 4, 3, 1 | Tb | 65 |
| Dysprosium | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erbium | 3 | Er | 68 |
| Thulium | 3, 2 | Tm | 69 |
| Ytterbium | 3, 2 | Yb | 70 |
| Lutetium | 3 | Lu | 71 |
| Hafnium | 4, 3, 2, 1 | Hf | 72 |
| Tantalum | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Tungsten | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W | 74 |
| Rhenium | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osmium | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platinum | 6, 5, 4, 2, 0 | Pt | 78 |
| Gold | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Mercury | 2, 1 | Hg | 80 |
| Thallium | 3, 1 | Tl | 81 |
| Lead | 4, 2 | Pb | 82 |
| Bismuth | -3, 5, 3, 1 | Bi | 83 |
| Polonium | -2, 6, 4, 2 | Po | 84 |
| Astatine | -1, 7, 5, 3, 1 | At | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Fr | 87 |
| Radium | 2 | Ra | 88 |
| Actinium | 3 | Ac | 89 |
| Thorium | 4, 3, 2 | Th | 90 |
| Protactinium | 5, 4, 3 | Pa | 91 |
| Uranium | 6, 5, 4, 3, 2 | U | 92 |
| Neptunium | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Plutonium | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Americium | 7, 6, 5, 4, 3, 2 | Am | 95 |
Atomic number defines the number of protons found in nucleus of an element.
The total number of protons and neutrons (found in nucleus) is calculated as the atomic mass number.
The following table illustrates the some of the significant elements with their atomic number, atomic mass, and symbols −
| Element | Atomic Number | Atomic Mass (g mol-1) | Symbol |
|---|---|---|---|
| Hydrogen | 1 | 1.0079 | H |
| Helium | 2 | 4.00 | He |
| Lithium | 3 | 6.94 | Li |
| Beryllium | 4 | 9.01 | Be |
| Boron | 5 | 10.81 | B |
| Carbon | 6 | 12.01 | C |
| Nitrogen | 7 | 14.0067 | N |
| Oxygen | 8 | 16.00 | O |
| Fluorine | 9 | 19.00 | F |
| Neon | 10 | 20.1797 | Ne |
| Sodium | 11 | 22.989768 | Na |
| Magnesium | 12 | 24.3050 | Mg |
| Aluminum | 13 | 26.981539 | Al |
| Silicon | 14 | 28.0855 | Si |
| Phosphorus | 15 | 30.973762 | P |
| Sulfur | 16 | 32.066 | S |
| Chlorine | 17 | 35.4527 | Cl |
| Argon | 18 | 39.948 | Ar |
| Potassium | 19 | 39.0983 | K |
| Calcium | 20 | 40.078 | Ca |
| Scandlum | 21 | 44.955910 | Sc |
| Titanium | 22 | 47.867 | Ti |
| Vanadium | 23 | 50.9415 | V |
| Chromium | 24 | 51.9961 | Cr |
| Manganese | 25 | 54.93805 | Mn |
| Iron | 26 | 55.845 | Fe |
| Cobalt | 27 | 58.93320 | Co |
| Nickel | 28 | 58.6934 | Ni |
| Copper | 29 | 63.546 | Cu |
| Zinc | 30 | 65.39 | Zn |
| Gallium | 31 | 69.723 | Ga |
| Germanium | 32 | 72.61 | Ge |
| Arsenic | 33 | 74.92159 | As |
| Selenium | 34 | 78.96 | Se |
| Bromine | 35 | 79.904 | Br |
| Krypton | 36 | 83.80 | Kr |
| Rubidium | 37 | 85.4678 | Rb |
| Strontium | 38 | 87.62 | Sr |
| Yttrium | 39 | 88.90585 | Y |
| Zirconium | 40 | 91.224 | Zr |
| Niobium | 41 | 92.90638 | Nb |
| Molybdenum | 42 | 95.94 | Mo |
| Technetium | 43 | 97.9072 | Te |
| Ruthenium | 44 | 101.07 | Ru |
| Rhodium | 45 | 102.90550 | Rh |
| Palladium | 46 | 106.42 | Pd |
| Silver | 47 | 107.8682 | Ag |
| Cadmium | 48 | 112.411 | Cd |
| Indium | 49 | 114.818 | In |
| Tin | 50 | 118.710 | Sn |
| Antimony | 51 | 121.760 | Sb |
| Tellurium | 52 | 127.60 | Te |
| Iodine | 53 | 126.90447 | I |
| Xenon | 54 | 131.29 | Xe |
| Cesium | 55 | 132.90543 | Cs |
| Barium | 56 | 137.327 | Ba |
| Lanthanum | 57 | 138.9055 | La |
| Cerium | 58 | 140.115 | Ce |
| Praseodymium | 59 | 140.90765 | Pr |
| Neodymium | 60 | 144.24 | Nd |
| Promethium | 61 | 144.9127 | Pm |
| Samarium | 62 | 150.36 | Sm |
| Europium | 63 | 151.965 | Eu |
| Gadolinium | 64 | 157.25 | Gd |
| Terbium | 65 | 158.92534 | Tb |
| Dysprosium | 66 | 162.50 | Dy |
| Holmium | 67 | 164.93032 | Ho |
| Erbium | 68 | 167.26 | Er |
| Thulium | 69 | 168.93421 | Tm |
| Ytterbium | 70 | 173.04 | Yb |
| Lutetium | 71 | 174.967 | Lu |
| Hafnium | 72 | 178.49 | Hf |
| Tantalum | 73 | 180.9479 | Ta |
| Tungsten | 74 | 183.84 | W |
| Rhenium | 75 | 186.207 | Re |
| Osmium | 76 | 190.23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platinum | 78 | 195.08 | Pt |
| Gold | 79 | 196.96654 | Au |
| Mercury | 80 | 200.59 | Hg |
| Thallium | 81 | 204.3833 | Tl |
| Lead | 82 | 207.2 | Pb |
| Bismuth | 83 | 208.98037 | Bi |
| Polonium | 84 | 208.9824 | Po |
| Astatine | 85 | 209.9871 | At |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Fr |
| Radium | 88 | 226.0254 | Ra |
| Actinium | 89 | 227.0278 | Ac |
| Thorium | 90 | 232.0381 | Th |
| Protactinium | 91 | 231.0388 | Pa |
| Uranium | 92 | 238.0289 | U |
| Neptunium | 93 | 237.0482 | Np |
| Plutonium | 94 | 244.0642 | Pu |
| Americium | 95 | 243.0614 | Am |
| Curium | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Californium | 98 | 251.0796 | Cf |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258.10 | Md |
| Nobelium | 102 | 259.1009 | No |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263.118* | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (a scientist of the Netherlands) was the first person who received the Nobel Prize in Chemistry in 1901.
Jacobus Henricus received the Nobel award for his work namely ‘the laws of chemical dynamics and osmotic pressure in solutions.’
Starting from the 1901 to 2016, total 174 scientists (of chemistry) have been received the Nobel Prize.
By the time, four women have been received the Nobel Prize in chemistry.
Marie Curie was the first lady who received the Nobel Prize in chemistry.
The following table illustrates the name of individuals who received Nobel Prize in chemistry along with their work (for which they received the Prize) −
| Name | Country (year) | Work/Area |
|---|---|---|
| Svante August Arrhenius | Sweden (1903) | Electrolytic theory of dissociation |
| Sir William Ramsay | UK (1904) | Discovery of the inert gaseous elements in air |
| Ernest Rutherford | UK/New Zealand (1908) | Chemistry of radioactive substances |
| Maria Skłodowska-Curie | Poland/France (1911) | Discovery of the elements radium and polonium |
| Alfred Werner | Switzerland (1913) | Linkage of atoms in molecules |
| Theodore William Richards | US (1914) | Determinations of the atomic weight |
| Walter Norman Haworth | UK (1937) | Investigations on carbohydrates and vitamin C |
| Paul Karrer | Switzerland (1937) | investigations on carotenoids, flavins and vitamins A and B2 |
| Adolf Friedrich Johann Butenandt | Germany (1939) | Work on sex hormones |
| Otto Hahn | Germany (1944) | Discovery of the fission of heavy nuclei |
| John Howard Northrop & Wendell Meredith Stanley | US (1946) | Preparation of enzymes and virus proteins in a pure form |
| Vincent du Vigneaud | US (1955) | First synthesis of a polypeptide hormone |
| Sir Cyril Norman Hinshelwood & Nikolay Nikolaevich Semenov | UK & Soviet Union (1956) | Mechanism of chemical reactions |
| Frederick Sanger | UK (1958) | The structure of proteins (especially insulin) |
| Willard Frank Libby | US (1960) | Method to use carbon-14 for age determination |
| Melvin Calvin | US (1961) | Carbon dioxide assimilation in plants |
| Karl Ziegler & Giulio Natta | Germany & Italy (1963) | Chemistry and technology of high polymers |
| Dorothy Crowfoot Hodgkin | UK (1964) | Determinations by X-ray techniques |
| Paul J. Flory | US (1974) | Physical chemistry of macromolecules |
| Paul Berg | US (1980) | recombinant-DNA |
| Aaron Klug | UK (1982) | Development of crystallographic electron microscopy |
| Henry Taube | US (1983) | Mechanisms of electron transfer reactions |
| Robert Bruce Merrifield | US (1984) | Methodology for chemical synthesis on a solid matrix |
| Elias James Corey | US (1990) | Methodology of organic synthesis |
| Richard R. Ernst | Switzerland (1991) | Methodology of high resolution nuclear magnetic resonance (NMR) spectroscopy |
| Kary B. Mullis | US (1993) | Polymerase chain reaction (PCR) method |
| George A. Olah | US & Hungary (1994) | Carbocation chemistry |
| Peter Agre | US (2003) | Discovery of water channels (cell membranes) |
| Roger D. Kornberg | US (2006) | Molecular basis of eukaryotic transcription |
| Gerhard Ertl | Germany (2007) | Chemical processes on solid surfaces |
| Venkatraman Ramakrishnan, Thomas A. Steitz, & Ada E. Yonath | 2009 | Structure and function of the ribosome |
| Tomas Lindahl, Paul L. Modrich, & Aziz Sancar | 2015 | DNA repair |
| Jean-Pierre Sauvage, Fraser Stoddart, & Ben Feringa | 2016 | Design and synthesis of molecular machines |