화학-탄소
소개
탄소는 비금속 및 4가 원소입니다.
4가 수단 – 탄소는 공유 화학 결합을 형성하기 위해 4 개의 전자를 사용할 수 있도록합니다.
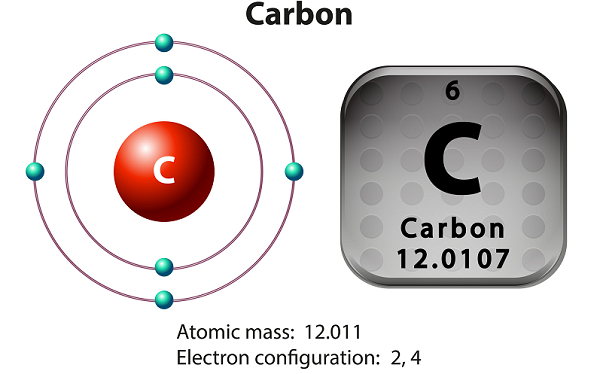
즉 - 탄소 자연적 세 동위 갖는다 12 C, 13 C 및 14 C.을
그 중에서도, 12 C 및 13 C는 안정하지만 14 C는 방사성 동위 원소이다. 의 반감기 (14) C는 5천7백30년에 관한 것입니다.
탄소의 두드러진 특징
탄소의 물리적 특성은 동소체에 크게 의존합니다.
탄소의 주요 동소체는 흑연, 다이아몬드 및 비정질 탄소입니다.
흑연은 불투명하고 검은 색이며 매우 부드럽습니다. 따라서 종이에 줄무늬를 형성하는 데 사용되었습니다.
다이아몬드는 매우 단단하고 (자연적으로 발생하는 가장 단단한 물질) 투명합니다.
흑연은 좋은 전기 전도체입니다.
다이아몬드는 나쁜 전기 전도체입니다.
탄소는 모든 원소 중에서 가장 높은 승화 점을 가지고 있습니다.
탄소 발생
질량 측면에서 탄소는 (수소, 헬륨 및 산소 다음으로) 우주에서 발견되는 네 번째로 풍부한 화학 원소입니다.
탄소는 태양, 별, 혜성 및 대부분의 행성 대기에서 풍부하게 이용할 수 있습니다.
탄소는 지구 대기에서 발견되며 물에 용해됩니다.
석탄, 석유 및 천연 가스와 같은 탄화수소에는 모두 탄소가 포함되어 있습니다.
탄소는 극지방과 해저에서 발견되는 메탄 수화물에서도 발견됩니다.
탄소가 풍부한 암석 중 일부는 석탄, 석회암, 백운석 등입니다.
석탄은 탄소가 매우 풍부합니다. 따라서 미네랄 탄소의 가장 큰 상업적 공급원입니다.
석탄은 약 4,000 기가 톤 또는 총 화석 연료의 80 %를 공유합니다.
탄소 화합물
다음은 탄소의 주요 화합물입니다-
시안 - CN 2
시안화 수소 - HCN
시안 아미드 - CN 2 H 2
사이 안산 - HNCO
시안 염화 - CNCL
클로로 술 포닐 이소시아네이트 - CNClO 3 S
염화 시아 누르 - NCCl 3
이황화 탄소 - CS 2
황화 카르 보닐 - OCS
탄소 티 우람 모노 - CS
탄소의 용도
동소체에 따라 탄소는 다양한 응용 분야에서 사용됩니다.
탄소는 그것 없이는 생명의 가장 필수적인 요소 중 하나입니다. 우리는 지구상의 생명체를 상상할 수 없습니다.
화석 연료 인 메탄 가스와 원유 (석유), 석탄 등은 일상 생활에서 사용됩니다.
점토와 결합 된 흑연은 연필에 사용되는 '납'을 만드는 데 사용됩니다.
숯은 또한 삽화, 철 제련, 바베큐 그릴 등의 그림 재료로 사용됩니다.
다이아몬드는 일반적으로 보석에 사용됩니다.
산업용 다이아몬드는 금속 및 석재 가공을위한 절단, 드릴링 및 연마 도구에 사용됩니다.
화석 탄화수소와 탄소 섬유는 플라스틱을 만드는 데 사용됩니다.