Chemia, część 2 - Krótki przewodnik
Wprowadzenie
Chemia to dziedzina nauk przyrodniczych, która bada strukturę, skład i zmieniające się właściwości materii.
Chemia bada najmniejszą część materii, tj. Atom (wraz ze wszystkimi jego właściwościami) do dużych materiałów (np. Złota, srebra, żelaza itp.) I ich właściwości.
Chemia bada również siły międzycząsteczkowe (które nadają materii ogólne właściwości) oraz interakcje między substancjami w wyniku reakcji chemicznych.

W 1998 roku profesor Raymond Chang zdefiniował chemię jako -
„Chemia” oznacza badanie materii i przemian, którym ona podlega.
Uważa się, że naukę o chemii zapoczątkowała teoria czterech elementów zaproponowana przez Arystotelesa.
Teoria czterech elementów głosi, że „ogień, powietrze, ziemia i woda były podstawowymi elementami, z których wszystko powstaje jako połączenie”.
Z powodu jego klasycznej pracy mianowicie “The Sceptical Chymist,” Robert Boyle jest znany jako ojciec założyciel chemii.
Boyle sformułował prawo, które stało się popularne jako „Prawo Boyle'a”.
Prawo Boyle'a jest eksperymentalnym prawem gazowym, które analizuje zależność między ciśnieniem gazu a objętością odpowiedniego pojemnika.
Broniąc swojego prawa Boyle odrzucił klasyczną teorię „czterech elementów”.
Amerykańscy naukowcy Linus Pauling i Gilbert N. Lewis wspólnie przedstawili elektroniczną teorię wiązań chemicznych i orbitali molekularnych.
Organizacja Narodów Zjednoczonych ogłosiła rok 2011 „Międzynarodowym Rokiem Chemii”.
Materia jest definiowana w chemii jako wszystko, co ma masę spoczynkową i objętość, a także zajmuje przestrzeń.
Plik matter składa się z cząstek.
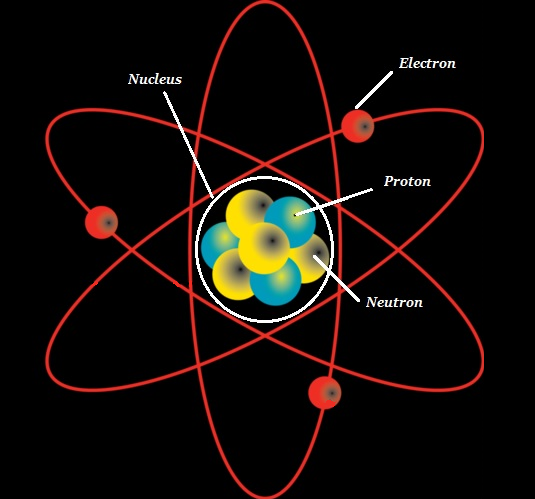
Plik atom jest podstawową jednostką chemii.
Atom składa się z gęstego rdzenia znanego jako atomic nucleus i jest otoczony przestrzenią znaną jako electron cloud.
Jądro (atomu) składa się z protons (+ve charged particles) i neutrons (neutral or uncharged particles); łącznie te dwa są znane jakonucleons (jak pokazano na obrazku podanym poniżej).
Pierwiastek chemiczny to czysta forma substancji; składa się z jednego typu atomu.
Układ okresowy jest znormalizowaną reprezentacją wszystkich dostępnych pierwiastków chemicznych.
Związek jest czystą formą substancji; składa się z więcej niż jednego elementu.
Cząsteczka jest najmniejszą niepodzielną częścią czystej substancji chemicznej; cząsteczka ma charakterystyczny zestaw właściwości chemicznych (patrz rysunek poniżej).
Poniższa tabela ilustruje gałęzie chemii -
| Gałąź | Oddział | Definicja |
|---|---|---|
| Physical Chemistry | Chemia fizyczna | Badanie właściwości fizycznych cząsteczek |
| Kinetyka chemiczna | Badanie szybkości reakcji chemicznych | |
| Elektrochemia | Badanie interakcji atomów, cząsteczek, jonów i prądu elektrycznego (tj. Transferu elektronów między elektrodą a elektrolitem lub gatunkiem) | |
| Chemia powierzchni | badanie reakcji chemicznych na powierzchniach (substancji) | |
| Termochemia | Zbadaj związek między działaniem chemicznym a ilością zaabsorbowanego ciepła | |
| Chemia kwantowa | Badanie zastosowań mechaniki kwantowej w modelach fizycznych | |
| Spektroskopia | Badanie widm światła lub promieniowania | |
| Fotochemia | badanie skutków chemicznych wywoływanych przez światło | |
| Organic Chemistry | Chemia organiczna | Badanie struktury, właściwości i przygotowania związków chemicznych (węgla) (np. Paliw, tworzyw sztucznych, dodatków do żywności, leków) |
| Stereochemia | Badanie względnego przestrzennego rozmieszczenia atomów (w cząsteczkach) | |
| Fizyczna chemia organiczna | badanie struktury i reaktywności (współzależności) w cząsteczkach organicznych | |
| Chemia polimerów | Badanie cząsteczek polimeru (skład i tworzenie) | |
| Chemia metaloorganiczna | Badanie chemikaliów zawierających wiązania (zwłaszcza między węglem a metalem) | |
| Chemia medyczna | Badanie projektowania, opracowywania i syntetyzowania leków i leków | |
| Inorganic chemistry | Chemia nieorganiczna | Badanie wszystkich materiałów nieorganicznych (takich jak minerały, metale, katalizatory, struktury krystaliczne itp.) |
| Chemia metaloorganiczna | Badanie związków chemicznych zawierających wiązania (zwłaszcza między węglem a metalem) | |
| Chemia ciała stałego | Badanie związków chemicznych zawierających wiązania między węglem a metalem | |
| Chemia jądrowa | Badanie substancji radioaktywnych | |
| Geochemia | Badanie składu chemicznego ziemi (np. Skały, minerały i atmosfera) | |
| Chemia nieorganiczna | Badanie interakcji między jonami metali a żywą tkanką | |
| Chemia koordynacyjna | ||
| Biochemistry | Biochemia | Badanie reakcji chemicznych (i zmian) w organizmach żywych |
| Biochemia molekularna | Badanie biomolekuł i ich funkcji | |
| Biochemia kliniczna | Badanie zmian chemicznych zachodzących w organizmach żywych wywołanych różnymi chorobami | |
| Biologia molekularna | Badanie różnych typów biosyntezy DNA, RNA i białek (i ich związków) | |
| Biochemia rolnicza | Badanie chemii fauny (tj. Roślin) | |
| Analytical Chemistry | Badanie znormalizowanych metod eksperymentalnych w chemii (tj. Ilościowe oznaczanie właściwości chemicznych substancji) | |
| Astrochemistry | Badanie reakcji pierwiastków i molekuł występujących we wszechświecie | |
| Cosmochemistry | Badanie składu chemicznego materii występującej we wszechświecie | |
| Environmental chemistry | Badanie zjawisk chemicznych i biochemicznych zachodzących w środowisku |
Wprowadzenie
Proces emisji cząstek z jąder z powodu niestabilności jądrowej; znana jest jako radioaktywność.
Substancja, która uwalnia taką energię / promienie, jest znana jako substancja radioaktywna.
Niewidzialne promienie uwolnione z takiej radioaktywnej substancji są znane jako promienie radioaktywne.
Podobnie radioaktywność jest zjawiskiem jądrowym, które występuje (naturalnie) z powodu jądrowej niestabilności atomów.
W 1896 roku Henri Becquerel po raz pierwszy zaobserwował zjawisko radioaktywności, ale termin „radioaktywność” został wymyślony przez Marie Curie.
Marie Curie odkryła pierwiastki radioaktywne, mianowicie polon i rad w 1898 roku.
Za swoje odkrycie Marie Curie otrzymała Nagrodę Nobla.
Promienie radioaktywne
Po długich latach eksperymentów Ernest Rutherford wraz ze swoim kolegą (Hansem Geigerem i jego uczniem Ernestem Marsdenem) odkryli promienie alfa, promienie beta i promienie gamma.
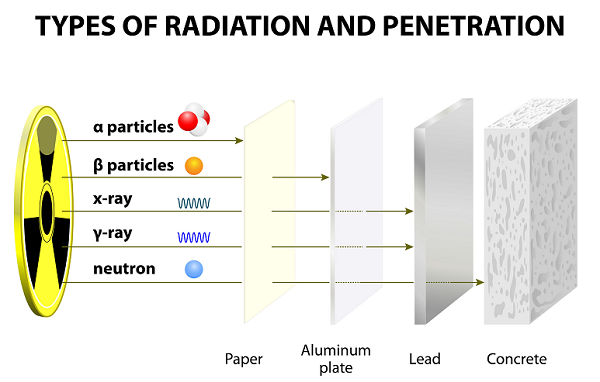
Promienie te emitowane są w wyniku rozpadu atomów.
Cząstki alfa (α)
Cząsteczki alfa zwykle składają się z dwóch protonów i dwóch neutronów, które są ze sobą ściśle związane.
Cząsteczki alfa są uwalniane podczas rozpadu radioaktywnego (lub rozpadu alfa) z radionuklidów jądra.
Cząsteczki alfa są identyczne z jądrem normalnego atomu helu lub podwójnie zjonizowanego atomu helu.
W porównaniu z innymi cząstkami (np. Gamma i Beta), cząsteczki alfa są ciężkie i wolne. Dlatego cząstki alfa mają bardzo mały zasięg w powietrzu.
Ze względu na małą prędkość cząsteczki Alfa mają bardzo słabą zdolność penetracji; cząsteczki te są nawet zatrzymywane przez cienki arkusz papieru (patrz ilustracja powyżej).
Ze względu na podwójny ładunek dodatni cząstki alfa są silnie jonizujące.
Cząsteczki beta (β)
Cząsteczki beta to szybko poruszające się elektrony emitowane przez niektóre radionuklidy podczas rozpadu radioaktywnego (znanego również jako rozpad beta).
Cząsteczki beta mają znacznie mniejszą wagę i mają jeden ładunek ujemny.
Cząsteczki beta rzadko jonizują niż cząsteczki alfa.
Ze względu na mniejszą wagę cząsteczki beta mogą podróżować znacznie dalej niż cząstki alfa; jednakże cząsteczki beta można zatrzymać kilkoma arkuszami papieru lub jednym arkuszem aluminium.
Cząsteczki beta są naładowane ujemnie i przyciągają cząstki naładowane dodatnio.
Cząsteczki gamma (ү)
Cząsteczki gamma to wiązka wysokiej energii, a mianowicie energii elektromagnetycznej (fotonu) emitowanej przez pierwiastki promieniotwórcze podczas rozpadu promieniotwórczego.
Spośród wszystkich trzech cząstek (alfa, beta i gamma), najbardziej energetycznymi fotonami są cząstki gamma.
Cząsteczki gamma, które są formą promieniowania elektromagnetycznego (PEM), pochodzą z jądra.
Długości fal gamma są najkrótsze ze wszystkich trzech.
Cząsteczki gamma nie mają ładunku i są neutralne; dlatego też nie mają na nie wpływu pola magnetyczne i elektryczne.
Zastosowania pierwiastków radioaktywnych
Pierwiastki promieniotwórcze są używane w -
Dziedzina medycyny (leczenie wielu schorzeń)
Proces przemysłowy
Produkcja energii - reaktory jądrowe
Wprowadzenie
Reakcje jądrowe uwalniają ogromne ilości energii (znanej jako energia jądrowa), która jest wykorzystywana do produkcji energii elektrycznej w elektrowni jądrowej.

Energia jądrowa zwykle wytwarzana przez nuclear fission, nuclear fusion, i nuclear decay.
W 1938 roku niemieccy chemicy Otto Hahn, Fritz Strassmann i austriacka fizyk Lise Meitner przeprowadzili eksperymenty, w których produkty uranu bombardowanego neutronami. W wyniku tego eksperymentu stosunkowo mały neutron rozszczepił jądro masywnych atomów uranu na dwie mniej więcej równe części i uwolnił ogromną energię.
Eksperymenty jądrowe Otto Hahna i jego współpracowników są popularne jako rozszczepienie jądrowe.
Rozszczepienia jądrowego
W procesie rozszczepienia jądrowego powstają wolne neutrony i fotony gamma, jednocześnie uwalniając bardzo dużą ilość energii.
Rozszczepienie jądra atomowego jest reakcją egzotermiczną, która może wyzwolić duże ilości energii w postaci promieniowania elektromagnetycznego oraz energii kinetycznej.
Czasami rozszczepienie jądra atomowego może wystąpić naturalnie (tj. Bez bombardowania neutronami) jako rodzaj rozpadu radioaktywnego.
Rodzaje rozszczepienia jądra atomowego
Poniżej przedstawiono główne typy rozszczepienia jądra atomowego -
Chain Reaction and
Fission Reaction
Omówmy je w skrócie -
Reakcja łańcuchowa
Kiedy jedna reakcja jądrowa powoduje jedną lub więcej następujących po sobie reakcji jądrowych, nazywa się to reakcją łańcuchową.
Taka reakcja łańcuchowa zwiększa możliwość samo-rozprzestrzeniania się serii reakcji jądrowych.
Jądrowe reakcje łańcuchowe uwalniają milion razy więcej energii na reakcję niż jakakolwiek inna reakcja chemiczna; dlatego jest również znany jako wybuchowa lub niekontrolowana reakcja łańcuchowa.
Kiedy ciężki atom ulega rozszczepieniu, zwykle rozpada się na dwa lub więcej fragmentów rozszczepienia. Podczas tego procesu emitowanych jest kilka wolnych neutronów, promieni gamma i neutrin, a ostatecznie uwalniana jest duża ilość energii.
Poniżej znajdują się dwa przykłady reakcji łańcuchowej -
235 U + → fragmenty rozszczepienia neutronów + 2,4 neutronów + 192,9 MeV
235 Pu + → fragmenty rozszczepienia neutronów + 2,9 neutronów + 198,9 MeV
W bombie atomowej stosowana jest technologia reakcji łańcuchowej, ponieważ wymagała stałego źródła energii.
Reakcje rozszczepienia
Reakcja rozszczepienia, w której neutrony (wytwarzane przez rozszczepienie atomów paliwa) są wykorzystywane do wywołania jeszcze większego rozszczepienia w celu uwolnienia zrównoważonej energii, jest znana jako reakcje rozszczepienia.
Takie reakcje są powolne i kontrolowalne; w związku z tym znany również jako kontrolowana reakcja łańcuchowa.
Reaktor jądrowy wytwarzający energię (elektryczność) jest idealnym przykładem kontrolowanej reakcji łańcuchowej.
Na podstawie właściwości i rodzaju zastosowań rozszczepienie / kontrolowana reakcja łańcuchowa jest klasyfikowana jako -
Power reactors
Research reactors
Breeder reactors
Te reaktory energetyczne na ogół przekształcają energię kinetyczną produktów rozszczepienia w ciepło; ponadto ciepło jest wykorzystywane do podgrzewania płynu roboczego, który napędza silnik cieplny, który ostatecznie wytwarza energię mechaniczną lub elektryczną.
Podstawowe elementy reaktora jądrowego
Poniżej przedstawiono podstawowe elementy reaktora jądrowego -
Nuclear fuels- Takich jak uran ( 233 U, 235 U), tor (Th 232 ), pluton (Pu 239 ).
Moderators- Służy do kontroli emitowanych neutronów. Np. Ciężka woda, beryl, grafit itp.
Coolant- Służy do chłodzenia reaktora. Np. Woda, para, hel, CO 2 , powietrze, stopione metale itp.
Control rods- Służy do uruchamiania i zatrzymywania reakcji rozszczepienia. Np. Pręty z kadmu lub boru są używane do tego celu.
Fuzja nuklearna
Proces, w którym dwa lekkie jądra ulegają fuzji, tworząc ciężkie jądro, jest znany jako fuzja jądrowa; podczas tego procesu uwalniana jest ogromna ilość energii, zwanej energią jądrową.
Najlepszym przykładem syntezy jądrowej jest - bomba wodorowa.
Bomba wodorowa jest około 1000 razy silniejsza niż bomba atomowa.
Wprowadzenie
Materiał (który może być pierwiastkiem, związkiem lub stopem), który jest charakterystycznie twardy, błyszczący, nieprzezroczysty i ma właściwości przewodzenia ciepła i elektryczności, nazywany jest metalem.
Metale występują naturalnie w skorupie ziemskiej w postaci nieczystej, tj. Rud. I jest wydobywany w procesie wydobywania.
Spośród wszystkich znanych 118 pierwiastków (układu okresowego) około 91 pierwiastków to metale.

Cechy metali
Poniżej przedstawiono istotne cechy metali -
Metale są generalnie plastyczne - co oznacza, że ich kształt można trwale zmienić bez łamania i pękania.
Metale są topliwe - to znaczy; można go łatwo stopić lub stopić.
Metale są plastyczne - to znaczy; może mieć dowolny kształt, nawet cienki arkusz lub drut.
Metale są dobrym przewodnikiem ciepła i elektryczności; Ołów jest wyjątkiem, ponieważ nie przenosi prądu.
Metale w naturalny sposób reagują z różnymi niemetalami i tworzą związki. Metale mogą reagować z zasadami i kwasami. Np. 4 Na + O 2 → 2 Na 2 O (tlenek sodu) itp.
Stopy
Stop jest produktem mieszaniny dwóch lub więcej pierwiastków, w których dominuje metal.
Aby wytworzyć pożądany produkt, miesza się różne metale (w różnych proporcjach) (tj. Stopy). Np. Stopy żelaza, a mianowicie stal nierdzewna, żeliwo, blachy stopowe itp. Mają duży udział zarówno pod względem ilości, jak i wartości handlowej.
Metale są zwykle wytwarzane ze stopów, aby były bardziej odporne na korozję, mniej kruche, aby nadać atrakcyjne kolory itp.
Metalowe terminologie
Base Metal- W chemii metal nieszlachetny oznacza - metal, który łatwo ulega utlenieniu lub korozji, a także łatwo reaguje z HCl (rozcieńczony kwas solny) i tworzy wodór. Np. Żelazo, nikiel, cynk, ołów itp.
Ferrous Metal- „Żelazo” to łacińskie słowo, które oznacza substancję „zawierającą żelazo”. Np. Stal itp.
Heavy Metal- Metal, który jest znacznie gęstszy niż zwykły metal, jest klasyfikowany jako metal ciężki. Metale ciężkie są toksyczne lub trujące w niskich stężeniach. Np. Rtęć (Hg), arsen (As), chrom (Cr), kadm (Cd), tal (Tl) i ołów (Pb).
Precious Metal- Pierwiastki metalowe, które zawierają rzadki metaliczny pierwiastek chemiczny o dużej wartości ekonomicznej, są klasyfikowane jako metale szlachetne. Np. Platyna, złoto, srebro, pallad itp.
Noble Metal- Metale odporne na korozję lub utlenianie. Np. Ruten (Ru), rod (Rh), pallad (Pd) itp.
Zastosowanie metali
Poniżej przedstawiono znaczące zastosowania metali -
Ponieważ metale są dobrym przewodnikiem ciepła i elektryczności; dlatego jest używany jako przewód elektryczny oraz w wielu innych urządzeniach elektrycznych, w tym silnikach elektrycznych itp. Np. miedź, srebro, aluminium itp.
Metale ciężkie są wykorzystywane do budowy mostów, basenów i do wielu podobnych celów.
Wiele metali jest używanych do produkcji różnych artykułów domowych, takich jak przybory kuchenne, garnki, piece itp.
Metale są często używane do produkcji wielu rodzajów narzędzi, od prostego śrubokręta po ciężki walec prętowy.
Metale szlachetne mają piękny wygląd i są atrakcyjne (np. Złoto, srebro itp.); dlatego są używane jako ozdoby.
W radiatorach zastosowano specjalny metal, który chroni wrażliwy sprzęt przed przegrzaniem.
Metale radioaktywne (np. Uran i pluton) są wykorzystywane do wytwarzania energii jądrowej.
Rtęć to metal, który pozostaje w postaci płynnej w temperaturze pokojowej; jest używany w termometrze.
Gałąź nauki i techniki zajmująca się badaniem właściwości metali oraz ich produkcją i oczyszczaniem znana jest jako metallurgy.
Naturalnie występująca stała substancja nieorganiczna jest znana jako mineral.
Naturalnie występujący materiał stały, z którego można ekstrahować cenny minerał lub metal, jest znany jako ore.
Poniższa tabela przedstawia główne pierwiastki i ich rudy -
| Element | Rudy | Skład chemiczny |
|---|---|---|
| Aluminium | Boksyt | Al 2 O 3 2H 2 O |
| Korund | Al 2 O 3 | |
| Kryolite | Na 3 AlF 6 | |
| Dyspore | Al 2 O 3 .H 2 O | |
| Miedź | Piryt miedziany | CuFeS 2 |
| Malachit | 2CuCO 3 Cu (OH) 2 | |
| Żelazo | Krwawień | Fe 2 O 3 |
| Magnetyt | Fe 3 O 4 | |
| Syderyt | FeCO 3 | |
| Sód | Węglan sodu | Na 2 CO 3 |
| Chlorek sodu | NaCl | |
| Azotan sodu | NaNO 3 | |
| Siarczan sodu | Na 2 SO 4 | |
| Potas | Chlorek potasu | KCl |
| Weglan potasu | K 2 CO 3 | |
| Azotan potasu | KNO 3 | |
| Magnez | Magnezyt | MgCO 3 |
| Dolomit | CaMg (CO 3 ) 2 | |
| Sól Epsom | MgSO 4 | |
| Wapń | Węglan wapnia | CaCO 3 |
| Cyna | Kasyteryt | SnO 2 |
| Prowadzić | Galena | PbS |
| Cerusyt | PbCO 3 | |
| Anglesite | PbSO 4 | |
| Srebro | Argentyt | Ag 2 S |
| Tetrahedrite | Sb 4 S 3 | |
| Cynk | Węglan cynku (znany jako calamine) | ZnCO 3 |
| Siarczek cynku | ZnS | |
| Rtęć | Cynobrowy | HgS |
| Mangan | Piroluzyt | MnO 2 |
| Fosfor | Fosforyt | Ca 3 (PO 4 ) 2 |
| Fluorapatyt | Ca 5 (PO 4 ) 3 F. | |
| Chlorapatyt | 3Ca 3 (PO 4 ) 2 .CaCI 2 | |
| Złoto | Calaverite | AuTe 2 |
| Sylvanite | (Ag, Au) Te 2 | |
| Nagyágite | (Pb 5 Au (Te, Sb) 4S 5-8 ) | |
| Petzite | Ag 3 AuTe 2 | |
| Antymon | Antymon | Sb 2 S 3 |
| Stibiconite | (Sb 3+ Sb 2 5+ O 6 (OH)) | |
| Kobalt | Kobaltyt | CoAsS |
| Nikiel | Pentlandite | ((Ni, Fe) S) |
| Chrom | Chromit | (FeCr 2 O 4 ) |
Wprowadzenie
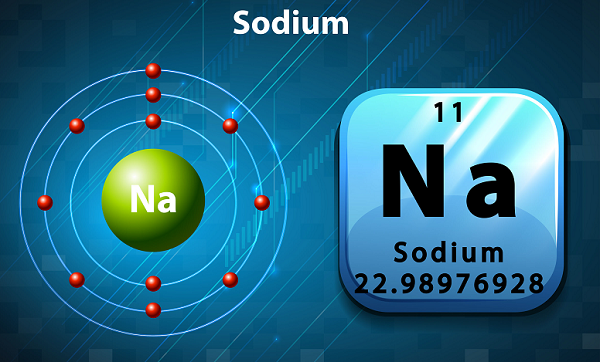
Sód ma miękki, srebrzysty kolor i jest wysoce reaktywnym metalem alkalicznym.
W układzie okresowym Sód jest trzymany w grupie 1, ponieważ ma pojedynczy elektron w zewnętrznej powłoce.
Symbolem sodu jest „Na,', które faktycznie zostało zaczerpnięte z łacińskiego słowa ‘natrium.’
Pod względem obfitości sód jest szóstym pierwiastkiem występującym w skorupie ziemskiej.
Sód występuje w różnych minerałach, w tym skalenie, sodalit i sól kamienna (NaCl).
W 1807 roku Humphry Davy jako pierwszy wyizolował sód przez elektrolizę wodorotlenku sodu.
Do tego czasu znanych jest 20 izotopów sodu, ale spośród wszystkich tylko 23 Na jest stabilne.
Istotne cechy sodu
Oto główne cechy pierwiastka sodu -
Sód metaliczny to miękki element, który można łatwo ciąć nożem.
Sód jest dobrym przewodnikiem ciepła i elektryczności.
Ze względu na małą masę atomową i duży promień atomowy, sód jest jednym z najmniej gęstych pierwiastków (trzeci najmniej gęsty pierwiastek - pierwsze dwa to lit i potas).
Sód może unosić się na wodzie.
Sód wzdłuż jego związków świeci na żółto (patrz zdjęcie poniżej).

Związki sodu mają bardzo duże znaczenie handlowe i duże zapotrzebowanie w przemyśle szklarskim, papierniczym, mydlanym i tekstylnym.
Związki sodu
Oto kilka znaczących przykładów związków sodu -
Sól kuchenna - (NaCl)
Soda kalcynowana - (Na 2 CO 3 )
Soda oczyszczona - (NaHCO 3 )
Soda kaustyczna - (NaOH)
Azotan sodu - (NaNO 3 )
Tiosiarczan sodu - (Na 2 S 2 O 3 · 5H 2 O)
Boraks - (Na 2 B 4 O 7 · 10H 2 O)
Występowanie sodu
Skorupa ziemska zawiera około 2,27% sodu.
Sód jest piątym najczęściej występującym metalem; pozostałe cztery to glin, żelazo, wapń i magnez.
W wodzie oceanicznej znajduje się około 1,08 × 104 miligramów sodu na litr.
Sód nie występuje jako czysty pierwiastek, ponieważ jest wysoce reaktywny.
Zastosowania sodu
Poniżej przedstawiono główne zastosowania sodu -
Chlorek sodu jest bardzo przydatny jako środek przeciwoblodzeniowy i odladzający, a także jako środek konserwujący.
Podczas gotowania stosuje się wodorowęglan sodu.
Sód i niektóre jego związki są używane w lekach.
W porównaniu do potasu (który jest lepszym jonem), sód jest częściej stosowany ze względu na niższą cenę i masę atomową.
W chemii organicznej wodorek sodu jest używany w różnych reakcjach.
Sód metaliczny jest głównie używany do produkcji borowodorku sodu, trifenylofosfiny sodu, azydku, indygo itp.
W niektórych szybkich reaktorach ciekły sód jest stosowany jako płyn przenoszący ciepło ze względu na dobrą przewodność cieplną.
Sód jest również niezbędnym minerałem dla zdrowia człowieka, ponieważ reguluje ciśnienie krwi, objętość krwi, równowagę osmotyczną i wartość pH.
Minimalna ilość 500 miligramów sodu jest wymagana każdego dnia dla zdrowego organizmu człowieka.
Wprowadzenie
Wapń to miękki, szaro-żółty, alkaliczny pierwiastek występujący głównie w skorupie ziemskiej.
Symbolem wapnia jest “Ca” a liczba atomowa to “20.”
Wolny wapń prawie nie występuje w przyrodzie, ponieważ jest wysoce reaktywny.
Wapń jest wytwarzany zwykle w nukleosyntezie supernowej.
Istotne cechy wapnia
Wapń jest jednym z najczęściej występujących masowo metali u wielu zwierząt.
Wapń jest bardzo ważnym składnikiem zębów, kości i muszli.
Węglan wapnia i cytrynian wapnia są głównymi suplementami diety wymaganymi dla dobrego zdrowia.
Światowa Organizacja Zdrowia (WHO) wymieniła wapń jako podstawowe leki.
W porównaniu z innymi metalami jon wapnia i większość innych związków wapnia ma niską toksyczność.
Jeśli wapń wejdzie w kontakt z wodą lub kwasem, reaguje z nimi i staje się niebezpieczny.
Jeśli wapń wejdzie w kontakt z powietrzem, reaguje szybko i tworzy szarobiałą powłokę z azotku wapnia i tlenku wapnia.
Większość soli wapnia jest zwykle bezbarwna.
Podczas spalania wapnia płomień ma kolor ceglastoczerwony (patrz zdjęcie poniżej).

Wapń metaliczny ma stosunkowo wyższą rezystywność elektryczną niż aluminium lub miedź.
Występowanie
Wapń występuje zwykle w skałach osadowych.
Minerały (osadowe), w których znajduje się wapń, to kalcyt, dolomit i gips.
Wapń znajduje się również w skałach magmowych i metamorficznych, głównie w minerałach krzemianowych, takich jak amfibole, plagioklazy, pirokseny i granaty.
Wapń znajduje się również w wielu produktach spożywczych, a mianowicie w produktach mlecznych, migdałach, orzechach laskowych, soi, brokułach, liściach mniszka lekarskiego, figach i wielu innych.
Związki wapnia
Tlenek wapnia - CaO
Wodorotlenek wapnia - Ca (OH) 2
Chlorek wapnia - CaCl 2
Podchloryn wapnia (proszek wybielający) - Ca (ClO) 2
Fosforan wapnia - Ca 3 (PO 4 ) 2
Zastosowania wapnia
Wapń ma szerokie zastosowanie, z których najważniejsze to -
Do produkcji cementu stosuje się węglan wapnia (CaCO 3 ).
Węglan wapnia (CaCO 3 ) jest również używany do produkcji pasty do zębów.
W insektycydach stosuje się arsenian wapnia (Ca 3 (AsO 4 ) 2 ).
Chlorek wapnia (CaCl 2 ) jest używany do usuwania lodu, a także do kontroli pyłu.
Cytrynian wapnia (Ca 3 (C 6 H 5 O 7 ) 2 ) jest powszechnie stosowany jako środek konserwujący żywność.
Glukonian wapnia (Ca (C 6 H 11 O 7 ) 2 ) jest często stosowany jako dodatek do żywności, a także w tabletkach witaminowych.
Podchloryn wapnia (Ca (OCl) 2 ) jest zwykle używany jako środek do dezynfekcji basenów, jako środek wybielający.
Wprowadzenie
Metal o srebrno-białym kolorze, miękki, niemagnetyczny i plastyczny, nazywany jest aluminium.
Symbolem aluminium jest ‘Al’ a jego liczba atomowa to ‘13.’
Pierwiastek chemiczny aluminium należy do grupy boru.

- Boksyt jest główną rudą aluminium.
Istotne cechy aluminium
Aluminium metaliczne jest pierwiastkiem reagującym chemicznie.
Aluminium może być odporne na korozję, a proces tej rezystywności jest znany jako pasywacja.
Aluminium to stosunkowo trwały, lekki, miękki, kowalny i ciągliwy metal.
Aluminium jest niemagnetyczne i nie zapala się łatwo.
Folia aluminiowa jest bardzo dobrym odbłyśnikiem światła widzialnego, ponieważ odbija ponad 90 procent docierających promieni.
Aluminium zwykle reaguje z wodą i tworzy wodór.
Aluminium to metal o małej gęstości, który jest odporny na korozję.
Aluminium ma właściwość przewodnictwa cieplnego i elektrycznego, dlatego jest dobrym przewodnikiem.
Występowanie aluminium
Aluminium stanowi (około) 8 procent skorupy ziemskiej.
Po tlenie i krzemie glin jest trzecim najliczniejszym pierwiastkiem; jednakże jest to najbardziej rozpowszechniony metal w skorupie.
Kiedy wodór łączy się z magnezem, tworzy stabilne aluminium.
Glin naturalnie występujący w postaci tlenków lub krzemianów.
Związki aluminium
Poniżej przedstawiono główne związki glinu -
Tlenek glinu - Al 2 O 3
Chlorek glinu - AlCl 3
Siarczan glinu - Al 2 (SO 4 ) 3
Wodorotlenek glinu - Al (OH) 3
Węglik glinu - Al 4 C 3
Zastosowanie aluminium
Aluminium znajduje szerokie zastosowanie w przemyśle jak iw życiu codziennym; znaczące z nich to -
Aluminium jest wykorzystywane w przemyśle transportowym, takim jak kolej, samochody, samoloty, statki kosmiczne, ciężarówki, statki morskie, rowery itp.
Aluminium jest używane do pakowania określonych materiałów.
Aluminium znajduje zastosowanie w konstrukcjach drzwi, okien, drutach budowlanych, poszyciach, pokryciach dachowych itp.
Aluminium jest szeroko stosowane do produkcji przewodów elektrycznych.
Aluminium jest używane do produkcji sprzętu AGD i wielu innych artykułów gospodarstwa domowego, takich jak przybory kuchenne.
Aluminium jest używane w kijach baseballowych, zegarkach i wielu innych tego typu produktach.
Aluminium jest używane w sprzęcie fotograficznym.
Aluminium jest używane w urządzeniach elektronicznych.
Aluminium jest używane jako odbłyśnik światła, ponieważ jest dobrym odbłyśnikiem światła; w zasadzie niektóre materiały są pokryte powłoką aluminiową specjalnie odbijającą światło.
Aluminium jest wykorzystywane do produkcji wodoru w reakcji z kwasem solnym.
Aluminium jest używane do produkcji instrumentów muzycznych.
Wprowadzenie
Magnez to lśniący szary pierwiastek.
Symbolem magnezu jest ‘Mg’ a liczba atomowa to ‘12.’

Z około 80% udziałem w rynku światowym, Chiny są największym dostawcą magnezu.
Istotne cechy magnezu
Gęstość magnezu stanowi dwie trzecie gęstości aluminium.
Spośród wszystkich metali alkalicznych na Ziemi, magnez ma najniższą temperaturę topnienia (tj. Około 1202 0 F) i najniższą temperaturę wrzenia (około 1,994 0 F).
Magnez zwykle reaguje z wodą w temperaturze pokojowej.
Czasami magnez jest również używany jako zapalnik termitu.
Magnez spalony w powietrzu wytwarza brylantowo-białe światło, które obejmuje również silne fale ultrafioletowe.

Magnez, gdy się pali, wytwarza intensywne jasne i białe światło (patrz zdjęcie powyżej).
Występowanie magnezu
Pod względem masy magnez jest ósmym najobfitszym pierwiastkiem występującym w skorupie ziemskiej.
Magnez znajduje się zwykle w dużych złożach magnezytu, dolomitu i innych podobnych minerałów.
Rozpuszczalny jon magnezu znajduje się w wodzie mineralnej.
Po sodu i chlorze magnez jest trzecim najbardziej rozpowszechnionym pierwiastkiem rozpuszczonym w wodzie morskiej.
Magnez występuje naturalnie tylko w połączeniu z niektórymi innymi pierwiastkami.
Masowych magnezu 11 th najbardziej rozpowszechnionych pierwiastków w ludzkim ciele i jest niezbędny do wszystkich komórek i enzymów.
Jony magnezu często oddziałują ze związkami polifosforanowymi, w tym ATP, DNA i RNA.
Związki magnezu
Poniżej przedstawiono główne związki magnezu -
Węglan magnezu - MgCO 3
Chlorek magnezu - MgCl 2
Cytrynian magnezu - C 6 H 6 MgO 7
Wodorotlenek magnezu - Mg (OH) 2
Tlenek magnezu - MgO
Siarczan magnezu - MgSO 4
Heptahydrat siarczanu magnezu - (MgSO 4 · 7H 2 O)
Heptahydrat siarczanu magnezu jest powszechnie znany jako Epsom salt.
Zastosowania magnezu
Magnez ma szerokie zastosowanie w naszym życiu; jednak niektóre znaczące zastosowania magnezu to -
Po żelazie i aluminium magnez jest trzecim najczęściej stosowanym pierwiastkiem.
Magnez jest szczególnie stosowany w super mocnych, lekkich materiałach i stopach.
Magnez jest również używany jako materiał silnikowy w przemyśle lotniczym.
Magnez jest również używany do oczyszczania rozpuszczalników; tak jak przy przygotowywaniu super-suchego etanolu.
Wiele dużych marek motoryzacyjnych, w tym Mercedes, Porsche, BMW, Volkswagen, Chevrolet itp., Używa magnezu do produkcji swoich samochodów wysokiej jakości.
Ze względu na niską wagę oraz dobre właściwości elektryczne i mechaniczne magnez jest powszechnie stosowany w produkcji laptopów i tabletów, telefonów komórkowych, aparatów fotograficznych i wielu innych elementów elektronicznych.
Siarczyn magnezu jest zwykle używany do produkcji papieru.
Wprowadzenie
Mangan to pierwiastek chemiczny, który zwykle występuje w połączeniu z żelazem.
Symbolem manganu jest ‘Mn’ a liczba atomowa to ’25.’
Mangan jest metalem bardzo ważnym w zastosowaniach przemysłowych.

W 1774 roku Johan Gottlieb Gahn po raz pierwszy wyizolował nieczystą próbkę metalicznego manganu w 1774 roku.
Właściwości manganu
Poniżej przedstawiono główne cechy i właściwości manganu -
Podobnie jak żelazo, mangan jest srebrzystoszarym metalem.
Mangan można łatwo utlenić, ale bardzo trudno go stopić, ponieważ jest bardzo twardy i kruchy.
W powietrzu mangan powoli matowieje (utlenianie).
Mangan to pierwiastek należący do grupy żelaza.
Występowanie manganu
Mangan jest 12 th najbardziej obfite element skorupy ziemskiej.
Gleba zawiera zwykle około 7-9000 ppm manganu, średnio 440 ppm.
Woda morska zawiera tylko około 10 ppm manganu; podczas gdy atmosfera zawiera około 0,01 µg / m3.
Piroluzyt (MnO 2 ) jest najważniejszą rudą manganu.
Związki manganu
Oto główne związki manganu -
Tlenek manganu (II) - MnO
Tlenek manganu (I) - Mn 2 O 3
Dwutlenek manganu - MnO 2
Chlorek manganu - MnCl 2
Nadmanganian potasu - KMnO 4
Siarczan manganu (II) - MnSO 4
Węglan manganu (II) - MnCO 3
Siarczek manganu (II) - MnS
Azotan manganu (II) - Mn (NO 3 ) 2
Bromek manganu (II) - MnBr 2
Heptotlenek manganu - Mn 2 O 7
Dekakarbonyl dimanganu - C 10 O 10 Mn 2
Jodek manganu (II) - MnI 2
Fluorek manganu (II) - MnF 2
Zastosowania manganu
Poniżej przedstawiono główne zastosowania manganu -
Mangan jest jednym z najważniejszych składników produkcji stali.
Fosforanowanie manganem jest powszechnie stosowane do zapobiegania rdzy i korozji stali.
W biologii jony manganu (II) działają jako kofaktory dla wielu różnych enzymów.
Mangan jest również ważny w zjawisku ewolucji tlenu w roślinach fotosyntetyzujących.
Dwutlenek manganu jest również używany do produkcji tlenu i chloru oraz do suszenia czarnych farb.
Wprowadzenie
Żelazo jest najpowszechniejszym pierwiastkiem występującym głównie w zewnętrznym i wewnętrznym jądrze ziemi.
Symbolem żelaza jest ‘Fe’ a liczba atomowa to ‘26.’

Żelazo jest jednym z najwcześniej znanych pierwiastków używanych przez ludzi.
Istotne cechy żelaza
Oto główne cechy żelaza -
Czysty element żelazny jest miękki, ciągliwy i ciągliwy.
Temperatura wrzenia żelaza waha się od 1533 0 C do 2450 0 C.
Żelazo łatwo przyciąga magnes.
W suchym powietrzu żelazo pozostaje nieaktywne i nie reaguje (z powietrzem); jednak w wilgotnym powietrzu reaguje i tworzy rdzę.
Czyste żelazo zwykle nie reaguje z czystą wodą; jednakże łatwo reaguje ze zwykłymi zanieczyszczonymi formami wody i rdzy.
Żelazo reaguje z halogenem i siarką, tworząc odpowiednio halogenek i siarczek.
Występowanie żelaza
Wewnętrzne i zewnętrzne jądro ziemi składa się głównie z żelaza i niklu.
Najprawdopodobniej żelazo jest najobficiej dostępnym pierwiastkiem ziemi; jest to jednak czwarty najobficiej dostępny element skorupy.
Rodzaje żelaza
Poniżej przedstawiono główne rodzaje żelaza -
Hematyt - Fe 2 O 3
Magnetyt - Fe 3 O 4
Sideryt - FeCO 3
Związki żelaza
Poniżej przedstawiono główne związki żelaza -
Tlenek żelaza (II) - FeO
Chlorek żelaza (III) - FeCl 3
Wodorotlenek żelaza (III) - Fe (OH) 3
Siarczek żelaza (II) - FeS
Chlorek żelaza (II) - FeCl 2
Fosforan żelaza - FePO 4
Żelazian (VI) - (FeO 4 ) 2-
Octan żelaza (II) - Fe (C 2 H 3 O 2 ) 2
Siarczek żelaza (III) - Fe 2 S 3
Chromian żelaza (III) - Fe 2 (CrO 4 ) 3
Wodorotlenek żelaza (II) - Fe (OH) 2
Octan żelaza (III) - C 14 H 27 Fe 3 O
Szczawian żelaza (II) - FeC 2 O 4
Żelaza (II), fluorkami - fef 2
Zastosowania żelaza
Spośród wszystkich metali najczęściej stosuje się żelazo (około 90% całkowitej światowej produkcji metali).
W większości gałęzi przemysłu ciężkiego żelazo jest najważniejszym pierwiastkiem.
W branżach takich jak kolejnictwo, budowa statków, motoryzacja, budownictwo inżynieryjne itp. Wszędzie zasadniczo potrzebne jest żelazo.
Wprowadzenie
Miedź to miękki, ciągliwy i ciągliwy metal.
Miedź ma bardzo wysoką przewodność cieplną i elektryczną.
Symbolem miedzi jest ‘Cu’ a liczba atomowa to ’29.’

Miedź jest znana ludziom od (około) c. 8000 pne.
Miedź jest pierwszym metalem, który został wytopiony z jej rudy około ok. 5000 pne.
Istotne cechy miedzi
Miedź była pierwszym metalem, który wlewano w kształt (w formie).
Miedź była pierwszym metalem, który z powodzeniem stopił się z innym metalem, np. Miedzią stopioną z cyną i otrzymano brąz. Odbywa się to około c. 3500 pne.
Pierwszy metal, który został celowo stopiony z innym metalem, cyną, w celu uzyskania brązu, c. 3500 pne.
Miedź ma naturalny czerwono-pomarańczowy kolor; jest widoczny po odsłonięciu jego powierzchni.
Miedź jest bardzo dobrym przewodnikiem prądu i ciepła.
Miedź jest pierwiastkiem z grupy 11 układu okresowego.
Miedź normalnie nie reaguje z wodą; jednakże reaguje powoli z tlenem atmosferycznym i tworzy warstwę brązowo-czarnego tlenku miedzi.
Brązowo-czarny tlenek miedzi zazwyczaj chroni metal przed dalszą korozją, podobnie jak pasywacja.
Pasywacja to proces polegający na zastosowaniu cienkiej warstwy materiału ochronnego, takiego jak tlenek metalu, który służy do tworzenia powłoki ochronnej przed korozją.
Występowanie miedzi
Miedź jest powszechnie spotykana w skorupie ziemskiej.
W 1857 roku odkryto największą masę miedzi elementarnej (o masie około 420 ton). Został znaleziony na półwyspie Keweenaw w Michigan w USA.
Stopy miedzi
Stopy metali, których głównym składnikiem jest miedź, nazywane są stopami miedzi.
Stopy miedzi są bardzo odporne na korozję.
Najlepszym (tradycyjnym) przykładem stopu miedzi jest brąz (wykonany przez zmieszanie cyny i mosiądzu).
Poniżej przedstawiono główne stopy miedzi -
Brass
Bronze
Auricupride
Chińskie srebro
Brąz koryncki
Electrum, zielone złoto
Szare złoto
Niello
Panchaloha
Różowe, czerwone i różowe złoto
Spangold
Shibuichi
tybetańskie srebro
białe złoto
Związki miedzi
Poniżej przedstawiono główne związki miedzi -
Octan miedziowy - Cu (CH 3 COO) 2
Tlenek miedzi (I) - Cu 2 O
Tlenek miedzi (II) - CuO
Chlorek miedzi (II) - CuCl 2
Trójwodorotlenek chlorku dwumiedziowego - Cu 2 (OH) 3 Cl
Chlorek miedzi (I) - CuCl
Azotan miedzi (II) - Cu (NO 3 ) 2
Cyjanek miedzi - CuCN
Zastosowania miedzi
Miedź jest szeroko wykorzystywana do produkcji przewodów elektrycznych.
Miedź jest używana w silnikach elektrycznych.
Miedź jest wykorzystywana w pokryciach dachowych, hydraulice i wielu innych gałęziach przemysłu.
Farba miedziana jest używana do malowania łodzi i wielu innych materiałów.
Wiele urządzeń gospodarstwa domowego składa się z czystej miedzi lub jej stopów.
Wprowadzenie
Srebro to miękkie, lśniące przejście i biały metal.
Srebro ma najwyższą przewodność elektryczną i cieplną; i ma również najwyższy współczynnik odbicia ze wszystkich metali.

Symbolem srebra jest ‘Ag’ a liczba atomowa to ’47.’
Istotne cechy srebra
Srebro jest metalem szlachetnym od dawna używanym przez ludzi.
Srebro jest pierwiastkiem z grupy 11 układu okresowego.
Srebro ma doskonały biały metaliczny połysk, powszechnie stosowany w wysokim połysku.
Ponieważ srebro nie ma koloru; dlatego ma wysoki współczynnik odbicia (światła).
Srebro ma bardzo wysoką przewodność elektryczną i cieplną. Jego przewodność elektryczna jest najwyższa - wyższa niż miedzi.
Spośród wszystkich metali srebro ma również najniższą rezystancję styku.
Występowanie srebra
Metalowe srebro zwykle znajduje się w skorupie ziemskiej w czystej postaci.
Srebro występuje również jako stop ze złotem i niektórymi innymi metalami.
Srebro znajduje się również w niektórych minerałach, takich jak argentyt i chlorargiryt.
Srebro jest głównie wytwarzane jako produkt uboczny złota, miedzi, cynku, ołowiu itp.
Stopy srebra
Poniżej znajdują się główne stopy srebra -
Srebro Sterling Argentium
Britannia srebrny
Doré bullion
Electrum
Goloid
Platynowy funt szterling
Srebro próby 925
tybetańskie srebro
Związki srebra
Poniżej znajduje się główny związek srebra -
Chlorek srebra - AgCl
Jodek srebra - Agl
Bromek srebra - AgBr
Tlenek srebra - Ag 2 O
Siarczek srebra - Ag 2 S.
Fluorek srebra - AgF
Cyjanek srebra - AgCN
Węglan srebra - Ag 2 CO 3
Octan srebra - AgC 2 H 3 O 2
Siarczan srebra - Ag 2 SO 4
Chromian srebra - Ag 2 CrO 4
Szczawian srebra - Ag 2 C 2 O 4
Chloran srebra - AgClO 3
Zastosowania srebra
Poniżej przedstawiono główne zastosowania srebra -
Od starożytności do produkcji monet używa się srebra.
Srebro jest również używane do wykonywania ozdób.
Wiele domowych garnków i innych przyborów również zostało wykonanych ze srebra.
Srebro ma również zastosowanie lecznicze, ponieważ jest stosowane jako powłoka antybiotykowa w wyrobach medycznych.
Ze względu na bardzo wysokie przewodnictwo elektryczne srebro jest powszechnie stosowane w niektórych urządzeniach elektronicznych.
Poza tym srebro ma wiele innych zastosowań, np. W fotografii, sprzęcie chemicznym, nanocząsteczkach itp.
Wprowadzenie
Złoto to jasny, czerwonawo-żółty, miękki, gęsty, kowalny i ciągliwy metal naturalnie występujący w skorupie ziemskiej.
Symbolem złota jest ‘Au’ a liczba atomowa to ‘79.’

Złoto jest (chemicznie) metalem przejściowym i należy do grupy 11 układu okresowego.
Istotne cechy złota
Najmniej reaktywnym pierwiastkiem jest złoto, które w normalnych warunkach pozostaje w stanie stałym.
Złoto jest odporne na większość kwasów.
Złoto rozpuszcza się w wodzie królewskiej; aqua regia to mieszanina kwasu azotowego i solnego.
Jednak złoto jest nierozpuszczalne w kwasie azotowym.
Złoto zwykle rozpuszcza się w alkalicznych roztworach cyjanku.
Roztwory cyjankowe są powszechnie stosowane w górnictwie i galwanotechnice.
Złoto również rozpuszcza się w rtęci i formach ‘amalgam alloys.’
Złoto nie reaguje z tlenem w żadnej temperaturze.
Występowanie złota
Złoto występuje powszechnie jako pierwiastek wolny, czyli w postaci naturalnej.
Złoto występuje w postaci bryłek lub też występuje w skałach, ziarnach, w żyłach i niektórych innych osadach aluwialnych.
Złoto występuje również w postaci stałego roztworu z rodzimym pierwiastkiem, takim jak srebro (jako elektrum).
W niektórych miejscach złoto jest również naturalnie stapiane z miedzią i palladem.
Stopy złota
Poniżej znajdują się główne stopy złota -
Kolorowe złoto
Korona złota
Electrum
Różowe złoto
Tumbaga
białe złoto
Związki złota
Poniżej znajdują się główne związki złota -
Chlorek złota (III) - AuCl 3
Chlorek złota (I) - AuCl
Cyjanek - CN
Kwas chloroaurynowy - HAuCl 4
Tlenek złota (III) - Au 2 O 3
Bromek złota - AuBr
Woda królewska - HNO 3 + 3HCl
Bromek złota - AuBr 3
Wodorotlenek złota (III) - AuH 3 O 3
Fluorek złota - AuF 3
Fluorek złota (V) - AuF 5
Siarczek złota - Au 2 S
Piorunujące złoto
Sole złota
Heptafluorek złota
Używa złota
Złoto to jeden z najstarszych pierwiastków, z których człowiek korzysta od tysięcy lat.
Ponieważ jest bardzo cenny i zapewnia piękny wygląd, jest charakterystyczny dla wykonania ozdób.
Zgodnie z najnowszym trendem (światowym) około 50% złota jest wykorzystywane do wyrobu biżuterii, 40% w inwestycjach, a pozostałe 10% w przemyśle.
Wprowadzenie
Platyna jest ciągliwym, ciągliwym, gęstym i wysoce niereaktywnym pierwiastkiem chemicznym.
Symbolem platyny jest ‘Pt’ a jego liczba atomowa to ‘78.’

Nazwa platyny pochodzi od hiszpańskiego terminu „platina”, co oznacza „little silver. ”
Platyna to najcenniejszy i najrzadszy metal (pierwiastek) na ziemi.
Istotne cechy platyny
Poniżej przedstawiono ważne cechy platyny -
Platyna to srebrno-biały metal.
Platyna jest elementem grupy 10 układu okresowego.
Platyna to jeden z najrzadszych pierwiastków w skorupie ziemskiej.
Platyna jest jednym z najmniej reaktywnych pierwiastków.
Platyna ma sześć naturalnych izotopów.
Platyna to jeden z najbardziej wartościowych i szlachetnych metali.
Platyna charakteryzuje się odpornością na korozję w każdych warunkach. Z tego powodu uważany jest za metal szlachetny.
Platyna jest zwykle nierozpuszczalna w kwasie azotowym i solnym, ale rozpuszcza się w gorącej wodzie królewskiej .
Po rozpuszczeniu w gorącej wodzie królewskiej platyna daje wodny roztwór kwasu chloroplatynowego (patrz zdjęcie poniżej).

Występowanie platyny
Platyna jest powszechnie spotykana jako natywna (naturalna) platyna i stop z drugą grupą platynowców.
Platyna występuje zwykle w rudach niklu i miedzi.
Platyna występuje również naturalnie w piaskach aluwialnych (powszechnie występujących w rzekach).
Platyna występuje w skorupie ziemskiej w stężeniu zaledwie (około) 0,005 ppm.
Stopy platyny
Platyna-iryd to jeden z najważniejszych stopów platyny.
Związki platyny
Poniżej znajdują się główne związki platyny -
Chlorek platyny (II) - Pt Cl 2
Chlorek platyny (IV) - PtCl 4
Katalizator Adama - PtO 2
Sześciofluorek platyny - PtF 6
Tetrachloropla potasu - K 2 PtCl 4
Sól Krogmanna - K 2 Pt (CN) 4 Br
Kwas chloroplatynowy - H 2 PtCl 6
Heksachloropl sodu - Na 2 PtCl 6
Woda królewska - HNO 3 + 3HCl
Zastosowania platyny
Platyna jest używana głównie w urządzeniach kontrolujących emisje spalin.
Platyna jest używana do rafinacji ropy naftowej i wielu innych produkcji chemicznych.
Platyna jest używana w urządzeniach elektronicznych, takich jak dyski twarde (napędy).
Platyna jest również używana w biżuterii.
Oprócz tych wszystkich zastosowań platyna znajduje również zastosowanie w medycynie (leki przeciwnowotworowe), sprzęcie szklarskim, elektrodach, silnikach turbinowych, inwestycjach itp.
Wprowadzenie
W układzie okresowym cynk jest pierwszym pierwiastkiem z grupy 12.
Symbolem cynku jest ‘Zn’ a liczba atomowa to ‘30.’
Pod względem dostępności, cynk jest 24 th najpowszechniejszym pierwiastkiem znaleźć w skorupie ziemskiej i ma pięć stabilnych izotopów.

Najbardziej powszechną rudą cynku jest sfaleryt (blenda cynku), który jest minerałem siarczku cynku.
Andreas Sigismund Marggraf, niemiecki chemik, po raz pierwszy odkrył czysty metaliczny cynk w 1746 roku.
Co ciekawe, alchemicy spalili cynk w powietrzu i utworzyli coś innego i nazwali to "philosopher's wool" lub „white snow. ”
Istotne cechy cynku
Cynk ma kolor niebieskawo-biały i jest metalem błyszczącym i diamagnetycznym.
Metal cynkowy jest zwykle twardy i kruchy; jednakże, gdy temperatura wzrasta od 100 0 C, staje się plastyczny.
Gdy temperatura wzrośnie do 210 ° C, metaliczny cynk ponownie staje się kruchy i można go łatwo sproszkować przez ubijanie.
Cynk jest przewodnikiem prądu elektrycznego.
Występowanie cynku
Cynk zwykle występuje w połączeniu z innymi metalami nieszlachetnymi, takimi jak miedź i ołów.
Sfaleryt jest formą siarczku cynku i jest to najsilniej wydobywana ruda.
Sfaleryt zawiera około 60 do 62% cynku.
Stopy cynku
Poniżej przedstawiono główne stopy cynku -
Brass
Nowe srebro
Niemieckie srebro
Związki cynku
Oto główne związki cynku -
Tlenek cynku - ZnO
Siarczek cynku - ZnS
Halogenki cynku - ZnF 2
Azotan cynku - Zn (NO 3 ) 2
Chloran cynku - Zn (ClO 3 ) 2
Siarczan cynku - ZnSO 4
Fosforan cynku - Zn 3 (PO 4 ) 2
Molibdenian cynku - ZnMoO 4
Chromian cynku - ZnCrO 4
Arsenin cynku - Zn (AsO 2 ) 2
Octan cynku - Zn (O 2 CCH 3 ) 2
Zastosowania cynku
Cynk jest jednym z najważniejszych pierwiastków dla zdrowia publicznego.
Cynk jest szeroko stosowany jako środek antykorozyjny i powłoka materiałów żelaznych i stalowych.
Cynk jest powszechnie stosowany jako anoda lub paliwo baterii cynkowo-powietrznej.
Tlenek cynku jest szeroko stosowany jako biały pigment (patrz zdjęcie poniżej) w farbach.

Tlenek cynku jest również używany jako katalizator w produkcji gumy.
Cynk jest pierwiastkiem niezbędnym dla naszego zdrowia; jest zwykle używany jako materiał uzupełniający w postaci tlenku cynku, octanu cynku lub glukonianu cynku.
Cynk jest zwykle materiałem przeciwutleniającym.
Niedobór cynku w organizmie człowieka może powodować poważne zaburzenia depresyjne.
Po uszkodzeniu ciała cynk przyspiesza proces gojenia.
Pirytionian cynku jest powszechnie stosowany w szamponach, aby zapobiegać łupieżowi.
Cynk chelatowany jest zwykle stosowany w pastach do zębów i płynach do płukania ust (płyn), ponieważ zapobiega nieświeżemu oddechowi.
Cynk chroni również skórę przed oparzeniami słonecznymi, dlatego jest stosowany w balsamach do ciała.
Wprowadzenie
Rtęć to pierwiastek chemiczny, zwykle znany jako „quicksilver”.
Dawniej rtęć była nazywana „hydrargyrum”.
Symbolem rtęci jest ‘Hg’ a liczba atomowa to ‘80.’

Czerwony pigment cynobrowy ekstrahuje się poprzez mielenie naturalnego cynobru lub syntetycznego siarczku rtęci.
Istotne cechy rtęci
Merkury to ciężki i srebrzystobiały metal.
Rtęć zwykle dostępna w stanie ciekłym; w normalnych warunkach tylko nieliczne elementy metaliczne pozostają w stanie ciekłym w temperaturze pokojowej.
Rtęć jest słabym przewodnikiem ciepła, ale dobrze przewodzi prąd.
Temperatura krzepnięcia rtęci wynosi -38,83 0 C, a temperatura wrzenia 356,73 0 C.
Zatrucie rtęcią spowodowane spożyciem jakiejkolwiek postaci rtęci. Jest to również spowodowane wdychaniem oparów rtęci.
Rtęć rozpuszcza wiele metali, w tym złoto i srebro, tworząc amalgamaty.
Występowanie rtęci
Rtęć jest jednym z najrzadszych pierwiastków w skorupie ziemskiej.
Najbogatsze rudy rtęci zawierają około 2,5% rtęci (pod względem masy).
Rtęć występuje jako pierwiastek rodzimy (naturalny) lub w minerałach korderoitu, cynobru, livingstonitu itp.
Merkury znajduje się w rejonie młodego pasa górskiego; pas, który wciąż wypycha gęstsze skały do skorupy ziemi. Na przykład region wulkaniczny lub nawet regiony gorących źródeł.
Stopy rtęci
Amalgamat jest głównym stopem rtęci.
Związki rtęci
Poniżej przedstawiono główne związki rtęci -
Chlorek rtęci (II) - HgCl 2
Tlenek rtęci (II) - HgO
Siarczek rtęci - HgS
Rtęć (I) - chlorek - Hg 2 Cl 2
Dimetylmer - C 2 H 6 Hg
Azotan rtęci (II) - Hg (NO 3 ) 2
Octan rtęci (II) - C 4 H 6 O 4 Hg
Siarczan rtęci (II) - HgSO 4
Jodek rtęci (I) - Hg 2 I 2
Selenek rtęci - HgSe
Piorwinian rtęci (II) - Hg (CNO) 2
Bromek rtęci (II) - HgBr 2
Jodek rtęci (II) - HgI 2
Tlenek rtęci (I) - Hg 2 O
Fluorek rtęci (I) - Hg 2 F 2
Amidochlorek rtęci - ClH 2 HgN
Dietylortęć - C 4 H 10 Hg
Zastosowania rtęci
Rtęć jest szeroko stosowana w przemyśle chemicznym.
Rtęć jest używana w zastosowaniach elektrycznych i elektronicznych.
Rtęć jest używana w termometrach, których używamy do pomiaru temperatury.
Rtęć wraz z jej związkami jest powszechnie stosowana w różnych lekach.
Wprowadzenie
Pluton jest w zasadzie metalem aktynowym i wygląda jak srebrzystoszary.
Pierwiastek, którego liczba atomowa mieści się w zakresie od 89 do 103, jest znany jako pierwiastek aktynowców.
Symbolem plutonu jest ‘Pu’ a liczba atomowa to ‘94.’

Pluton zwykle posiada sześć alotropów.
Nazwa plutonu pochodzi od „Pluto”.
Pluton został po raz pierwszy odkryty w 1940 roku przez grupę naukowców, mianowicie Glenn T. Seaborg, Joseph W. Kennedy, Edwin M. McMillan i Arthur C. Wahl.
Istotne cechy plutonu
Pluton jest radioaktywnym pierwiastkiem chemicznym.
Pluton pod wpływem powietrza matowieje, a po utlenieniu tworzy matową powłokę.
Pluton reaguje z wieloma pierwiastkami, w tym z halogenami, azotem, węglem, krzemem i wodorem.
W wyniku procesu rozszczepienia neutrony są uwalniane i przekształcają jądra uranu-238 w pluton-239.
Pluton-239 i pluton-241 są rozszczepialne, a zatem mogą podtrzymywać jądrową reakcję łańcuchową. Jest bardzo dobrze stosowany w broni jądrowej i reaktorach jądrowych.
Temperatura topnienia plutonu wynosi 640 0 C, a jego temperatura wrzenia wynosi 3228 0 C.
Uwolnienie jądra helu (o wysokiej energii) jest najpowszechniejszą formą rozpadu radioaktywnego plutonu.
Występowanie plutonu
Pluton występuje naturalnie tylko w śladowych ilościach w złożach uranu.
Pluton jest również pozyskiwany poprzez spalanie uranu (podczas rozwijania energii jądrowej).
Stopy plutonu
Poniżej przedstawiono główne stopy plutonu -
Pluton – gal jest jednym z ważnych stopów plutonu, a także galu.
Pluton – gal jest używany w wyrobiskach broni jądrowej.
Pluton – gal ma właściwość bardzo małej rozszerzalności cieplnej.
Niektóre inne stopy plutonu to -
Plutonium–aluminum
Plutonium–gallium–cobalt
Plutonium–zirconium
Plutonium–cerium
Plutonium–uranium
Plutonium–uranium–titanium
Thorium–uranium–plutonium
Związki plutonu
Tlenek plutonu (IV) - PuO 2
Chlorek plutonu (III) - PuCl 3
Tetrafluorek plutonu - PuF 4
Zastosowania plutonu
Izotop plutonu-239 jest jednym z istotnych pierwiastków w rozwoju broni jądrowej.
Pluton jest używany jako paliwo w elektrowniach jądrowych.
Wprowadzenie
Uran jest metalem z szeregu aktynowców układu okresowego.
Symbolem uranu jest ‘U’ a liczba atomowa to ’92.’
W 1789 roku Martin Heinrich Klaproth odkrył pierwiastek uran i nazwał go po nazwie Uran.
Istotne cechy uranu
Uran to srebrzystobiały metal.
Atom uranu ma 92 elektrony oraz 92 protony, z których 6 to elektrony walencyjne.
Ze względu na niestabilne izotopy uran jest słabym pierwiastkiem radioaktywnym.
Uran-238 jest najpowszechniejszym izotopem uranu.
Uran występuje naturalnie w bardzo niskich stężeniach, tj. Kilka części na milion w skałach, glebie i wodzie.
Uran rozpada się stopniowo (powoli), emitując cząstkę alfa.
Uran ma słabą przewodność elektryczną (tak słaby przewodnik prądu elektrycznego).
Uran jest kowalny, ciągliwy i marginalnie paramagnetyczny
Występowanie uranu
Uran występuje (naturalnie) jako uran-238, uran-235 i uran-234.
Okres półtrwania uranu-238 wynosi około 4,47 miliarda lat, prawie tyle samo co na Ziemi, a okres półtrwania uranu-235 wynosi około 704 milionów lat.
Stopy uranu
Poniżej przedstawiono główne stopy uranu -
Staballoy
Wodorek uranu
Związki uranu
Oto główne związki uranu -
Azotek uranu - U 2 N 3
Pentafluorek uranu - UF 5
Węglik uranu - UC
Fluorek uranylu - UO 2 F 2
Dwutlenek uranu - UO 2
Sześciofluorek uranu - UF 6
Oksoksyd triuranu - U 3 O 8
Czterofluorek uranu - UF 4
Trójtlenek uranu - UO 3
Czterochlorek uranu - Ucl 4
Azotan uranylu - UO 2 (NO 3 ) 2
Zastosowania uranu
Uran jest używany jako źródło energii w atomowych okrętach podwodnych (zwłaszcza przez wojsko).
Uran jest używany do produkcji broni jądrowej.
Uran jest również używany jako balast dla statków.
Wprowadzenie
Ołów jest ciężkim pierwiastkiem chemicznym (metalem), tzn. Ma dużą gęstość.
Symbolem ołowiu jest ‘Pb’ a liczba atomowa to ‘82.’

Ołów ma tendencję do wiązania się; podobnie może tworzyć łańcuchy, wiązania, pierścienie i struktury wielościenne.
Istotne cechy ołowiu
Ołów to miękki i ciągliwy metal; ma stosunkowo niską temperaturę topnienia.
Ołów jest stosunkowo niereaktywnym pierwiastkiem i ma tendencję do tworzenia więzi przymierza.
Po odcięciu ołowiu wydaje się niebieskawo-biały odcień.
Podczas spalania ołów daje niebieskawo-biały płomień (patrz zdjęcie poniżej).

Związki ołowiu zwykle znajdują się na +2 stopniu utlenienia.
Występowanie ołowiu
Ołów znany jest prehistorycznym mieszkańcom zachodniej Azji.
Ołów znajduje się w skorupie ziemskiej; rzadko występuje głęboko pod ziemią.
Ołów zwykle występuje w połączeniu z siarką.
Galena jest głównym minerałem zawierającym ołów, występującym głównie w rudach cynku.
Stopy ołowiu
Poniżej przedstawiono główne stopy ołowiu -
Molybdochalkos (miedź)
Lut (cyna)
Terne (puszka)
Związki ołowiu
Poniżej przedstawiono główne związki ołowiu -
Tlenek ołowiu - PbO
Dwutlenek ołowiu - PbO 2
Zastosowania ołowiu
Ołów był używany do produkcji pocisków od setek lat.
Ołów jest powszechnie używany jako powłoka ochronna kabli podwodnych (tylko dlatego, że ma właściwość odporności na korozję).
Blachy ołowiane są również używane jako metale architektoniczne, zwłaszcza w pokryciach dachowych.
Ołów jest również używany w akumulatorach kwasowych.
Związki ołowiu są powszechnie stosowane jako barwniki i półprzewodniki.
Związki ołowiu są również używane w plastiku, świecach, szkle itp.
Ołów jest powszechnie stosowany w polichlorku winylu (tj. Stosowany do powlekania przewodów elektrycznych).
Ostrożność
Obecność ołowiu (w nadmiernej jakości) w organizmie może spowodować poważne uszkodzenie mózgu i nerek; może nawet ostatecznie spowodować śmierć.
Wprowadzenie
Tor jest jednym z radioaktywnych aktynowców, które występują naturalnie w dużych ilościach.
Symbolem toru jest ‘Th’ a liczba atomowa to ’90.’

W 1829 roku norweski mineralog Morten Thrane Esmark jako pierwszy odkrył tor.
Jöns Jacob Berzelius, szwedzki chemik, zidentyfikował i nazwał go „torem” od imienia „Thor”, nordyckiego boga piorunów.
Istotne cechy toru
Tor jest paramagnetycznym i miękkim radioaktywnym aktynowcem.
Metaliczny kolor toru jest srebrzysty; gdy jest wystawiony na działanie powietrza, matowieje na czarno i tworzy dwutlenek.
Wszystkie izotopy toru są nietrwałe i jest to słaby pierwiastek promieniotwórczy.
Spośród wszystkich znaczących pierwiastków promieniotwórczych okres półtrwania toru jest najdłuższy, bo wynosi około 14,05 mld lat.
Temperatura topnienia toru wynosi około 1750 0 C.
Występowanie toru
Tor jest pierwotnym pierwiastkiem, który istnieje w swojej obecnej formie jeszcze przed powstaniem Ziemi.
Tor, który znajduje się w skorupie ziemskiej, jest rafinowany z piasków monacytu.
Najważniejszym źródłem toru jest monacyt, który występuje w dużych ilościach na całym świecie.
Stopy toru
Mag-Thor i tor-aluminium to najważniejsze stopy toru, magnezu i aluminium.
Związki toru
Poniżej znajdują się główne związki toru -
Dwutlenek toru - ThO 2
Siarczek toru (IV) - ThS 2
Jodek toru (IV) - ThI 4
Czterofluorek toru - ThF 4
Tor (chlorek IV - ThCl 4
Węglik toru (IV) - ThC
Inni to -
Thorite
Azotan toru (IV)
Ortokrzemian toru (IV)
Zastosowania toru
Tor jest zwykle używany do spawania łukiem wolframowym (GTAW), ponieważ (tor) zwiększa wytrzymałość elektrod wolframowych w wysokich temperaturach i odpowiednio poprawia stabilność łuku.
W sprzęcie elektronicznym nałożenie powłoki torowej na drut wolframowy zwiększa emisję elektronów z ogrzewanych katod.
W przemyśle chemicznym mianowicie dwutlenek toru ‘thoria’ jest powszechnie używany.
Wprowadzenie
W układzie okresowym najlżejszym pierwiastkiem jest wodór, jego masa atomowa wynosi zaledwie 1,008.
Symbolem wodoru jest ‘H’ a liczba atomowa to ‘1.’

Na początku lat 16 XX wieku po raz pierwszy wodór sztucznego wytwarza się w reakcji kwasów i metali.
Henry Cavendish po raz pierwszy rozpoznał wodór jako substancję dyskretną w latach 1766-81, ponieważ podczas spalania wytwarza on wodę.
Istotne cechy wodoru
W stanie plazmy, gwiazdy nie będące pozostałością składają się głównie z wodoru.
W standardowej temperaturze i ciśnieniu wodór wydaje się bezbarwny, bez smaku, bezwonny, niemetaliczny, nietoksyczny i wysoce palny gaz dwuatomowy.
Wzór cząsteczkowy wodoru to H 2 .
Na ziemi wodór występuje w postaci molekularnej, na przykład wody lub innych związków organicznych.
Wodór odgrywa również ważną rolę w reakcjach kwasowo-zasadowych.
Wodór w powietrzu jest wysoce łatwopalny.
Płomienie czystego wodoru i tlenu emitują światło ultrafioletowe; ponadto, przy wysokiej mieszance tlenu są prawie niewidoczne gołym okiem.
Wodór może reagować z prawie każdym pierwiastkiem utleniającym.
W temperaturze pokojowej wodór normalnie reaguje spontanicznie i złośliwie z chlorem i fluorem i tworzy odpowiednie halogenowodory.
Występowanie wodoru
Składający się z około 75 procent całej masy barionowej wodór jest najpowszechniej występującym związkiem chemicznym we Wszechświecie.
W całym wszechświecie wodór występuje zwykle w stanach atomowych i plazmowych; jednakże właściwości są zupełnie inne od właściwości wodoru cząsteczkowego.
Na ziemi wodór występuje w postaci dwuatomowego gazu, czyli H 2 .
Ze względu na niewielką wagę wodór łatwo ucieka z atmosfery ziemskiej.
Wodór jest trzecim najbardziej rozpowszechnionym pierwiastkiem występującym na powierzchni Ziemi, ale występuje głównie w postaci węglowodorów i wody.
Związki wodoru
Poniżej przedstawiono główne związki wodoru -
Woda - H 2 O
Amoniak - NH 3
Chlorowodór - HCl
Fluorowodór - HF
Siarkowodór - H 2 S
Metan - CH 4
Wodorotlenek - OH -
Bromowodór - HBr
Jodowodór - HI
Cyjanowodór - HCN
Fosfina - PH 3
Selenowodór - H 2 Se
Metanol - CH 3 OH
Wodorek litu - LiH
Wodorowęglan - HCO 3
Tellurowodór - H 2 Te
Ciekły wodór - H 2
Cyjanek - CN
Wodorek wapnia - CaH 2
Ciężka woda - D 2 O
Diboran - B 2 H 6
Wodorek sodu - NaH
Wodorek potasu - KH
Zastosowania wodoru
Najwięcej H 2 zużywa się przy przeróbce paliw kopalnych oraz przy produkcji amoniaku.
Wodór (H 2 ) jest szeroko stosowany w przemyśle naftowym i chemicznym.
H 2 jest zwykle stosowany jako środek uwodorniający, zwłaszcza przy zwiększaniu poziomu nasycenia nienasyconych tłuszczów i olejów.
H 2 jest również używany jako gaz osłonowy w procesach spawalniczych, takich jak spawanie atomowym wodorem itp.
Wprowadzenie
Hel jest drugim najlżejszym (po wodorze) i drugim najliczniej występującym pierwiastkiem we Wszechświecie.
Symbolem helu jest ‘He’ a liczba atomowa to ‘2.’

W układzie okresowym Hel jest pierwszym w grupie gazów szlachetnych.
Nazwa helu pochodzi od imienia greckiego boga słońca ”Helios”.
Istotne cechy helu
Hel to bezbarwny, bezwonny, pozbawiony smaku, obojętny, nietoksyczny i jednoatomowy gaz.
Temperatura wrzenia (-268,9 0 C) helu jest najniższa spośród wszystkich pierwiastków.
Hel zazwyczaj składa się z dwóch elektronów na orbitali atomowych i jest otoczony jądrem składającym się z dwóch protonów i dwóch neutronów.
Występowanie helu
Większość helu we wszechświecie należy do helium-4, i uważa się, że powstał podczas Wielkiego Wybuchu.
Większa część nowego helu jest zwykle wytwarzana w wyniku syntezy jądrowej wodoru w gwiazdach, w tym w Słońcu.
Chociaż istnieje ciągłe tworzenie nowego helu; niemniej jednak dostępność helu na Ziemi jest zasadniczo niska, ponieważ będąc lekkim pierwiastkiem, łatwo ucieka w kosmos.
W heterosferze (atmosferze zewnętrznej) ziemi hel jest jednym z najobficiej występujących pierwiastków (gazów).
W skorupie ziemskiej hel występuje w dużych ilościach w minerałach uranu i toru.
Związki helu
Poniżej przedstawiono główne związki helu -
Helidek disodowy - Na 2 He
Cristobalite He II (krzemiany) - SiO 2 He
Arsenolit dihelium - As 4 O 6 • 2He
Izotopy helu
Istnieje około dziewięciu znanych izotopów helu, ale kolejne dwa to najbardziej stabilne izotopy -
Hel-3 i
Helium-4
Zastosowania helu
Ze względu na niską gęstość, niską temperaturę wrzenia, niską rozpuszczalność, wysoką przewodność cieplną, hel jest pierwiastkiem szeroko stosowanym; najpopularniejszym przykładem jest - użycie helu w balonie.
Duża część helu ma zastosowania kriogeniczne, takie jak chłodzenie nadprzewodzących magnesów używanych w medycznych skanerach MRI i spektrometrach NMR.
Hel jest również używany jako gaz ochronny w hodowli kryształów krzemu i germanu.
Hel jest również stosowany w chromatografii gazowej oraz w produkcji tytanu i cyrkonu.
Hel jest używany w naddźwiękowych tunelach aerodynamicznych.
Hel jest również stosowany jako gaz osłonowy w procesach spawania łukowego.
Wprowadzenie
Tlen jest członkiem grupy 16 układu okresowego; jednak przez większość czasu jest traktowany inaczej niż jego grupa.
Symbolem tlenu jest ‘O’ a liczba atomowa to ‘8.’

Tlen ma około dziewięciu alotropów, a najpowszechniejszym alotropem jest tlen dwuatomowy (tj. O 2 ). Innym ważnym alotropem jest ozon, czyli O 3 .
Tlen po raz pierwszy zauważył szwedzki farmaceuta Carl Wilhelm Scheele.
Istotne cechy tlenu
Tlen jest charakterystycznie zaliczany do grupy „chalkogenów”.
Słowo „chalkogen” pochodzi od greckiego słowa „khalkόs, ”Co oznacza„ miedź ”, a łacińsko-greckie słowo„Genēs, ”Co oznacza urodzony lub wyprodukowany.
Tlen jest wysoce reaktywnym gazem (lub pierwiastkiem niemetalicznym); w związku z tym jest środkiem utleniającym, który łatwo tworzy tlenki z większością pierwiastków i związków.
Tlen ma sześć elektronów walencyjnych.
Temperatura topnienia tlenu wynosi -218,8 0 C, a temperatura wrzenia -183 0 C.
Występowanie tlenu
Mając około 20,8% udziału (w całkowitych składnikach atmosfery Ziemi), tlen jest drugim pod względem rankingu składnikiem atmosfery ziemskiej.
Tlen występuje prawie w sferze ziemi, a mianowicie w atmosferze, hydrosferze i litosferze.
Podczas procesu fotosyntezy wolny tlen wytwarzany jest przez wszystkie rośliny zielone.
Tlen występuje jako składnik rud miedzi.
Ciało ludzkie zawiera około 65 procent tlenu.
Masowo prawie połowa skorupy ziemskiej składa się z tlenu (tj. Jego tlenków).
Pod względem masy tlen jest trzecim najbardziej rozpowszechnionym pierwiastkiem we wszechświecie; pierwsza i druga to odpowiednio wodór i hel.
Tlen (tj. O 2 ) jest bezbarwnym i bezwonnym gazem dwuatomowym.
Tlen bardzo łatwo rozpuszcza się w wodzie; jednak rozpuszczalność tlenu w wodzie jest zależna od temperatury.
Związki tlenu
Poniżej przedstawiono główne związki tlenu -
Oxide
Peroxide
Dwutlenek węgla - CO 2
Wodorotlenek - OH -
Ozon - O 3
Tlenek rtęci (II) - HgO
Chloran - ClO 3
Tlenek glinu - Al 2 O 3
Tlenek węgla - CO
Podchloryn - ClO -
Dwutlenek krzemu - SiO 2
Kwas hipofluorowaty - HOF
Nadtlenek sodu - Na 2 O 2
Chloran potasu - KClO 3
Difluorek tlenu - OF 2
Tlenek sodu - Na 2 O
Zastosowania tlenu
Tlen (O 2 ) jest najważniejszym zapotrzebowaniem na oddychanie, bez niego nie można sobie wyobrazić życia.
Tlen jest używany w medycynie.
Terapia tlenowa jest zwykle stosowana w leczeniu niektórych chorób, takich jak rozedma płuc, zapalenie płuc, niektóre choroby serca itp.
Niektóre czynności podwodne, takie jak nurkowanie, łodzie podwodne itp., Również wykorzystują sztuczny tlen.

Samoloty, alpiniści itp. Również używają sztucznego tlenu.
Tlen jest również wykorzystywany w niektórych gałęziach przemysłu, np. W przetapianiu rudy żelaza na stal - w tym procesie zużywa się około 55% tlenu.
Wprowadzenie
Węgiel jest pierwiastkiem niemetalicznym i czterowartościowym.
Oznacza czterowartościowe - węgiel udostępnia cztery elektrony do tworzenia kowalencyjnych wiązań chemicznych.
Węgiel ma trzy izotopy, które występują naturalnie - mianowicie 12 C, 13 C i 14 C.
Wśród nich 12 C i 13 C są stabilne, ale 14 C jest radioaktywnym izotopem. Okres półtrwania 14 C wynosi około 5730 lat.
Istotne cechy węgla
Fizyczne właściwości węgla w dużej mierze zależą od jego związków alotropowych.
Główne alotropy węgla to grafit, diament i węgiel amorficzny.
Grafit jest matowy, czarny i bardzo miękki; w związku z tym tworzył smugę na papierze.
Diament bardzo twardy (najtwardszy materiał występujący naturalnie) i przezroczysty.
Grafit jest dobrym przewodnikiem elektryczności.
Diament jest złym przewodnikiem prądu.
Węgiel najprawdopodobniej ma najwyższy punkt sublimacji spośród wszystkich pierwiastków.
Występowanie węgla
Pod względem masy węgiel jest czwartym najbardziej rozpowszechnionym pierwiastkiem chemicznym we wszechświecie (po wodorze, helu i tlenie).
Węgiel występuje w dużych ilościach w Słońcu, gwiazdach, kometach oraz w atmosferach większości planet.
Węgiel znajduje się w ziemskiej atmosferze i rozpuszcza się w wodzie.
Węglowodory, takie jak węgiel, ropa naftowa i gaz ziemny, wszystkie zawierają węgiel.
Węgiel znajduje się również w hydratach metanu, które występują w regionach polarnych i pod morzami.
Niektóre skały wzbogacone w węgiel to węgiel, wapień, dolomit itp.
Węgiel jest bardzo bogaty w węgiel; w związku z tym jest największym komercyjnym źródłem węgla mineralnego.
Węgiel stanowi około 4000 gigaton, czyli 80% wszystkich paliw kopalnych.
Związki węgla
Poniżej przedstawiono główne związki węgla -
Cyjan - CN 2
Cyjanowodór - HCN
Cyjanamid - CN 2 H 2
Kwas izocyjanowy - HNCO
Chlorek cyjanu - CNCl
Izocyjanian chlorosulfonylu - CNClO 3 S
Chlorek cyjanurowy - NCCl 3
Dwusiarczek węgla - CS 2
Siarczek karbonylu - OCS
Siarczek węgla - CS
Zastosowania węgla
W zależności od alotropów węgiel jest używany w szeregu zastosowań.
Bez niego węgiel jest jednym z najważniejszych elementów życia, nie wyobrażamy sobie życia na ziemi.
Paliwa kopalne, czyli metan i ropa naftowa (ropa naftowa), węgiel itp. Są wykorzystywane w życiu codziennym.
Grafit, w połączeniu z gliną, służy do wyrobu „ołowiu” używanego w ołówkach.
Węgiel drzewny jest również używany jako materiał do rysowania w pracach plastycznych, wytopie żelaza, grillowaniu itp.
Diament jest zwykle używany w biżuterii.
Diamenty przemysłowe są używane w narzędziach do cięcia, wiercenia i polerowania do obróbki metali i kamienia.
Do produkcji tworzyw sztucznych wykorzystuje się węglowodory kopalne i włókno węglowe.
Wprowadzenie
Azot jest pierwiastkiem chemicznym z grupy 15 układu okresowego; spośród wszystkich elementów z grupy 15 jest najlżejszym elementem.
Symbolem azotu jest ‘N’ a liczba atomowa to 7.

W 1772 roku szkocki lekarz Daniel Rutherford jako pierwszy odkrył i wyodrębnił węgiel.
Jednak nazwę `` azot '' po raz pierwszy nadał Jean-Antoine-Claude Chaptal w 1790 roku.
Istotne cechy azotu
Azot ma dwa stabilne izotopy, mianowicie 14 N i 15 N.
Wolne atomy azotu zwykle łatwo reagują z większością pierwiastków i tworzą azotki.
Cząsteczki N 2 są gazem bezbarwnym, bezwonnym, bez smaku i diamagnetycznym w standardowych warunkach.
Temperatura topnienia N 2 wynosi -210 0 C, a temperatura wrzenia --196 0 C.
Związki azotu powtarzają się wzajemnie między atmosferą a żywymi organizmami, tworząc cykl azotowy.
Występowanie azotu
Azot jest pierwiastkiem najobficiej występującym na Ziemi, gdyż stanowi około 78,1% całej objętości ziemskiej atmosfery.
Azot, który jest gazem przemysłowym, wytwarzany głównie w wyniku destylacji frakcjonowanej ciekłego powietrza.
Związki azotu
Oto główne związki azotu -
Amon - NH 4+
Amoniak - NH 3
Kwas azotowy - HNO 3
Azotyn - NO 2-
Dwutlenek azotu - NO 2
Pentatlenek diazotu - N 2 O 5
Hydrazyna - N 2 H 4
Azot - N 2
Cyjanek - CN
Saletra amonowa - (NH 4 ) (NO 3 )
Trichlorek azotu - NCl 3
Trifluorek azotu - NF 3
Trójjodek azotu - NI 3
Pirydyna - C 5 H 5 N
Jon nitroniowy - NO 2+
Kwas hydrazoesowy - HN 3
Siarczan amonu - (NH 4 ) 2 SO 4
Zastosowania azotu
Związki azotu są szeroko stosowane w wielu dziedzinach i gałęziach przemysłu.
Czysty azot jest używany jako dodatek do żywności.
Stosowany w systemach przeciwpożarowych, zwłaszcza w sprzęcie informatycznym.
Używany również do produkcji stali nierdzewnej.
Azot jest również używany do pompowania opon niektórych samolotów i samochodów wyścigowych.
Jako czynnik chłodniczy stosowany jest ciekły azot.
Prawa natury związane z chemią nazywane są prawami chemicznymi.
Reakcje chemiczne zwykle rządzą się pewnymi prawami, których przestrzeganie i sformułowanie słowami staje się podstawowymi pojęciami chemii.
Poniżej znajdują się istotne prawa chemiczne -
| Prawa | Wyjaśnienie |
|---|---|
| Prawo Avogadro | „Jednakowe objętości wszystkich gazów, przy tej samej temperaturze i ciśnieniu, mają taką samą liczbę cząsteczek” |
| Prawo Beera-Lamberta (lub po prostu prawo Beera lub prawo Lamberta-Beera) | „Wyjaśnia tłumienie światła przez właściwości materiału, przez który ono (światło) przechodzi” |
| Prawo Boyle'a | „Ciśnienie bezwzględne wywierane przez daną masę gazu doskonałego jest odwrotnie proporcjonalne do zajmowanej przez nie objętości, jeżeli temperatura i ilość gazu pozostają niezmienione w układzie zamkniętym” |
| Prawo Charlesa (znane również jako prawo objętości) | „Gdy ciśnienie w próbce suchego gazu jest utrzymywane na stałym poziomie, temperatura Kelvina i objętość będą bezpośrednio powiązane” |
| Fick's Laws of Diffusion | Opisuje „dyfuzję” (strumienia) |
| Prawo Gay-Lussaca | „Wszystkie gazy mają taką samą średnią rozszerzalność cieplną przy stałym ciśnieniu w tym samym zakresie temperatur” |
| Zasada Le Chateliera („Prawo równowagi”) | „Gdy jakikolwiek układ będący w stanie równowagi zostanie poddany zmianie stężenia, temperatury, objętości lub ciśnienia, wówczas system dostosowuje się ponownie, aby przeciwdziałać (częściowo) efektowi zastosowanej zmiany i ustanawia się nową równowagę” |
| Prawo Henry'ego | „Prawo oblicza stężenie gazu w roztworze pod ciśnieniem” |
| Prawo Hessa | „Zmiana entalpii w reakcji chemicznej (czyli ciepło reakcji przy stałym ciśnieniu) jest niezależna od drogi między stanem początkowym i końcowym” |
| Prawo zachowania energii | „Energii nie można ani stworzyć, ani zniszczyć” |
| Prawo Raoulta | „Ciśnienie cząstkowe pary każdego składnika idealnej mieszaniny cieczy jest równe prężności pary czystego składnika pomnożonej przez jego ułamek molowy w mieszaninie” |
| Elektroliza prawa Faradaya | „Ilość substancji wytwarzanej na elektrodzie jest wprost proporcjonalna do ilości przepuszczonej energii elektrycznej” |
| Teoria atomowa | „Materia składa się z odrębnych jednostek zwanych atomami” |
| Teoria Köhlera | „Wyjaśnia proces, w którym para wodna skrapla się i tworzy kropelki cieczy” |
| Równanie Van 't Hoffa | „Opisuje zmianę stałej równowagi reakcji chemicznej” |
| Teoria stanu przejściowego | „Szybkość reakcji elementarnych reakcji chemicznych” |
| Grotthuss – Draper Law | „Opisuje, że światło, które jest pochłaniane przez układ / powierzchnię, może przynieść zmianę fotochemiczną” |
| Kinetyczna teoria gazów | „Opisuje zachowanie hipotetycznego gazu doskonałego” |
| Zasada Aufbau | „Wyjaśnia, że elektrony krążące wokół atomów najpierw wypełniają najniższe poziomy energii, a następnie drugie wyższe i tak dalej, i tak dalej” |
| Reguła Hunda | „Wyjaśnia, że każdy orbital na poziomie podrzędnym jest zajęty pojedynczo, zanim którykolwiek orbital zostanie zajęty podwójnie” |
| Teoria zderzeń | „W oparciu o kinetyczną teorię gazów, teoria zderzeń opisuje, że reakcje chemiczne w fazie gazowej zachodzą, gdy cząsteczki zderzają się z wystarczającą energią kinetyczną” |
Wprowadzenie
Najprawdopodobniej pierwszym pierwiastkiem wydobywanym i wykorzystywanym przez ludzi była miedź.
Dowody na najwcześniejsze użycie miedzi znaleziono w Anatolii, która należy do 6000 pne.
Ołów był najprawdopodobniej drugim elementem, którego ludzie zaczęli używać.
Najstarszym znanym artefaktem ołowiu jest statuetka, która została znaleziona w świątyni Ozyrysa w Abydos w Egipcie.
Statuetka świątyni Ozyrysa pochodzi z (około) 3800 lat pne.
Najstarszy znany skarb złota odkryto w Warnie w Nekropolii (Bułgaria).
Ten złoty skarb należy do (około) 4400 pne.
Odkrycie srebra jest prawie takie samo jak złota; jej dowody znaleziono w Azji Mniejszej.
Niektóre dowody wskazują, że żelazo było znane od (około) 5000 lat pne.
Najstarsze znane żelazne przedmioty, z których korzystali ludzie, znaleziono w Egipcie (należy do 4000 pne).
Poniższa tabela ilustruje istotne elementy wraz z datą ich odkrycia i odkrywa -
| Element | Odkrywca | Data odkrycia |
|---|---|---|
| Miedź | Bliski Wschód (miejsce) | Około 9000 pne |
| Prowadzić | Egipt (miejsce) | Około 7000 pne |
| Złoto | Bułgaria (miejsce) | Około 6000 pne |
| Srebro | Azja Mniejsza (Miejsce) | Około 5000 pne |
| Żelazo | Egipt (miejsce) | Około 5000 pne |
| Cyna | Około 3500 pne | |
| Siarka | Chiński / Indie | Około 2000 pne |
| Rtęć | Egipt | 2000 pne |
| Fosfor | H. Brand | 1669 |
| Kobalt | G. Brandt | 1735 |
| Platyna | A. de Ulloa | 1748 |
| Nikiel | F. Cronstedt | 1751 |
| Bizmut | CF Geoffroy | 1753 |
| Magnez | J. Black | 1755 |
| Wodór | H. Cavendish | 1766 |
| Tlen | W. Scheele | 1771 |
| Azot | D. Rutherford | 1772 |
| Bar | W. Scheele | 1772 |
| Chlor | W. Scheele | 1774 |
| Mangan | W. Scheele | 1774 |
| Molibden | W. Scheele | 1781 |
| Wolfram | W. Scheele | 1781 |
| Cyrkon | H. Klaproth | 1789 |
| Uran | H. Klaproth | 1789 |
| Tytan | W. Gregor | 1791 |
| Chrom | N. Vauquelin | 1797 |
| Beryl | N. Vauquelin | 1798 |
| Wanad | M. del Río | 1801 |
| Potas | H. Davy | 1807 |
| Sód | H. Davy | 1807 |
| Wapń | H. Davy | 1808 |
| Bor | L. Gay-Lussac i LJ Thénard | 1808 |
| Fluor | AM Ampère | 1810 |
| Jod | B. Courtois | 1811 |
| Lit | A. Arfwedson | 1817 |
| Kadm | S. L Hermann, F. Stromeyer i JCH Roloff | 1817 |
| Selen | J. Berzelius i G. Gahn | 1817 |
| Krzem | J. Berzelius | 1823 |
| Aluminium | HCØrsted | 1825 |
| Brom | J. Balard i C. Löwig | 1825 |
| Tor | J. Berzelius | 1829 |
| Lantan | G. Mosander | 1838 |
| Rubid | R. Bunsen i GR Kirchhoff | 1861 |
| Tal | W. Crookes | 1861 |
| Ind | F. Reich i T. Richter | 1863 |
| Hel | P. Janssen i N. Lockyer | 1868 |
| Neon | W. Ramsay i W. Travers | 1898 |
| Ksenon | W. Ramsay i W. Travers | 1898 |
| Fermium | A. Ghiorso i in | 1952 |
| Nobelium | ED Donets, VA Shchegolev i VA Ermakov | 1966 |
| Dubnium | A. Ghiorso, M. Nurmia, K. Eskola, J. Harris i P. Eskola | 1970 |
| Tennessine | Y. Oganessian i in | 2010 |
Poniższa tabela ilustruje istotne elementy i ich wartościowość -
| Element | Wartościowość | Symbol | Liczba atomowa |
|---|---|---|---|
| Wodór | -1, +1 | H. | 1 |
| Hel | 0 | On | 2 |
| Lit | 1 | Li | 3 |
| Beryl | 2 | Być | 4 |
| Bor | 3, 2, 1 | b | 5 |
| Węgiel | -1, -2, -4, 4, 3, 2, 1, | do | 6 |
| Azot | 0, -1, -2, -3,0, 5, 4, 3, 2, 1, | N | 7 |
| Tlen | -1, -2, 0, 2, 1, | O | 8 |
| Fluor | -1, 0 | fa | 9 |
| Neon | 0 | Ne | 10 |
| Sód | -1, 1 | Na | 11 |
| Magnez | 2 | Mg | 12 |
| Aluminium | 3, 1 | Glin | 13 |
| Krzem | -1, -2, -4, 4, 3, 2, 1 | Si | 14 |
| Fosfor | -1, -2, -3, 0, 5, 4, 3, 2, 1 | P. | 15 |
| Siarka | -1, -2, 0, 6, 5, 4, 3, 2, 1 | S | 16 |
| Chlor | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Cl | 17 |
| Argon | 0 | Ar | 18 |
| Potas | -1, 1 | K. | 19 |
| Wapń | 2 | Ca | 20 |
| Skand | 3, 2, 1 | Sc | 21 |
| Tytan | -1, -2, 0, 4, 3, 2, | Ti | 22 |
| Wanad | -1, -2, 0, 5, 4, 3, 2, 1 | V | 23 |
| Chrom | -1, -2, -3, -4, 0, 6, 5, 4, 3, 2, 1 | Cr | 24 |
| Mangan | -1, -2, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Mn | 25 |
| Żelazo | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Fe | 26 |
| Kobalt | -1, 0, 5, 4, 3, 2, 1 | Współ | 27 |
| Nikiel | -1, 0, 6, 4, 3, 2, 1 | Ni | 28 |
| Miedź | 4, 3, 2, 1, 0 | Cu | 29 |
| Cynk | 2, 1, 0 | Zn | 30 |
| Gal | 3, 2, 1 | Ga | 31 |
| German | 4, 3, 2, 1 | Ge | 32 |
| Arsen | -3, 5, 3, 2, | Tak jak | 33 |
| Selen | -2, 6, 4, 2, 1 | Se | 34 |
| Brom | -1, 0, 7, 5, 4, 3, 1 | Br | 35 |
| Krypton | 2, 0 | Kr | 36 |
| Rubid | -1, 1 | Rb | 37 |
| Stront | 2 | Sr | 38 |
| Itr | 3, 2 | Y | 39 |
| Cyrkon | 0, -2, 4, 3, 2, 1 | Zr | 40 |
| Niob | -1, -3, 0, 5, 4, 3, 2, 1 | Nb | 41 |
| Molibden | -1, -2, 0, 6, 5, 4, 3, 2, 1 | Mo | 42 |
| Technet | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Tc | 43 |
| Ruten | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Ru | 44 |
| Rod | -1, 0, 6, 5, 4, 3, 2, 1 | Rh | 45 |
| Paladium | 4, 2, 0 | Pd | 46 |
| Srebro | 3, 2, 1, 0 | Ag | 47 |
| Kadm | 2, 1 | Płyta CD | 48 |
| Ind | 3, 2, 1 | W | 49 |
| Cyna | -4, 4, 2 | Sn | 50 |
| Antymon | -3, 5, 3 | Sb | 51 |
| Tellur | -2, 6, 5, 4, 2, 1 | Te | 52 |
| Jod | -1, 0, 7, 5, 3, 1 | ja | 53 |
| Ksenon | 8, 6, 4, 3, 2, 0 | Xe | 54 |
| Cez | -1, 1 | Cs | 55 |
| Bar | 2 | Ba | 56 |
| Lantan | 3, 2 | La | 57 |
| Cer | 4, 3, 2 | Ce | 58 |
| Prazeodym | 4, 3, 2 | Pr | 59 |
| Neodym | 4, 3, 2 | Nd | 60 |
| Promethium | 3 | Po południu | 61 |
| Samar | 3, 2 | Sm | 62 |
| Europ | 3, 2 | Eu | 63 |
| Gadolin | 3, 2, 1 | Gd | 64 |
| Terb | 4, 3, 1 | Tb | 65 |
| Dysproz | 4, 3, 2 | Dy | 66 |
| Holmium | 3, 2 | Ho | 67 |
| Erb | 3 | Er | 68 |
| Tul | 3, 2 | Tm | 69 |
| Iterb | 3, 2 | Yb | 70 |
| Lutet | 3 | Lu | 71 |
| Hafn | 4, 3, 2, 1 | Hf | 72 |
| Tantal | -1, -3, 5, 4, 3, 2, 1 | Ta | 73 |
| Wolfram | -1, -2, -4, 0, 6, 5, 4, 3, 2, 1 | W. | 74 |
| Ren | -1, -3, 0, 7, 6, 5, 4, 3, 2, 1 | Re | 75 |
| Osm | -2, 0, 8, 7, 6, 5, 4, 3, 2, 1 | Os | 76 |
| Iridium | -1, 0, 6, 5, 4, 3, 2, 1 | Ir | 77 |
| Platyna | 6, 5, 4, 2, 0 | Pt | 78 |
| Złoto | -1, 0, 7, 5, 3, 2, 1 | Au | 79 |
| Rtęć | 2, 1 | Hg | 80 |
| Tal | 3, 1 | Tl | 81 |
| Prowadzić | 4, 2 | Pb | 82 |
| Bizmut | -3, 5, 3, 1 | Bi | 83 |
| Polon | -2, 6, 4, 2 | Po | 84 |
| Astat | -1, 7, 5, 3, 1 | W | 85 |
| Radon | 2, 0 | Rn | 86 |
| Francium | 1 | Ks | 87 |
| Rad | 2 | Ra | 88 |
| Aktyn | 3 | Ac | 89 |
| Tor | 4, 3, 2 | Cz | 90 |
| Protaktyn | 5, 4, 3 | Rocznie | 91 |
| Uran | 6, 5, 4, 3, 2 | U | 92 |
| Neptun | 7, 6, 5, 4, 3, 2 | Np | 93 |
| Pluton | 7, 6, 5, 4, 3, 2 | Pu | 94 |
| Ameryk | 7, 6, 5, 4, 3, 2 | Jestem | 95 |
Liczba atomowa określa liczbę protonów znajdujących się w jądrze pierwiastka.
Całkowita liczba protonów i neutronów (znajdujących się w jądrze) jest obliczana jako liczba mas atomowych.
Poniższa tabela ilustruje niektóre z istotnych pierwiastków wraz z ich liczbą atomową, masą atomową i symbolami -
| Element | Liczba atomowa | Masa atomowa (g mol-1) | Symbol |
|---|---|---|---|
| Wodór | 1 | 1,0079 | H. |
| Hel | 2 | 4.00 | On |
| Lit | 3 | 6,94 | Li |
| Beryl | 4 | 9.01 | Być |
| Bor | 5 | 10,81 | b |
| Węgiel | 6 | 12.01 | do |
| Azot | 7 | 14.0067 | N |
| Tlen | 8 | 16.00 | O |
| Fluor | 9 | 19.00 | fa |
| Neon | 10 | 20.1797 | Ne |
| Sód | 11 | 22,989768 | Na |
| Magnez | 12 | 24.3050 | Mg |
| Aluminium | 13 | 26,981539 | Glin |
| Krzem | 14 | 28.0855 | Si |
| Fosfor | 15 | 30,973762 | P. |
| Siarka | 16 | 32.066 | S |
| Chlor | 17 | 35,4527 | Cl |
| Argon | 18 | 39,948 | Ar |
| Potas | 19 | 39.0983 | K. |
| Wapń | 20 | 40.078 | Ca |
| Scandlum | 21 | 44,955910 | Sc |
| Tytan | 22 | 47.867 | Ti |
| Wanad | 23 | 50,9415 | V |
| Chrom | 24 | 51,9961 | Cr |
| Mangan | 25 | 54.93805 | Mn |
| Żelazo | 26 | 55.845 | Fe |
| Kobalt | 27 | 58.93320 | Współ |
| Nikiel | 28 | 58,6934 | Ni |
| Miedź | 29 | 63,546 | Cu |
| Cynk | 30 | 65,39 | Zn |
| Gal | 31 | 69,723 | Ga |
| German | 32 | 72,61 | Ge |
| Arsen | 33 | 74,92159 | Tak jak |
| Selen | 34 | 78,96 | Se |
| Brom | 35 | 79.904 | Br |
| Krypton | 36 | 83,80 | Kr |
| Rubid | 37 | 85,4678 | Rb |
| Stront | 38 | 87,62 | Sr |
| Itr | 39 | 88.90585 | Y |
| Cyrkon | 40 | 91,224 | Zr |
| Niob | 41 | 92.90638 | Nb |
| Molibden | 42 | 95,94 | Mo |
| Technet | 43 | 97.9072 | Te |
| Ruten | 44 | 101.07 | Ru |
| Rod | 45 | 102.90550 | Rh |
| Paladium | 46 | 106,42 | Pd |
| Srebro | 47 | 107,8682 | Ag |
| Kadm | 48 | 112.411 | Płyta CD |
| Ind | 49 | 114,818 | W |
| Cyna | 50 | 118,710 | Sn |
| Antymon | 51 | 121,760 | Sb |
| Tellur | 52 | 127,60 | Te |
| Jod | 53 | 126.90447 | ja |
| Ksenon | 54 | 131,29 | Xe |
| Cez | 55 | 132.90543 | Cs |
| Bar | 56 | 137,327 | Ba |
| Lantan | 57 | 138,9055 | La |
| Cer | 58 | 140,115 | Ce |
| Prazeodym | 59 | 140.90765 | Pr |
| Neodym | 60 | 144,24 | Nd |
| Promethium | 61 | 144,9127 | Po południu |
| Samar | 62 | 150,36 | Sm |
| Europ | 63 | 151,965 | Eu |
| Gadolin | 64 | 157,25 | Gd |
| Terb | 65 | 158,92534 | Tb |
| Dysproz | 66 | 162,50 | Dy |
| Holmium | 67 | 164,93032 | Ho |
| Erb | 68 | 167,26 | Er |
| Tul | 69 | 168,93421 | Tm |
| Iterb | 70 | 173.04 | Yb |
| Lutet | 71 | 174,967 | Lu |
| Hafn | 72 | 178,49 | Hf |
| Tantal | 73 | 180,9479 | Ta |
| Wolfram | 74 | 183,84 | W. |
| Ren | 75 | 186.207 | Re |
| Osm | 76 | 190,23 | Os |
| Iridium | 77 | 192.217 | Ir |
| Platyna | 78 | 195.08 | Pt |
| Złoto | 79 | 196,96654 | Au |
| Rtęć | 80 | 200,59 | Hg |
| Tal | 81 | 204,3833 | Tl |
| Prowadzić | 82 | 207,2 | Pb |
| Bizmut | 83 | 208,98037 | Bi |
| Polon | 84 | 208,9824 | Po |
| Astat | 85 | 209,9871 | W |
| Radon | 86 | 222.0176 | Rn |
| Francium | 87 | 223.0197 | Ks |
| Rad | 88 | 226.0254 | Ra |
| Aktyn | 89 | 227.0278 | Ac |
| Tor | 90 | 232.0381 | Cz |
| Protaktyn | 91 | 231.0388 | Rocznie |
| Uran | 92 | 238.0289 | U |
| Neptun | 93 | 237.0482 | Np |
| Pluton | 94 | 244.0642 | Pu |
| Ameryk | 95 | 243.0614 | Jestem |
| Kiur | 96 | 247.0703 | Cm |
| Berkelium | 97 | 247.0703 | Bk |
| Kaliforn | 98 | 251.0796 | Por |
| Einsteinium | 99 | 252.083 | Es |
| Fermium | 100 | 257.0951 | Fm |
| Mendelevium | 101 | 258,10 | Md |
| Nobelium | 102 | 259.1009 | Nie |
| Lawrencium | 103 | 262.11 | Lr |
| Unnilquadium | 104 | 261.11 | Unq |
| Unnilpentium | 105 | 262.114 | Unp |
| Unnilhexium | 106 | 263,118 * | Unh |
| Unnilseptium | 107 | 262.12 | Uns |
Jacobus Henricus van 't Hoff (naukowiec z Holandii) był pierwszą osobą, która otrzymała Nagrodę Nobla w dziedzinie chemii w 1901 roku.
Jacobus Henricus otrzymał Nagrodę Nobla za swoją pracę „prawa dynamiki chemicznej i ciśnienia osmotycznego w roztworach”.
Począwszy od 1901 do 2016 roku, łącznie 174 naukowców (chemii) otrzymało Nagrodę Nobla.
Do tego czasu cztery kobiety otrzymały Nagrodę Nobla w dziedzinie chemii.
Marie Curie była pierwszą kobietą, która otrzymała Nagrodę Nobla w dziedzinie chemii.
Poniższa tabela przedstawia nazwiska osób, które otrzymały Nagrodę Nobla w dziedzinie chemii wraz z ich pracą (za którą otrzymali Nagrodę) -
| Nazwa | Kraj (rok) | Miejsce pracy |
|---|---|---|
| Svante August Arrhenius | Szwecja (1903) | Elektrolityczna teoria dysocjacji |
| Sir William Ramsay | Wielka Brytania (1904) | Odkrycie obojętnych pierwiastków gazowych w powietrzu |
| Ernest Rutherford | Wielka Brytania / Nowa Zelandia (1908) | Chemia substancji promieniotwórczych |
| Maria Skłodowska-Curie | Polska / Francja (1911) | Odkrycie pierwiastków radu i polonu |
| Alfred Werner | Szwajcaria (1913) | Powiązanie atomów w cząsteczkach |
| Theodore William Richards | Stany Zjednoczone (1914) | Oznaczenia masy atomowej |
| Walter Norman Haworth | Wielka Brytania (1937) | Badania węglowodanów i witaminy C. |
| Paul Karrer | Szwajcaria (1937) | badania karotenoidów, flawin i witamin A i B2 |
| Adolf Friedrich Johann Butenandt | Niemcy (1939) | Pracuj nad hormonami płciowymi |
| Otto Hahn | Niemcy (1944) | Odkrycie rozszczepienia ciężkich jąder |
| John Howard Northrop i Wendell Meredith Stanley | Stany Zjednoczone (1946) | Przygotowanie enzymów i białek wirusowych w czystej postaci |
| Vincent du Vigneaud | Stany Zjednoczone (1955) | Pierwsza synteza hormonu polipeptydowego |
| Sir Cyril Norman Hinshelwood i Nikolay Nikolaevich Semenov | Wielka Brytania i Związek Radziecki (1956) | Mechanizm reakcji chemicznych |
| Frederick Sanger | Wielka Brytania (1958) | Struktura białek (zwłaszcza insuliny) |
| Willard Frank Libby | Stany Zjednoczone (1960) | Metoda użycia węgla-14 do określenia wieku |
| Melvin Calvin | Stany Zjednoczone (1961) | Asymilacja dwutlenku węgla w roślinach |
| Karl Ziegler i Giulio Natta | Niemcy i Włochy (1963) | Chemia i technologia polimerów wysokopolimerowych |
| Dorothy Crowfoot Hodgkin | Wielka Brytania (1964) | Oznaczenia technikami rentgenowskimi |
| Paul J. Flory | Stany Zjednoczone (1974) | Chemia fizyczna makrocząsteczek |
| Paul Berg | Stany Zjednoczone (1980) | rekombinowany DNA |
| Aaron Klug | Wielka Brytania (1982) | Rozwój krystalograficznej mikroskopii elektronowej |
| Henry Taube | Stany Zjednoczone (1983) | Mechanizmy reakcji przeniesienia elektronu |
| Robert Bruce Merrifield | Stany Zjednoczone (1984) | Metodologia syntezy chemicznej na stałej matrycy |
| Elias James Corey | Stany Zjednoczone (1990) | Metodologia syntezy organicznej |
| Richard R. Ernst | Szwajcaria (1991) | Metodologia wysokorozdzielczej spektroskopii magnetycznego rezonansu jądrowego (NMR) |
| Kary B. Mullis | Stany Zjednoczone (1993) | Metoda reakcji łańcuchowej polimerazy (PCR) |
| George A. Olah | USA i Węgry (1994) | Chemia karbokationowa |
| Peter Agre | Stany Zjednoczone (2003) | Odkrycie kanałów wodnych (błony komórkowe) |
| Roger D. Kornberg | USA (2006) | Molekularne podstawy transkrypcji eukariotycznej |
| Gerhard Ertl | Niemcy (2007) | Procesy chemiczne na powierzchniach stałych |
| Venkatraman Ramakrishnan, Thomas A. Steitz i Ada E. Yonath | 2009 | Struktura i funkcja rybosomu |
| Tomas Lindahl, Paul L. Modrich i Aziz Sancar | 2015 | Naprawa DNA |
| Jean-Pierre Sauvage, Fraser Stoddart i Ben Feringa | 2016 | Projektowanie i synteza maszyn molekularnych |